基于多组学分析高盐饮食诱导的大鼠高血压靶器官损伤机制
丁瑞丰, 朱嗣博, 周新丽*
(1. 上海理工大学健康科学与工程学院,上海 200093;2. 复旦大学生命科学院,上海 200438)
高血压是导致心血管疾病和肾脏疾病的主要因素,造成的死亡人数占全球所有死亡人数的5.8%[1]。心脏、肾脏是主要靶器官,在高血压的长期影响下将破坏这些器官的正常结构和功能,最终导致功能衰竭[2-3]。 高盐饮食已被确定为引起高血压的独立危险因素,长期的高盐饮食会导致体内钠潴留、外周血管阻力增大和血容量升高[4]。 随着我国经济的发展,居民饮食结构发生明显改变,食盐的摄入量提高到了约10 g/d,远高于世界卫生组织推荐的5 g/d的摄盐量[5]。 研究表明,摄盐量每增加2 g/d,可使血压升高1~2 mmHg[6]。 除此之外,过量的膳食盐摄入会导致肾脏肥大和肾脏小动脉、冠状动脉血管周围纤维化,双心室缺血和心室舒张功能异常等一系列器官功能障碍[7-9]。
肠黏膜是吸收过量盐分的主要部位,过多的摄盐量会破坏肠道微生物群的稳态并上调高血压特征菌群等有害菌丰度[10-12]。 一项临床研究发现,减少膳食盐的摄入会增加高血压患者体内与血压下降有关的短链脂肪酸(short-chain fatty acid,SCFA)水平,而大部分SCFA 都来源于肠道微生物代谢,间接说明了盐的摄入对于肠道菌群组成及功能的影响[13]。 一些研究则发现在高盐饮食及高血压的作用下,肾脏损伤和心血管疾病的发展受到了来自肠道微生物群通过免疫、代谢和神经调控等一系列途径的影响[14-17]。
高通量测序技术的发展为揭示疾病的分子机制提供了新的途径。 然而,高盐饮食引起的高血压靶器官损伤的潜在机制和对肠道微生物群的影响仍少有探究。 因此,作者通过高盐饮食的方式构建了高血压大鼠模型,基于基因组和微生物组全面探讨了高盐诱导的高血压大鼠靶器官损伤的分子机制。
1 材料与方法
1.1 材料与试剂
健康雄性Sprague-Dawley(SD)大鼠(12 只,4周龄,体质量(170±5) g):上海斯莱克实验动物有限责任公司提供。 实验中对实验动物的处置均遵守《关于善待实验动物的指导性意见》规定(动物实验伦理审核编号:SZY-201601007)。
普通标准饲料(SFS9112)、定制高盐饲料(普通标准饲料基础上含质量分数8%NaCl):江苏省协同医药生物工程有限责任公司提供。
1.2 仪器与设备
SW-CJ-2D 双人单面净化垂直送风工作台:苏州净化设备有限公司产品;Ultra Pure UF 除热源型超纯水机:上海和泰仪器有限公司产品;Sorvall ST 8台式离心机、NanoDropTM2000 分光光度计: 北京赛默飞科技有限公司产品;Agilent 2100 Bioanalyzer 生物分析仪:美国Agilent 公司产品;BP98A 无创血压仪:日本Softron 产品。
1.3 实验方法
1.3.1 实验设计 实验采用12 只健康4 周龄雄性SD 大鼠,在适应性喂养一周后随机分成两组,每组6 只:NC 组(空白对照组,喂养普通标准饲料)、HSD组(高盐饮食组,喂养含质量分数8%NaCl 定制高盐饲料)。 所有大鼠允许自由饮水,并放置于昼夜光照条件为12 h 光照/12 h 黑暗、环境温度(22±2) ℃、相对湿度(30±2)%的实验动物房环境下,每4 周于同一时间测量大鼠体质量和动脉血压。 连续喂养12 周后,腹腔注射戊巴比妥钠(50 mg/kg)对动物实施安乐死,待大鼠完全麻醉后放血处死。 收集肾脏的皮质和髓质组织、心脏的心房和心室组织、结肠组织和粪便样本,并立即放于液氮中速冻,随后储存在-80 ℃冰箱用于后续高通量测序, 实验总体设计和分析流程如图1 所示。
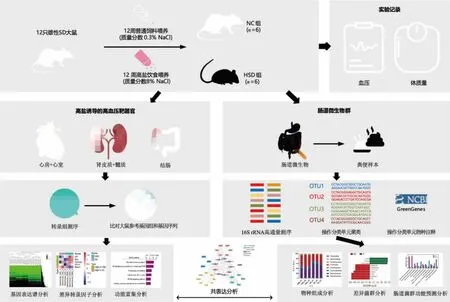
图1 实验总体设计和分析流程Fig. 1 Experimental overall design and analytical procedures
1.3.2 大鼠血压测量 使用无创血压仪测量大鼠尾部的收缩压和舒张压,并根据如下公式计算平均动脉压作为大鼠血压测量结果。 测量前让大鼠自由饮水并在笼中休息15 min 以保持冷静。随后将大鼠的尾巴放在温度合适的尾套中,将其充气和释放多次,让动物适应这个过程。 通过3~5 次连续成功的血压读数获得平均动脉压。
式中:pMAP为平均动脉压 (mean arterial pressure),mmHg;pDBP为舒张压 (diastolic blood pressure),mmHg;pSBP为收缩压 (systolic blood pressure),mmHg。
1.3.3 组织RNA 提取和高通量测序 根据TRIzol试剂盒操作说明分别提取各器官组织的总RNA,琼脂糖凝胶电泳检查RNA 的完整性,NanoDropTM2000分光光度计测定RNA 纯度和浓度, 并用Agilent 2100 Bioanalyzer 生物分析仪测定RNA 完整值(RNA integrity number,RIN)。 RNA 质控标准为:OD260nm/280nm为1.8~2.2、 ρRNA≥200 ng/μL、RIN 值≥8。通过质控的RNA 样本使用SmartScribeTMReverse Transcriptase 试剂盒进行cDNA 扩增和文库制备,随后用TruePrep®DNA Library Prep Kit V2 for Illumina 试剂盒对DNA 进行片段化、加接头和扩增反应,使用VANTS DNA Clean Beads 对各阶段产物进行分选, 使用Agilent 2100 Bioanalyzer 生物分析仪对获得的文库样品进行定量分析, 最终获得250~1 000 bp 文库片段。 根据定量分析结果,构建好的文库样品按照体积比1∶1 比例混合, 送交北京贝瑞和康生物技术有限公司通过Illumina NextSeq 500 平台进行高通量测序。 测序下机原始数据使用Fastqc(v0.11.9)和Multiqc(v1.11)软件进行质控统计, 采用Trimmomatic (v0.39) 软件过滤低质量reads, 序列过滤后得到的高质量reads, 利用HiSat(v2.1.0)软件比对到Ensemble 基因组数据库发布的大鼠参考基因组和基因序列Rnor6(release 102)上,比对结果利用featureCounts(v1.6.5)进行基因水平定量,得到各样本的基因表达矩阵。 通过每个组织的NC 组和HSD 组之间的基因表达谱差异倍数(fold change)来鉴定差异表达基因,差异表达基因使用R 包DESeq2 进行筛选,差异倍数大于1.3 或小于0.77,P<0.05 作为筛选标准,随后通过比对AnimalTFDB(v3_20210214)数据库进一步识别出差异表达基因中的转录因子,并进行深入挖掘分析。 最后,通过R包clusterProfiler 分析差异表达基因列表, 根据GO数据库和KEGG 数据库来探索其生物学功能。
1.3.4 粪便16S rRNA 基因测序与分析 使用粪便DNA 基因组提取试剂盒从冷冻粪便样本中提取细菌基因组,经过琼脂糖凝胶电泳检查合格后,采用16S rRNA 基因V3~V4 区引物(338F:F5′-TCGTCG GCAGCGTCAGATGTGTATAAGAGACAGCCTACGG GNGGCWGCAG-3′;806R:R5′-GTCTCGTGGGCTCG GAGATGTGTATAAGAGACAGGACTACHVGGGTAT CTAATCC-3′) 进行DNA 提取和聚合酶链式反应(polymerase chain reaction,PCR) 扩增, 扩增采用KAPA HiFi HotStart Ready Mix 试剂盒。扩增产物随后采用琼脂糖凝胶电泳检测, 合格的样品使用TruePrep®DNA Library Prep Kit V2 for Illumina 试剂盒构建基因文库,VANTS DNA Clean Beads 回收各阶段目标片段扩增产物。 使用Agilent 2100 Bioanalyzer 生物分析仪对获得的文库样品进行定量,最终获得630 bp 附近的文库片段。 根据定量结果,构建好的文库样品按照体积比1∶1 比例混合,送交晶能生物技术 (上海) 有限公司通过Illumina Novaseq 6000 平台进行高通量测序。 下机测序数据采用QIIME(v1.9.1)软件进一步处理,以97%的相似性分类阈值来进行不同操作分类单元(operational taxonomic units,OTUs)的聚类和物种注释,比对参照数据库为Greengenes 数据库(2013 release)。使用R 包vegan 进行肠道菌群数据的多样性分析和主坐标分析(principal coordinates analysis,PCoA)。 采用线上工具Galaxy(http://huttenhower.sph.harvard.edu/galaxy/)的线性判别分析(linear discriminant analysis effect size,LEfSe)工具分析组间菌群差异。肠道菌群的KEGG 功能预测使用 PICRUSt(phylogenetic investigation of communities by reconstruction of unobserved states) 软件进行分析。
1.3.5 数据统计与分析 使用GraphPad Prism(v8.4.2)和R 统计软件(v3.6.2)进行统计学分析。组间差异显著性检验采用Mann-Whitney-Wilcoxon 检验,采用Spearman 进行相关性分析,差异比较结果表示为平均值±标准差(mean±SD),P<0.05 作为统计学意义筛选标准。
2 结果与分析
2.1 高盐饮食对大鼠血压和体质量的影响
本研究的目的是根据长期高盐饮食诱导的高血压大鼠组织和肠道微生物的差异来表征高血压的潜在分子机制。 在实验过程中,各组大鼠均未出现死亡;NC 组的大鼠活动情况正常, 精神状态良好;HSD 组大鼠活动减少,精神状态萎靡。 各组大鼠的体质量和血压变化情况如图2 所示,与正常饮食(空白对照组)的大鼠相比,高盐喂养的大鼠体质量显著降低,由(468.00±13.53)g 降至(411.67±31.82)g。在高盐饮食的作用下,HSD 组的血压显著高于NC 组,在高盐饮食喂养8 周后已经观察到了差异,并且在整个研究过程中都保持了显著差异, 由NC 组(112.67±5.13) mmHg 升至HSD 组 (143.00±4.58)mmHg。 高盐饮食造成了大鼠的体质量增长减缓和血压显著升高,与Bier 等的研究结果[18]一致。
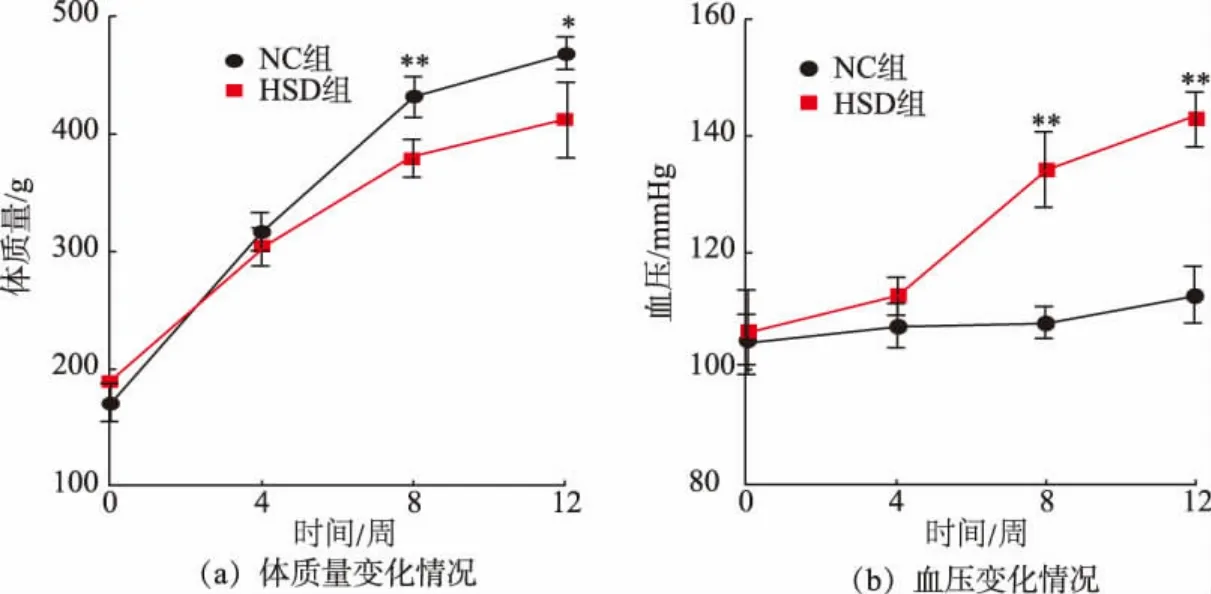
图2 大鼠的体质量、血压变化情况Fig. 2 Changes in body weight and blood pressure of rats
2.2 高血压靶器官的转录组测序数据分析
为了明确长期高盐饮食所导致的高血压靶器官损伤机制,对上述两组大鼠肾脏的皮质和髓质组织、 心房和心室组织和结肠组织共30 个组织样本进行了高通量测序,共测定了20 207 个基因的表达量。 无监督学习中的主成分分析(PCA) 和层次聚类分析(HCA)是转录组测序数据分析前质量控制的常用方法之一,通过二维坐标或聚类树查看样本之间的聚类情况, 以判定样本的组间差异和组内差异。 PCA 的结果如图3(a)所示,第一主成分的贡献度为36.12%,第二主成分的贡献度为12.77%,相同器官组织样本聚集在一起。 从HCA 的结果可以看出(见图3(b)),每个器官组织中的样本大致分成2个大类,大多数高盐饮食组单独形成一类,空白对照组形成另一大类。总体来说,PCA 和HCA 结果相互印证,均证实样本的组间差异大于组内差异。 本研究比较了每个组织的基因表达谱差异以表征由高盐高血压引起的分子变化。 根据基因表达谱差异倍数和显著性对基因进行筛选比较,各个器官组织的差异表达基因数如表1 所示。
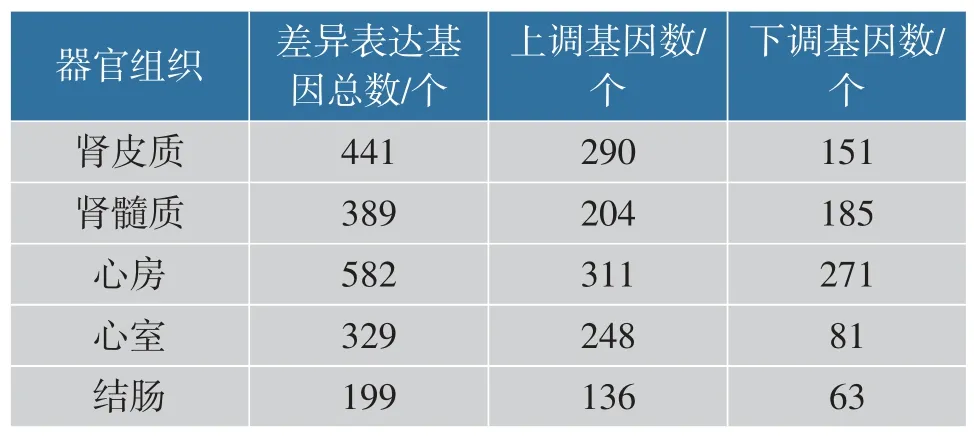
表1 各组织差异表达基因的数量Table 1 Numbers of differentially expressed genes in each tissue
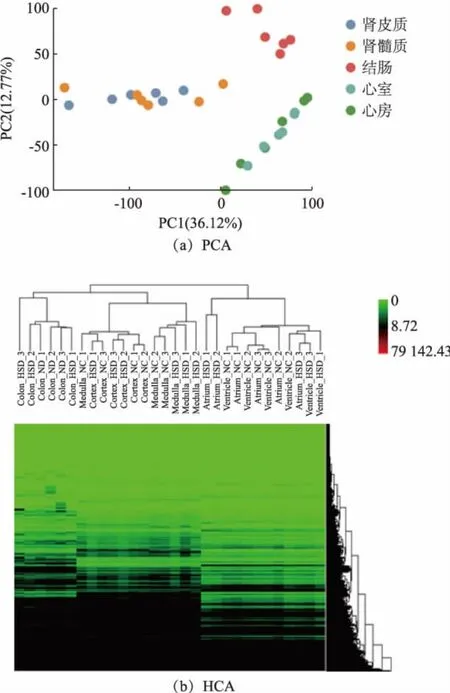
图3 器官组织基因表达谱差异分析图Fig. 3 Gene expression profile analysis of organs and tissues
为了更好地阐明高盐饮食对高血压靶器官损伤的潜在机制,进一步筛选了差异表达基因中的转录因子,如图4 所示。 结果表明,HSD 组中结肠中的基因Irf1 和心室中的基因Irf7 的表达量高于NC组,而心房中的基因Zfp91、心室中的基因Epas1 表达量低于NC 组。 除此之外,HSD 组中Id 基因家族在多个器官组织中的表达量均低于NC 组, 如肾髓质中的基因Id1、Id2、Id3,肾皮质的基因Id2、Id3、Id4。

图4 各组织的差异转录因子Fig. 4 Differential transcription factors in each tissue
为了解高盐饮食可能影响的细胞功能与代谢过程,本研究中对各个器官组织的组间差异表达基因分别采用了GO 和KEGG 进行富集分析,结果如图5 和图6 所示。 GO 分类结果表明,高盐饮食所导致的差异表达基因在心房主要参与前体代谢产物和能量产生,在心室和肾皮质则主要与ATP 代谢过程有关,结肠和肾皮质组织的差异表达基因分别与细胞修饰的氨基酸代谢过程和线粒体呼吸链复合体组装过程有关。 KEGG 富集结果表明各器官组织的差异表达基因与多种代谢过程密切相关,在心房和肾皮质主要与三羧酸循环有关,肾皮质和髓质的差异表达基因主要与丙氨酸、天冬氨酸和谷氨酸代谢有关, 心房和结肠的差异表达基因与胆固醇代谢有关。
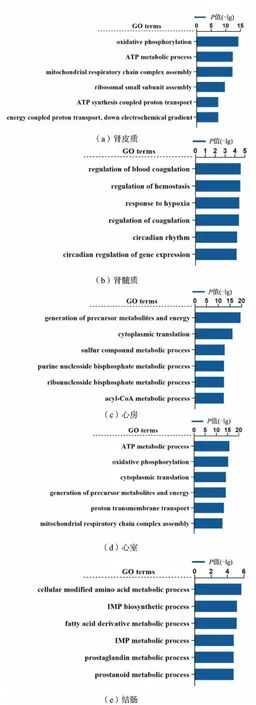
图5 各组织的差异表达基因GO 分类Fig. 5 GO classification of differentially expressed genes in each tissue
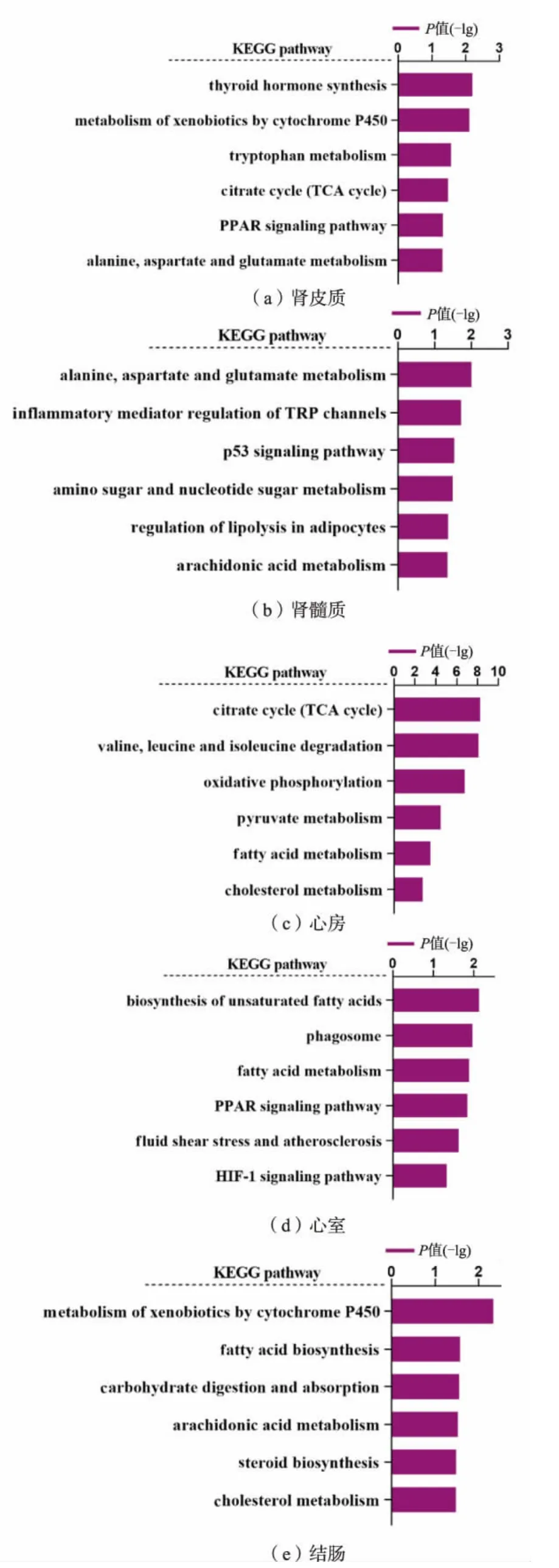
图6 各组织的差异表达基因KEGG 富集Fig. 6 KEGG enrichment analysis of differentially expressed genes in each tissue
2.3 高盐饮食对大鼠肠道菌群组成及多样性的影响
为了明确高盐饮食对肠道微生物群组成的影响, 本研究中通过16S rRNA 基因测序分析了各组大鼠肠道微生物群结构组成情况。 如图7(a)所示,两组大鼠肠道菌群在门水平上主要由拟杆菌门(Bacteroidetes)、厚壁菌门(Firmicutes)、变形菌门(Proteobacteria)和蓝细菌门(Cyanobacteria)构成。Yang 等的研究结果表明,厚壁菌门和拟杆菌门丰度的比值(F/B 值)升高是高血压肠道菌群失调的标志[19]。 如图7(b)所示,在本研究中高盐饮食组大鼠相比于空白对照组大鼠的厚壁菌门和拟杆菌门丰度的比值显著升高,反映了在高盐饮食及高血压的影响下大鼠肠道菌群组成结构的改变。
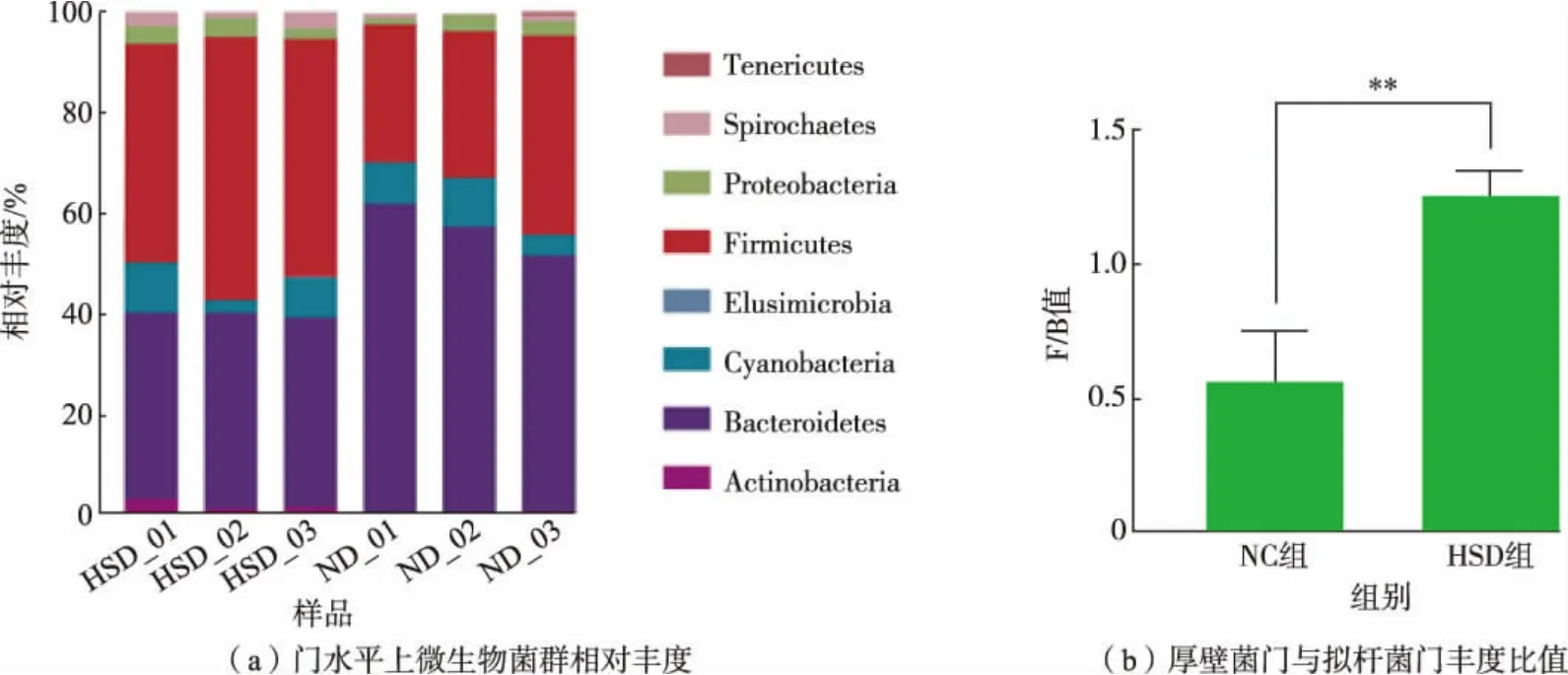
图7 门水平上大鼠微生物菌群的物种组成分析Fig. 7 Rat microbial species composition analysis on the phylum level
α-多样性能够反映出样品中微生物群落的丰富度和均匀程度。 Shannon 指数和Simpson 指数可定量评估样本中菌群丰富度和均匀程度,Shannon指数越大或者Simpson 指数越小则代表样本菌群多样性越高。 ACE 指数与Chao1 指数类似,通过统计样本中OTUs 数量来对样本多样性进行评估,其值越大,代表样本菌群多样性越丰富。 样本的α-多样性指数 (ACE 指数、Chao1 指数、Shannon 指数、Simpson 指数)具体数值如表2 所示,高盐饮食会使大鼠的肠道菌群丰富度和均匀程度略微降低,但是Shannon 指数、Simpson 指数、ACE 指数与NC 组差异不显著,Chao1 指数显著下降(P<0.05),本研究结果表明了高盐饮食对大鼠的肠道菌群丰富度和均匀程度有影响。

表2 大鼠肠道菌群α-多样性指数Table 2 α-Diversity index of rat intestinal microflora
进一步比较高盐饮食对大鼠肠道菌群组成的影响,本研究中采用PCoA 比较了两个实验组在门、属水平上微生物组成的菌群多样性差异。 如图8 所示, 在门水平上PC1 坐标轴贡献率占总成分的94.67%,在属水平上为89.98%,符合PCoA 要求。分析结果表明了本研究中两实验组各自的样本都能显著分为一个群体,并且微生物群落结构和丰度都有自己明显的特征。
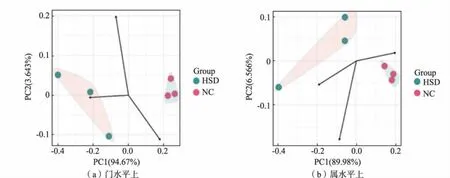
图8 大鼠肠道菌群的PCoA 分析结果Fig. 8 PCoA analysis of rat intestinal microflora
2.4 高盐饮食对特定菌群和功能的影响
为了明确高盐饮食造成的关键差异菌群,为相关疾病的分类、检测和机理研究等临床应用提供参考。 本研究中采用了LEfSe 方法分析了不同样本组别间的菌群差异,通过计算LDA 分数来区分两个实验组中对菌群结构差异贡献较大的标志性微生物。如图9 所示, 两组样本的肠道菌群存在一定的差异,NC 组中对菌群结构差异影响较大的微生物主要来自拟杆菌门(Bacteroidetes)、梭菌纲(Clostridia)和瘤胃球菌科(Ruminococcaceae),而高盐饮食组中对菌群结构差异影响较大的微生物主要来自厚壁菌门(Firmicutes)、β-变形菌纲(Betaproteobacteria)、伯克氏菌目 (Burkholderiales)、 放线菌目(Actinomycetales)和费克蓝姆菌属(Facklamia)等。本研究结果说明了高盐饮食能够改变大鼠肠道中特定菌群的相对丰度,对大鼠的肠道菌群结构组成有显著影响。 PICRUSt 可以用于样本肠道微生物群的基因功能预测。 如图10 所示,结果显示高盐饮食影响了多个微生物组代谢途径,下调较大的途径为初级胆汁酸生物合成,次级胆汁酸生物合成,果糖和甘露糖代谢,甘氨酸、丝氨酸和苏氨酸代谢;上调途径主要为脂肪酸代谢和赖氨酸降解。 总之,上述结果表明高盐饮食改变了大鼠肠道微生物群的组成和功能。
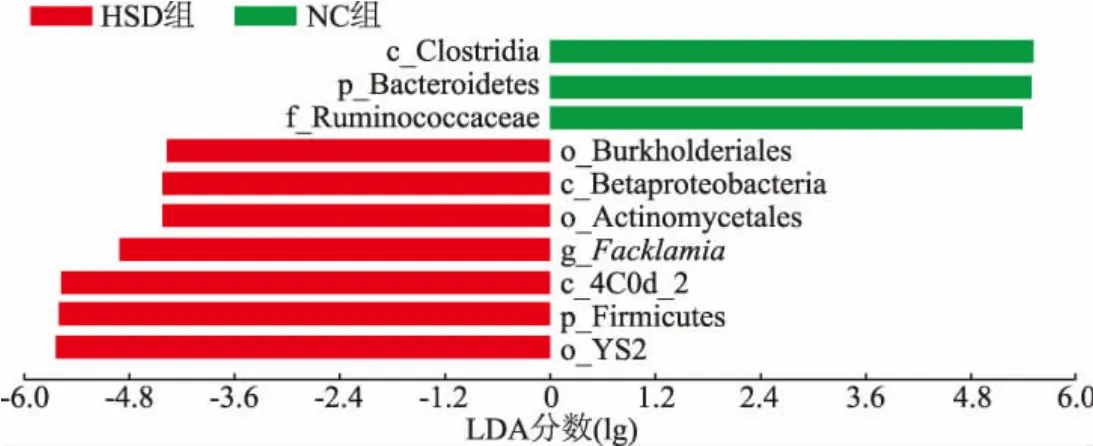
图9 基于LEfSe 分析大鼠肠道菌群组成结构差异Fig. 9 Analysis of differences in the composition and structure of rat intestinal microflora based on LEfSe
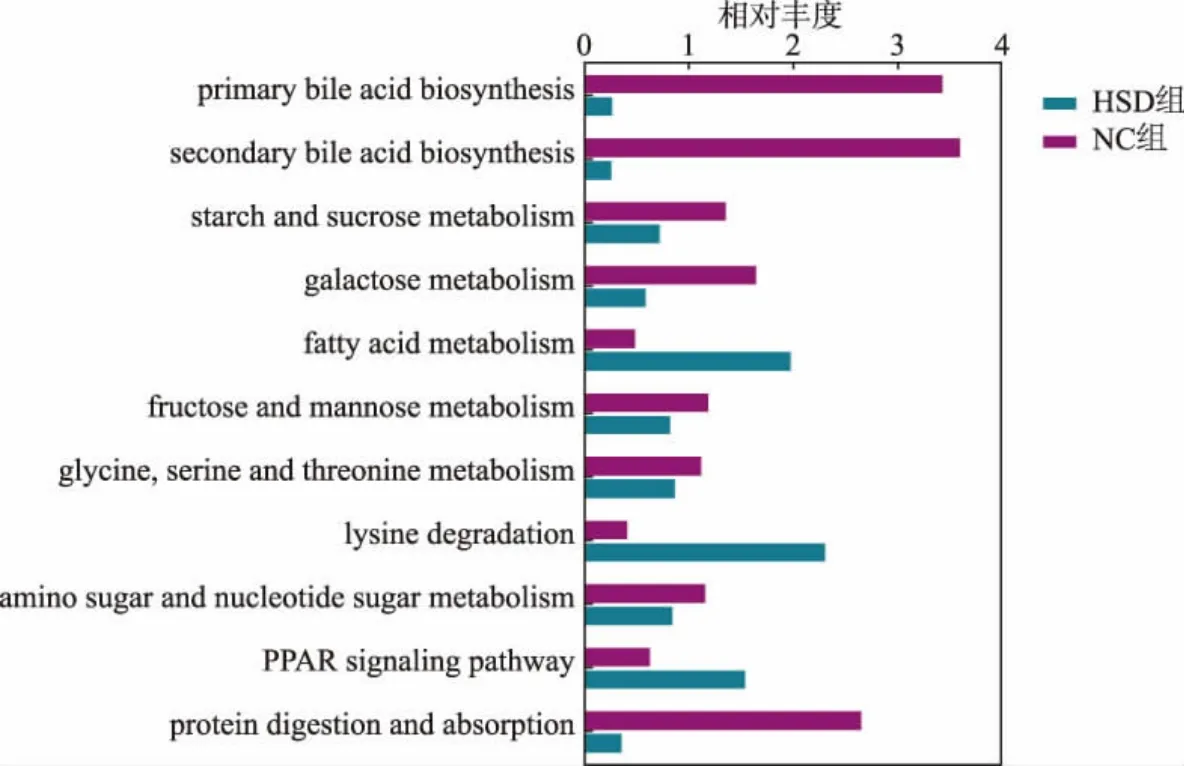
图10 基于PICRUSt 的大鼠肠道菌群基因功能预测Fig. 10 Genomic functional prediction of rat intestinal microflora based on PICRUSt
2.5 高盐饮食影响下大鼠基因表达和肠道菌群的串扰
肠道屏障作为一个通道,通过跨细胞和细胞旁转运机制,使大量代谢产物和免疫信号在肠道和循环系统之间双向传递[20]。目前的研究发现,高盐饮食会损害肠道屏障功能,最终导致细菌内毒素进入循环系统从而引发免疫反应和促炎细胞因子的产生[14]。为了揭示在高盐饮食的作用下肠道菌群影响靶器官组织基因表达的潜在机制,采用了Spearman 相关性分析探索了靶器官组织的差异转录因子与肠道菌群OTUs 之间的共表达关系。 如图11 所示,5 个器官组织共有23 个差异转录因子的表达与9 个微生物群菌属具有显著相关性。 萨特氏菌属(Sutterella) 主要与结肠中 Nr0b2、Atf3、Hopx、Hmgb2、Irf1 和Crebrf 的表达高度相关(见图11,粉色节点),乳酸杆菌属(Lactobacillus)则与多个组织中转录因子的表达相关, 如心房的Ciz1 基因 (图11,蓝色节点)、结肠的Irf1 和Atf3 基因(见图11,粉色节点)、肾髓质的Id2 和Zfp91 基因(见图11,黄色节点)。
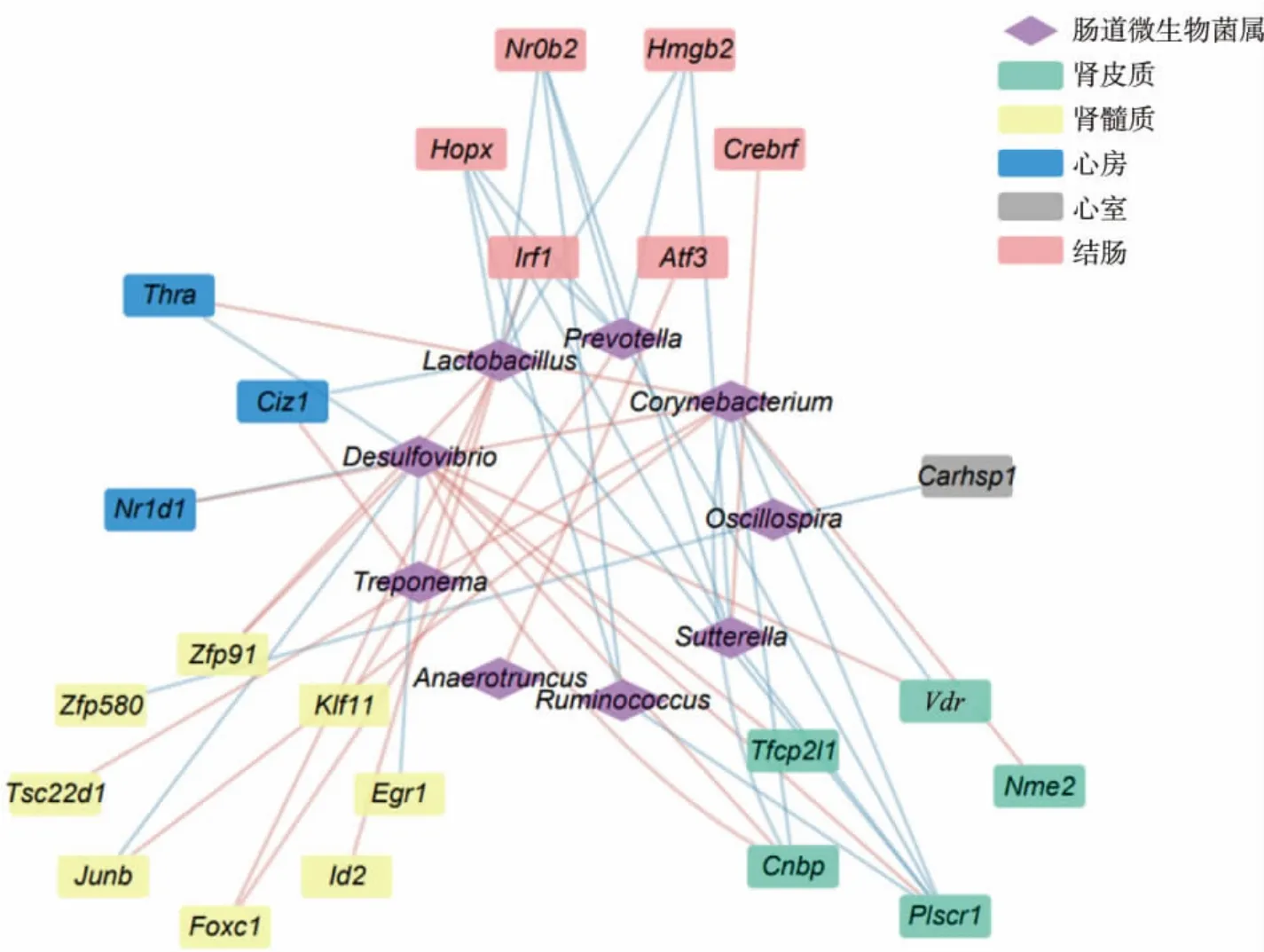
图11 差异转录因子与肠道菌群的共表达分析Fig. 11 Co-abundance analysis between differential transcription factors and the gut microbiome
2.6 讨论
作者成功构建了高盐饮食诱导的高血压大鼠模型,与空白对照组相比,高盐饮食组大鼠的血压在第8 周开始至第12 周实验结束时均显著升高。为了揭示在高盐饮食影响下产生高血压的潜在分子机制,本研究中基于高通量测序技术探索了高盐饮食对大鼠模型高血压靶器官以及肠道微生物群的影响。 本研究中所发现的一系列差异转录因子有助于解释高血压疾病发展过程中分子机制,高盐饮食造成的大鼠肠道菌群组成的改变与微生物组代谢功能失调密切相关,并基于多组学数据整合分析为高盐饮食诱导的高血压及其靶器官心-肾-肠轴损伤的分子机制提供了新的认识。
转录因子是细胞对外界环境刺激和微生物群信号等胞外信号调节变化的关键响应节点[21],明确高盐饮食所导致的靶器官差异转录因子有助于更好地理解疾病发展的分子机制。 通过对高血压靶器官进行转录组测序,发现了一系列失调的差异转录因子。 有研究表明,高盐饮食会导致肠道和血管炎症,并驱动T 细胞产生γ 干扰素(IFN-γ)和白细胞介素17A(IL-17A)[22-23]。Irf1 是IFN-γ 介导Th1 细胞炎症反应的关键调节基因[24]。 既往研究表明,Irf1 能够特异性抑制Foxp3 的表达,负向调节CD4+CD25+调节性T 细胞(regulatory T cell,Treg)的发育和功能,从而破坏宿主免疫稳态[25]。 本研究中发现了Irf1在高盐饮食组的结肠组织中上调,提示了高盐饮食造成的肠黏膜损伤和肠道炎症反应的关键基因。 Id基因家族能够拮抗碱性-螺旋-环-螺旋(basic helix-loop-helix,bHLH)转录因子的表达,抑制上皮间充质转化(epithelial-mesenchymal transformation,EMT)[26-27]。 有研究表明,高盐饮食会激活大鼠肾小管细胞EMT 过程, 并导致钙黏蛋白和α-平滑肌肌动蛋白(α-SMA)的异常表达[28]。本研究中,高盐饮食组中肾脏Id 基因家族的基因表达均降低,高盐饮食造成的EMT 异常激活可能与Id 基因家族的抑制作用减弱有关。 Wu 等的研究发现Zfp91 基因调控多个与心脏舒张功能相关基因的表达[29]。 Tanaka 等的研究发现Epas1 能够响应环境刺激进而诱导肾上腺髓质素的表达,抑制心肌细胞的炎症反应[30]。在本研究中,Zfp91 和Epas1 在高盐饮食诱导的高血压大鼠心脏中表达显著下调,提示高盐饮食造成的心脏损害和血压升高可能与一系列心肌稳态以及炎症反应相关的基因功能失调有关。 高血压常伴有代谢异常,一些研究发现机体的能量代谢和盐的摄入量显著相关[6,18,31-32]。 本研究中的GO 分类结果表明,高盐饮食组中多个组织的线粒体功能发生了改变。KEGG 富集表明高盐饮食造成的功能差异还集中在三羧酸循环,丙氨酸、天冬氨酸和谷氨酸代谢,胆固醇代谢等代谢相关途径。 Binger 等研究发现高盐饮食会抑制巨噬细胞的活化,并通过AKT/mTOR 信号通路破坏线粒体功能[33]。此外,有研究发现三羧酸循环途径受损与高盐摄入导致的ATP 生成减少以及氧消耗降低有关[34-35]。 而脂质代谢紊乱将直接导致过量饮食但体质量增长缓慢[36],多种代谢途径紊乱可能是本研究中高盐饮食组大鼠体质量低于空白对照组的关键原因。
多项研究发现了长期高盐饮食改变宿主肠道微生物群的组成[18,37-38]。 最近的研究发现,失调的肠道微生物群会产生血管活性激素并促进高血压的发生[39-40]。 本研究中发现在长期高盐饮食的影响下大鼠的肠道Actinomycetales 水平升高,这与之前一项针对高盐饮食喂养的小鼠肠道微生物群组成分析结果一致,这项研究还发现了肠道放线菌门与保护性SCFA 丁酸呈负相关, 肠道处于慢性炎症状态[18]。 而本研究中发现了高盐饮食组中丁酸的主要产生菌Ruminococcaceae 的相对丰度减少, 进一步验证了高盐饮食造成了保护性SCFA 丁酸含量的降低。 SCFA 在人类正常生理过程中起着关键作用,例如丁酸能够通过抑制IFN-γ/STAT1 信号通路、促进Foxp3 基因表达从而减弱组织炎症反应[41-43]。 此外,在一项针对高血压患者的肠道微生物群临床分析研究中发现,Betaproteobacteria 和Burkholderiales菌群丰度的降低与运动能力减弱显著相关[44],这与本研究中高盐饮食组大鼠的肠道菌群改变情况以及活动与精神状态表现一致,提示了一种新的高盐饮食所造成的高血压损伤表型,并可能与肠道菌群的改变密切相关。 除此之外,本研究中发现高盐饮食影响了多个微生物组代谢途径, 这与Miranda 等的研究结果[38]一致。 正常情况下,大约有5%的胆汁酸将在肠肝循环中作为肠道微生物群的转化底物参与体内循环,这些胆汁酸的正常代谢对维持结肠转录因子RORγ 和Treg 细胞的稳态至关重要[45-47]。此外,在多项关于高血压的研究中发现肠道微生物群的氨基酸代谢途径异常[38,48-49],这与本研究中高盐饮食所导致的高血压大鼠肠道菌群氨基酸代谢异常的结果一致。 作者探索了在高盐饮食影响下肠道微生物群的变化,这些潜在生物途径以及标志物对高盐饮食造成的肠道损伤以及微生物靶向治疗具有重要参考价值。
一些研究发现了肠道微生物群与炎症性肠病[50-51]、心血管疾病[52]和肾脏疾病[53-54]等多种疾病都存在一定的联系。 高盐饮食会破坏肠道屏障,导致肠道黏膜渗漏性增高,从而导致内毒素等细菌物质进入血液参与全身循环[55-57]。 本研究中发现,一些肠道微生物群与多个器官组织的基因表达具有显著相关性。比如,Sutterella 与结肠中Nr0b2、Hopx 的表达高度相关,这些基因主要与代谢功能以及IFN-γ 的转录激活密切相关[58-60]。 有多个研究证实,Sutterella 与血压独立相关,并影响肠道免疫调节功能[61-63]。 此外,本研究发现Lactobacillus 与多个组织中的差异转录因子表达高度相关。 目前的证据表明,Lactobacillus与肠道黏膜免疫和屏障功能密切相关[38]。 目前宿主基因与肠道微生物群的相互作用机制尚不完全清楚,了解微生物与基因组之间的共表达关系有助于解释高血压复杂的病因和发病机制。 本研究为揭示高盐饮食引起的宿主-菌群串扰提供了可靠的参考依据。
本研究的局限性在于没有对大鼠代谢组学进行进一步检测,基因组、微生物组以及代谢组的联合分析能够提供更加完备的参考依据。 此外,本研究中微生物组检测样本来源于大鼠粪便,进一步采用结肠内容物进行分析能够更有效地避免相关干扰因素。 总之,基于多组学分析揭示了在高盐饮食作用下高血压靶器官基因表达和肠道微生物群的变化。
3 结 语
本研究中发现的一系列失调差异转录因子和肠道菌群有助于解释高盐饮食在高血压疾病发展过程中的分子调控机制,高盐饮食造成的大鼠肠道菌群组成和功能的显著变化与多种微生物代谢功能失调密切相关。 创新的多组学关联分析为探索高血压及其相关疾病的分子机制提供了理论和实验基础,并为肠道菌群的靶向治疗提供了实验依据。

