枸杞多糖体外调节人体肠道菌群的功能研究
关天越, 任怡琳,2, 管祺杰, 史劲松, 许正宏, 耿 燕*
(1. 江南大学生命科学与健康工程学院 江苏 无锡 214122; 2. 江南大学附属医院消化内科, 江苏 无锡 214122;3. 江南大学生物工程学院,江苏 无锡 214122 )
枸杞是茄科、枸杞属植物,是我国传统的药食两用植物,其中栽培范围最广的宁夏枸杞,主要分布在我国西北地区[1]。 枸杞果实是人们日常食用的主要部分[2-3]。 枸杞多糖(LBP)是从果实中提取的枸杞最主要活性成分,具有广泛的药理学作用,包括抗氧化、抗疲劳、抗衰老、抗肿瘤、保护肝脏、降血脂等功能[4-6]。 多糖作为一种大分子活性物质往往不能在胃与小肠处分解,需经肠道菌群的分解才能被人体利用[7]。 人体内肠道微生物能够协助宿主完成大量的生理生化功能,被称为人体的另一大器官[8],其数量约为人体细胞数量的10 倍。 因此,研究枸杞多糖对人体肠道菌群结构和功能的影响对探究枸杞多糖的药理活性具有重要的价值。
1 材料与方法
1.1 试剂与主要仪器
枸杞粗多糖:百瑞源公司产品;AKTA 蛋白质纯化系统、DEAE -Sepharose Fast Flow 10/16 柱、Sephadex G-75 葡聚糖凝胶柱: 美国GE 公司产品;UPLC 系统(LC-30A):日本岛津公司产品。
1.2 枸杞多糖的制备
将购置的枸杞粗多糖溶于蒸馏水中,并不断搅拌使多糖充分溶解, 使最终料液质量体积比为1 g∶5 mL,设置提取温度为50 ℃,提取时间为120 min,过滤浓缩后加入乙醇,多糖溶液与乙醇溶液体积比为1∶4,并在4 ℃的条件下静置过夜,溶液离心取沉淀干燥后得实验用枸杞粗多糖[9-10],再应用Sevage法除蛋白质。使用氯仿、正丁醇试剂以4∶1 的体积比配制Sevage 溶液,Sevage 溶液与糖溶液以1∶1 的体积比混合,搅拌4 h 后,上层溶液为多糖溶液,中间层为蛋白质层,下层溶液为有机试剂,重复此操作3次至中间层无蛋白质析出[11]。 再对上层多糖溶液进行脱色处理,将大孔树脂置于大烧杯中,使乙醇完全浸没树脂,并不断搅拌,以除去气泡,使之充分混合,静置24 h;之后对树脂进行水洗、酸洗、碱洗;大孔树脂洗净后,以大孔树脂和多糖溶液1∶20 的体积比加入多糖溶液,搅拌1 h,抽滤回收滤液,滤液冷冻干燥后,进行下一步纯化。
1.3 枸杞多糖的纯化
使用AKTA 蛋白质纯化系统对多糖进行纯化处理[12-13]。 首先使用离子交换柱进行分离,分离柱选择DEAE-Sepharose Fast Flow 10/16 柱, 超纯水(A洗脱液)和1 mol/L NaCl 溶液(B 洗脱液)作为流动相进行梯度洗脱,自动收集器进行收集。 用苯酚-硫酸法测定溶液中多糖的质量浓度,绘制对应的洗脱曲线,并合并同一洗脱峰下的各管洗脱液,旋蒸浓缩并冷冻干燥,得到不同组分的洗脱样品[14]。之后利用相对分子质量差异对已分离出的各组分再次进行分离纯化, 纯化柱选择Sephadex G-75 葡聚糖凝胶柱, 使用0.1 mol/L NaCl 溶液作为流动相进行洗脱,使用自动收集器收集流出液。 用苯酚-硫酸法测定多糖的质量浓度,并绘制对应的洗脱曲线,合并同一洗脱峰下的各管洗脱液,旋蒸浓缩,透析48 h,每12 h 更换超纯水,之后冷冻干燥得到纯化后的枸杞多糖样品。
1.4 体外模拟厌氧发酵
取6 名在3 个月内未接受抗生素治疗的健康人(男女志愿者各3 人)粪便样本,在PBS 溶液中离心重悬,制备成肠道菌群种子进行体外模拟厌氧发酵。 本实验已通过江南大学医学院伦理审核(JNU20210618IRB19)。 厌氧发酵培养基为8.0 g/L可溶性淀粉、4.5 g/L 酵母抽提物、3.0 g/L 胰蛋白胨、3.0 g/L 蛋白胨、0.4 g/L 胆盐3 号、0.8 g/L L-半胱氨酸盐、0.5 g/L 三氯化铁红霉素、4.5 g/L 氯化钠、2.5 g/L 氯化钾、0.45 g/L 六水合氯化镁、0.2 g/L 六水合氯化钙、0.4 g/L 磷酸二氢钾、1.0 mL/L 吐温80 和2.0 mL/L 微量元素溶液,调节pH 至6.5,121 ℃灭菌20 min。 在厌氧发酵瓶中静置48 h 后进行接种,其中,多糖组枸杞多糖加入量为2 g/L。 空白对照的厌氧发酵瓶与加入枸杞多糖的厌氧发酵瓶分别为9个,接种的菌种种子分别为6 名志愿者提供的单独样本与6 名志愿者样本经混合后的等微生物量的3个混合样本。 其中,空白对照组为CTRL 组、混合种子空白对照组为CTRLMIX 组、 枸杞多糖组为LBP组、混合种子枸杞多糖组为LBPMIX 组。 CTRL 空白对照组与LBP 枸杞多糖组皆为6 名志愿者的样本单独放入厌氧发酵瓶进行发酵(n=6)。 CTRLMIX 混合种子空白对照组与LBPMIX 混合种子枸杞多糖组,皆为6 名志愿者的样本经混合后等微生物量加入厌氧发酵瓶中发酵 (n=3)。 总空白对照组为TCTRL 组,总枸杞多糖组为TLBP 组(n=9)。
1.5 发酵液短链脂肪酸的测定
取接种后的肠道微生物体外模拟厌氧发酵液,于1 000 r/min 离心5 min, 吸取上清液并经0.22 μm 滤膜过滤后4 ℃保存。 参照文献[15]通过UPLC系统测定发酵液中的短链脂肪酸浓度, 色谱柱为InertSustain AQ-C18(150 mm×2.1 mm,1.9 μm),流量0.5 mL/min,检测波长210 nm,柱温40 ℃,进样量10 μL。 洗脱液A 液为20 mmol/L 的NaH2PO4溶液,B 液为乙腈。 UPLC 的洗脱程序为0 min 时A 液体积分数为95%, 在10 min 时A 液体积分数线性下降至60%,之后不变至12 min,分析程序结束。
1.6 16S rRNA 基因高通量测序与数据统计学分析
选择菌群16S rRNA 基因的测序区域为V3~V4区。 取微生物基因组DNA 样品与对应的融合引物配制PCR 反应体系,设置PCR 反应参数进行扩增,之后使用Agencourt AMPure XP 磁珠对扩增产物纯化, 纯化后完成cDNA 文库的建立。 使用Agilent 2100 Bioanalyzer 对文库的片段范围及浓度进行检测。检测合格的文库根据插入片段大小,使用HiSeq平台测序。 应用DADA2 聚类方法, 通过去噪的序列,并以100%的相似度聚类生成ASV 序列。
两组之间显著性差异比较应用Wilcox Test 方法,3 组及以上比较用Kruskal Test 方法,当P<0.05时表示实验具有统计学差异。 通过华大基因公司的微生物扩增子系统(http://meta.bgi.com) 分析处理16S rRNA 基因测序数据。 并应用GraphPad Prism 8.0 进行绘图与统计学分析。 16S rRNA 基因测序数据汇交至国家微生物科学数据中心数据库(https://nmdc.cn/)。 生物项目正式编号为NMDC10017931,生物样本正式编号为NMDC20029604。
2 结果与分析
2.1 枸杞多糖对肠道微生物群落多样性的影响
经AKTA 蛋白质纯化系统纯化得到了LBP(见图1 和图2)。 利用人体肠道菌群体外发酵体系及16S rRNA 基因扩增子测序, 研究LBP 对肠道微生物群落多样性的影响。 首先利用Chao1 指数、ACE指数、Shannon 指数和Simpson 指数来判断LBP 对肠道微生物的α-多样性的影响。 如图3 所示,LBP组和LBPMIX 组的Chao1 指数与ACE 指数均显著上升(P<0.05),Shannon 指数也呈上升趋势,Simpson指数则呈下降趋势。以上结果表明LBP 能够明显提高肠道菌群的多样性。
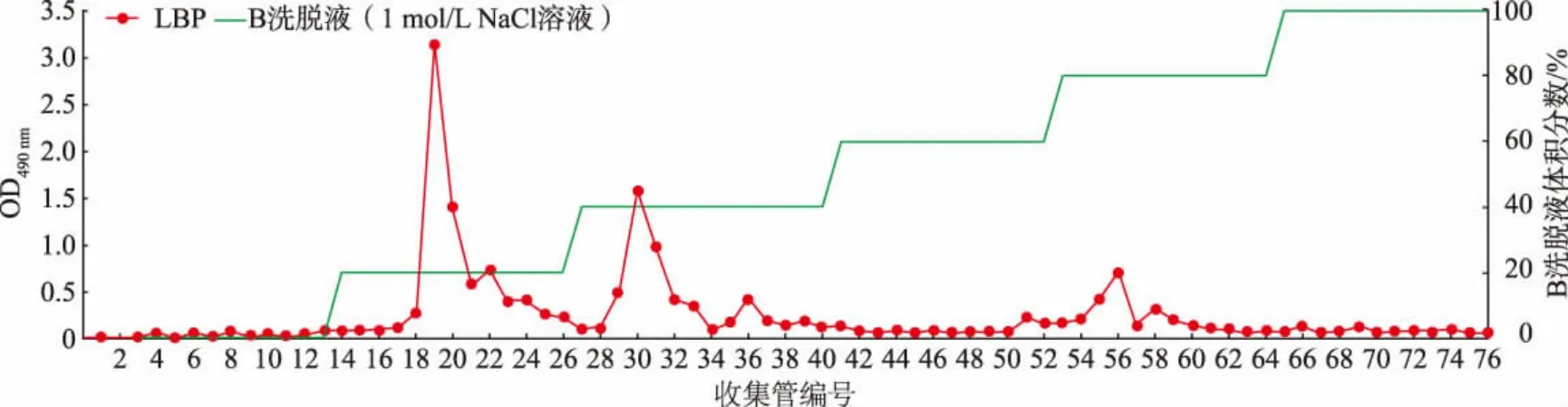
图1 DEAE-Sepharose Fast Flow 离子交换柱色谱分离Fig. 1 Chromatographic separation of DEAE-Sepharose Fast Flow ion exchange column
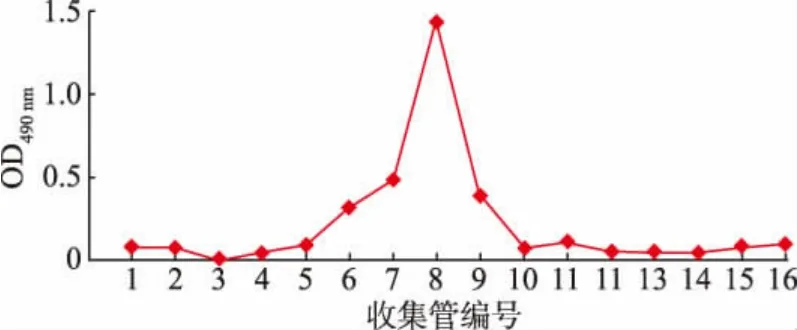
图2 Sephadex G-75 葡聚糖凝胶柱色谱分离Fig. 2 Chromatographic separation of Sephadex G-75 sephadex column
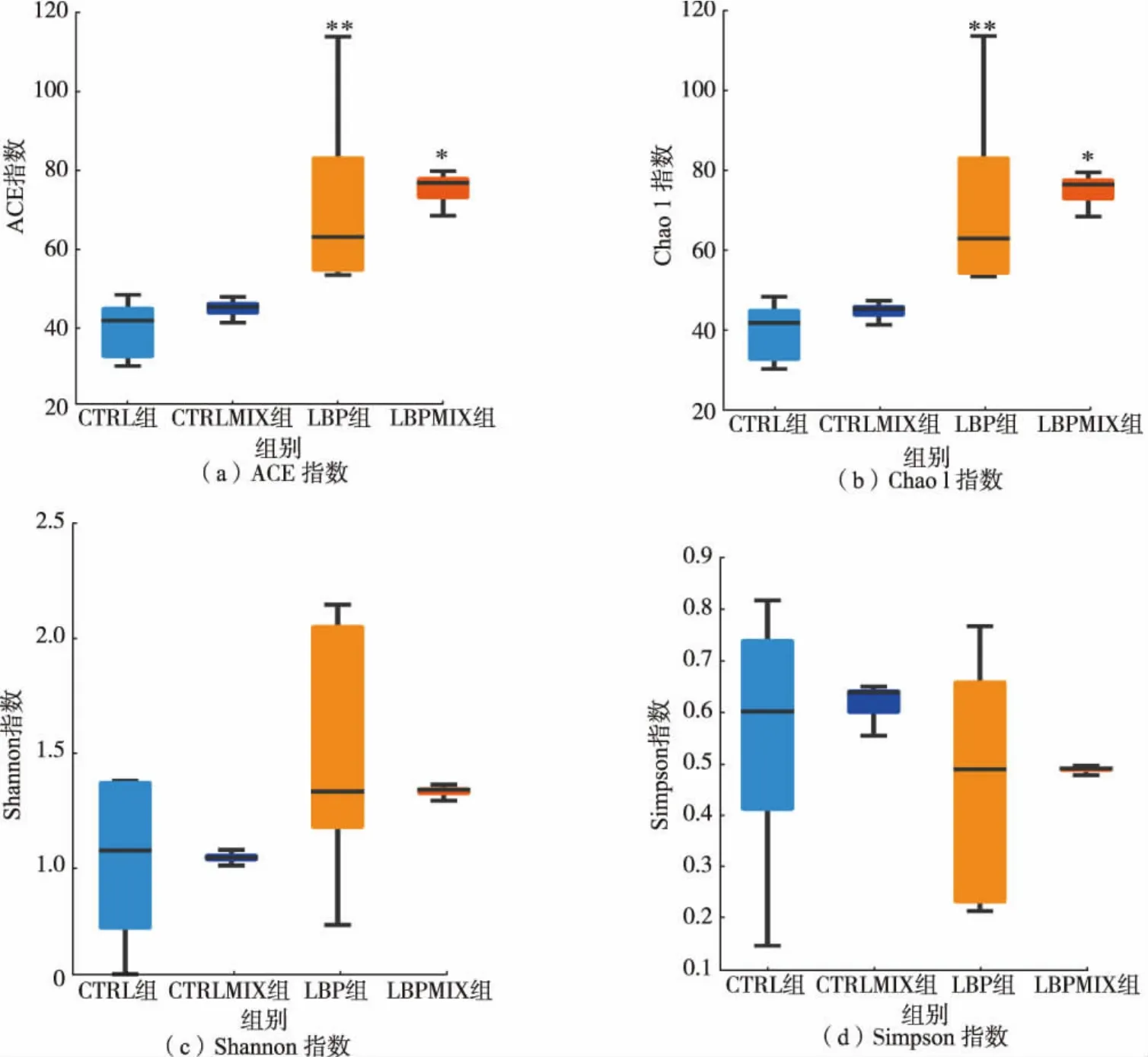
图3 体外发酵的人体肠道微生物菌群的α-多样性Fig. 3 α-Diversity of human gut microbiota produced by in vitro fermentation
为了研究肠道微生物的β-多样性的差异,基于ASV 进行主成分分析(PCA),结果如图4 所示。枸杞多糖组与空白对照组分别位于PC1 的两侧,两组的混合种子发酵样本同样在图上分离明显,并分别呈现聚集状态。 其中CTRLMIX 组和LBPMIX 组组的样本分别显示了很好的聚集, 但未与CTRL 组和LBP 组明显分开,说明将志愿者样本的混合处理虽提高了菌群结构的稳定性但并没有与单独发酵的样本有显著差异,但是含LBP 的体外发酵显著改变了肠道菌群的结构。
2.2 枸杞多糖对肠道微生物物种差异的影响
利用线性判别分析 (linear discriminant analysis effect size,LEfSe 分析),研究添加LBP 后与空白对照组相比具有差异性的肠道微生物。 如图5所示,TLBP 组在属水平上具有显著性差异(LDA>2,P<0.05)的有乳酸杆菌属(Lactobacillus)、双歧杆菌属(Bifidobacterium)、瘤胃球菌属(Ruminococcus)、布劳特氏菌属(Blautia)、多尔氏菌属(Dorea)、毛螺菌属 (Lachnospiracea_incertae_sedis)、 肠单胞菌属(Intestinimonas)、罗氏菌属(Roseburia)等。而丰度降低的有小杆菌属 (Dialister) 、 氨基酸球菌属(Acidaminococcus)与有害的肠道致病菌属克雷伯氏菌属(Klebsiella)等[16]。
2.3 枸杞多糖对肠道菌群功能差异的预测分析
通过京都基因与基因组百科全书(KEGG)通路功能预测含LBP 的体外发酵对肠道菌群功能差异的影响。 如图6 所示,LBP 添加到肠道菌群体外发酵体系后,显著影响了菌群与初级和次级胆汁酸代谢(primary and secondary bile acid biosynthesis)、蛋白质的消化吸收(protein digestion and absorption)、亚油酸代谢(linoleic acid metabolism) 和多糖代谢(other glycan degradation)等方面的功能(P<0.05)。

图6 肠道菌群的功能差异分析Fig. 6 Functional difference analysis of gut microbiota
2.4 枸杞多糖对肠道微生物代谢物短链脂肪酸(SCFAs)生成的影响
SCFAs 对于肠道健康有着重要的作用[17],也是多糖在肠道内发酵的产物[18]。 通过超高效液相色谱系统对发酵液中的短链脂肪酸进行检测,并将肠道内含量最丰富的SCFAs(如乙酸、丙酸与丁酸)的浓度进行比较。 TLBP 组的乙酸、丙酸与丁酸单独组分浓度和总短链脂肪酸浓度与TCTRL 组相比都具有显著性差别,结果如图7 所示。
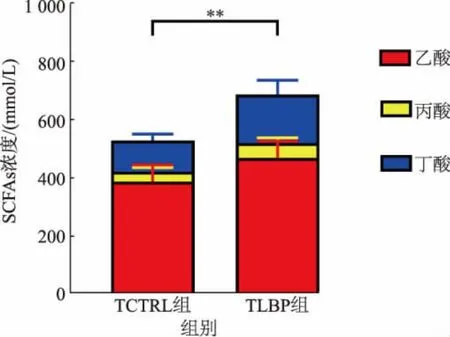
图7 发酵液中的短链脂肪酸(SCFAs)浓度Fig. 7 Concertation of short-chain fatty acids (SCFAs) in the fermentation broth
2.5 讨论
肠道微生物是位于肠道内部的庞大微生物群,肠道菌群的细胞数达100 万亿以上,种群至少存在1 000 种以上, 是人体拥有的最复杂的微生态系统[19]。而且它是一个对宿主健康至关重要生物反应器。 这些微生物在体内参与了宿主的营养代谢活动,并作为宿主代谢的重要参与者提供许多宿主所不能合成的代谢产物,调节机体的生化生理状态[20]。肠道菌群的相对丰度与菌株丰富度与人的健康息息相关,膳食调节被认为是改变微生物菌群结构的重要方式[21]。许多中草药对肠道菌群有显著促进作用,其对肠道菌群的调节能力可能是其药理作用的来源[22]。多糖作为一种活性物质具有改善肠道功能,枸杞多糖有可能以改变肠道微生物结构的方式发挥其药理功能[23]。
通过对模拟人类肠道微生物体外厌氧发酵体系进行测序分析来研究枸杞多糖对肠道微生物的作用。 菌群多样性数据显示了在发酵培养基中加入枸杞多糖后,菌群结构发生了明显变化,枸杞多糖提高了肠道菌群的丰度与多样性,并且混合种子样本的菌群丰度高于单一样本的菌群丰度。 从主成分分析可知,对菌群种子样本的混合可以提高发酵后肠道微生物的丰度与促进菌群结构的稳定。 并且枸杞多糖作为一种大分子活性物质可以有效影响人类的肠道微生物结构。 从两组的功能差异可以看出,肠道微生物的改变使一系列代谢相关的功能上调,改善了肠道的消化能力。
多糖代谢往往由多种微生物共同作用[24]。 根据LDA 值,在具有显著性的差异物种中,总枸杞多糖组的乳酸杆菌属和双歧杆菌属是著名的益生菌菌属,还有瘤胃球菌属、布劳特氏菌属、多尔氏菌属、毛螺菌属和罗氏菌属与多糖代谢、SCFAs 生成有关,这些菌在属水平上丰度的升高对肠道起到了调节作用。 乳酸杆菌是一种能够发酵产生大量乳酸的益生菌, 通过拮抗有害微生物来维持肠道菌群平衡,并且是一种能够产生SCFAs 的益生菌[25-26]。双歧杆菌同样是能够产生有机酸的益生菌,促进人体对一系列营养物质的吸收,并具有抗菌、抗癌、抗衰老、保护肝脏等功能[27]。这些益生菌影响人体的消化与健康[28-29]。 多糖在肠道代谢的终产物为SCFAs,其可以调节肠道生理功能,如维持肠道系统的正常功能和结肠上皮细胞的形态和功能、发挥抗炎作用并调节免疫系统、作为能量来源并改变菌群组成[30-31]。TLBP 组的SCFAs 显著性增加, 表明LBP 可能通过提高肠道SCFAs 的浓度发挥其药理作用[18,32]。 除产生SCFAs 外,枸杞多糖对肠道微生物结构及其功能的影响仍有待进一步研究。
3 结 语
综上所述,枸杞多糖能够提高人类肠道微生物的多样性,提高益生菌的丰度,降低肠道内致病菌的丰度, 并促进碳水化合物代谢菌产生短链脂肪酸,最终调节机体的健康。

