耐盐芽孢杆菌R1 高效壳聚糖酶异源表达及特性分析
王建荣, 王永华, 祝木金, 王 平, 陈 微, 余 思, 钟 斌
(1. 深圳润康生态环境股份有限公司, 广东 深圳 518102;2. 华南理工大学食品科学与工程学院, 广东 广州 510641;3. 深圳诺普信农化股份有限公司,广东 深圳 518102)
作为一种生物多糖,几丁质来源广泛,据统计,每年自然界产生的几丁质多达数百亿吨[1]。 几丁质由于溶解性太差,限制其产业化应用。 几丁质脱去乙酰基团形成的壳聚糖可以溶于稀酸,提升其应用价值,但是黏度高、溶水性差等缺点还是限制其进一步推广和应用[1]。 壳寡糖作为壳聚糖的降解产物,聚合度一般在2~20,相比于壳聚糖,壳寡糖具有低黏度、良好的水溶性以及生物可降解性等优势[2]。 研究表明,壳寡糖具有抗炎症、抗肿瘤、抑菌、抗氧化等功效,因此可广泛应用于食品、医药、绿色农业种植等领域[3-4]。 目前壳寡糖的制备方式可分为化学法、物理法和酶法三大类,相比另外两种方法,化学法速度快、成本低,因此产业化应用以化学法为主[5]。 随着对壳寡糖研究的深入,越来越多的研究人员提倡酶法制备壳寡糖, 酶法工艺具有绿色环保、反应过程和产物可控、产物结构完好等优势[5]。 但是较高的生产成本限制了酶法工艺的推广应用,因此降低酶法工艺成本,寻找高效壳聚糖酶具有重要意义。
壳聚糖酶能够分解壳聚糖形成壳寡糖,壳聚糖酶来源广泛,已报道的壳聚糖酶主要来源于细菌和真菌。 根据蛋白质结构特性,壳聚糖酶可细分为多个家族,其中46 家族壳聚糖酶因具有催化效率高、反应条件温和等优点,在许多领域具有良好的应用价值[6-7]。46 家族壳聚糖酶主要来源于细菌,迄今,已有多种46 家族壳聚糖酶被分离纯化以及特性表征。 来源于芽孢杆菌的壳聚糖酶作为46 家族重要组成部分, 前期的研究主要集中在萎缩芽孢杆菌、蜡样芽孢杆菌、莫海威芽孢杆菌、解淀粉芽孢杆菌和枯草芽孢杆菌[8-12],而关于耐盐芽孢杆菌壳聚糖酶的研究还未有报道。 本研究以前期筛选到的耐盐芽孢杆菌R1 为研究对象, 通过同源克隆获得耐盐芽孢杆菌R1 壳聚糖酶基因(csnbh46),通过毕赤酵母异源表达获得重组耐盐芽孢杆菌壳聚糖酶CsnBh46,此外对重组CsnBh46 进行表征分析,为其下一步研究和产业化应用奠定基础。
1 材料与方法
1.1 菌种、质粒以及试剂
耐盐芽孢杆菌R1(分离自土壤,保存于-60 ℃低温冰箱):作者所在实验室提供;大肠杆菌Top10感受态细胞:宝日医生物技术(北京)有限公司产品;表达载体pPICZαA、毕赤酵母X33:美国赛默飞世尔科技公司产品。
限制性内切酶Sac I、EcoR I、Not I:宝日医生物技术(北京)有限公司产品;Ni-IDA 蛋白质纯化试剂盒:上海生工股份有限公司产品;壳聚糖、氨基葡萄糖、几丁质、木聚糖、羧甲基纤维素钠:上海源叶生物科技有限公司产品;不同聚合度壳寡糖(聚合度2~6): 惠州长龙生物技术有限公司产品;Silica gel 60 F254 薄层层析硅胶板:德国默克公司产品;其他试剂均为国产分析纯。
实验过程中所用的培养基主要包括LBZ 培养基、YPDZ 培养基、BMGY 培养基、BMMY 培养基和BSM 培养基,所有培养基的配制均参照前期报道方法[13]。
1.2 仪器与设备
PCR 仪:美国应用生物系统(ABI)公司产品;凝胶成像系统、电转化仪:美国伯乐公司产品;核酸浓度测定仪: 北京百泰克生物技术有限公司产品;7 L发酵罐: 镇江东方生物工程设备技术公司产品;紫外分光光度计:日本岛津公司产品;UltiMate3000 高效液相色谱仪:美国赛默飞世尔科技公司产品。
1.3 方法
1.3.1 耐盐芽孢杆菌R1 壳聚糖酶基因克隆及分析将前期保藏于-60 ℃冰箱的耐盐芽孢杆菌R1 取出活化, 以单菌落的形式接入LB 液体培养基进行培养, 吸取50 μL 培养好的菌液,98 ℃热处理5 min后作为PCR 扩增模板。根据耐盐芽孢杆菌KKD1 基因组中假定壳聚糖酶基因序列 (基因登录号:CP054584.1,1 312 385~1 313 226) 设计一对引物(csnbh46-fw:5′-ATGAAAATCAGTTTGGAGAAA-3′和csnbh46-rev:5′-TTATTTGATTACGAAATCACC-3′)用于PCR 扩增。 以处理好的菌液为扩增模板,通过PCR 扩增获得目标产物,通过琼脂糖凝胶电泳对目标PCR 产物进行纯化回收,将纯化回收后的PCR产物送至广州艾基生物有限公司进行测序分析,根据测序结果获得壳聚糖酶基因csnbh46。
1.3.2 耐盐芽孢杆菌壳聚糖酶CsnBh46 序列分析通过NCBI 数据库完成壳聚糖酶基因csnbh46 序列比对分析;通过expasy 平台提供的软件完成壳聚糖酶CsnBh46 理化性质及基础结构分析;通过在线软件SignalP-5.0 Server 完成信号肽分析;通过在线软件SWISS-MODEL 完成壳聚糖酶CsnBh46 三维建模; 通过软件Autodockviner 完成壳聚糖酶CsnBh46和底物对接分析; 通过软件PyMOL 分析壳聚糖酶CsnBh46 三维结构。
1.3.3 重组工程菌构建及筛选 由于在毕赤酵母X33 中进行重组表达, 因此根据毕赤酵母密码子偏好性进行序列优化。 优化后的基因序列 (命名为csnbh46s, 不含信号肽编码序列) 由通用生物系统(安徽)有限公司合成。合成过程中在csnbh46s 基因序列两端添加EcoR I 和Not I 酶切位点, 此外去掉csnbh46s 基因序列自身终止密码子, 将合成的csnbh46s 基因和载体pPICZαA 进行连接反应,获得表达载体 pPICZαA-csnbh46s。 将表达载体pPICZαA-csnbh46s 用限制性内切酶Sac I 线性化后,转入毕赤酵母X33 感受态细胞中,将转化后的毕赤酵母X33 感受态细胞涂布于YPDZ 固体培养基,30 ℃静置培养。 参照前期报道的方法进行筛选实验[13],最终确定1 个重组工程菌进行高密度发酵培养。
1.3.4 高密度发酵 高密度发酵培养在7 L 发酵罐中进行,实验过程如下:1)将重组工程菌以单菌落形式接入YPDE 培养基中过夜培养(200 r/min、30 ℃),作为一级种子液;2)将一级种子液按1%的接种体积分数接入含有100 mL YPD 培养基的500 mL 摇瓶中,200 r/min、30 ℃培养至OD600nm值达到6~10;3)将培养好的菌液按照10%的接种体积分数接入7 L 发酵罐中进行培养;4)初始阶段补加甘油作为碳源供菌体生长,当菌体质量浓度(以菌体湿质量计)增加至181 g/L,停止流加甘油,开始补加甲醇进行诱导培养;5)培养过程中每隔24 h 取样进行酶活力、总蛋白质质量浓度以及细胞质量浓度的测定,测定过程和前期报道方法一致[8]。
1.3.5 重组CsnBh46 分离纯化及酶动力学参数测定重组CsnBh46 纯化参照文献[8]的方法进行。 通过超滤管(相对分子质量1.0×104)对高密度发酵上清液进行浓缩。 以浓缩好的酶液为对象,利用Ni-IDA 蛋白质纯化试剂盒获得纯化后重组CsnBh46。 测定重组CsnBh46 对不同质量浓度胶体壳聚糖(1~10 mg/mL)的反应速度,通过软件GraphPad Prism 8.0.2 拟合分析获得相关酶动力学参数,如米氏常数Km、最大反应速度vmax等。
1.3.6 重组CsnBh46 特性测定 重组CsnBh46 最适反应pH 测定如下:在55 ℃、不同pH 条件下(pH 3.5~6.0 时为0.05 mol/L 乙酸乙酸钠缓冲液,pH 6.5~7.0 时为0.05 mol/L 磷酸缓冲液)测定纯化后重组CsnBh46 酶活力,参照前期报道方法[8]计算相对酶活力;pH 稳定性测定如下: 将纯化后重组CsnBh46 在25 ℃、不同pH 条件下(pH 3.0~11.0)处理4 h 后测定剩余酶活力。 重组CsnBh46 最适反应温度测定如下:在pH 6.0 条件下,测定纯化后重组CsnBh46 在不同温度(40~70 ℃)的酶活力,参照前期报道方法[8]计算相对酶活力;将纯化后重组CsnBh46 在45~60 ℃条件下水浴处理30 min 和60 min 后,测定剩余酶活力。不同金属离子对纯化后重组CsnBh46 稳定性影响参照前期报道方法[8]。 以不同脱乙酰度胶体壳聚糖、几丁质、羧甲基纤维素钠、木聚糖为底物,分别测定纯化后重组CsnBh46 酶活力,将测得的最高酶活力设置为100%,计算相对酶活力。
1.3.7 重组CsnBh46 水解特性分析 以5 g/dL 不同聚合度壳寡糖(壳二糖至壳六糖)为底物,参照前期报道的方法[8,14]研究重组CsnBh46 水解特性。
1.3.8 不同聚合度壳寡糖可控性制备 以脱乙酰度95%胶体壳聚糖为底物,通过重组CsnBh46 可控性制备不同聚合度壳寡糖。 首先, 摸索不同重组CsnBh46 添加量(5~25 U/mL)对不同质量浓度胶体壳聚糖(1~3 g/dL)的水解效果。 总反应体系为10 mL,在55 ℃、100 r/min 反应1 h 后取样进行分析。 其中水解率和产物组成测定均参照前期报道方法[15-16]。其次,在55 ℃、100 r/min 条件下,以质量浓度3 g/dL胶体壳聚糖为底物, 重组CsnBh46 添加量为10 U/mL, 解析反应过程中水解率和产物组成动态变化。
2 结果与分析
2.1 壳聚糖酶基因csnbh46 序列分析
结合测序结果以及NCBI 比对分析, 发现csnbh46 基因全长837 bp,编码278 个氨基酸。通过软件ProtParam 预测,CsnBh46分子式为C1390H2172N382O426S8,蛋白质相对分子质量为31 300。 NCBIblastp 比对结果显示CsnBh46 与枯草芽孢杆菌壳聚糖酶(WP_133486751.1)相似性为93.1%,与萎缩芽孢杆菌壳聚糖酶 (WP_088117259.1) 相似性为91.2%。NCBIblastp 比对结果表明CsnBh46 属于糖苷水解酶46 家族。 将CsnBh46 与已经获得晶体的壳聚糖酶(包括链霉菌174 壳聚糖酶Csn174,P33665.1;链霉菌SirexAA-E 壳聚糖酶Csn5457,AEN13266.1;环状芽孢杆菌壳聚糖酶CsnBac,P33673.2; 枯草芽孢杆菌壳聚糖酶CsnMY002,WP_148982050.1)进行比对分析,实验结果如图1 所示。 虽然不同微生物来源的壳聚糖酶氨基酸序列差异性大,但是酶催化活性位点高度保守,根据比对结果以及之前的文献报道[17],推测第55 位的谷氨酸和第71 位的天冬氨酸为CsnBh46 催化活性位点。此外,SignalP-5.0 Server 预测CsnBh46 前36 个氨基酸为其潜在信号肽序列。

图1 壳聚糖酶CsnBh46 与46 家族壳聚糖酶蛋白质比对分析Fig. 1 Protein comparative analysis of chitosanase CsnBh46 and glycoside hydrolase family 46
以枯草芽孢杆菌壳聚糖酶CsnMY002 (PDB 登录号为7C6C) 为模板, 通过在线软件SWISSMODEL 建模,获得CsnBh46 三维构象(见图2(a))。和已报道的壳聚糖酶一致[18],CsnBh46 三维结构呈球状,主要由α 螺旋构成,其中α2~α4 构成上半球;下半球主要有α1、α6~α9 和2 个β 折叠构成; 上下两个半球由长螺旋α5 连接。 CsnBh46 和壳六糖分子对接由Autodockviner 完成。 由图2(b)可知,CsnBh46 底物结合区域呈孔洞状态, 壳六糖被包裹在底物结合区域。 由图2(c)可知,CsnBh46 底物结合区域与壳六糖之间的作用力主要是氢键,其中多个关键氨基酸在水解过程中发挥重要作用。
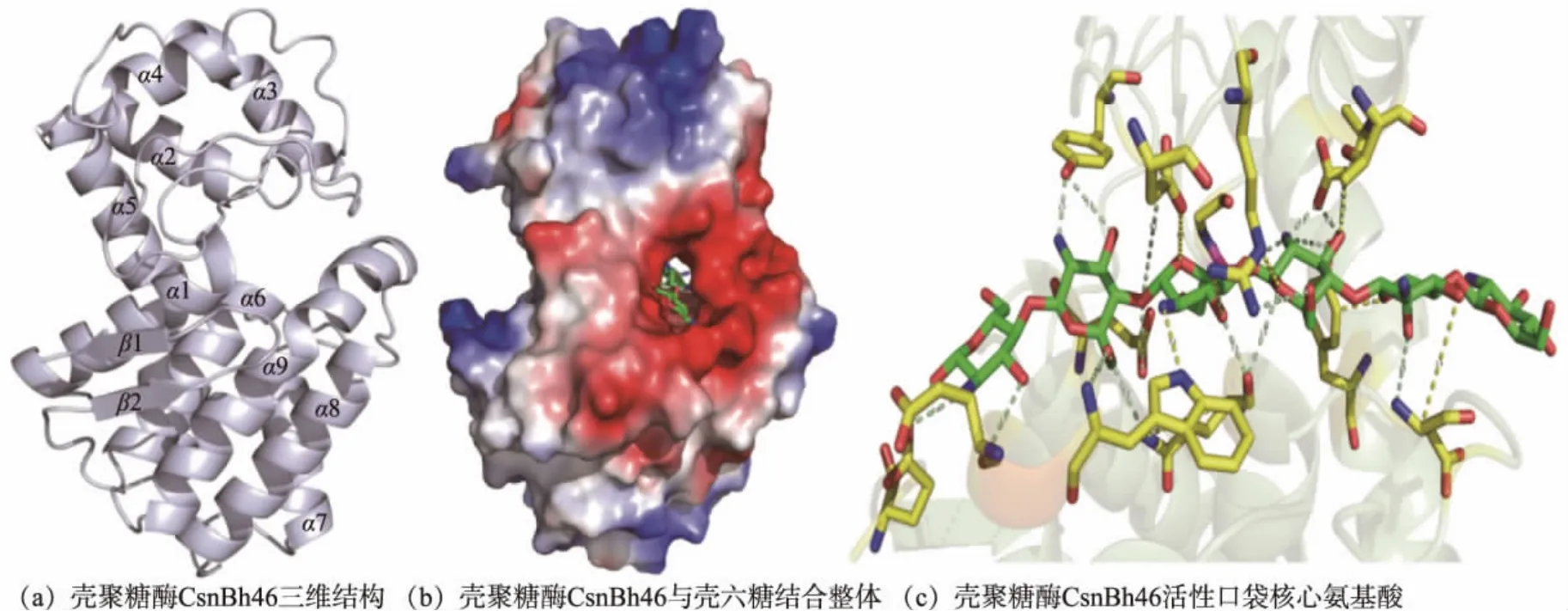
图2 壳聚糖酶CsnBh46 结构分析Fig. 2 Structure analysis of chitosanase CsnBh46
2.2 重组工程菌构建及筛选
由于在毕赤酵母X33 中进行重组表达,因此选择毕赤酵母最经典的α 信号肽替代CsnBh46 自身信号肽。 此外通过分析,发现耐盐芽孢杆菌和毕赤酵母密码子偏好性存在差异,因此需要根据毕赤酵母密码子偏好性进行序列优化。 通过密码子优化,将原始基因csnbh46 的GC 含量由45.1%提升至48.2%, 更接近毕赤酵母高效表达最适范围 (约50%),密码子适用指数(CAI)由0.62 提升至0.78,整个过程对179 个碱基进行了优化(见图3)。 优化后的基因连接至载体pPICZαA, 获得表达载体pPICZαA-csnbh46s。将表达载体pPICZαA-csnbh46s线性化后转入毕赤酵母X33 获得多个重组转化子。初步筛选挑取96 个转化子,通过酶活力测定分析,最终选取3 个高酶活力重组工程菌 (分别命名为bh-5、bh-65 和bh-73)进行复筛。 复筛采用摇瓶培养,诱导时间均为120 h,摇瓶复筛结果显示重组工程菌bh-5 发酵酶活力最高(125 U/mL),其次为bh-73(105 U/mL)和bh-65(101 U/mL)。

图3 csnbh46 基因密码子优化序列分析Fig. 3 Sequence analysis of optimized and native gene of csnbh46
2.3 重组工程菌高密度发酵
选取重组工程菌bh-5 进行高密度发酵, 实验在7 L 发酵罐中进行。 由图4(a)可知,在诱导培养168 h 后,重组工程菌bh-5 的酶活力、总蛋白质质量浓度和细胞质量浓度均达到最高, 分别为6 375 U/mL、4.3 g/L 和465 g/L。 相比摇瓶培养,重组工程菌bh-5 在7 L 发酵罐发酵后的酶活力提升了50倍。由图4(b)可知,发酵上清液中存在两条主要蛋白质条带,相对分子质量分别约为3.3×104和2.7×104,推测相对分子质量3.3×104条带是由蛋白质翻译过程中糖基化形成的。 由图4(c)可知,重组CsnBh46去糖基化后只剩下一条相对分子质量约为2.7×104的条带,表明重组CsnBh46 存在糖基化修饰。此外发酵上清液中基本为重组CsnBh46(见图4(b))。
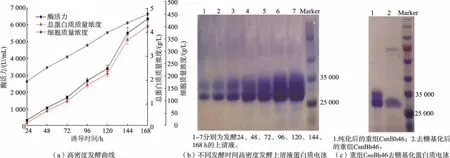
图4 重组菌bh-5 在7 L 发酵罐发酵曲线及不同样品SDS-PAGE 蛋白质电泳Fig. 4 Fermentation curve and SDS-PAGE analysis of different samples of recombinant strain bh-5 cultivated in 7 L bioreactor
2.4 分离纯化、酶动力学参数及底物特异性测定
通过实验获得纯化重组CsnBh46, 纯化后的重组CsnBh46 酶比活为2 310 U/mg,重组CsnBh46 酶反应动力学参数如表1 所示。重组CsnBh46 米氏常数Km为0.75 mg/mL, 表明重组CsnBh46 对壳聚糖具有良好的亲和力。 最大反应速度vmax为2 513 μmol/(L·min·mg), 表明重组CsnBh46 能够高效水解壳聚糖。

表1 重组CsnBh46 酶动力学参数Table 1 Kinetic parameters of recombinant CsnBh46
2.5 温度特性
重组CsnBh46 温度特性如图5 所示,由图5(a)可知,重组CsnBh46 最适反应温度为60 ℃,在50~65 ℃时相对酶活力均大于80%。 由图5(b)可知,重组CsnBh46 在45~55 ℃时具有良好的稳定性,水浴处理1 h 后,剩余酶活力均大于80%,当处理温度大于55 ℃,剩余酶活力急剧下降,重组CsnBh46 在60 ℃水浴处理1 h 后,剩余酶活力仅为11%。 有研究报道萎缩芽孢杆菌壳聚糖酶Csn-SH[18]、解淀粉芽孢杆菌壳聚糖酶BaCsn46A[15]和BaCsn46B[11],在55 ℃热处理30 min 后, 剩余酶活力分别为7%、31%和60%。 相比于上述芽孢杆菌壳聚糖酶, 重组CsnBh46 具有更好的热稳定性。
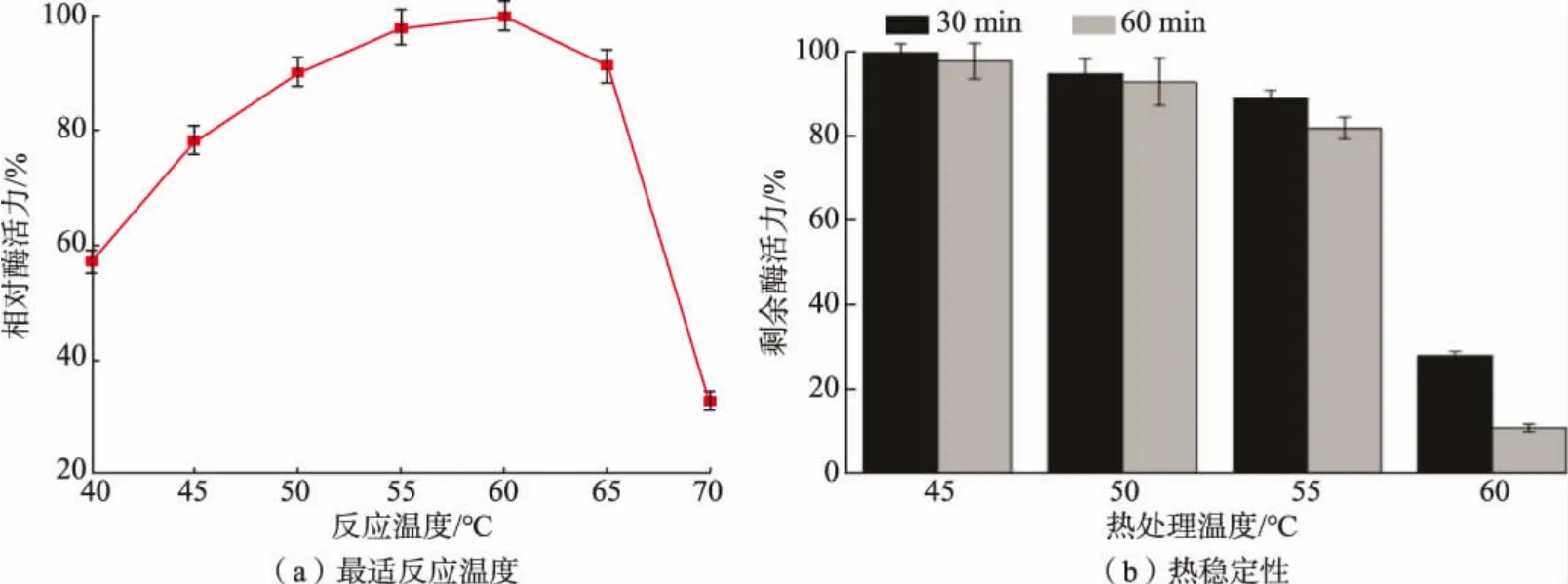
图5 温度对重组CsnBh46 的影响Fig. 5 Effect of temperature on recombinant CsnBh46
2.6 pH 特性
重组CsnBh46 的pH 特性如图6 所示, 由图6(a)可知,重组CsnBh46 最适反应pH 为6.0。 由图6(b)可知,重组CsnBh46 在pH 6.0~8.0 时具有良好的稳定性, 室温放置4 h 后, 剩余酶活力均大于80%。 重组CsnBh46 的pH 特性与已报道的吉氏菌壳聚糖酶相似[19]。
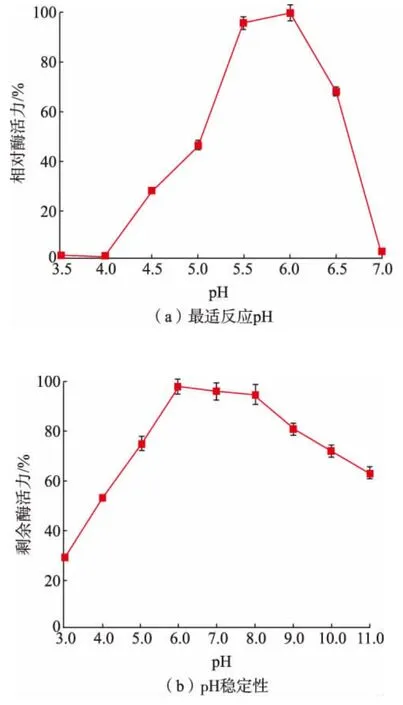
图6 重组CsnBh46 最适反应pH 和pH 稳定性Fig. 6 Optimal reaction pH and pH stability of recombinant CsnBh46
2.7 金属离子特性
不同金属离子对重组CsnBh46 稳定性影响如表2 所示。 Mn2+、Mg2+和Ca2+对重组CsnBh46 具有激活作用, 其中Mn2+效果最好。 在1 mmol/L 条件下,Mn2+、Mg2+和Ca2+处理组剩余酶活力分别为145.2%、111.5%和115.5%;在5 mmol/L 条件下,Mn2+、Mg2+和Ca2+处理组剩余酶活力分别为164.8%、118.6%和123.2%。 金属离子Cu2+、Fe2+和Co2+对重组CsnBh46具有抑制作用,其中Fe2+的影响最大。当离子浓度为1 mmol/L 和5 mmol/L 时,Fe2+处理组的剩余酶活力分别仅为26.6%和8.5%。
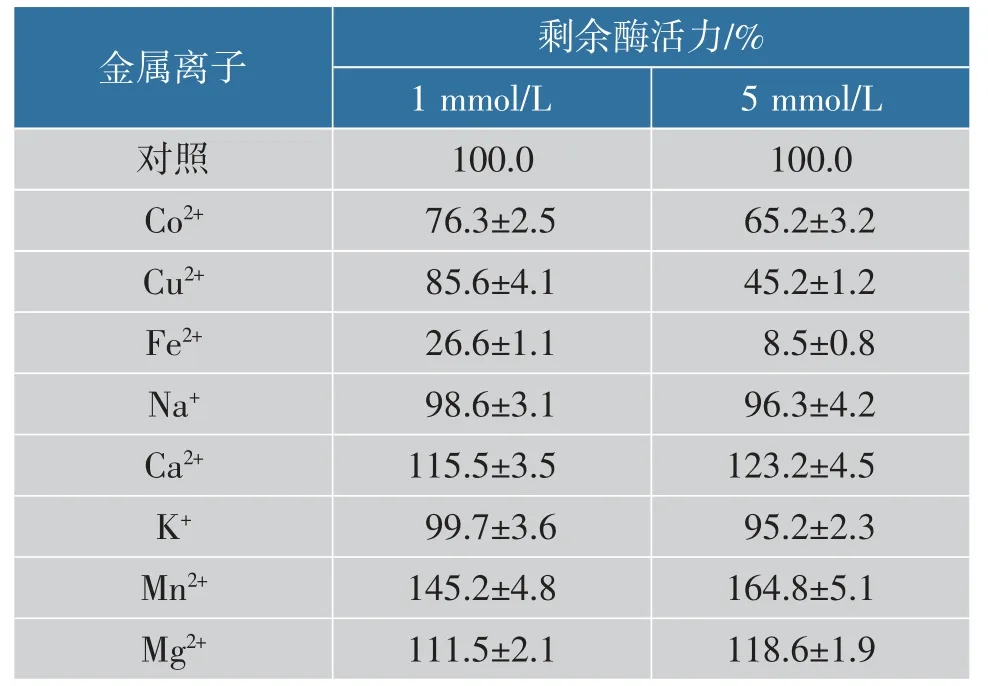
表2 不同金属离子对重组CsnBh46 稳定性影响Table 2 Effects of different metal ions on the stability of recombinant CsnBh46
2.8 底物特异性
重组CsnBh46 底物特异性如表3 所示, 重组CsnBh46 只对胶体壳聚糖具有水解活性, 其中对脱乙酰度95%胶体壳聚糖表现出最高水解活性。 重组CsnBh46 对粉末几丁质、胶体几丁质、羧甲基纤维素钠以及木聚糖均没有活性。
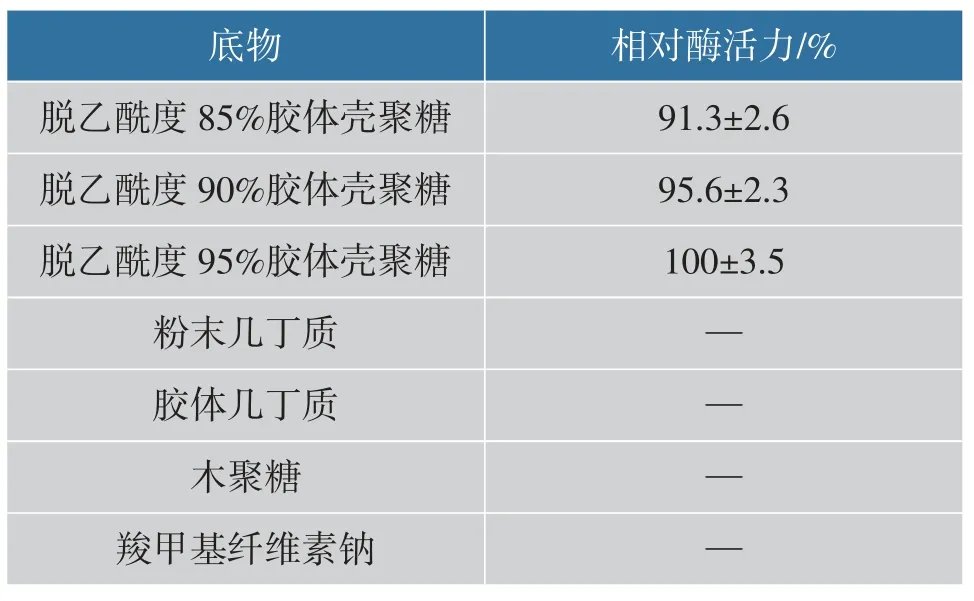
表3 重组CsnBh46 底物特异性Table 3 Substrate specificity of recombinant CsnBh46
2.9 水解特性
重组CsnBh46 水解不同聚合度壳寡糖实验结果如图7 所示,重组CsnBh46 对壳二糖和壳三糖没有水解活性,反应2 h 后,壳二糖和壳三糖均没有被分解成更小的糖。 重组CsnBh46 对壳四糖水解活性较弱,反应2 h 后,少量壳四糖被转化为壳二糖。 重组CsnBh46 对壳五糖和壳六糖具有良好的水解活性, 反应1 h 后, 壳五糖全部转化为壳二糖和壳三糖,壳六糖则全部转化为壳二糖、壳三糖和壳四糖。在所有的反应过程中均没有出现单糖, 表明重组CsnBh46 是一种内切壳聚糖酶。此外,在所有的反应体系中均没有出现比初始底物聚合度更高的壳寡糖,表明重组CsnBh46 不具有转糖苷酶活性。
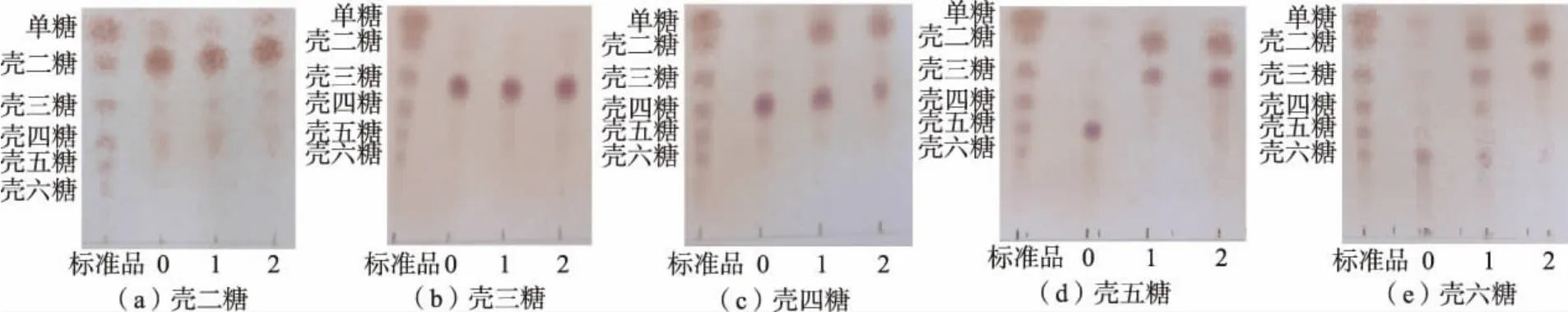
图7 重组CsnBh46 水解不同聚合度壳寡糖产物分析Fig. 7 Analysis of the hydrolysis products from differently polymerized chitosan oligosaccharides hydrolyzed by recombinant CsnBh46
2.10 重组CsnBh46 水解壳聚糖制备不同聚合度壳寡糖
不同酶添加量对不同质量浓度(1~3 g/dL)底物的水解效果如图8 所示。底物质量浓度为1 g/dL、酶添加量在5~20 U/mL 时,反应1 h 后,水解产物主要由壳二糖和壳三糖构成,含有少量壳四糖;当酶添加量为25 U/mL 时,水解产物则基本为壳二糖和壳三糖(见图8(a))。 底物质量浓度2 g/dL 和3 g/dL的水解结果相似, 当酶添加量为5~10 U/mL 时,水解产物主要为壳二糖、壳三糖、壳四糖和壳五糖,包含少量壳六糖;当酶添加量大于10 U/mL,水解产物则主要由壳二糖、壳三糖和壳四糖构成(见图8(b)和图8(c))。
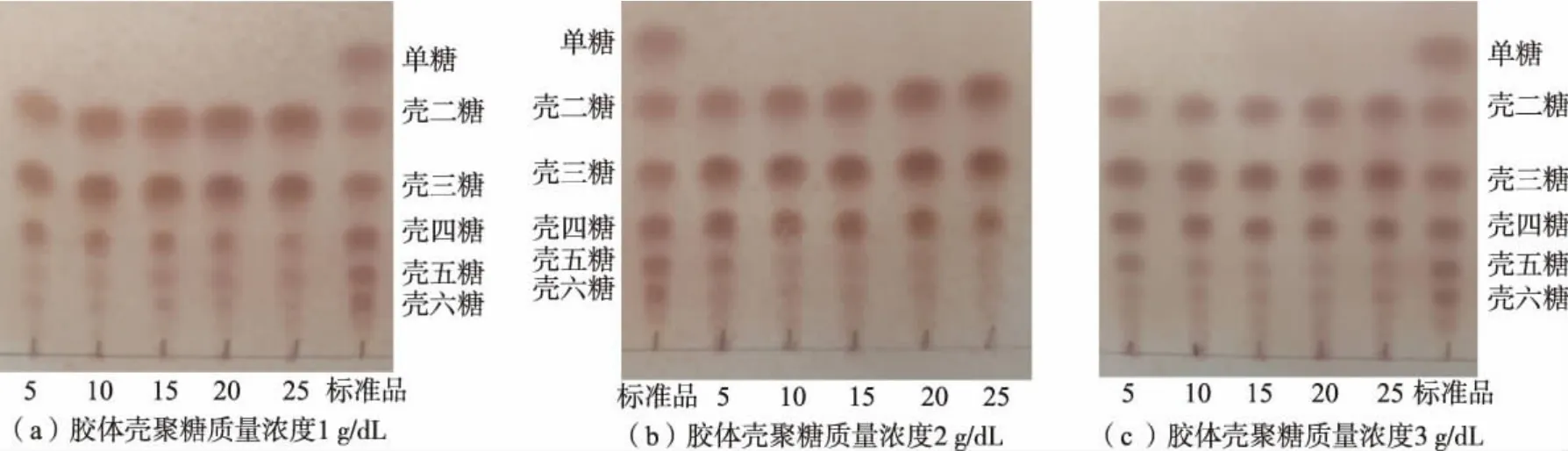
图8 重组CsnBh46 水解不同质量浓度胶体壳聚糖产物TLC 分析Fig. 8 TLC analysis of products from different concentration of colloidal chitosan catalyzed by recombinant CsnBh46
根据不同酶添加量水解不同质量浓度胶体壳聚糖实验结果,进一步研究10 U/mL 酶添加量水解3 g/dL 胶体壳聚糖反应过程中产物组成和水解率,实验结果如图9 所示。 反应15 min 后,水解产物由壳二糖至壳六糖构成(见图9(a)),其中壳三糖、壳四糖、 壳五糖和壳六糖的质量浓度分别为6.32、7.12、6.51、5.32 mg/mL(见图9(b)),水解率达到92.5%(见图9(c))。 反应30 min 后,壳五糖和壳六糖的质量浓度逐渐降低,壳二糖、壳三糖和壳四糖的质量浓度以及水解率逐渐增加(见图9)。 反应至45 min 和60 min 时,水解产物主要由壳二糖、壳三糖、壳四糖和壳五糖构成。
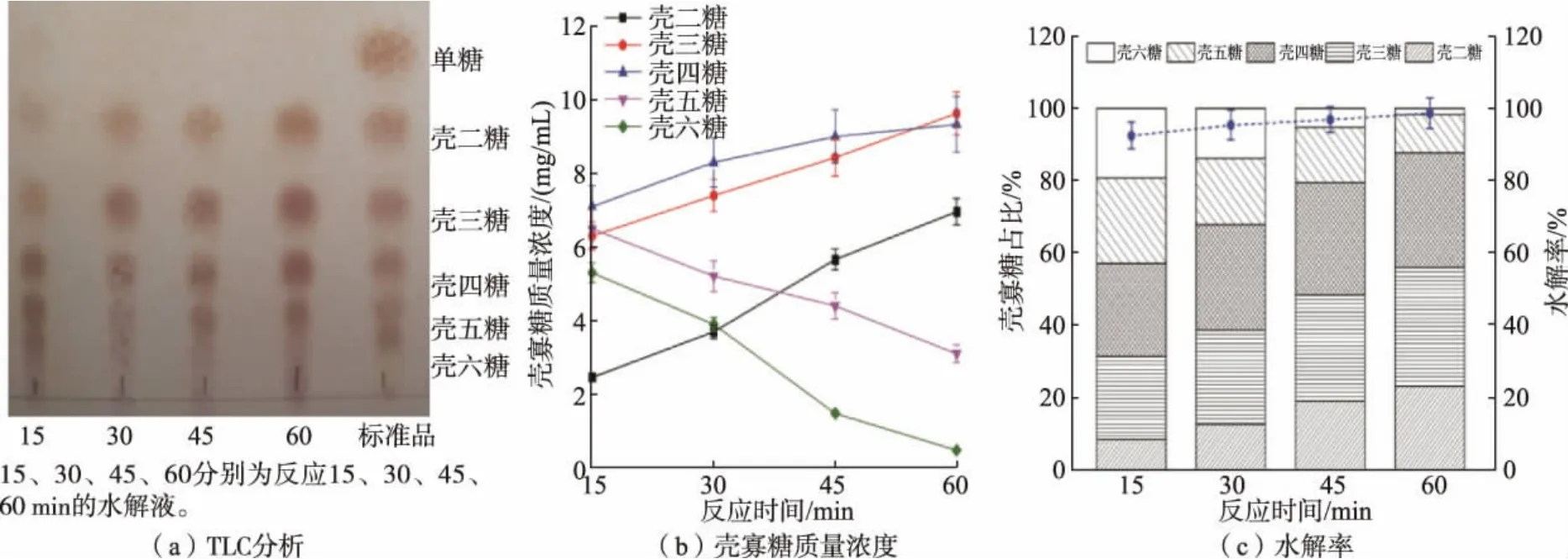
图9 不同反应时间下重组CsnBh46 水解3 g/dL 胶体壳聚糖的水解产物TLC 分析、壳寡糖质量浓度以及水解率Fig. 9 TLC analysis of products, mass concentration of chitosan digosaccharides and hydrolysis rate of 3 g/dL colloidal chitosan hydrolyzed under different reaction time by recombinant CsnBh46
迄今,已有多种酶用于制备壳寡糖,根据酶的种类可以分为专一性酶(壳聚糖酶)和非专一性酶(包括果胶酶、纤维素酶、脂肪酶等)。 由表4 可知,壳聚糖酶水解效率明显优于非专一性酶,此外重组CsnBh46 水解效率优于已报道的多种壳聚糖酶。
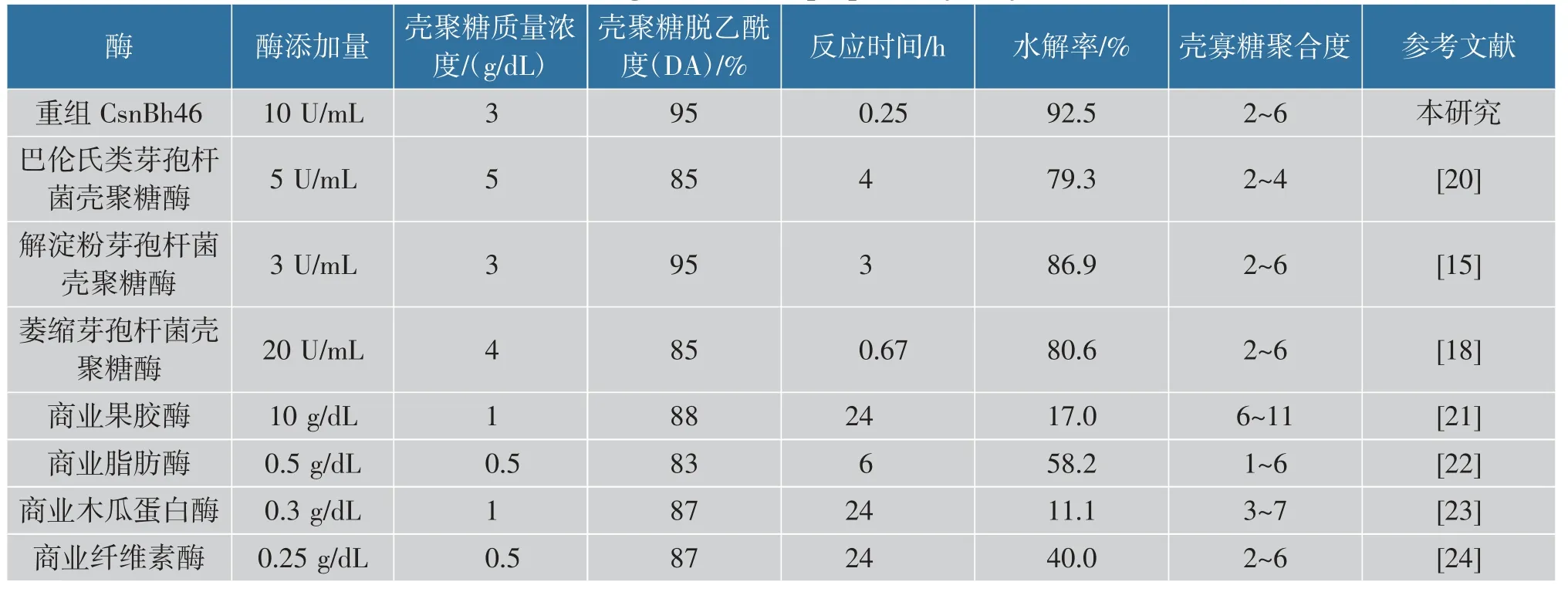
表4 酶法制备壳寡糖Table 4 Chitosan oligosaccharides prepared by enzymatic methods
3 结 语
通过同源克隆获得耐盐芽孢杆菌R1 壳聚糖酶基因csnbh46,该基因全长为837 bp,编码278 个氨基酸,其中前36 个氨基酸为其潜在信号肽序列,序列比对结果表明壳聚糖酶CsnBh46 属于糖苷水解酶46 家族。 以毕赤酵母X33 为宿主,重组表达壳聚糖酶CsnBh46, 在7 L 发酵罐条件下, 重组工程菌bh-5 最高酶活力为6 375 U/mL。此外通过蛋白质纯化以及酶动力学参数测定发现重组CsnBh46 米氏常数Km为0.75 mg/mL,最大反应速度vmax为2 513 μmol/(L·min·mg), 表明重组CsnBh46 对壳聚糖具有良好的亲和力和水解活性。重组CsnBh46 在45 ~55 ℃具有良好的活性和稳定性。重组CsnBh46 水解特性表明其是一种内切壳聚糖酶。 重组CsnBh46 能够高效水解3 g/dL 胶体壳聚糖, 酶添加量10 U/mL条件下, 反应15 min 壳聚糖水解率便达到92.5%,表明重组CsnBh46 适用于壳寡糖的酶法制备,为CsnBh46 下一步产业化应用奠定基础。

