子宫内膜癌病人血清circWHSC1和circPUM1的表达及诊断价值
阴莉,许剑利,程其军,陈新
作者单位:自贡市第一人民医院,a妇产科,b中西医结合肺病科,四川 自贡643000
子宫内膜癌是严重威胁妇女健康的恶性肿瘤之一,发病率占据妇女肿瘤的第二位,病死率占据妇女肿瘤的第三位,多发年龄为围绝经期与绝经后[1-2]。子宫内膜癌相对宫颈癌与卵巢癌病死率低的原因为可早期发现,早期发现尽早治疗情况下预后较好,5年生存率高达90%,但若发现较迟,病死率将急剧升高[3],因此提高子宫内膜癌的早期诊断效能是临床孜孜不倦追求的目标。环状RNA(Circular RNA,circRNAs)是一类非编码RNA,具有难降解、高稳定性的优点,其可海绵化miRNA,调控子宫内膜癌生物学进程[4-6]。circWHSC1与circPUM1均属于circRNAs,circWHSC1在宫颈癌细胞C-33A中过表达可促进癌进展,反之会抑制癌进展[7];circ-WHSC1可通过海绵化miR-212-5p调控AKT3表达参与三阴性乳腺癌的肿瘤进展以及糖酵解途径[8]。circPUM1可通过海绵吸附miR-615-5p与miR-6753-5p促进卵巢癌的发生与发展[9];circPUM1在结肠癌中可促进恶性生物学行为[10]。但关于circWHSC1和circPUM1在子宫内膜癌中的表达情况以及所发挥的作用仍未见研究。因此,本研究将从此着手,检测子宫内膜癌病人血清circWHSC1、circPUM1表达水平,分析其对子宫内膜癌诊断的价值,为子宫内膜癌早期诊断提供候选分子标志物。
1 资料与方法
1.1 一般资料 选取2018年6月至2020年6月自贡市第一人民医院接受治疗的120例子宫内膜癌病人作为子宫内膜癌组,年龄40~65(52.35±7.24)岁;其中绝经者81例,未绝经者39例。根据FIGO分期标准分为:Ⅰ期66例,Ⅱ期26例,Ⅲ期18例,Ⅳ期10例。根据组织学分化程度高低分为高分化(G1)组71例、中分化(G2)组35例、低分化(G3)组14例。
纳入标准:①病人均接受手术治疗;②病理资料完整;③纳入研究前未接受放化疗以及分子靶向治疗;④病人知情同意。
排除标准:①存在其他肿瘤占位;②入院存在感染;③精神认知障碍;④肝肾功能衰竭。
另选取自贡市第一人民医院同期行诊断性刮宫确认为子宫内膜增生的病人123例作为子宫内膜增生组,年龄40~65(54.21±7.17)岁。选取体检健康者125例作为对照组,年龄40~65(53.37±7.58)岁。子宫内膜癌组、子宫内膜增生组、对照组年龄比较,差异无统计学意义(P>0.05)。本研究符合《世界医学协会赫尔辛基宣言》相关要求。
1.2 血清标本采集 子宫内膜癌组病人术前、子宫内膜增生组病人确诊后、对照组体检时抽取空腹静脉血5 mL,4 ℃条件下离心,离心力设置为800g,得上清液保存至-20 ℃冰箱内待测。
1.3 研究对象血清circWHSC1和circPUM1水平测定 Trizol法提取子宫内膜癌组、子宫内膜增生组和对照组血清总RNA,使用反转录试剂盒将5 μg RNA反转录为cDNA。使用SYBR Premix Ex TaqTM进行扩增,内参选用GAPDH,circWHSC1、circPUM1、GAPDH引物序列由上海生工生物工程有限公司构建,序列见表1。

表1 qRT-PCR引物序列
反转录试剂盒(D7178M)购自上海碧云天;SYBR Premix Ex TaqTM(DRR420A)购自北京智杰方远科技有限公司。qRT-PCR反应条件为95 ℃预变性10 min;40个PCR循环(95 ℃变性10 s;55 ℃退火20 s;72 ℃延伸15 s)。2-ΔΔCt方法计算子宫内膜癌病人血清中circWHSC1、circPUM1相对表达量。
1.4 统计学方法 数据分析采用SPSS 25.0软件。本研究计数资料均符合正态分布,以描述,多组间比较采用单因素方差分析,有差异后两两比较再采用SNK-q检验;以例(%)描述计数资料,采用χ2检验;logistic回归分析法分析血清circWHSC1和circPUM1水平与子宫内膜癌发病的关系;ROC曲线分析血清circWHSC1和circPUM1表达水平对子宫内膜癌的诊断价值。P<0.05为差异有统计学意义。
2 结果
2.1 三组研究对象血清circWHSC1和circPUM1表达水平比较 与对照组相比,子宫内膜增生组血清circWHSC1、circPUM1表达水平差异无统计学意义(P>0.05),子宫内膜癌组血清circWHSC1、circPUM1表达水平均升高(P<0.05);与子宫内膜增生组相比,子宫内膜癌组血清circWHSC1、circPUM1表达水平均升高(P<0.05),见表2。
表2 三组血清中circWHSC1和circPUM1表达水平比较/
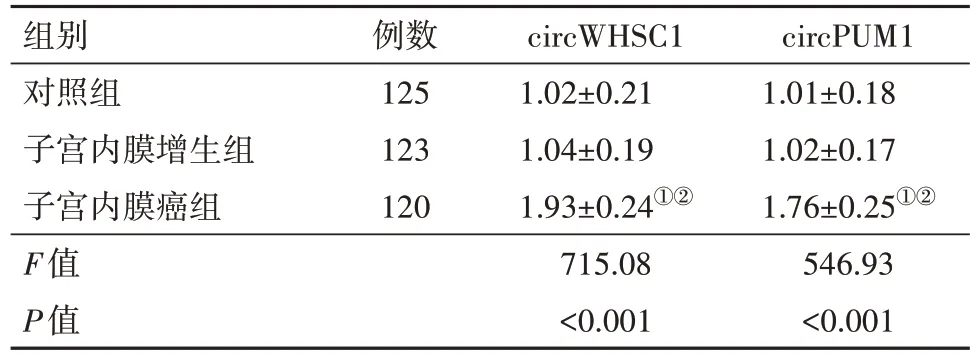
表2 三组血清中circWHSC1和circPUM1表达水平比较/
注:①与对照组相比,P<0.05。②与子宫内膜增生组相比,P<0.05。
circPUM1 1.01±0.18 1.02±0.17 1.76±0.25①②546.93<0.001组别对照组子宫内膜增生组子宫内膜癌组F值P值例数125 123 120 circWHSC1 1.02±0.21 1.04±0.19 1.93±0.24①②715.08<0.001
2.2 子宫内膜癌不同组织学分化程度病人血清circWHSC1、circPUM1表达水平比较 与G1组相比,G2组、G3组子宫内膜癌病人血清circWHSC1、circPUM1表达水平均升高(P<0.05);与G2组相比,G3组子宫内膜癌病人血清circWHSC1、circPUM1表达水平均升高(P<0.05),见表3。
表3 不同组织学分化程度子宫内膜癌病人血清circWHSC1、circPUM1表达水平比较/
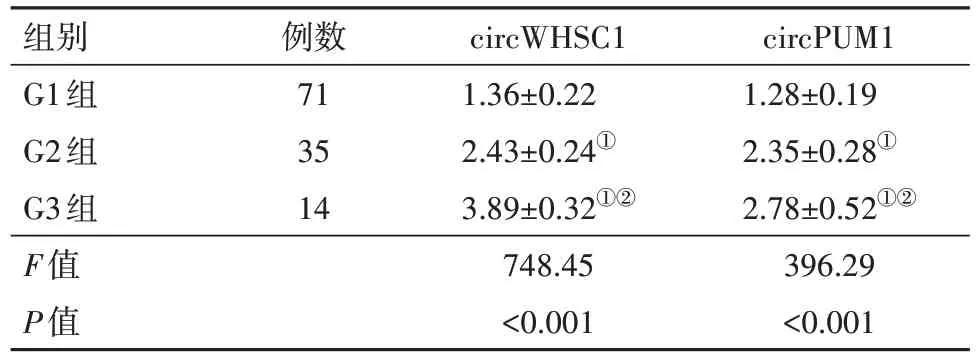
表3 不同组织学分化程度子宫内膜癌病人血清circWHSC1、circPUM1表达水平比较/
注:①与G1组相比,P<0.05。②与G2组相比,P<0.05。
组别G1组G2组G3组F值P值circPUM1 1.28±0.19 2.35±0.28①2.78±0.52①②396.29<0.001例数71 35 14 circWHSC1 1.36±0.22 2.43±0.24①3.89±0.32①②748.45<0.001
2.3 子宫内膜癌不同FIGO分期病人血清circWHSC1、circPUM1表达水平比较 与Ⅰ期病人相比,Ⅱ期、Ⅲ期、Ⅳ期子宫内膜癌病人血清circWHSC1、circPUM1表达水平升高(P<0.05);与Ⅱ期病人相比,Ⅲ期、Ⅳ期子宫内膜癌病人血清circWHSC1、circPUM1表达水平均升高(P<0.05);与Ⅲ期病人相比,Ⅳ期子宫内膜癌病人血清circWHSC1、circPUM1表达水平均升高(P<0.05),见表4。
表4 不同FIGO分期子宫内膜癌病人血清circWHSC1、circPUM1表达水平比较/
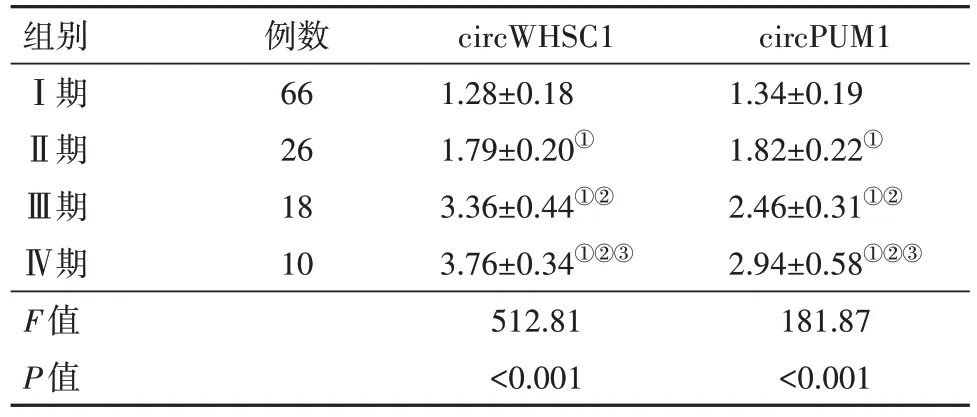
表4 不同FIGO分期子宫内膜癌病人血清circWHSC1、circPUM1表达水平比较/
注:①与Ⅰ期相比,P<0.05。②与Ⅱ期相比,P<0.05。③与Ⅲ期相比,P<0.05。
circPUM1 1.34±0.19 1.82±0.22①2.46±0.31①②2.94±0.58①②③181.87<0.001组别Ⅰ期Ⅱ期Ⅲ期Ⅳ期F值P值例数66 26 18 10 circWHSC1 1.28±0.18 1.79±0.20①3.36±0.44①②3.76±0.34①②③512.81<0.001
2.4 logistic回归分析法分析血清circWHSC1、circPUM1表达水平与子宫内膜癌的关系 以血清circWHSC1、circPUM1表达水平为自变量,以是否发生子宫内膜癌为因变量,circWHSC1、circPUM1表达水平与子宫内膜癌的发病密切相关(OR=2.75、3.71,P<0.05),见表5。
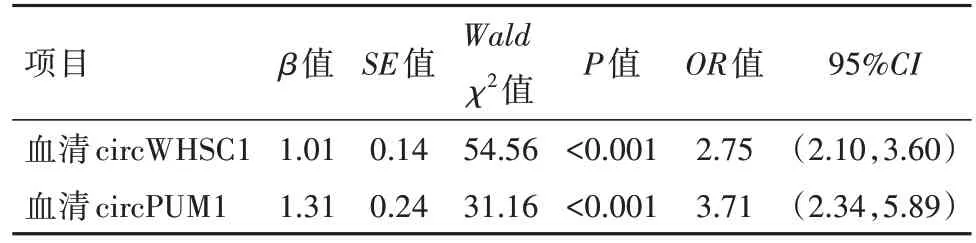
表5 血清circWHSC1、circPUM1表达水平与子宫内膜癌的关系
2.5 ROC曲线分析血清circWHSC1、circPUM1表达水平对子宫内膜癌的诊断价值 血清circWHSC1表达水平对子宫内膜癌诊断的曲线下面积为0.88,最佳截断值为3.01,此时的灵敏度为88.2%,特异度为81.5%;血清circPUM1表达水平对子宫内膜癌诊断的曲线下面积为0.82,最佳截断值为1.65,此时的灵敏度为79.8%,特异度为83.1%;二者联合检测对子宫内膜癌诊断的曲线下面积为0.95,灵敏度为89.1%,特异度为93.5%。
3 讨论
子宫内膜癌是女性常见生殖道恶性肿瘤,其发病率随社会发展而升高,围绝经期以及绝经后妇女卵巢功能衰竭,雌激素降低,免疫功能减弱,较容易发病。早期发现及早治疗是子宫内膜癌预后良好的前提条件,治病于初有助于病人长期生存。因此诊断标志物的探寻是临床的长久课题,对于提升子宫内膜癌的生存率具有重要意义。
circRNAs是非编码RNA中的一种,是目前RNA领域的新研究热点,其呈闭环状,含有大量miRNA的结合位点,可作为miRNA海绵吸附miRNA,进而调控miRNA下游靶基因,发挥对靶基因的调控作用,在多种恶性肿瘤中发挥关键作用。比如谷文露等[11]通过高通量测序技术筛选得到hsa_circ_0008234在肺腺癌组织中低表达,并通过临床肺腺癌组织、癌旁组织标本以及细胞实验验证,沉默hsa_circ_0008234表达可促进肺腺癌细胞增殖与迁移;邹晨等[12]研究发现circ_0076704在人胃癌组织中高表达。而circWHSC1来源于WHSC1基因的外显子反向剪接。Zong等[13]研究显示,circWHSC1可通过吸附miR-145与miR-1182,调节其下游靶点MUC1以及hTERT表达。MUC1、hTERT被证实在子宫内膜样腺癌中高表达[14-15]。推测circWHSC1可能在子宫内膜癌中发挥一定作用。本研究中子宫内膜癌病人血清circWHSC1表达水平显著高于对照组以及子宫内膜增生组病人血清circWHSC1表达水平,提示circWHSC1可能在子宫内膜癌中发挥促癌作用,logistic回归分析与ROC曲线结果显示,circWHSC1与子宫内膜癌的发病密切相关,且当circWHSC1表达水平高于3.013时,对子宫内膜癌的发病有较高诊断价值,此时诊断曲线下面积为0.86,灵敏度、特异度均较高,提示circWHSC1有望作为子宫内膜癌诊断的血清标志物。进一步研究显示,血清circWHSC1与子宫内膜癌病人临床FIGO分期、组织学分化程度等临床病理特征相关,提示circWHSC1与子宫内膜癌的发展有一定关系。
circPUM1是一种功能性circRNA,定位于线粒体,其在肺腺癌中高表达,在体内与体外增强细胞肿瘤的发生[16];circPUM1可通过对miR-615-5p与miR-6753-5p的调控参与卵巢癌的发生与发展[9];circPUM1在食管癌中有致癌特性,可能通过抑制食管癌细胞的细胞焦亡促进肿瘤生长[17]。但其在子宫内膜癌中仍未见研究,基于子宫内膜癌是一个受多基因调控的恶性肿瘤,且circPUM1拥有多个miRNA结合位点,我们猜测circPUM1可能在子宫内膜癌中发挥作用。本研究中子宫内膜癌病人血清circPUM1水平显著高于对照组以及子宫内膜增生组,提示子宫内膜癌中血清circPUM1表达异常,可能与癌进展有关,logistic回归分析显示,circPUM1表达水平与子宫内膜癌的发病密切相关,提示血清circPUM1可能作为诊断子宫内膜癌发病的一个血清标志物,本研究进一步使用ROC曲线分析,结果显示血清circPUM1表达水平诊断子宫内膜癌发生的曲线下面积为0.80,诊断效能高,当血清circPUM1表达水平高于1.650时,病人罹患子宫内膜癌的可能性较高,此时诊断灵敏度、特异度分别为78.3%、84.8%,诊断可靠性较高,病人需做进一步检查确诊。本研究进一步对子宫内膜癌病人临床病理特征进行分析,发现血清circPUM1表达水平与组织学分化程度、临床FIGO分期有一定相关性,提示其可能参与子宫内膜癌的癌进展,可作为一个长期监控指标。通过将血清circWHSC1与circPUM1联合检测,发现可提高对子宫内膜癌的诊断效能,诊断灵敏度与特异度均升高。
综上所述,子宫内膜癌病人血清circWHSC1、circPUM1表达水平处于高位,二者联合检测有望作为筛查子宫内膜癌病人的血清标志物,为子宫内膜癌的早期诊断做贡献。但本研究存在样本量不足、研究不深入等局限,下一步将扩大样本量进行验证,并进行细胞以及体内实验进行进一步探讨。

