去整合素-金属蛋白酶17、Notch1及α-平滑肌动蛋白在子宫内膜异位症组织中的表达及意义
汤孟冬,张浩然,崔文杰,潘姿璇,张旭艳,2
作者单位:1潍坊医学院妇产科教研室,山东 潍坊261000;2青岛大学附属青岛市海慈医院(青岛市中医医院)妇二科,山东 青岛266000
子宫内膜异位症(endometriosis,EMs)是妇科一种良性疾病,其最主要的特征是子宫腔外存在子宫内膜的腺体及间质[1-2]。这种疾病严重影响病人的生活质量,特别是育龄期女性,也是一个重大的公共卫生问题[3-4]。尽管这种疾病的发病机制尚不完全清楚,但目前研究发现子宫内膜异位症是一种复杂的慢性炎症状态[5],与前列腺素、金属蛋白酶、细胞因子和趋化因子的过度产生有关,这些炎性因子产生一个自我支持的循环,维持并增加疾病的发展[6]。研究表明炎性因子的过度激活在不同形式子宫内膜异位症的发病和进展中起着关键作用,如卵巢子宫内膜异位症和深层浸润性子宫内膜异位症[7]。Notch蛋白是一种跨膜受体,调节许多疾病的发生过程。ADAM家族成员对多种具有免疫相关性的靶蛋白(例如Notch1)具有蛋白水解活性[8]。本研究的目的是将ADAM17与Notch介导的纤维化联系起来,进行EMs的发病机制与临床病理学的相关性研究。本课题分析ADAM17、Notch1、α-SMA在EMs异位内膜、在位内膜与正常内膜中的表达差异,评估这三种因子在EMs中的作用,并评估不同分期的EMs中ADAM17的表达程度与纤维化严重程度的关系。
1 资料与方法
1.1 一般资料 选取2019年10月至2020年10月在潍坊医学院附属医院妇科行腹腔镜手术治疗的卵巢型子宫内膜异位症病人40例为异位内膜组,手术过程中留取卵巢型子宫内膜异位症囊肿的囊壁组织;同期选取因子宫切除或行刮宫术获得子宫内膜的在位内膜组25例;因子宫肌瘤而行全子宫切除术获得正常子宫内膜的正常内膜组25例。三组年龄范围为25~50岁,年龄差异无统计学意义(P>0.05) 。按 1996年美国生殖医学协会修改的子宫内膜异位症r-AFS分期,分为Ⅰ~Ⅱ期20例,Ⅲ~ Ⅳ期20例。所有例数在手术治疗之前的6个月均未接受激素及其他抗子宫内膜异位症药物治疗,未手术治疗且生化指标及血常规指标均正常。知情同意书均术前签署。本研究符合《世界医学协会赫尔辛基宣言》相关要求。
1.2 方法 三组组织分别以10%甲醛液固定,石蜡包埋,3 μm连续切片,HE染色后显微镜下能观察到典型子宫内膜组织者为入选标本。免疫组化Envision二步法处理标,将组织切片置0.01 mol/L柠檬酸缓冲液(pH 6.0)中高火煮沸,转至低火煮15 min。除去PBS,将内源性过氧化物酶阻断加入在切片组织区域,室温孵育30 min,蒸馏水冲洗,0.01 mol/L PBS 液洗涤。除去PBS,加非特异染色阻断剂,37 ℃孵育60 min。除去非特异性染色阻断剂,加一抗,除去PBS,加生物素标记的IgG聚合物,室温孵育50 min,蒸馏水冲洗,用0.01 mol/L的PBS液洗涤4次,每次均5 min。除去PBS,加链霉菌抗生素蛋白-过氧化物酶,室温孵育30 min,蒸馏水冲洗,0.01 mol/L PBS 液洗涤。除去PBS,加DAB显色液显色,室温孵育,显微镜下观察呈色效果,蒸馏水终止反应,苏木素复染,流水冲洗蓝,中性树胶封片,用显微镜观察。
1.3 结果判断 ADAM17、Notch1、α-SMA的染色结果根据Watanabe免疫组化半定量评分标准: 高倍镜(×400)下对每张切片任意选5个视野,计数200个细胞/视野,共计1 000个细胞,观察阳性细胞的表达强度,视野中无表达为阴性(0分)、细胞呈浅黄色为可疑阳性(1分)、棕黄色为阳性(2分)、棕褐色为强阳性(3分)。计算阳性细胞的表达个数(取5个视野的平均数),无表达为阴性(0分)、1%~15%为可疑(1分)、16%~50%为弱阳性(2分)、51%~75%为阳性(3分)、76%~100%为强阳性(4分)。评分结果:1~2分为阴性(-);3~4分为弱阳性(+) ; 5~7分为中等阳性(2+);>7分为强阳性(3+)。结果判断均由两名高年资病理医生盲法判断。
1.4 指标观察 比较三种不同内膜组织中ADAM17、Notch1、α-SMA的表达;分析子宫内膜异位症中异位内膜组织中ADAM17、Notch1、α-SMA的表达与病理特征的关系;采用Pearson相关分析法分析ADAM17、Notch1、α-SMA在三组中表达的相关性。
1.5 统计学方法 实验数据通过SPSS 25进行分析,计量资料数据运用表述,两组比较采用独立样本t检验,多组间比较釆用单因素方差分析(one-way ANOVA),相关性分析用GraphPad PRISM 7进行Pearson分析,并完成制图,P<0.05为差异有统计学意义。
2 结果
2.1 ADAM17、Notch1、α-SMA在免疫组化中的表达 ADAM17、Notch1、α-SMA主要表达于腺上皮细胞及部分间质胞质中,ADAM17、Notch1主要表达于细胞胞质中,α-SMA主要表达于间质中。可发现三者在正常内膜、EMs在位内膜及异位内膜组织中的染色强度为浅黄色至棕褐色,与切片的背景对比发现,EMs异位内膜及在位内膜中的细胞表达数量及染色深度明显高于正常内膜,表达强度比较为EMs异位内膜>EMs在位内膜>正常内膜。见图1。
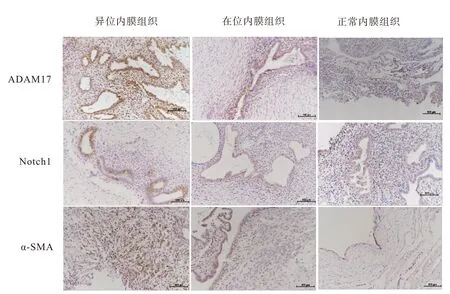
图1 ADAM17、Notch1及α-SMA在三种子宫内膜组织中的表达(免疫组化染色×200)
2.2 ADAM17、Notch1、α-SMA表达的相关性 异位内膜组中ADAM17、Notch1、α-SMA的表达均呈高水平,高于在位内膜组及正常内膜组,在位内膜组中表达均高于正常内膜组,均差异有统计学意义。见表1。
表1 三组子宫内膜中ADAM17、Notch1、α-SMA的表达/
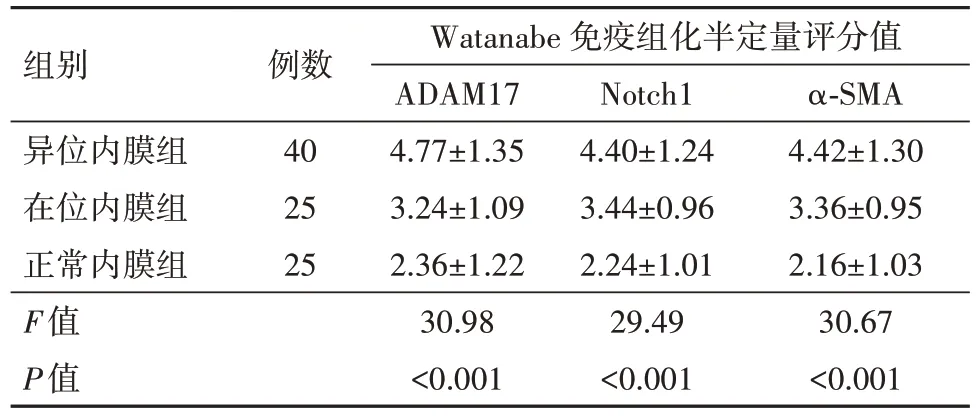
表1 三组子宫内膜中ADAM17、Notch1、α-SMA的表达/
组别异位内膜组在位内膜组正常内膜组F值P值例数40 25 25 Watanabe 免疫组化半定量评分值ADAM17 4.77±1.35 3.24±1.09 2.36±1.22 30.98<0.001 Notch1 4.40±1.24 3.44±0.96 2.24±1.01 29.49<0.001 α-SMA 4.42±1.30 3.36±0.95 2.16±1.03 30.67<0.001
异位内膜组中ADAM17、Notch1、α-SMA三者之间均呈两两正相关(P<0.001)。在位内膜组中ADAM17、Notch1、α-SMA三者之间均呈两两正相关(P<0.001)。正常内膜组中ADAM17、Notch1、α-SMA三者之间均无明显相关性(P>0.05)。见表2。
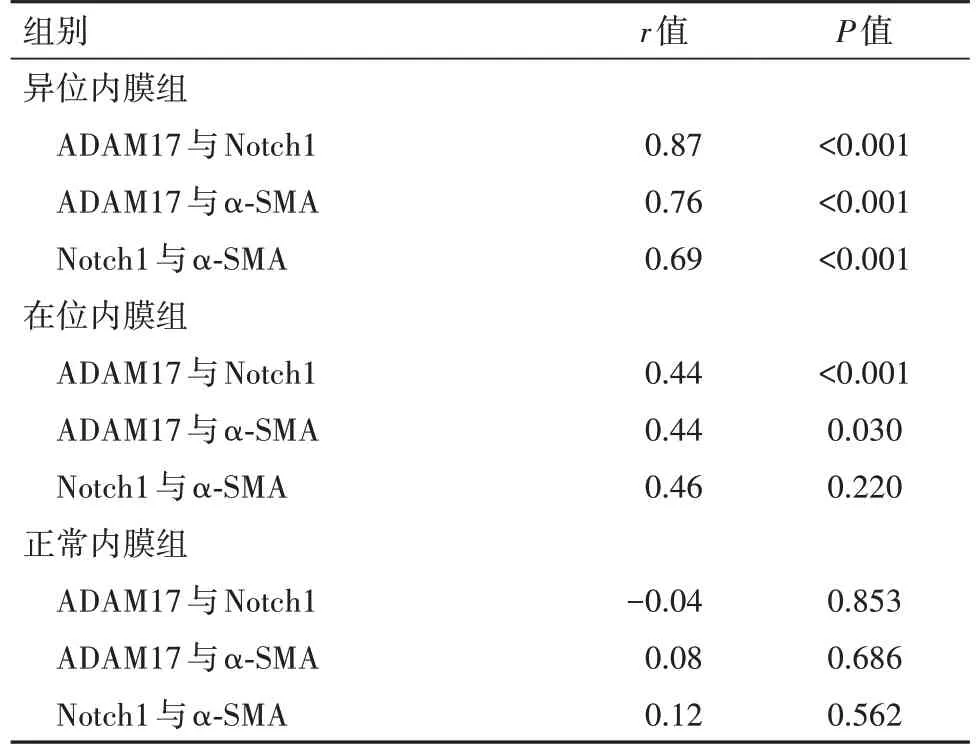
表2 ADAM17、Notch1、α-SMA在三组子宫内膜组织中表达的相关性
2.3 ADAM17、Notch1、α-SMA与临床病理特征的相关性表达 异位内膜组中ADAM17、Notch1、α-SMA在Ⅲ~Ⅳ期中的表达高于Ⅰ~Ⅱ期,差异有统计学意义(P<0.001)。在EMs病人中异位内膜组中ADAM17、NOTCH1、α-SMA的表达与年龄和囊肿长径差异无统计学意义(P>0.05)。见表3。
表3 ADAM17、NOTCH1、α-SMA在异位内膜组织中的表达与病理特征的关系/
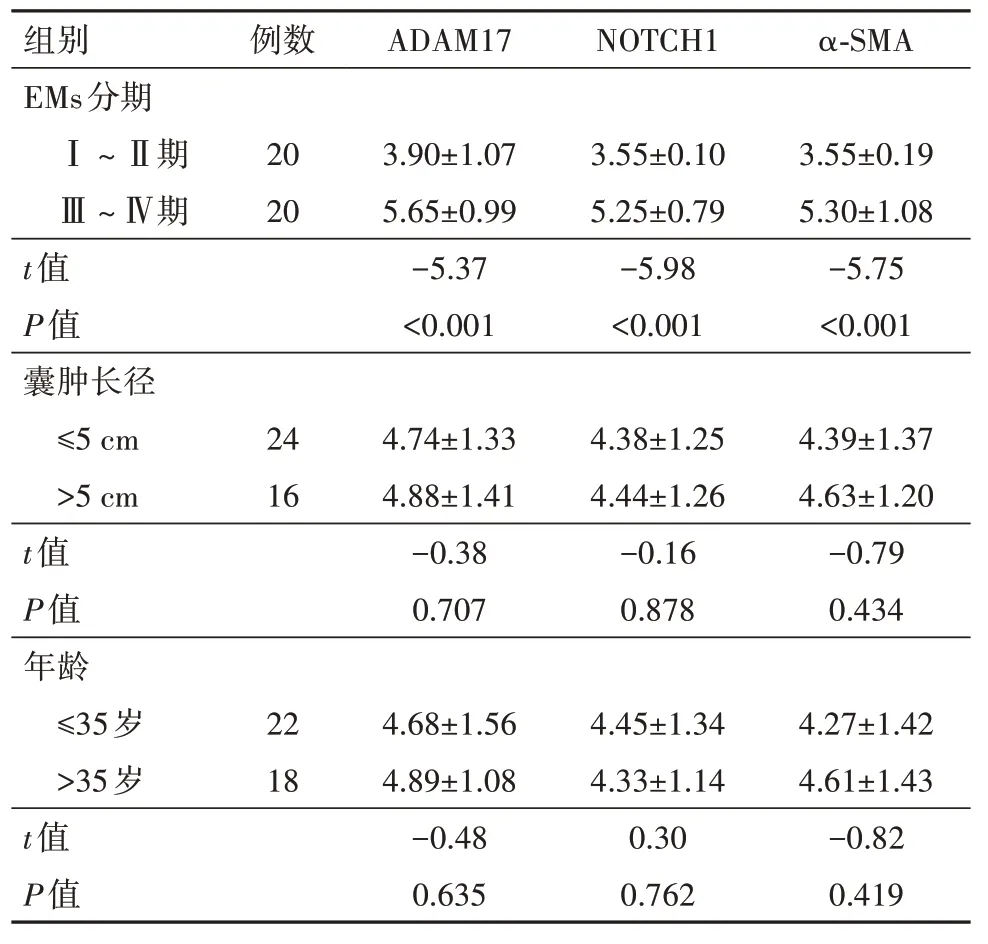
表3 ADAM17、NOTCH1、α-SMA在异位内膜组织中的表达与病理特征的关系/
组别EMs分期例数ADAM17NOTCH1α-SMAⅠ~Ⅱ期Ⅲ~Ⅳ期t值P值囊肿长径≤5 cm>5 cm t值P值年龄≤35岁>35岁t值P值-5.37<0.001-5.98<0.001-5.75<0.001 24 16 4.74±1.33 4.88±1.41-0.38 0.707 4.38±1.25 4.44±1.26-0.16 0.878 4.39±1.37 4.63±1.20-0.79 0.434 22 18 4.68±1.56 4.89±1.08-0.48 0.635 4.45±1.34 4.33±1.14 0.30 0.762 4.27±1.42 4.61±1.43-0.82 0.419 20 20 3.90±1.07 5.65±0.99 3.55±0.10 5.25±0.79 3.55±0.19 5.30±1.08
3 讨论
EMs是子宫内膜的腺体和间质出现在子宫体以外的部位,可根据病理类型分为卵巢型、腹膜型和深部浸润型等,继发性痛经进行性加重是其最主要的临床表现[9-10]。1921年Sampson提出经血逆流与种植理论,即经血逆流后,具有活性的子宫内膜细胞黏附在腹膜表面逐渐形成子宫内膜异位组织。该学说不能解释大多数女性都会出现经血逆流,但只有一部分女性出现EMs这一现象[11]。2005年郎景和院士提出子宫内膜异位症发病的“在位内膜决定论”,研究证明了EMs病人和非EMs病人的在位内膜在血管形成、黏附肌侵袭性等能力均有差异,通过猕猴动物的模型构建,更说明了EMs的“在位内膜决定论”[12]。目前研究发现,子宫内膜在盆腔内的扩散、附着、植入和纤维化,以及异位病变的形成和发展,受到多个因子的综合影响[13-14]。
ADAM17作为一种具有膜黏附的金属蛋白酶,在细胞分化和细胞增殖中起到一定的作用,通过脱落生长因子和激活表皮生长因子受体信号,对多种具有免疫相关性的靶蛋白(例如Notch1)具有蛋白水解功能[6]。子宫内膜异位症的迁移、黏附、血管生成、等类肿瘤行为,ADAM17作为一种膜黏附的蛋白酶,亦在子宫内膜异位的发生和发展中起着重要作用[7]。氧化应激能够诱导去整合素、金属蛋白酶家族的一些成员的合成,并在不同形式的EMs如卵巢EMs和深部浸润性EMs的发病和进展中起着关键作用。Foruria等[16]发现ADAM17/Notch信号通路在EMs中的作用。ADAM17、Notch1、Jagged1和Hes1在小鼠的子宫异位症中过度表达,会导致辅助T细胞(TH)17的增加和调节性T细胞(Tregs)的减少,会导致小鼠EMs的增加。阻断Notch信号可以减少骨髓源性抑制细胞(MDSCs)(未成熟髓系细胞的异质性亚群),从而减少EMs的发生[16]。与没有EMs的正常女性相比,由于ADAM17基因转录的激活,导致ADAM17蛋白在EMs异位组织中的过度表达。尽管以前曾报道过EMs病人异位部位腺上皮和腔上皮中ADAM17蛋白水平升高,但这种蛋白表达增强与ADAM17转录物水平的变化无关[17-18]。ADAM17表达水平的这些细胞变化与病变实体、月经周期无关[19]。因此,细胞内ADAM17调节过程的更强激活可能存在生物学选择,支持异位病变的形成并促进其存活,例如增强子宫内膜细胞迁移、黏附和侵袭,炎症反应增加和免疫反应受损,这些还需进一步研究。本课题研究发现,ADAM17在EMs病变中的表达高于在位子宫内膜,并且与对照组相比,患有EMs的女性在位子宫内膜中的ADAM17表达也更高,再次证实了EMs的“在位内膜决定论”,这与国内外研究一致,ADAM17在EMs的发生及发展中起到促进作用。EMs异位组织对照术中按r-AFS进行分期,发现ADAM17在Ⅲ~Ⅳ期的表达明显高于Ⅰ~Ⅱ期,表明该因子与内异症的严重程度及进展有关。本课题也发现,ADAM17、Notch1及α-SMA在内异症的异位内膜组织中呈正相关表达,表明ADAM17协同Notch1促进EMs的纤维化。
Notch信号是一种高度保守的跨越种系的通路,广泛见于多细胞生物的机体。它在细胞间通信中发挥作用,调节各种细胞在胚胎和人类中的发育进程[20]。Notch信号是通过4个跨膜的受体(Notch 1-4)及5个跨膜的配基来表达的。Notch的活化主要依靠功能重组信号序列结合蛋白的启动,诱导邻近的细胞产生与其受体及配基之间的交互反应,从而引发一系列的受体破坏,从而使Notch胞内区的形成得以实现。然后,将缺口胞内域(notch intracellular domain ,NICD)切入细胞核,与Notch家族的转录因子重组信号键结合,进而启动 Notch靶标基因的表达[21-22]。目前发现皮肤、肺、肾和心脏纤维化与Notch激活有关,细胞内NICD异位到细胞核内,可直接启动细胞核内合成α-SMA和胶原纤维Ⅱ基因的转录和翻译,诱导纤维组织增生引起的纤维变性[23]。本课题组研究发现,Notch1在EMs异位病变中的表达高于在位子宫内膜,并且与对照组相比,患有EMs在位子宫内膜中的Notch1也表达,均差异有统计学意义。这说明Notch在EMs的发生及发展中起到促进作用。在于ADAM17的相关性分析中发现,ADAM17、Notch1在子宫内膜的异位内膜组织中呈正相关,由此可见,Notch通路在EMs中起到促进作用,这一通路的研究发现为内异病的诊治提供了新途径。
α-SMA是平滑肌细胞的标志,是检测细胞上皮向间质转化的指标,这一蛋白质活化在纤维的生成过程中起关键作用,可作为检测组织纤维化的指标。EMs过度纤维化可通过临床表现有所体现,卵巢型EMs主要因粘连和疤痕形成导致病人疼痛和不孕等临床表现。在患有EMs病人的卵巢中可观察到伴随卵泡丢失的纤维化现象,表明该疾病导致卵巢功能改变[24-25]。纤维化是EMs病理生理学机制发展的重要过程[26]。抑制纤维组织的形成可能是治疗EMs的一个方向。本课题研究发现,EMs病人的异位内膜组与ADAM17、Notch1及α-SMA的表达水平之间存在显著正相关,与对照组相比,EMs在位内膜组织表达水平也显著升高,差异具有统计学意义,提示ADAM17与Notch1促进EMs的纤维化,参与EMs的发病机制。ADAM17可能通过Notch通路引起EMs纤维化。更重要的是,我们的研究发现EMs中Ⅲ~Ⅳ期病人的异位组织中,三者的表达均高于Ⅰ~Ⅱ期,这就表明ADAM17可能通过Notch通路调控内异症的纤维化严重程度,可以为治疗内异病的临床研究开辟新途径。从而为临床上对内异症的治疗提供了新的思路。
本课题的研究生发现ADAM17、Notch1及α-SMA在EMs异位内膜的中的表达与病人的年龄及囊肿大小无关,但与分期呈正相关,即卵巢型子宫异位症的纤维化程度与ADAM17及Notch1的表达呈正相关,说明干扰这两者的表达,可能会减轻EMs的纤维化,但仍需进行相关抑制剂研究来证实。
4 结论
ADAM17、Notch1及α-SMA在异位内膜中较在位内膜及正常内膜中表达均偏高,在位内膜中ADAM17、Notch1和α- SMA的表达比正常的内膜高,符合“在位内膜决定论”,提示这三种蛋白在EMs的发生、发展中起到重要的作用。三者在异位内膜及在位内膜中均两两呈正相关,提示ADAM17可能通过Notch通路参与EMs的纤维化发生。三者在内异症Ⅲ~Ⅳ期病人的异位内膜的表达均高于Ⅰ~Ⅱ期,提示ADAM17可能通过Notch通路调控EMs的纤维化严重程度。
关于ADAM17在健康和疾病中的结构和功能已经有大量研究,ADAM17参与免疫系统、纤维化和癌症进展的关键途径,抑制ADAM17已被证明是一种有前途的治疗策略[26-28]。尽管如此,仍需进行进一步研究,以开发新的特异性ADAM17抑制剂,并测试其EMs进展中的益处。尽管本课题为EMs的病因和寻找有效的治疗目标,仍有待深入地研究。
我们通过免疫组化实验发现ADAM17、Notch1及α-SMA在异位内膜、在位内膜及正常内膜中有不同程度的表达,定位表达亦能明显观察到,但定量不明确,内容较简单,样本数较局限,可考虑联合其他医院样本进行研究。希望之后的实验可结合动物实验及细胞扩增实验进行更系统的研究,并结合相关抑制剂进行研究。

