CTA1-DD蛋白在枯草芽胞杆菌中的分泌表达
张元鹏,侯立婷,杜露平,于晓明,李兰,杨利,张浩明,王义伟,乔绪稳,程海卫,秦竹,3,4,5*,陈瑾 ,3,4,5*,郑其升,3,4,5*
(1. 江苏省农业科学院动物免疫工程研究所,江苏 南京 210014;2. 江苏省农业科学院国家兽用生物制品工程技术研究中心,江苏 南京 210014;3. 江苏省动物重要疫病与人兽共患病防控协同创新中心,江苏 扬州 225009;4. 江苏省食品质量安全重点实验室-省部共建国家重点实验室培育基地,江苏 南京 210014;5. 兽用生物制品(泰州)国泰技术创新中心,江苏 泰州 225300)
黏膜系统不但是病毒侵入宿主机体的主要位点,同时也是宿主对抗病毒感染的免疫反应的重要场所。黏膜免疫能够刺激机体产生多种类型的免疫反应:促进分泌型IgA(sIgA)的产生,血清中产生IgG中和抗体和细胞介导的免疫反应[1]。尽管黏膜免疫具有很多的优点,但是由于黏膜系统具有免疫屏障,往往单纯的免疫抗原并不能引起足够的免疫反应。为了增强抗原的免疫原性,免疫的过程中往往要添加免疫佐剂。霍乱毒素(CT)作为当前最热门的黏膜佐剂之一,当与抗原混合使用进行口服或者滴鼻免疫时,能够引起强烈的黏膜免疫和系统免疫,因此被认为是最有应用前景的佐剂之一[2],但是由于其具有神经毒性,限制了开发和利用[3-5]。为了解决这个问题,Agren等[6]通过把CTA1亚基与葡萄球菌G蛋白的D肽偶联在一起,构建了基因融合蛋白CTA1-DD。葡萄球菌G蛋白的D肽通过与免疫球蛋白的Fc和Fab片段结合,可以将CTA1导向免疫球蛋白,而且还能够导向B细胞受体。融合蛋白CTA1-DD保留了具有ADP-核糖基转移酶活性的CTA1亚基,而CTB亚基和与GM1神经节苷脂受体结合的能力被去除。广泛的研究表明,CTA1-DD融合蛋白具有与完整CT分子相当的全身和黏膜免疫的佐剂功能[7]。CTA1-DD提供了相当的佐剂效果,大大增强了机体对与佐剂联合免疫的特异性免疫原的细胞和体液免疫力[8]。
本研究采用枯草芽胞杆菌分泌表达CTA1-DD基因,旨在获得胞外分泌的CTA1-DD蛋白,并初步验证其黏膜佐剂活性,为大规模生产应用打下基础。
1 材料与方法
1.1 主要材料
流感病毒HA抗原由江苏省农业科学院刘青涛副研究员惠赠;6周龄ICR小鼠购自扬州大学比较医学中心;枯草芽胞杆菌WB600、重组穿梭载体pHT43、pMDT-18T-CTA1-DD-His载体、大肠杆菌DH5α由本实验室保存;ExTaq酶 、T4 DNA连 接 酶 、 DNA Marker、限制性内切酶购自大连宝生物科技有限公司;蛋白Marker购自Thermo公司;氨苄青霉素、氯霉素、异丙基硫代-β-D-半乳糖苷(IPTG)购自上海生工生物工程公司;琼脂糖凝胶 DNA 回收试剂盒、质粒提取试剂盒购自Axygen公司;Ni-IDA琼脂糖纯化树脂购自中科森辉微球技术公司;凝胶法鲎试剂盒购自厦门鲎试剂生物科技股份有限公司;鼠抗His单克隆抗体、HRP标记的羊抗小鼠IgG二抗购自南京翼飞雪生物科技有限公司;HRP标记的羊抗小鼠IgA二抗购自北京普利莱基因技术有限公司;其他试剂均为进口或国产分析纯。
1.2 重组表达载体pHT43-CTA1-DD构建
用XbaⅠ和SmaⅠ双酶切pMDT-18T-CTA1-DD-His对CTA1-DD基因片段进行胶回收,然后用 T4连接酶与同样双酶切后胶回收的pHT43载体连接。将连接产物转化进入DH5α感受态细胞,涂布于含有氨苄青霉素的固体LB培养基中37 ℃培养过夜。挑选单克隆提取质粒进行双酶切鉴定,阳性克隆送入南京擎科生物科技有限公司测序。
1.3 CTA1-DD在枯草芽胞杆菌WB600中的转化及诱导表达
将重组载体pHT43-CTA1-DD通过化学转化法[9]转入枯草芽胞杆菌WB600中,涂布于含有终浓度为10 μg/mL氯霉素的固体LB培养基中,37 ℃培养过夜。挑取阳性克隆,在含有氯霉素LB培养基的摇瓶中培养至OD值为0.5~1.0时,加入1.0 mmol/L的IPTG,37 ℃诱导24 h后离心取上清液进行SDS-PAGE分析。
1.4 3L发酵罐培养
将菌液按照5%体积分数接种到3L发酵罐中,培养条件:温度37 ℃,pH=7.2,搅拌转速为500 r/min,溶氧为30%,通气量为1.0 (V/V·min),添加1.0 mmol/L的IPTG,分别在6、12、24、36 h取样进行SDS-PAGE分析。
1.5 重组蛋白的纯化
将发酵液离心取上清液,加入终浓度为20 mmol/L Tris-HCl、100 mmol/L NaCl后按照Ni-IDA 说明书进行层析纯化,收集洗脱蛋白并用脱盐柱进行脱盐。然后参照凝胶法鲎试剂盒说明书检测蛋白的内毒素含量,并用BCA蛋白定量试剂盒对蛋白浓度进行定量分析。
1.6 重组蛋白的Western blot鉴定
将纯化后的样品经处理后进行SDS-PAGE,电泳结束后电转移到硝酸纤维素膜上,用5%的脱脂乳37 ℃封闭2 h,PBST洗涤5次;用1∶1 000稀释的鼠抗His单克隆抗体作为一抗,37 ℃孵育1 h,PBST洗涤5次;放入1∶5 000稀释的HRP标记的羊抗小鼠IgG二抗中,37 ℃作用30 min,PBST 洗涤5次后,DAB进行显色。
1.7 CTA1-DD重组蛋白佐剂活性的测定
将30只雌性6周龄的ICR小鼠随机分成3组:第1组,生理盐水;第2组,生理盐水+5 μg流感病毒HA抗原;第3组,10 μg CTA1-DD蛋白+5 μg流感病毒HA抗原,每只小鼠免疫的体积为20 μL。将疫苗分别于第0、14天对小鼠进行滴鼻免疫,在免后4周眼眶采血分离血清,小鼠处死后用200 μL的PBS对支气管肺泡进行灌洗并收集灌洗液。采用终点稀释ELISA法检测特异性IgG和IgA抗体的滴度[10],具体步骤如下:ELISA板包被HA抗原(200 ng/孔),用含有3%的PBST封闭1 h后,再用PBST清洗3次。制备2倍连续稀释的血清和黏膜样品,分别加入孔中。37 ℃孵育1 h后,PBST洗3次,加入1∶3 000稀释的HRP标记羊抗小鼠IgG二抗或者HRP标记羊抗小鼠IgA二抗,37 ℃孵育1 h,洗3次后加入底物液显色15 min后,加入2 mol/L的硫酸终止反应,酶标仪测定吸光值A450 nm。样品的抗体滴度为样品孔A450 nm-空白孔A450 nm≥0.2的最大稀释倍数。
1.8 数据统计分析
数据采用独立样本t检验进行统计学分析,结果以“平均值±标准差”表示。
2 结果
2.1 重组表达载体pHT43-CTA1-DD的构建
将连接产物转化、涂板,挑取单克隆菌落,提取质粒,用XbaⅠ和SmaⅠ双酶切鉴定。如图1所示,重组质粒被切成2个片段,分别得到一个约8 000 bp的条带,与pHT43载体大小相等;另一个片段约1 000 bp,与目的片段(CTA1亚基和DD亚基大小分别为585 bp和576 bp)大小相符。

M.5000 DNA Ladder;1. pHT43-CTA1-DD双酶切产物。
2.2 CTA1-DD重组蛋白在枯草芽胞杆菌中的表达验证
将空载体pHT43重组菌和含重组质粒pHT43-CTA1-DD重组菌WB600经IPTG诱导培养24 h后终止,离心取上清液进行SDS-PAGE,如图2所示。与对照组相比,试验组上清液在43 kDa处出现明显的外源蛋白条带,该蛋白分子量大小与CTA1-DD融合蛋白预期的分子量一致。Western blot结果(图3)也证明CTA1-DD基因在枯草芽胞杆菌中已成功表达,其表达量约占上清液总蛋白的60%。

M. 预染Marker;1. pHT43空载体发酵液上清液;2. pHT43-CTA1-DD发酵液上清液。

M.蛋白Marker;1. pHT43空载体发酵液上清液;2~3. pHT43-CTA1-DD发酵液上清液。
2.3 CTA1-DD重组蛋白的发酵表达及蛋白的纯化
使用发酵罐来表达CTA1-DD重组蛋白,分别在6、12、24、36 h取样进行SDS-PAGE分析(图4),可以发现随着时间的推移蛋白的表达量越高,最终在36 h达到最高,产量约为700 μg/mL。收集上清液通过镍离子柱亲和层析纯化的方法进行纯化,经过100 mmol/L咪唑的冲洗后,再用500 mmol/L咪唑的洗脱液洗脱后即可获得较高纯度的CTA1-DD蛋白(图5)。纯化的蛋白经过脱盐柱脱盐后,BCA法检测蛋白浓度为0.15 mg/mL,内毒素含量低于10 U/mL。
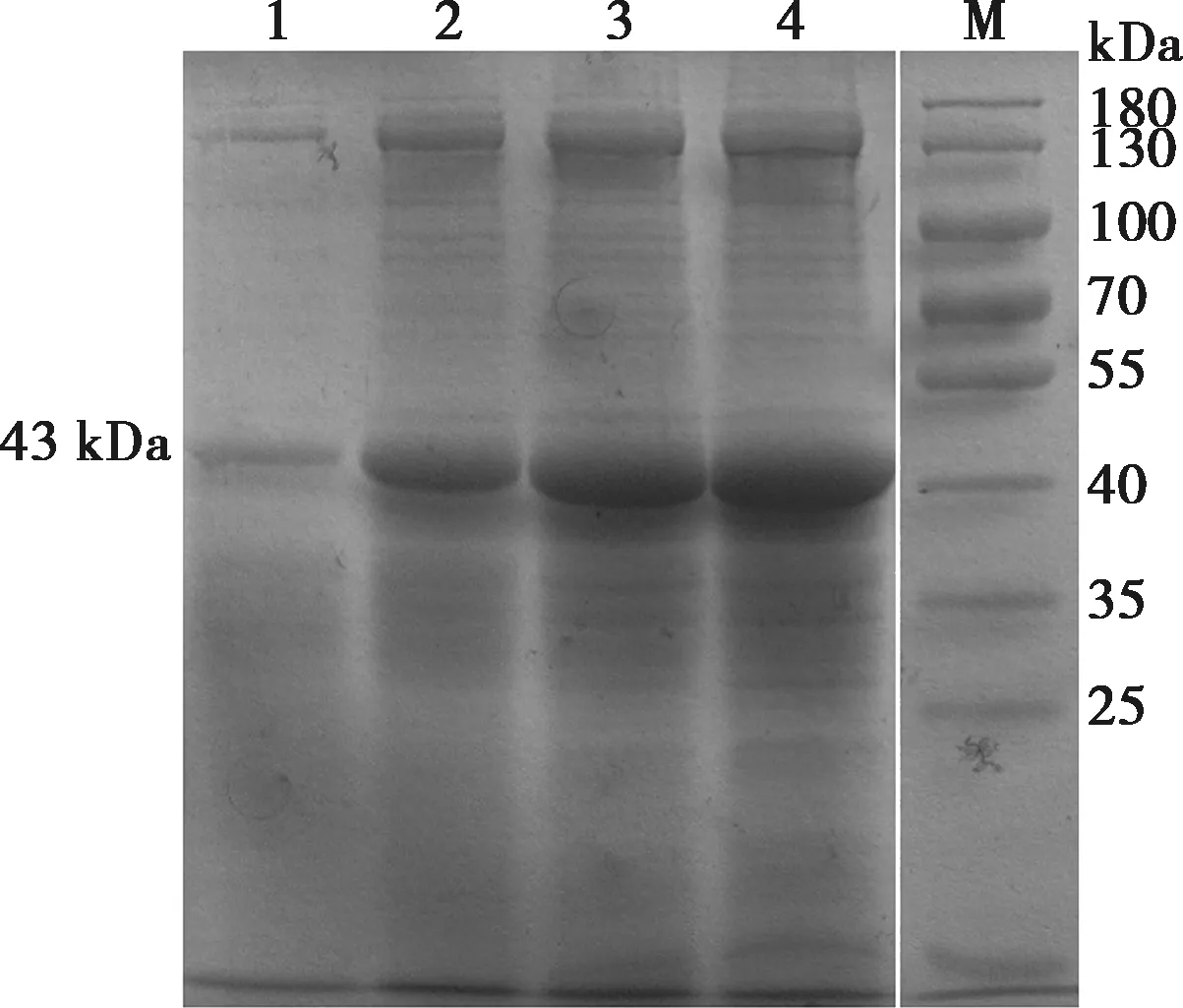
1~4. 发酵时间分别为6、12、24和36 h;M.蛋白Marker。
2.4 CTA1-DD重组蛋白佐剂活性
为了验证枯草芽胞杆菌表达的CTA1-DD重组蛋白佐剂活性,将10 μg的CTA1-DD蛋白与5 μg流感病毒HA抗原混合后滴鼻免疫小鼠(第3组),分别设生理盐水组(第1组)和HA对照(第2组),28 d后收集血清和鼻腔灌洗液分别检测IgG和IgA抗体。血清IgG抗体检测结果显示免疫HA组只能诱导很低的IgG抗体,而添加CTA1-DD蛋白组能够诱导更高的IgG抗体水平;黏膜IgA抗体检测结果显示添加CTA1-DD蛋白也能够显著提升IgA抗体水平(图6),说明枯草芽胞杆菌表达的重组CTA1-DD蛋白具有佐剂活性。
3 讨论
CTA1-DD蛋白作为黏膜佐剂在预防传染病疫苗方面的功效得到了充分验证,科研人员证明CTA1-DD可用于人类免疫缺陷病毒(HIV),人类乳头瘤病毒(HPV),埃博拉病毒(EBOV)、甲型流感病毒(H1N1)和轮状病毒(RV)等病毒疫苗的显著保护[11-15]。同时科研人员也发现CTA1-DD佐剂鼻内免疫可以增强对幽门螺杆菌和结核分枝杆菌的保护性免疫[16-17]。根据这些报道和建议,我们相信它在其他黏膜疫苗中也是有效的。因此,CTA1-DD作为黏膜佐剂是非常理想和安全的。当前兽用疫苗中,禽流感病毒(AIV)、猪流行性腹泻病毒(PEDV)等病毒疫苗都需要强有力的黏膜佐剂来提高黏膜免疫的效力。但是文献报道的CTA1-DD蛋白多由大肠杆菌表达,蛋白产量低,还需要进行细菌破碎、纯化等复杂工艺,并且革兰阴性菌表达系统会伴有大量的内毒素,处理过程繁琐、成本高,限制了其在兽用疫苗上的应用。
原核表达系统中大肠杆菌表达系统应用最为广泛,操作简单,生产成本低廉,体系也非常成熟和完善。但其最大缺点是目的蛋白只能表达于胞内和周质空间,不能像其他真核表达系统在胞外分泌表达,虽然也有一些信号元件可以实现这个功能,但是远远没有芽胞杆菌容易和高效。枯草芽胞杆菌表达系统作为原核表达系统的一种,是一种对环境无害的革兰阳性细菌且能分泌表达已广泛应用于医药和食品行业[18]。枯草芽胞杆菌表达系统相对于大肠杆菌表达系统,其优势如:非致病性、细胞壁组成简单、重组表达的蛋白内毒素低、较低密码子偏爱性、表达蛋白可溶性高、生物活性好[19]。本试验采用枯草芽胞杆菌表达系统,其一是蛋白能够直接分泌到培养基中,省去了大肠杆菌所需的菌体的离心、破碎等过程;其二是枯草芽胞杆菌不含有内毒素,不会引起动物的不良反应。本试验选用枯草芽胞杆菌表达系统高效表达了可溶性蛋白CTA1-DD,证明它是一种很有优势的表达系统。使用发酵罐发酵36 h蛋白的产量就能够达到700~1 000 mg/L,目的蛋白能占到上清液总蛋白的60%以上。将发酵液经过简单的离心后,上清液就可以直接进行亲和层析纯化,并且能够获得很纯的目的蛋白。蛋白经过检测,不含有内毒素,可直接进行动物试验,极大地精简了蛋白的处理步骤,为大规模应用奠定了基础。
为了验证枯草芽胞杆菌表达的CTA1-DD蛋白是否具有佐剂活性,本研究将CTA1-DD蛋白与HA抗原混合滴鼻后,显著提高了小鼠血清中的IgG抗体水平及肺泡黏膜中的sIgA抗体水平,表明CTA1-DD很好地发挥了黏膜佐剂作用,显著提升了小鼠呼吸道局部黏膜免疫应答。本试验说明枯草杆菌表达系统表达的CTA1-DD蛋白是一种有效的黏膜佐剂,并且具有产量高、易于纯化等特点,为以后的大规模生产应用奠定了基础。

