基于IL-6/miR-155轴探讨溃结宁膏穴位敷贴对脾肾阳虚型溃疡性结肠炎大鼠的影响
陈凯,朱莹,周牧之
湖南中医药大学第一附属医院,湖南 长沙 410007
溃疡性结肠炎(ulcerative colitis,UC)主要临床特征包括大便带血、腹部疼痛,以及大便形状、质地等改变。肠黏膜损伤和溃疡形成是UC常见病理表现,好发于直肠与乙状结肠,也可延伸至降结肠甚至整个结肠[1]。UC在我国发病率逐年升高[2-3],常用药物有5-氨基水杨酸、激素、生物制剂及免疫调节剂,约一半患者服药后症状有效缓解,但可能导致严重不良反应,如呕吐、贫血和全身水肿等。由于UC病因复杂、复发风险高,易伴发其他并发症,已成为临床亟需解决的难题。UC发病机制复杂,具体原因尚未完全明确。IL-6/miR-155轴在UC发生发展中发挥重要作用,白细胞介素(IL)-6通过作用于下游信号因子促进信号传导与转录激活因子(STAT)3磷酸化,STAT3磷酸化入核后能诱导miR-155表达,进一步调控UC炎症反应及Th17/Threg平衡[4-6]。溃结宁膏是朱莹教授根据多年临床经验所创,课题组运用溃结宁膏穴位敷贴治疗脾肾阳虚型UC临床疗效显著[7]。前期实验研究表明,溃结宁膏能减轻UC大鼠及细胞模型炎症反应,降低肿瘤坏死因子(TNF)-α、IL-1等促炎因子分泌[8-9]。本实验在前期研究基础上,观察溃结宁膏穴位敷贴对UC大鼠炎症反应及Th17/Threg平衡的影响,进一步阐明其治疗UC的分子机制,为临床应用提供实验依据。
1 材料与方法
1.1 动物
SPF级雄性SD大鼠60只,体质量180~220 g,购于湖南斯莱克景达实验有限公司。饲养于湖南中医药大学第一附属医院动物房,温度20~25 ℃,湿度40%~70%,12 h光暗循环,自由摄食饮水。本实验经湖南中医药大学第一附属医院实验动物伦理委员会批准(ZYFY20190814-1)。
1.2 药物、试剂及仪器
溃结宁膏(由炮附子、延胡索、丁香、芥子、赤芍、细辛、生姜按1∶1∶1∶1∶1∶1∶2组成)、无药物巴布剂基质(由聚丙烯酸钠、高岭土、明胶、甘羟铝、聚乙烯醇、蓖麻油、甘油组成),湖南省中医院药剂科提供。柳氮磺嘧啶(SASP)片,批号09190501,上海信谊天平药业有限公司。番泻叶,湖南然润堂中药有限公司。
2,4,6-三硝基苯磺酸(TNBS,批号2297,美国Sigma公司),腺嘌呤(批号A8626-25G,美国Sigma公司),大便隐血试剂(批号C027-1-1,珠海贝索生物技术有限公司),IL-8、IL-17、IL-23 ELISA试剂盒(批号分别为I03050436、I0303471、I040347110,武汉华美生物工程有限公司),mRNA反转录试剂盒(批号CW2569,北京康为世纪),miRNA反转录试剂盒(批号CW2141,北京康为世纪),p-STAT3一抗(批号ab76315,英国Abcam),IL-6一抗(批号ab233706,英国Abcam),CD4-FITC抗体(批号11-0040-82,美国Invitrogen公司),IL-17A-PE抗体(批号12-7177-81,美国Invitrogen公司),Cell Stimulation Cocktail(Plus protein transport inhibitors)500×(批号00-4975-93,美国eBiosciences公司),人外周血淋巴细胞分离液(批号P8610,北京索莱宝公司),红细胞裂解液(批号C3702,北京索莱宝公司),CD25-PE抗体(批号17-0390-82,美国eBiosciences公司),Foxp3-APC抗体(批号12-5773-80,美国eBiosciences公司),β-actin抗体(批号66009-1-Ig,美国Proteintech),HRP标记山羊抗小鼠IgG(批号SA00001-1,美国Proteintech),HRP标记山羊抗兔IgG(批号SA00001-2,美国Proteintech)。
台式高速冷冻离心机(型号H1650R,湖南湘仪),多功能酶标分析仪(型号MB-530,深圳汇松科技发展有限公司),全自动酶标洗板机(型号PW-812,深圳市汇松科技发展有限公司),电热恒温培养箱(型号DHP-500,北京市永光明医疗仪器有限公司),荧光定量RCP仪(型号PIKOREAL96,美国Thermo),荧光PCR板(型号SPL0960,美国Thermo),摇床(型号TS-1,江苏其林贝尔),电泳仪(型号DYY-6C,北京六一),电泳槽(型号DYCZ-24DN,北京六一),转膜仪(型号DYCZ-40D,北京六一),-80 ℃冰箱(型号DW-HW438,中国美菱)。
1.3 造模
大鼠适应性喂养1周,采用随机数字表法选取12只大鼠正常喂养,剩余48只参照课题组前期方法[10]制备脾肾阳虚型UC大鼠模型,先予腺嘌呤10 mL/kg灌胃2周,第3周起用冰番泻叶溶液10 mL/kg灌胃,连续2周,期间自由摄食饮水,每日灌胃30 min后将冰水喷至大鼠毛发,使肌肉等全身各处湿透,再用风扇吹干。第29日大鼠禁食不禁水24 h,腹腔注射0.3%戊巴比妥钠10 mL/kg麻醉,用石蜡油润滑聚乙烯管后插入大鼠直肠,深度约8 cm,缓慢注入5%TNBS(100 mg/kg,加50%乙醇0.25 mL),提起大鼠尾巴倒置2 min。次日开始观察大鼠一般状况,随机取模型组4只、空白组1只过量麻醉处死,验证造模效果。造模后大鼠精神萎靡,毛发枯槁,体质量降低,进食减少,明显黏液脓血便,肉眼可见结肠组织局部溃疡、充血、糜烂,显微镜下可见中性粒细胞聚集,腺体排列紊乱,结合黏膜组织缺损提示造模成功。
1.4 分组及给药
将正常喂养的11只大鼠作为空白组,44只成模大鼠按随机数字表法分为模型组、非穴位敷贴组、穴位敷贴组和SASP组,每组11只。取穴参考《实验针灸学》[11],选择“脾俞”“膈俞”“足三里”“大肠俞”“天枢”“肾俞”,模型组用无药物巴布剂基质敷贴穴位+生理盐水灌胃,穴位敷贴组用溃结宁膏敷贴穴位+生理盐水灌胃,非穴位敷贴组用溃结宁膏敷贴臀部肌肉丰厚处+生理盐水灌胃,SASP组用无药物巴布剂基质敷贴穴位+SASP灌胃,两侧穴位交替进行,1.5 h/次,1次/d,连续14 d。
1.5 取材
末次干预后大鼠禁食不禁水24 h,腹腔注射3%戊巴比妥钠10 mL/kg麻醉,腹主动脉取血,3 500 r/min离心10 min,血清保存于-20 ℃备用。取血后脱颈处死大鼠,取距肛门6~10 cm结肠组织于多聚甲醛中固定,用于病理检测,另取部分结肠组织于-80 ℃保存备用。
1.6 指标检测
1.6.1 一般状况及疾病活动指数评分
观察大鼠一般状况(精神状态、毛发、大小便等),干预结束后对大鼠进行疾病活动指数(DAI)评分,DAI=(体质量下降分数+大便性状分数+便隐血分数)÷3。具体评分标准见表1。
1.6.2 结肠组织病理形态观察及结肠黏膜损伤评分
取病变部位结肠组织,于多聚甲醛中固定,石蜡包埋,切片,60 ℃烤片12 h,切片脱蜡至水,苏木精染色1~10 min,伊红染色1~5 min,脱水,烤干,封片。显微镜下观察结肠组织病理变化,并进行结肠黏膜损伤指数(CMDI)评分。评分标准见表2[12]。

表2 CMDI评分标准
1.6.3 ELISA检测
按试剂盒说明书配制标准品、洗液工作液、生物素标记抗体工作液及辣根过氧化物酶标记亲和素工作液。将试剂在室温平衡30 min,设置标准孔与待测样品孔,加样,弃液,加生物素标记抗体工作液,弃液,加辣根过氧化物酶标记亲和素工作液,弃液,甩干,加底物,避光显色,加终止液终止反应。用酶标仪测定波长450 nm处光密度(OD值),根据样品OD值计算血清IL-8、IL-17、IL-23含量。
1.6.4 RT-PCR检测
用Trizol、异丙醇、三氯甲烷、乙醇提取结肠组织总RNA,紫光分光光度计测定波长260 nm与280 nm吸光度,计算RNA浓度和纯度。配制反转录体系,将总RNA反转录为cDNA。PCR条件:95 ℃、10 min,95 ℃、15 s,60 ℃、60 s,共40个循环。引物序列见表3。以β-actin为内参,2-ΔΔCt法计算各基因相对表达量。

表3 各基因PCR引物序列
1.6.5 Western blot检测
取结肠组织剪碎,加入RIRA裂解液,生物匀质仪匀浆,冰上裂解10 min,4 ℃、12 000 r/min离心15 min,BCA法测定蛋白浓度。制备15%分离胶及4.8%浓缩胶,蛋白样品中加入loading buffer,煮沸,置于冰盒中备用。上样,75 V电泳130 min,300 mA恒流转膜,用脱脂奶粉室温封闭90 min。将膜与IL-6一抗(1∶750)、p-STAT3一抗(1∶1 000)、β-actin一抗(1∶5 000)于低温孵育过夜。次日室温放置30 min,加HRP-山羊抗小鼠IgG(1∶5 000)、HRP-山羊抗兔IgG(1∶6 000)孵育60 min,ECL发光液进行显色,凝胶成像系统成像,Image J软件分析蛋白相对灰度值。
1.6.6 流式细胞术检测
取抗凝全血,加入淋巴细胞分离液,800×g离心30 min,吸取白膜细胞层,400×g离心5 min,用1640完全培养基重悬细胞备用。按1∶500稀释Cell Stimulation Cocktail(Plus protein transport inhibitors)后加入细胞悬液中,恒温培养箱培养4 h。收集细胞,用1×Fixation/Permeabilization concentrate重悬细胞沉淀,避光固定破膜30 min,加入1×工作液,反复离心,PBS重悬细胞沉淀,加入CD4、IL-17A、CD25和Foxp3抗体孵育,流式细胞仪上机检测。
1.7 统计学方法
采用Graphpad Prism 8.0软件进行统计分析。计量资料以-表示,多组间比较采用单因素方差分析。P<0.05表示差异有统计学意义。
2 结果
2.1 溃结宁膏对模型大鼠一般状况及疾病活动指数评分的影响
干预过程中除空白组外,其余各组均有大鼠死亡,分别为模型组3只、穴位敷贴组1只、非穴位敷贴组2只、SASP组1只,死亡时间主要集中在造模后1个星期内,考虑可能为结肠穿孔所致。
大鼠造模后精神状态变差,摄食量减少,毛发逐渐稀薄、干枯,体质量下降,形体消瘦,弓背蜷缩,喜扎堆,大便质地稀薄,部分夹杂黏液脓血,小便清长。与模型组和非穴位敷贴组比较,穴位敷贴组和SASP组大鼠精神状态好转,毛发润泽,摄食量增加,体质量上升,大便逐渐成形,黏液脓血便程度减轻。
与空白组比较,模型组大鼠DAI评分明显升高(P<0.05);与模型组和非穴位敷贴组比较,穴位敷贴组和SASP组大鼠DAI评分明显降低(P<0.05)。见表4。
表4 各组大鼠DAI评分比较(-,分)
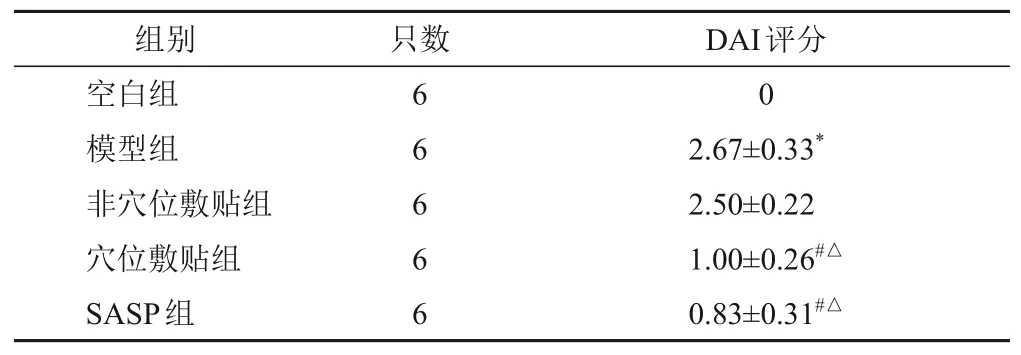
表4 各组大鼠DAI评分比较(-,分)
注:与空白组比较,*P<0.05;与模型组比较,#P<0.05;与非穴位敷贴组比较,△P<0.05
DAI评分组别只数0 2.67±0.33*2.50±0.22 1.00±0.26#△0.83±0.31#△空白组模型组非穴位敷贴组穴位敷贴组SASP组6 6 6 6 6
2.2 溃结宁膏对模型大鼠结肠组织病理形态的影响
空白组大鼠结肠组织表面光滑,呈淡粉白色,局部未见膨隆,结肠内壁未见溃疡、充血、水肿等表现;显微镜下腺体排列整齐,无炎性细胞浸润,未见细胞变性及坏死。模型组和非穴位敷贴组大鼠结肠长度不同程度缩短、结肠周径不一,局部可见红肿膨胀,部分肠段质地变硬,可见深浅不一的溃疡,黏膜局部红肿充血;显微镜下腺体排列紊乱,可见炎性细胞浸润及细胞变性、坏死。穴位敷贴组和SASP组大鼠结肠长度有所增加,结肠黏膜充血、水肿、溃疡明显好转,显微镜下腺体排列较前规则,细胞变性、坏死明显好转。见图1。
与空白组比较,模型组大鼠CMDI评分明显升高(P<0.05);与模型组和非穴位敷贴组比较,穴位敷贴组和SASP组大鼠CMDI评分明显降低(P<0.05)。见表5。
表5 各组大鼠CMDI评分比较(-,分)
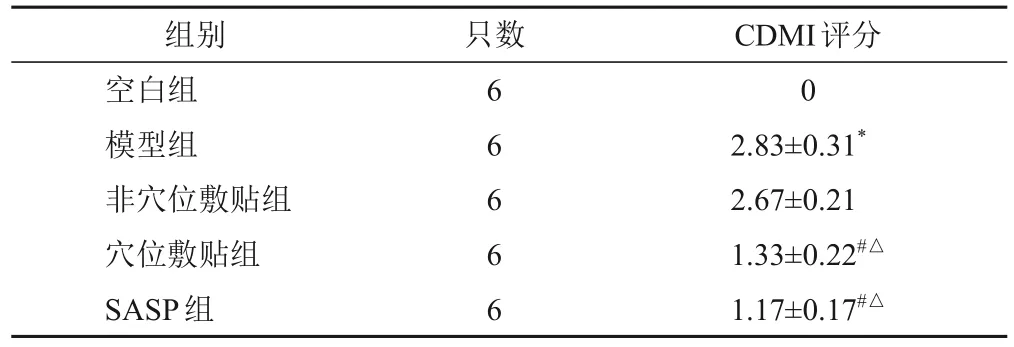
表5 各组大鼠CMDI评分比较(-,分)
注:与空白组比较,*P<0.05;与模型组比较,#P<0.05;与非穴位敷贴组比较,△P<0.05
CDMI评分0 2.83±0.31*2.67±0.21 1.33±0.22#△1.17±0.17#△组别空白组模型组非穴位敷贴组穴位敷贴组SASP组只数6 6 6 6 6
2.3 溃结宁膏对模型大鼠血清白细胞介素-8、白细胞介素-17、白细胞介素-23含量的影响
与空白组比较,模型组大鼠血清IL-8、IL-17、IL-23含量明显增加(P<0.05);与模型组和非穴位敷贴组比较,穴位敷贴组和SASP组大鼠血清IL-8、IL-17、IL-23含量明显减少(P<0.05)。见表6。
表6 各组大鼠血清IL-8、IL-17、IL-23含量比较(-,pg/mL)

表6 各组大鼠血清IL-8、IL-17、IL-23含量比较(-,pg/mL)
注:与空白组比较,*P<0.05;与模型组比较,#P<0.05;与非穴位敷贴组比较,△P<0.05
只数IL-23组别IL-8IL-17 0.88±0.02 3.93±0.08*3.74±0.26 1.39±0.12#△1.21±0.09#△空白组模型组非穴位敷贴组穴位敷贴组SASP组4 4 4 4 4 24.50±0.58 63.09±2.02*58.35±1.06 31.21±0.42#△28.43±2.43#△605.62±3.65 997.14±14.60*979.33±6.73 656.92±19.22#△645.71±16.22#△
2.4 溃结宁膏对模型大鼠结肠组织白细胞介素-6、白细胞介素-17、白细胞介素-23、miR-155、信号传导与转录激活因子3 mRNA表达的影响
与空白组比较,模型组大鼠结肠组织IL-6、IL-17、IL-23、miR-155、STAT3 mRNA表达明显升高(P<0.05);与模型组和非穴位敷贴组比较,穴位敷贴组和SASP组大鼠结肠组织IL-6、IL-17、IL-23、miR-155、STAT3 mRNA表达明显降低(P<0.05)。见表7。
表7 各组大鼠结肠组织IL-6、IL-17、IL-23、miR-155、STAT3 mRNA表达比较(-)

表7 各组大鼠结肠组织IL-6、IL-17、IL-23、miR-155、STAT3 mRNA表达比较(-)
注:与空白组比较,*P<0.05;与模型组比较,#P<0.05;与非穴位敷贴组比较,△P<0.05
STAT3 0.99±0.15 4.73±0.52*4.08±0.33 1.45±0.12#△1.32±0.31#△组别空白组模型组非穴位敷贴组穴位敷贴组SASP组只数5 5 5 5 5 IL-6 0.47±0.08 2.45±0.15*2.00±0.14 0.88±0.18#△0.88±0.16#△IL-17 0.76±0.06 3.25±0.28*2.85±0.21 1.09±0.11#△1.11±0.07#△IL-23 0.66±0.10 3.85±0.18*3.65±0.19 1.15±0.15#△1.17±0.06#△miR-155 0.48±0.06 2.50±0.18*2.23±0.22 0.88±0.09#△0.93±0.12#△
2.5 溃结宁膏对模型大鼠结肠组织白细胞介素-6、磷酸化信号传导与转录激活因子3蛋白表达的影响
与正常组比较,模型组大鼠结肠组织IL-6、p-STAT3蛋白表达明显升高(P<0.05);与模型组和非穴位敷贴组比较,穴位敷贴组和SASP组大鼠结肠组织IL-6、p-STAT3蛋白表达明显降低(P<0.05)。见图2、表8。
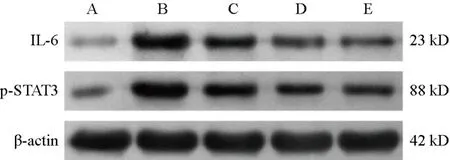
图2 各组大鼠结肠组织IL-6、p-STAT3蛋白免疫印迹
表8 各组大鼠结肠组织IL-6、p-STAT3蛋白表达比较(-)
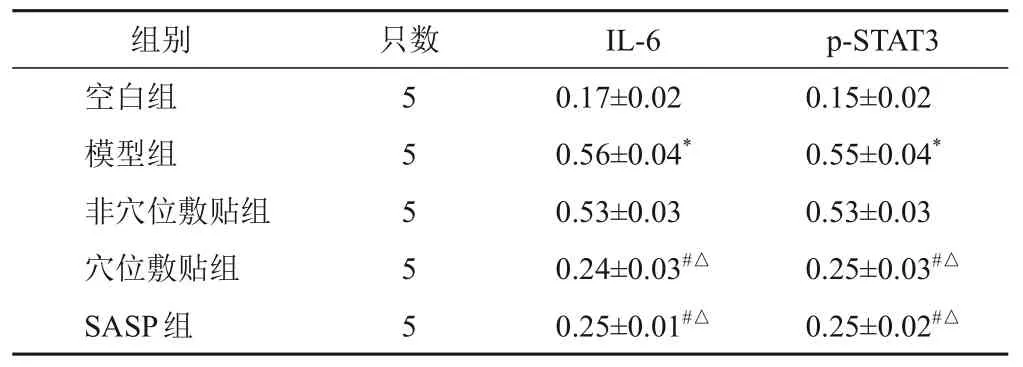
表8 各组大鼠结肠组织IL-6、p-STAT3蛋白表达比较(-)
注:与空白组比较,*P<0.05;与模型组比较,#P<0.05;与非穴位敷贴组比较,△P<0.05
p-STAT3组别只数IL-6 0.15±0.02 0.55±0.04*0.53±0.03 0.25±0.03#△0.25±0.02#△空白组模型组非穴位敷贴组穴位敷贴组SASP组5 5 5 5 5 0.17±0.02 0.56±0.04*0.53±0.03 0.24±0.03#△0.25±0.01#△
2.6 溃结宁膏对模型大鼠血液Th17、Treg细胞比例的影响
与空白组比较,模型组大鼠血液Th17细胞比例升高,Treg细胞比例降低(P<0.05),Th17/Treg细胞比例明显升高(P<0.05);与模型组和非穴位敷贴组比较,穴位敷贴组和SASP组大鼠血液Th17细胞比例降低,Treg细胞比例升高(P<0.05),Th17/Treg细胞比例降低(P<0.05)。见表9。
表9 各组大鼠血液Th17、Treg细胞比例比较(-)

表9 各组大鼠血液Th17、Treg细胞比例比较(-)
注:与空白组比较,*P<0.05;与模型组比较,#P<0.05;与非穴位敷贴组比较,△P<0.05
组别空白组模型组非穴位敷贴组穴位敷贴组SASP组Th17/Treg 0.11±0.02 7.82±1.01*4.42±0.40#0.18±0.04#△0.22±0.03#△只数5 5 5 5 5 Th17/%1.79±0.31 13.85±1.01*12.37±0.67 2.27±0.37#△2.65±0.33#△Treg/%15.58±0.73 1.87±0.21*2.86±0.22 12.93±0.90#△12.58±1.02#△
3 讨论
根据UC临床症状,可将其归属于中医学“泄泻”“痢疾”等范畴,主要有湿热下注、脾肾阳虚、肝郁脾虚等类型[13]。本研究用SD大鼠制备动物模型,腺嘌呤灌胃2周后改为番泻叶灌胃。腺嘌呤具有肾毒性,常作为肾阳虚证的造模药物。番泻叶苦寒,伤脾肾之阳气,在灌胃同时进行环境干预,进一步损伤机体脾肾阳气,最后以TNBS和乙醇复合物灌肠制备脾肾阳虚型UC模型。该病证结合模型经前期研究证实可靠[10]。本研究发现,大鼠造模后出现活动迟缓、毛发枯槁、大便溏泻、便中带血等表现,结合肠道黏膜情况,提示造模成功。通过溃结宁膏穴位敷贴干预,能够有效改善模型大鼠一般状况。
UC发病机制复杂,主要与遗传、环境、菌群失调和免疫功能障碍相关。肠道炎症严重程度与促炎因子表达密切相关[14-15]。IL-6是由活化的免疫细胞产生的重要促炎因子,越来越多证据表明,IL-6水平能影响UC病情发展,改变疾病结局与预后。采用IL-6拮抗剂托珠单抗能减轻患者症状,缓解机体炎症反应[16-17]。IL-6能与其受体结合形成复合物,激活信号转导β受体gp130和细胞内信号级联通路,其中最重要的是JAK/STAT通路。gp130相关的Janus激酶(JAK)特别是JAK1在配体结合后被激活,从而使STAT3磷酸化入核,靶向miR-155转录。目前染色质免疫共沉淀已证实STAT3能够直接与miR-155位点结合,从而调节IL-6、IL-17、IL-23等炎症因子分泌。相反,miR-155通过JAK/STAT通路调节UC Th17/Treg平衡与炎症反应[5,18-19]。研究表明,IL-6/STAT3信号通路具有调节T细胞分化、免疫、肠道炎症的作用,阻断STAT3可调节机体免疫反应,缓解肠道炎症[20-21]。miR-155是具有不同功能的微小RNA,参与造血、炎症和免疫反应。炎症因子及Toll样受体能诱导miR-155表达,UC病变结肠组织miR-155表达升高,采用miR-155拮抗剂能降低其表达,减少炎症因子分泌,改善UC症状及体征[22-23]。以上研究表明,IL-6/miR-155轴在UC发展中扮演重要角色。本实验中模型大鼠血清IL-6、IL-8、IL-17、IL-23含量增加,结肠组织IL-6/miR-155轴关键因子IL-6、STAT3、miR-155表达升高,溃结宁膏干预能减少模型大鼠血清IL-6、IL-8、IL-17、IL-23含量,抑制IL-6/miR-155轴相关因子表达,调节Th17/Treg平衡。
穴位敷贴是常用医外治法,具有疗效显著、不良反应少、使用方便等特点,在临床广泛应用。在中西药内服基础上加用穴位敷贴能提高UC治疗效果,减轻药物不良反应,临床取穴主要为脾俞、肾俞、大肠俞、神阙等[24-25]。溃结宁膏依据脏腑经络理论选择穴位,采用药物外用刺激穴位,进一步通过经络将药效输送至相应部位,从而温补脾肾、调节气血。
综上,溃结宁膏可降低脾肾阳虚型UC大鼠DAI评分和CMDI评分,修复结肠组织损伤,其机制与减少炎症因子分泌,抑制IL-6/miR-155轴相关因子IL-6、p-STAT3、miR-155表达,调节Th17/Treg平衡有关。

