基于网络药理学和细胞验证探讨甘草抗肺癌机制
张尚龙 ,闫潇 ,杨秀娟 ,杨志军 ,连小龙 ,张楠 ,叶礼巧 ,杨必乾 ,殷亭湄 ,付晓艳 ,马趣环 ,邓毅,
1.甘肃中医药大学,甘肃 兰州 730000; 2.甘肃省中药药理与毒理学重点实验室,甘肃 兰州 730000
肺癌是全球发病率最高的恶性肿瘤之一,治疗方法主要有手术治疗、放射治疗、化学治疗、分子靶向治疗等。由于肺癌早期症状不明显,恶性程度较高,很多患者在确诊时已发生肿瘤转移和扩散,无法接受手术治疗,故化疗的作用不可替代。然而大剂量或重复低剂量化疗药物会引起较强的不良反应,且导致患者产生耐药性。甘草具有补脾益气、清热解毒、祛痰止咳、缓急止痛、调和诸药等功效[1]。药理研究表明,甘草具有抗肿瘤、抗炎杀菌、抗病毒、保肝、抗心力衰竭、调节免疫及抗纤维化等作用[2]。近年来,甘草有效成分如甘草次酸、甘草苷、异甘草素等在抗肝癌、乳腺癌、肺癌、结肠癌等肿瘤的研究取得了一定进展[3-7]。本研究采用网络药理学方法,对甘草抗肺癌作用进行靶点与通路筛选,并进行体外实验验证,为后续深入研究及新药开发提供参考。
1 材料与方法
1.1 网络药理学分析
1.1.1 甘草活性成分及靶点收集
通过TCMSP(http://tcmspw.com/tcmsp.php),以口服生物利用度(OB)≥30%且类药性(DL)≥0.18为条件筛选甘草的活性成分及对应靶点;通过R语言软件获得靶点的缩写名称,构建中药-化合物-靶点数据库。
1.1.2 肺癌靶点收集
以“lung cancer”为关键词,通过GeneCards(https://www.genecards.org/)、OMIM(http://https://omim.org/)、DrugBank(https://go.drugbank.com)数据库检索疾病靶点,检索结果合并后去重,得到肺癌相关靶点。
1.1.3 甘草治疗肺癌靶点收集
将甘草靶点与肺癌相关靶点通过微生信在线平台(https://www.bioinformatics.com.cn/)可视化得到甘草-肺癌共有靶点,即为甘草治疗肺癌的靶点。
1.1.4 蛋白相互作用网络构建
将共有靶点导入STRING(https://string-db.org/)数据库,在“organism”中选择“Homo Sapiens”进行搜索,获得蛋白相互作用(PPI)网络,导出TSV格式文件,将其导入Cytoscape3.8.0(http://www.cytoscape.org/)软件筛选关键靶点,绘制PPI网络。
1.1.5 GO和KEGG通路富集分析
通过Metascape(http://metascape.org/)在线软件对获得的关键靶点进行GO和KEGG通路富集分析。GO富集分析包括生物过程(BP)、细胞组分(CC)、分子功能(MF)。将分析结果前10条进行可视化。
1.1.6 共有靶点-化合物网络构建
将共有靶点及化合物通过Cytoscape3.8.0软件进行可视化,构建共有靶点-化合物网络图。
1.2 实验验证
1.2.1 药物与细胞
甘草采自甘肃省金塔县,经甘肃中医药大学中药鉴定教研室鉴定为豆科植物甘草Glycyrrhiza uralensisFisch.的干燥根和根茎。甘草提取物制备方法:称取甘草粉末100 g,加50%乙醇(1∶10,W/V)浸提30 min,超声提取(功率100 W,频率60 kHz)30 min,真空抽滤后,减压回收溶剂至50 mL,水浴加热至干浸膏,快速研磨成细粉[8],4 ℃冰箱保存,实验时用DMEM高糖培养基配制成50 mg/mL母液。
人肺腺癌A549细胞,甘肃省肿瘤医院惠赠。
1.2.2 试剂与仪器
DMEM高糖培养基(Cytiva公司,批号AH29027412),胎牛血清(浙江天杭生物科技股份有限公司,批号21030707),噻唑蓝(MTT,北京索莱宝科技有限公司,批号917Q051),胰蛋白酶、青链霉素(武汉赛维尔生物科技有限公司,批号GP2211017、GA22020011094),二甲基亚砜(DMSO,北京索莱宝科技有限公司,批号1121E0331),兔抗β-actin、羊抗兔二抗(Abbkine公司,批号分别为ATVMA0302、ATVE16011),兔抗Bax、兔抗Bcl-2、兔抗HIF-1α及兔抗GLUT1(Abmart公司,批号分别为T40051、T40056、TA1009、T55360),BCA蛋白浓度测定试剂盒(北京索莱宝科技有限公司,批号20211213)。
CO2恒温培养箱(型号HF151,力康发展有限公司),酶标仪(型号RT-6100,深圳雷杜生命科学股份有限公司),电泳仪(型号DYY-6D,北京六一生物科技有限公司),超净工作台(型号B2HFsafe,上海力申科学有限公司),低温冷冻离心机(型号H1650R,湖南湘仪实验室仪器开发有限公司),荧光倒置显微镜(型号MoticamPro2058,上海捷辰仪器有限公司)。
1.2.3 细胞培养
将冻存的A549细胞迅速解冻,加入完全培养基,1 000 r/min离心5 min,弃上清液,转移至培养瓶,加入5 mL配制好的完全培养液(10%胎牛血清、1%青链霉素混合液、89%高糖DEME培养基),轻轻吹打使细胞悬浮,转移悬浮液至细胞培养瓶,置37 ℃、5%CO2培养箱进行培养,待培养瓶中细胞融合至80%~90%时,用胰酶消化并转移至新的培养瓶中。
1.2.4 MTT法检测细胞存活率
将细胞消化悬浮后以5×104个/mL接种于96孔板,待细胞贴壁生长24 h后,分为调零组(不加细胞和药物)、对照组(不加药物)及给药组,每组3个复孔,给药组用不同浓度(1、2、3、4、5 mg/mL)甘草提取物处理24 h,加入20 μL MTT溶液(5 mg/mL),4 h后加入150 μL DMSO,混匀,于酶标仪波长570 nm处检测吸光度(OD值),计算细胞存活率。存活率(%)=(OD给药组-OD调零组)÷(OD对照组-OD调零组)×100%。
1.2.5 Western blot检测Bax、Bcl-2、HIF-1α、GLUT1蛋白表达
将A549细胞分为对照组和甘草低、中、高剂量组,以1×105个/mL接种于6孔板中,待其贴壁后,甘草低、中、高剂量组加入不同浓度(3、4、5 mg/mL)甘草提取物处理24 h,对照组加入不含药物的培养基,收集细胞,于冰上加入细胞裂解液,分别提取总蛋白,加入上样缓冲液,100 ℃金属浴变性。根据分子量不同进行SDS-PAGE,转PVDF膜,5%脱脂牛奶封闭2 h,加入Bax、Bcl-2、HIF-1α、GLUT1一抗(均为1∶2 000),4 ℃孵育过夜,1×TBST清洗3次,每次10 min,加二抗(1∶5 000),室温孵育2 h,1×TBST清洗3次,每次10 min,曝光显影,用Image J软件计算灰度值。
1.2.6 统计学方法
2 结果
2.1 甘草活性成分及靶点
通过TCMSP得到甘草化合物及靶点,删去无靶点的化合物,最终得到甘草活性成分88个,靶点213个。
2.2 肺癌靶点
将GeneCards、OMIM、DrugBank数据库收集到的肺癌靶点进行合并,删除重复靶点,最终得到肺癌靶点23 458个。
2.3 甘草抗肺癌靶点
将检索到的213个甘草活性成分的靶点与23 458个肺癌靶点比较分析后取重复值,得到共同作用靶点209个,作为甘草治疗肺癌的潜在靶点。
2.4 核心靶点蛋白相互作用网络
将209个潜在作用靶点导入STRING数据库,获得的PPI网络导入Cytoscape3.8.0软件进行分析,根据Degree值与中介中心性(betweenness centrality,BC)、接近中心性(closeness centrality)高于平均值筛选出排名靠前的核心靶点43个。Degree值排序居前列的靶点有MAPK1、MAPK3、MMP2、MMP9、AKT1、VEGFA及HIF1A等。这些靶点主要参与细胞周期进程、细胞增殖、分化、侵袭、迁移、凋亡、细胞血管生成等过程。因此,蛋白质分子之间的相关性表明这些靶点可能是甘草对肺癌起到核心调控作用的靶点。见图1。
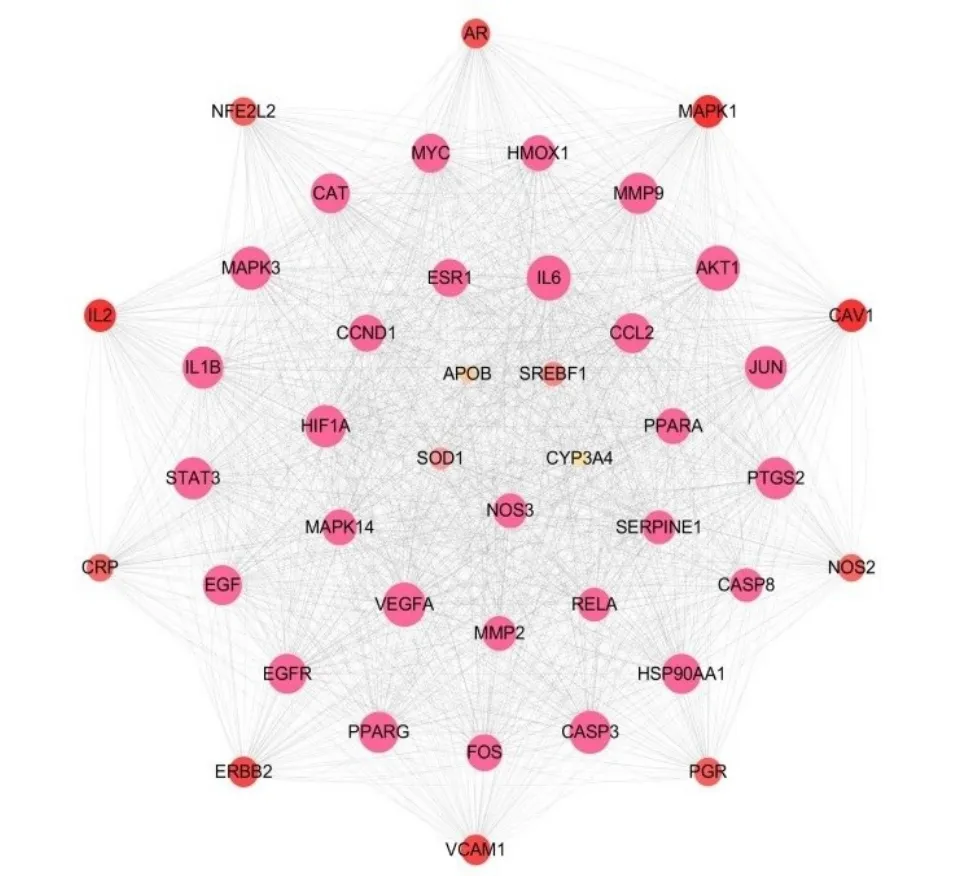
图1 甘草抗肺癌核心靶点PPI网络
2.5 GO和KEGG通路富集分析结果
对甘草抗肺癌209个潜在靶点进行GO富集分析,共得到1 312条结果。其中BP 1 202条,主要涉及凋亡信号通路、细胞对脂质的反应、蛋白磷酸化的正调控等;CC 46条,主要涉及转录调节复合物、过氧化物酶体、囊泡腔、细胞器外膜等;MF 64条,主要涉及细胞因子受体结合、转录因子的结合、一氧化氮合酶的调节活性、蛋白质丝氨酸/苏氨酸/酪氨酸激酶活性等。各前10条结果见图2。

图2 甘草抗肺癌潜在靶点GO富集分析
对甘草抗肺癌209个潜在靶点进行KEGG通路富集分析,共得到226条通路,主要涉及癌症相关通路、动脉粥样硬化、HIF-1信号通路、非酒精性脂肪肝、小细胞肺癌、幽门螺杆菌感染的上皮细胞信号转导等,前10条通路见图3。Bcl-2家族是与细胞凋亡密切相关的一类蛋白,包括Bcl-2等凋亡抑制因子和Bax等促凋亡因子。甘草主要活性成分甘草查尔酮A[9]、甘草次酸[10]、异甘草素[11]等通过调节Bcl-2/Bax表达促进肿瘤细胞凋亡,从而发挥抗肿瘤作用。HIF-1信号通路是缺氧微环境的关键通路,HIF-1α作为调节氧稳态的核转录因子,可调节70多个基因,如血管内皮生长因子、基质金属蛋白酶等,调控恶性肿瘤的细胞增殖、血管生成、侵袭和转移[12]。因此,推测甘草可能通过影响肿瘤细胞的凋亡通路及HIF-1α信号通路发挥抗肿瘤作用。
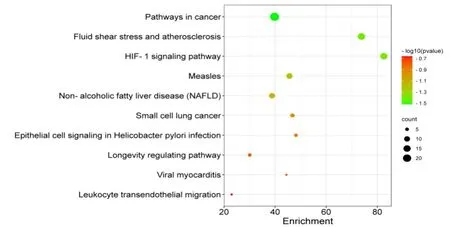
图3 甘草抗肺癌潜在靶点KEGG通路富集分析
2.6 共有靶点-化合物网络
甘草与肺癌共有靶点-化合物网络见图4。该网络包含297个节点、1 495条边。

图4 甘草抗肺癌共有靶点-化合物网络
2.7 实验验证结果
2.7.1 不同浓度甘草提取物对细胞存活率的影响
与对照组比较,1、2、3、4、5 mg/mL甘草提取物对A549细胞增殖均有抑制作用(P<0.01),表明甘草对A549细胞存活率的影响有剂量依赖性。见表1。
表1 各组A549细胞存活率比较(,n=3)

表1 各组A549细胞存活率比较(,n=3)
注:与对照组比较,**P<0.01
存活率/%100.00±1.55 72.21±1.61**66.73±0.22**58.89±0.44**44.62±7.02**22.11±0.30**组别对照组给药组浓度/(mg/mL)1 2 3 4 5
2.7.2 甘草对A549细胞Bax、Bcl-2、HIF-1α、GLUT1蛋白表达的影响
与对照组比较,甘草各剂量组Bcl-2、HIF-1α、GLUT1表达下调,Bax表达上调(P<0.01),表明甘草对HIF-1α信号通路有抑制作用。见表2、图5。
表2 各组A549细胞Bax、Bcl-2、HIF-1α和GLUT1蛋白表达比较(,/β-actin,n=3)

表2 各组A549细胞Bax、Bcl-2、HIF-1α和GLUT1蛋白表达比较(,/β-actin,n=3)
注:与对照组比较,**P<0.01
组别对照组甘草低剂量组甘草中剂量组甘草高剂量组GLUT1 1.39±0.05 0.96±0.02**0.57±0.06**0.30±0.06**浓度/(mg/mL)3 4 5 Bax 0.17±0.02 0.41±0.11**0.52±0.13**1.17±0.23**Bcl-2 1.44±0.07 0.69±0.04**0.52±0.08**0.23±0.07**HIF-1α 0.95±0.08 0.59±0.01**0.54±0.03**0.41±0.03**

图5 各组A549细胞Bax、Bcl-2、HIF-1α和GLUT1蛋白免疫印迹
3 讨论
目前肺癌治疗以化疗为主,而化疗药物的不良反应限制其临床应用。甘草作为临床常用药物,可通过诱导细胞凋亡、干扰细胞周期、诱导自噬、抑制糖酵解、调节免疫、调控miRNA和多种信号通路等作用机制发挥抗肿瘤作用[2]。但甘草抗肺癌的作用机制尚未完全阐明。本研究通过网络药理学对甘草抗肺癌的机制进行研究,获得88个药物活性成分、209个潜在作用靶点,通过PPI网络进一步分析获得MAPK1、MAPK3、MMP2、MMP9及HIF1A等43个核心靶点。此外,通过对209个关键靶蛋白进行GO和KEGG通路富集分析,推测甘草活性成分靶点通过癌症相关通路、HIF-1信号通路调控肿瘤细胞增殖、侵袭、迁移及凋亡。
本研究筛选出甘草提取物3、4、5 mg/mL 3种给药浓度作用于人肺癌A549细胞,并选择富集程度较高的HIF-1α信号通路进行验证。与对照组比较,不同浓度甘草提取物均可抑制A549细胞增殖且具有浓度依赖性,甘草各剂量组能上调促凋亡蛋白Bax表达,下调抗凋亡蛋白Bcl-2、HIF-1α及GLUT1表达。
综上所述,本研究通过网络药理学及实验验证方法,对甘草抗肺癌机制进行研究,验证了甘草抗肺癌多成分、多靶点、多途径的作用特点,提示甘草抗肺癌的作用机制可能与抑制肺癌细胞增殖、促进细胞凋亡及调控HIF-1α信号通路有关,相关机制仍需体内实验进一步验证。本研究可为甘草的临床应用及抗肿瘤新药的开发提供依据。今后课题组将利用代谢组学及蛋白质组学等多种手段结合网络药理学对甘草抗肺癌的作用机制进行深入研究。

