延龄草皂苷对脑缺血大鼠梗死灶周围皮层少突胶质细胞GSK-3/β-catenin/CRMP2信号表达的影响
庄雨明,杨乐,欧阳俊摇,邹海艳,冯雪枫,陆允,李明聪,赵晖
首都医科大学中医药学院,中医络病研究北京市重点实验室,北京 100069
缺血性卒中具有致残率高的特点[1-2]。脑缺血缺氧后不仅诱导大量神经元死亡,还损伤少突胶质细胞,造成髓鞘脱失、轴突功能障碍,是肢体感觉运动和学习记忆障碍的重要原因[3-4]。促进髓鞘修复和轴突重构对改善脑缺血后神经功能缺损症状具有重要意义[5]。延龄草为百合科延龄草属多年生草本植物延龄草Trillium tschonoskiiMaxim.的干燥根及根茎,具有活血、通络、安神功效。临床以单味药或配伍应用治疗眩晕头痛、脑震荡后遗症等疾病[6]。延龄草主要活性成分为延龄草皂苷(total saponin ofTrillium tschonoskiiMaxim.,TSTT),前期研究结果显示,TSTT可减轻脑缺血大鼠轴突髓鞘损伤[7],并通过诱导内源性少突胶质前体细胞增殖分化为少突胶质细胞,启动再髓鞘化过程[8],促进轴突损伤后的修复。其分子机制尚待进一步阐明。
研究发现,糖原合成酶激酶-3(GSK-3)是TSTT抗炎、抗肿瘤的重要作用靶点[9]。GSK-3是一种丝氨酸/苏氨酸蛋白激酶,脑缺血发生后,GSK-3作为β-连环蛋白(β-catenin)、脑衰蛋白反应调节蛋白-2(CRMP2)的负性调节蛋白,抑制新生细胞增殖与轴突延伸[10],在新生细胞增殖、分化、成熟过程中产生重要的调控作用[11-12]。在前期研究基础上,本研究分析TSTT影响脑缺血大鼠少突胶质前体细胞增殖及保护成熟少突胶质细胞的作用机制,为进一步明确TSTT抗脑缺血损伤的药理作用提供研究基础。
1 实验材料
1.1 动物
SPF级雄性SD大鼠65只,8周龄,体质量330~360 g,北京维通利华实验动物技术有限公司提供,动物生产许可证号SCXK(京)2021-0011。动物饲养于首都医科大学实验动物中心SPF级实验室,温度18~22 ℃,湿度40%~60%,自由摄食饮水。动物使用许可证号SYXK(京)2021-0030。本实验过程符合动物伦理相关规定,并经过首都医科大学实验动物伦理委员会审核批准(AEEI-2019-221)。适应性饲养1周后正式进行实验。
1.2 药物与试剂
延龄草药材购自湖北恩施,由首都医科大学中医药学院李佳副教授鉴定为百合科延龄草属植物延龄草Trillium tschonoskiiMaxim.的干燥根及根茎,存放于中医络病研究北京市重点实验室。TSTT由首都医科大学中药药效物质基础研究实验室提供,每克提取物相当于原药材16.55 g,经课题组前期测定,重楼皂苷Ⅶ、重楼皂苷Ⅵ、偏诺皂苷元-3-O-α-L-鼠李糖基(1→4)-[O-α-L-鼠李糖基(1→2)]-O-β-D-葡萄糖苷、偏诺皂苷元-3-O-β-D-吡喃葡萄糖苷、重楼皂苷Ⅴ含量分别为43.96、98.83、75.27、4.98、4.57 mg/g[7]。使用时分别称取TSTT 65、33 mg,用10 mL蒸馏水溶解,配制成6.5、3.3 mg/mL溶液。金纳多(批号1380817),德国威玛舒培博士药厂。使用时将60 mg金纳多溶于10 mL蒸馏水,配成浓度为6 mg/mL溶液。
蛋白聚糖(NG2)抗体(批号ab50009)、2′,3′-环核苷酸-3′-磷酸二酯酶(CNPase)抗体(批号ab6319)、CRMP2抗体(批号ab62478),英国Abcam公司;β-catenin抗体(批号1247-1),美国Epitomics公司;GSK-3β抗体(批号GTX111192),美国GeneTex公司;Goat anti-mouse IgG-FITC抗体(批号1036-02)、goat anti-rabbit IgG-TRITC抗体(批号4030-03),美国SouthernBiotech公司;RNAprep Pure Tissue Kit动物组织总RNA提取试剂盒(批号cat#DP431)、RNase-Free DNaseⅠ试剂盒(批号RT411),北京天根生化科技有限公司。
1.3 仪器
涡旋混匀器(江苏海门其林贝尔仪器制造有限公司,型号VORTEX-5),pH仪(德国Sartorius公司,型号PB-21),电热鼓风干燥箱(天津市泰斯特仪器有限公司,型号101-OAB型),磁力加热搅拌器(德国IKA公司,型号C-MAG HS7),实时荧光定量PCR仪(美国Applied Biosystems公司,型号7300Real time PCR System),梯度PCR仪(德国Eppendorf公司,型号Mastercycler pro),台式离心机(德国Sartorius公司,型号138727)。
2 实验方法
2.1 造模、分组及给药
参照文献[13]制备永久性大脑中动脉栓塞(pMCAO)致大鼠局灶性脑缺血模型。55只造模大鼠经异氟烷吸入麻醉(5%诱导麻醉,2%维持麻醉)后,仰卧位固定,颈前皮肤消毒,正中切口,钝性分离皮下组织。暴露右侧颈总动脉(CCA)、颈内动脉(ICA)及颈外动脉(ECA),分离迷走神经,结扎ECA主要动脉分支,并用动脉夹夹闭ICA远心端和CCA近心端。在ECA远心端两处结扎并在结扎点间剪一小口,将已备好的尼龙线栓(直径0.265 mm)插入ECA,移去ICA远心端的动脉夹,将线栓沿ECA推向ICA,向内推入16~18 mm,感到阻力后停止进线,结扎动脉残端,移去CCA动脉夹,缝合皮肤。假手术组10只大鼠麻醉后仅暴露ECA、ICA,不结扎。大鼠完全清醒后进行神经行为学观察,以大鼠不能完全伸展左前爪、不能自行行走、不能向左侧旋转为造模成功。参考文献[14]将造模成功大鼠按随机数字表法分为模型组15只、TSTT 65 mg/kg组12只、TSTT 33 mg/kg组12只和金纳多组(60 mg/kg)12只[15]。于术后第6小时开始各给药组灌胃相应药物,假手术组、模型组予等量生理盐水(10 mL/kg),每日1次,连续15 d。
2.2 取材
干预结束后,每组随机选5只大鼠麻醉,生理盐水300 mL快速左心室灌注冲洗,4%多聚甲醛-0.1 mol/L磷酸缓冲液(pH 7.4)心内灌注固定,固定充分后,开颅取脑,切取视交叉后4 mm×15 mm×4 mm组织块,投入固定液,4 ℃固定1周,常规石蜡包埋,切片机连续切取4 μm冠状切片,进行HE染色、LFB染色及免疫荧光染色。各组剩余大鼠麻醉后断头取脑,分离梗死灶周围皮层组织,液氮中贮存,进行组织检测。
2.3 HE染色
石蜡切片二甲苯脱蜡,经逐级乙醇至蒸馏水洗脱,苏木素染色10 min,蒸馏水冲洗;盐酸乙醇分化30 s,蒸馏水浸泡15 min;1%伊红染液浸泡15 min,蒸馏水冲洗,常规脱水,中性树胶封片。光学显微镜下用NIS-Elements Basic Research图像采集系统对染色图像进行观察和采集,获取患侧梗死灶周围皮层3个不重叠视野进行分析,统计每个视野下的神经细胞数量,参照文献[16]计算单位面积视野下神经细胞数量(神经细胞数量÷视野面积)。
2.4 LFB染色
石蜡切片二甲苯脱蜡,经逐级乙醇至水洗;LFB染液染色,4 ℃孵育过夜;95%乙醇冲洗后,蒸馏水冲洗;0.05%碳酸锂分化10 s,蒸馏水立即冲洗终止;70%乙醇分化,观察着色情况,重复碳酸锂和乙醇分化步骤直至灰白质可明显分辨。常规脱水,中性树胶封片。利用NIS-Elements Basic Research图像采集系统对图像进行采集,获取大鼠健侧及患侧梗死灶周围皮层3个不重叠视野进行分析。利用Image J软件统计每个视野下LFB染色的积分光密度(IOD),计算患侧/健侧相对IOD[17]。
2.5 免疫荧光染色
石蜡切片电热鼓风干燥机60 ℃干燥1 h,二甲苯脱蜡,乙醇水化,0.01 mol/L PBS冲洗3次,柠檬酸缓冲液热修复抗原。冷却至室温,PBS洗涤2次,10%羊血清37 ℃封闭1 h,加一抗:CNPase(1∶300)、GSK-3β(1∶400);CNPase(1∶300)、β-catenin(1∶250);NG2(1∶100)、GSK-3β(1∶400);NG2(1∶100)、β-catenin(1∶250),4 ℃孵育48 h。复温,PBS洗涤5次,避光滴加goat anti-mouse IgG-FITC(1∶300)、goat anti-rabbit IgG-TRITC(1∶400),37 ℃封闭2 h。0.01 mol/L PBS洗涤6次,DAPI染细胞核,避光冷藏保存。荧光显微镜下观察切片,每张切片在梗死灶周围皮层选取3个固定视野进行观察。激发/发射波长470/490 nm条件下,CNPase、NG2阳性细胞呈绿色荧光,分别统计CNPase和NG2阳性表达的IOD;激发/发射波长595/618 nm条件下,GSK-3β、β-catenin阳性细胞呈红色荧光,利用NIS-Elements Basic Research图像采集系统计数每个视野内双标阳性细胞数。
2.6 RT-PCR检测
按试剂盒说明提取大鼠缺血边缘脑组织总RNA,以总RNA为模板反转录合成cDNA,配制反应体系混合液进行PCR。反应条件:95 ℃预变性15 min,95 ℃变性10 s,共40个循环,52 ℃退火31 s,72 ℃延伸30 s。以β-actin为内参,采用2-ΔΔCt法计算目的基因相对表达量。引物由日本Takara公司合成,引物序列见表1。

表1 各基因PCR引物序列
3 统计学方法
采用SPSS Statistics 26.0统计软件进行分析。计量资料用表示,符合正态分布且方差齐用单因素方差分析,组间多重比较采用LSD检验,方差不齐采用Tamhane's T2检验,不符合正态分布采用非参数检验。P<0.05表示差异有统计学意义。
4 结果
最终存活大鼠为假手术组10只、模型组10只、TSTT 65 mg/kg组10只、TSTT 33 mg/kg组9只、金纳多组10只。
4.1 延龄草皂苷对模型大鼠脑组织病理变化的影响
假手术组大鼠脑组织神经细胞形态正常、核仁清晰、胞浆丰富、排列整齐;模型组大鼠患侧脑组织出现明显坏死区,神经细胞大量死亡,胞体皱缩,胞核深染固缩,胞膜轮廓不清;与模型组比较,TSTT 65 mg/kg组、TSTT 33 mg/kg组及金纳多组大鼠患侧梗死灶周围皮层神经细胞形态有所改善,排列较为整齐。见图1。
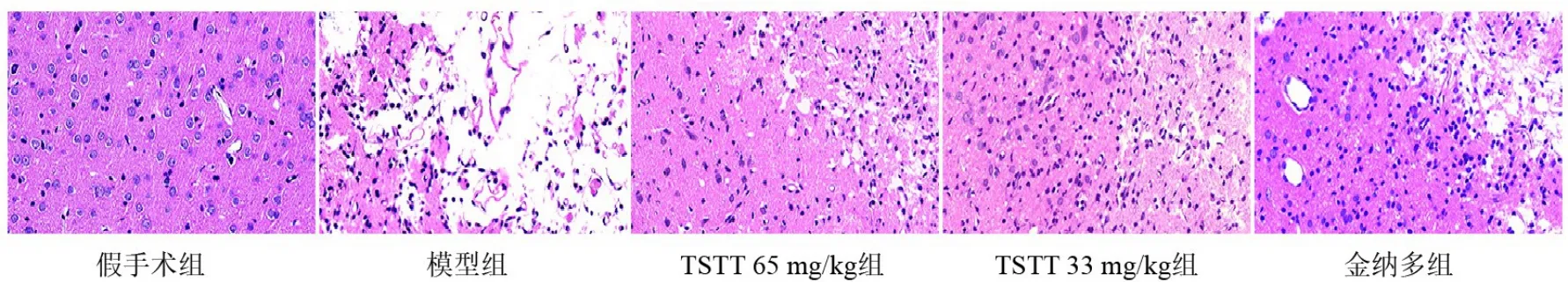
图1 各组大鼠梗死灶周围皮层脑组织形态(HE染色,×400)
与假手术组比较,模型组大鼠梗死灶周围皮层单位面积神经细胞数量显著减少(P<0.01);与模型组比较,TSTT 65 mg/kg组、TSTT 33 mg/kg组和金纳多组大鼠梗死灶周围皮层单位面积神经细胞数量显著增加(P<0.05,P<0.01)。见表2。
表2 各组大鼠梗死灶周围皮层神经细胞数量比较(,个/mm2)
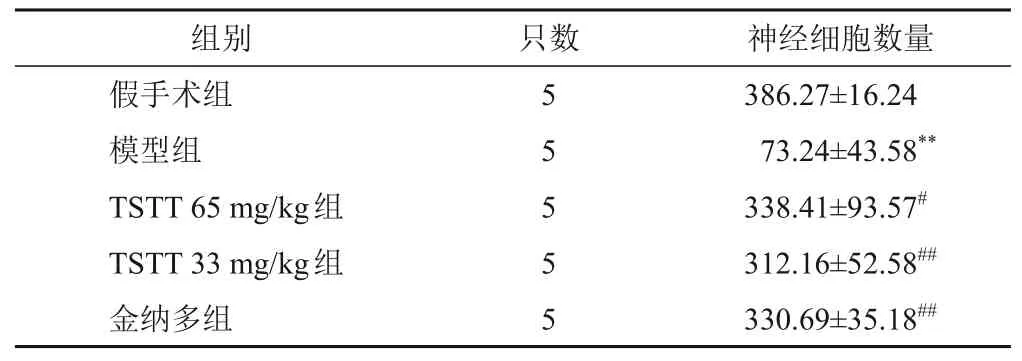
表2 各组大鼠梗死灶周围皮层神经细胞数量比较(,个/mm2)
注:与假手术组比较,**P<0.01;与模型组比较,#P<0.05,##P<0.01
神经细胞数量组别只数386.27±16.24 73.24±43.58**338.41±93.57#312.16±52.58##330.69±35.18##假手术组模型组TSTT 65 mg/kg组TSTT 33 mg/kg组金纳多组5 5 5 5 5
4.2 延龄草皂苷对模型大鼠神经纤维损伤的影响
假手术组大鼠脑组织神经纤维排列致密有序,髓鞘结构清晰完整;模型组大鼠患侧神经纤维大量丢失,纤维排列混乱无序,髓鞘中有大量空泡形成;与模型组比较,TSTT 65 mg/kg组、TSTT 33 mg/kg组及金纳多组大鼠患侧神经纤维排列较有序,轴突外有致密的髓鞘包裹,髓鞘中空泡较少。见图2。

图2 各组大鼠梗死灶周围皮层脑组织形态(LFB染色,×400)
与假手术组比较,模型组大鼠梗死灶周围皮层神经纤维相对IOD显著减少(P<0.01);与模型组比较,TSTT 65 mg/kg组、TSTT 33 mg/kg组及金纳多组大鼠梗死灶周围皮层神经纤维相对IOD显著增加(P<0.01)。见表3。
表3 各组大鼠梗死灶周围皮层神经纤维相对IOD比较()
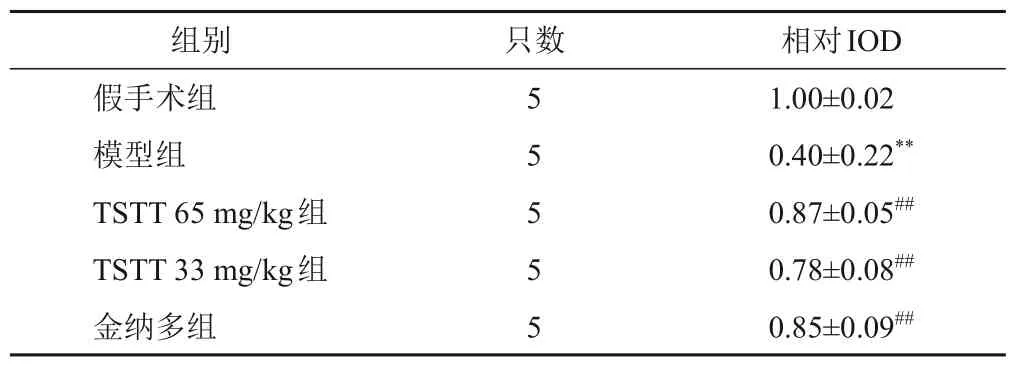
表3 各组大鼠梗死灶周围皮层神经纤维相对IOD比较()
注:与假手术组比较,**P<0.01;与模型组比较,##P<0.01
相对IOD组别只数1.00±0.02 0.40±0.22**0.87±0.05##0.78±0.08##0.85±0.09##假手术组模型组TSTT 65 mg/kg组TSTT 33 mg/kg组金纳多组5 5 5 5 5
4.3 延龄草皂苷对模型大鼠梗死灶周围皮层CNPase、NG2表达的影响
NG2为少突胶质前体细胞标志蛋白,CNPase为成熟少突胶质细胞标志蛋白。采用免疫荧光染色检测梗死灶周围皮层CNPase、NG2表达,结果显示,假手术组大鼠皮层CNPase阳性表达明显,几乎不表达NG2;与假手术组比较,模型组大鼠梗死灶周围皮层CNPase阳性表达显著降低,NG2阳性表达显著升高(P<0.01);与模型组比较,TSTT 65 mg/kg组、TSTT 33 mg/kg组及金纳多组大鼠梗死灶周围皮层CNPase、NG2阳性表达显著升高(P<0.01)。见图3、表4。
表4 各组大鼠梗死灶周围皮层CNPase、NG2表达比较(,IOD)

表4 各组大鼠梗死灶周围皮层CNPase、NG2表达比较(,IOD)
注:与假手术组比较,**P<0.01;与模型组比较,##P<0.01
组别假手术组模型组TSTT 65 mg/kg组TSTT 33 mg/kg组金纳多组NG2 0 164 415.71±51 911.62**353 648.83±53 557.37##260 287.63±48 273.40##401 797.33±44 513.46##只数5 5 5 5 5 CNPase 592 690.42±44 825.43 282 167.21±47 423.48**435 087.20±17 927.84##341 818.85±31 622.01##458 615.40±29 546.07##
与假手术组比较,模型组大鼠梗死灶周围皮层NG2/GSK-3β、NG2/β-catenin、CNPase/GSK-3β、CNPase/β-catenin阳性细胞显著增加(P<0.01);与模型组比较,TSTT 65 mg/kg组、TSTT 33 mg/kg组及金纳多组大鼠梗死灶周围皮层NG2/GSK-3β、CNPase/GSK-3β阳性细胞显著减少,NG2/β-catenin、CNPase/β-catenin阳性细胞显著增加(P<0.05,P<0.01)。见图4、图5、表5。

图4 各组大鼠梗死灶周围皮层NG2/GSK-3β、NG2/β-catenin阳性表达(免疫荧光染色,标尺=50 μm)

图5 各组大鼠梗死灶周围皮层CNPase/GSK-3β、CNPase/β-catenin阳性表达(免疫荧光染色,标尺=50 μm)
表5 各组大鼠梗死灶周围皮层NG2/GSK-3β、NG2/β-catenin、CNPase/GSK-3β、CNPase/β-catenin阳性细胞比较(,个)
注:与假手术组比较,**P<0.01;与模型组比较,#P<0.05,##P<0.01
CNPase/β-catenin 5.83± 3.93 79.50±12.98**130.17±12.77##97.40± 7.84##135.00±38.93##组别假手术组模型组TSTT 65 mg/kg组TSTT 33 mg/kg组金纳多组只数5 5 5 5 5 NG2/GSK-3β 0 140.50±22.60**82.50±16.05##105.33±16.91##74.00±14.14##NG2/β-catenin 0 68.77±15.49**118.00±17.07##105.13±32.95##149.50±24.32##CNPase/GSK-3β 45.30±10.54 115.00±36.12**78.33±18.89##91.50±29.29#85.22±16.43##
4.4 延龄草皂苷对模型大鼠脑组织GSK-3/β-catenin/CRMP2基因表达的影响
与假手术组比较,模型组大鼠梗死灶周围皮层GSK-3α mRNA表达显著升高,β-catenin、CRMP2 mRNA表达显著降低(P<0.05,P<0.01);与模型组比较,TSTT 65 mg/kg组大鼠梗死灶周围皮层GSK-3α、GSK-3β mRNA表达显著降低,β-catenin、CRMP2 mRNA表达显著升高,TSTT 33 mg/kg组大鼠梗死灶周围皮层GSK-3α、GSK-3β mRNA表达显著降低,金纳多组CRMP2 mRNA表达显著升高(P<0.01)。见表6。
表6 各组大鼠梗死灶周围皮层GSK-3α、GSK-3β、β-catenin、CRMP2 mRNA表达比较()

表6 各组大鼠梗死灶周围皮层GSK-3α、GSK-3β、β-catenin、CRMP2 mRNA表达比较()
注:与假手术组比较,*P<0.05,**P<0.01;与模型组比较,#P<0.05,##P<0.01
组别假手术组模型组TSTT 65 mg/kg组TSTT 33 mg/kg组金纳多组CRMP2 2.16±0.81 1.17±0.26*2.17±0.69#1.98±0.62 2.52±1.35##只数5 5 5 4 5 GSK-3α 0.91±0.27 1.40±0.41*1.03±0.26#0.93±0.30#1.18±0.12 GSK-3β 1.27±0.11 1.61±0.91 0.99±0.29#0.83±0.37#1.25±0.29 β-catenin 1.83±0.57 1.14±0.18**1.63±0.40#1.24±0.35 1.41±0.38
5 讨论
脑卒中发生后,缺血诱导组织损伤,造成神经元大量死亡丢失。本研究发现,模型组大鼠缺血脑区出现明显梗死灶,血管水肿明显,神经细胞变性坏死,脑缺血导致梗死灶周围皮层区域神经细胞数量减少;TSTT能增加脑缺血大鼠梗死灶周围皮层神经细胞数量,减轻脑组织损伤。脑白质主要由大量少突胶质细胞和髓鞘构成,少突胶质细胞通过髓鞘化神经纤维发挥传导功能,维持神经元正常功能[5]。脑缺血后,少突胶质细胞在数分钟至数小时内肿胀、死亡,导致神经纤维脱髓鞘损伤。脑白质由穿支动脉供血,对缺血性损伤极为敏感[18]。缺血导致严重的脑白质损伤,表现为少突胶质细胞死亡、髓鞘脱失,轴突功能受损[19-20]。LFB染色显示,模型组大鼠缺血脑区神经纤维大量断裂,纤维排列混乱无序,髓鞘中有大量空泡形成,定量分析结果显示,模型组大鼠梗死灶周围皮层神经纤维相对IOD显著降低,TSTT能增加模型大鼠梗死灶周围皮层神经纤维相对IOD,提示TSTT可减轻脑缺血后神经病理损伤,保护神经细胞,减少神经纤维髓鞘脱失。脑白质损伤后内源性修复启动,少突胶质前体细胞增殖分化为成熟的少突胶质细胞,促进脑缺血损伤后髓鞘修复[21]。本研究结果显示,脑缺血能下调少突胶质细胞标志蛋白CNPase,上调少突胶质前体细胞标志蛋白NG2表达,说明脑缺血可损伤少突胶质细胞,诱导内源性少突胶质前体细胞增殖,促进髓鞘损伤后的修复。但机体内源性修复能力有限[22],受损的少突胶质细胞不足以维持髓鞘形成,缺血诱导的少突胶质前体细胞很难分化为少突胶质细胞[23]。因此,减轻少突胶质细胞损伤,刺激内源性少突胶质前体细胞增殖、分化,对髓鞘再生具有重要意义。本研究发现,TSTT能上调脑缺血大鼠梗死灶周围皮层CNPase和NG2表达,提示TSTT可减轻少突胶质细胞损伤,促进少突胶质前体细胞增殖,对缺血损伤后的髓鞘重构产生积极的干预作用。
内源性少突胶质前体细胞增殖、分化过程涉及不同的分子信号级联。Wnt信号通路对神经干细胞的作用受到广泛关注。当β-catenin水平低下时,Wnt途径关闭;β-catenin水平升高时,Wnt途径开启[24]。GSK-3β是β-catenin信号分子的关键负性调节蛋白,其表达升高可促进β-catenin磷酸化及降解过程,抑制Wnt信号向下传递[25]。当GSK-3活性被抑制时,可解除对β-catenin的磷酸化作用,导致β-catenin在胞浆内累积并入核,从而影响少突胶质前体细胞增殖、存活及向少突胶质细胞分化[26]。本实验进一步采用免疫荧光双标法观察GSK-3β、β-catenin在CNPase、NG2阳性细胞的表达。研究发现,TSTT下调模型大鼠梗死灶周围皮层CNPase、NG2阳性细胞GSK-3β表达的同时,上调CNPase、NG2阳性细胞β-catenin表达。GSK-3、β-catenin转录水平分析结果也显示,TSTT可下调梗死灶周围皮层GSK-3基因表达,上调β-catenin基因表达。进一步检测GSK-3β下游底物微管相关蛋白CRMP2表达。CRMP2作为介导轴突和树突特异性生长的胞浆磷蛋白,通过将微管蛋白单体沉积到神经丝的生长端,促进轴突的生长和延伸[27]。GSK-3β能够磷酸化CRMP2蛋白,导致生长锥坍塌,抑制轴突再生[28]。抑制GSK-3活性,升高CRMP2表达,可促进轴突的生长与修复,调节髓鞘形成[29]。本研究结果显示,TSTT可明显上调CRMP2转录活性。研究显示,阳性药金纳多可明显下调模型大鼠梗死灶周围皮层NG2、CNPase阳性细胞GSK-3β表达,上调β-catenin表达。基因检测结果显示,金纳多虽可明显上调缺血脑组织CRMP基因表达,但GSK-3、β-catenin基因表达较模型组无明显差异,结合免疫荧光结果,提示金纳多主要通过影响NG2、CNPase阳性细胞GSK-3β、β-catenin表达,促进轴突生长和修复。
TSTT主要成分为甾体皂苷类,包括偏诺皂苷类与薯蓣皂苷类。相关研究显示,延龄草中偏诺皂苷元、偏诺皂苷元-3-O-α-L-吡喃鼠李糖基(1→2)-β-D-吡喃葡萄糖苷等4个单体成分能够抑制MCAO大鼠小胶质细胞激活,减少肿瘤坏死因子-α、白细胞介素-1β、白细胞介素-6等多种炎症因子释放,发挥抗炎作用,通过升高MCAO大鼠血清超氧化物歧化酶活性,降低丙二醛含量,抑制谷氨酸合成和分泌,减少一氧化氮和Ca2+释放,从而减弱机体的氧化损伤程度,保护缺血脑组织[30]。薯蓣皂苷可通过调控HMGB-1/RAGE信号通路发挥抗炎、抗凋亡和抗氧化作用,对脑缺血后的海马神经元起保护作用[31]。本研究发现,TSTT可减轻脑缺血大鼠梗死灶周围皮层少突胶质细胞损伤,促进OPC增殖,并对GSK-3/β-catenin/CRMP2信号轴产生重要的调控作用,这对于促进髓鞘缺血性损伤后的重构具有重要意义,值得深入研究。

