临床药师促进胃肠外科抗菌药物合理应用的实践*
张 梨,郑冬妮,任常谕,龙 霞,张琪敏,周后凤△
(1. 四川省成都市第五人民医院,四川成都 611130; 2. 西南医科大学药学院,四川泸州 646000)
腹腔感染(IAI)可并发于多种腹部疾病,如各种原因导致的消化道穿孔、坏死与坏疽、阑尾炎、肠梗阻与肠坏死等[1]。IAI 为胃肠外科手术或腹部创伤常见术后并发症[2],病死率达20%[3],严重威胁公共卫生安全。近年来,国内外各级学会发布并更新修订多部IAI 指南,为感染诊治提供依据。相关指南均明确了胃肠外科围术期预防和治疗使用抗菌药物,但部分医疗机构执行不彻底,仍存在抗菌药物使用不合理情况[4-5]。我院胃肠外科抗菌药物使用不合理问题仍存在,在医务科和质控部门牵头下,临床药师参与医疗机构部分感染相关疾病的本地化临床路径的制订,并推广实施。2020 年7 月,建立了以临床药师为主导的胃肠外科预防和治疗性使用抗菌药物的管理模式,将IAI 的防治和合理用药有机结合。本研究中通过计划- 执行- 检查- 处理(PDCA)循环的方法不断改进,以抗菌药物使用强度(AUD)、抗菌药物使用品种占比及抗菌药物不合理使用情况作为评价指标,为促进胃肠外科抗菌药物临床合理用药提供新思路。现报道如下。
1 预防性与治疗性使用抗菌药物路线图制订与药学干预要点
1.1 抗菌药物路线图制订
1)建立临床决策依据。基于循证医学证据,参考国家指导原则和权威学会的指南,包括《抗菌药物临床应用指导原则(2015年版)》[6]、《国家抗微生物治疗指南》[7]、《中国腹腔感染诊治指南(2019版)》[3]等,并结合科室细菌流行分布数据及收治病种,建立临床决策依据。结合指南和循证医学证据的更新、医院及科室耐药菌变化,以及临床问题反馈、合理用药监管中发现的问题,借助PDCA循环管理,不断修订和完善预防性和治疗性使用抗菌药物路线图。
2)胃肠外科围术期预防性应用抗菌药物。收集临床问题、处方点评中常见不合理用药及相关政策文件,如《β内酰胺类抗菌药物皮肤试验指导原则(2021 年版)》[8],根据患者术前抗菌药物的应用情况、结合手术部位、主要考虑覆盖的病原菌、术中患者情况等进行制订,并形成路线图。详见图1 A。

图1 胃肠外科应用抗菌药物路线图A.Prophylactic use of antibiotics during perioperative period B.Therapeutic use of antibiotics for intra-abdominal infectionFig.1 Route diagrams of antibiotics use in the Gastrointestinal Surgery
3)胃肠外科IAI 经验性使用抗菌药物。如怀疑为IAI,采集病原学标本送检后,有积脓或病灶者除进行引流或外科干预去除感染灶外,尽早进行合理的抗感染经验性治疗会对控制感染起到重要作用。IAI 的初始抗感染治疗通常采用经验性治疗,覆盖病原体包括需氧革兰阴性菌(如肠杆菌科)、需氧链球菌和专属消化道厌氧菌[9]。将入住胃肠外科怀疑IAI 的患者根据发病场所分为社区获得性和医院获得性IAI,根据疾病严重程度、可能的致病菌、耐药情况等选择不同抗感染方案,并形成路线图。详见图1 B。该路径适用于未取得病原体依据及药物敏感性试验(简称药敏试验)结果的经验性治疗。
1.2 抗菌药物选择路线图在胃肠外科的药学干预要点
1)事前沟通。开展胃肠外科医师抗菌药物选择路线图的培训,列举循证医学证据,剖析药物选择的理由,统一路线图的合理性评价,强化路径管理运用的意识。
2)事中干预。以临床药师驻科模式保障科室的抗菌药物路线图的执行。专科定点临床药师负责胃肠外科的用药医嘱审核,发现问题,并及时干预。
3)事后点评。通过每月的处方点评工作,包括Ⅰ类和Ⅱ类/Ⅲ类切口围术期预防性应用抗菌药物点评、治疗性抗菌药物专项点评、重点科室处方专项点评等,形成经药师初评-临床反馈-药师复核-处方点评专家组会议定性-全院通报-经济、行政处罚-监督整改-再培训的闭环的合理用药管理流程,发挥临床药师的监督作用。
2 成效分析
2.1 AUD
胃肠外科AUD 由干预前(2019 年7 月至2020 年6月)的64.78降至第二轮干预后(2021年7月至2022年6月)的58.94,降幅为9.02%。详见图2。
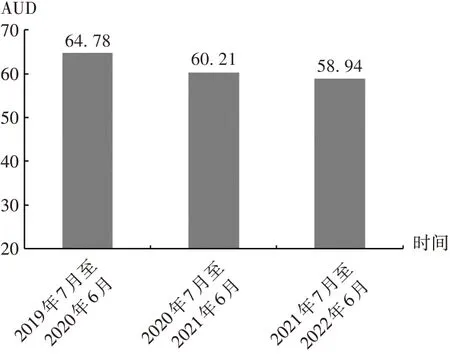
图2 干预前后胃肠外科AUD变化Fig.2 Changes of AUD before and after the intervention in the Gastrointestinal Surgery
2.2 抗菌药物品种变化
统计胃肠外科各时间段使用的抗菌药物的累计DDD 数。以某类(个)抗菌药物使用占比(%)统计胃肠外科抗菌药物使用品种变化,某类(个)抗菌药物使用品种占比(%)= 某类(个)抗菌药物使用量(累计DDD数)/同期抗菌药物总使用量(累计DDD数)×100%。由表1可知,干预前与第一轮干预后(2020年7月至2021年6 月)、第二轮干预后比较,第3 代头孢菌素类抗菌药物占比逐年上升;但β内酰胺类抗菌药物/β内酰胺酶抑制剂使用占比降低。进一步分析发现,干预后第3 代头孢菌素类抗菌药物排名前3 的品种分别为头孢曲松(4.45%)、头孢噻肟(3.60%)、头孢唑肟(0.84%);β内酰胺类抗菌药物/β内酰胺酶抑制剂排名前3 的品种分别为阿莫西林克拉维酸(18.67%)、哌拉西林他唑巴坦(14.77%)和头孢哌酮舒巴坦(2.19%),均符合指导原则和权威指南推荐。青霉素类,第1 代、第2 代头孢菌素类抗菌药物的使用占比变化可能受国家药品集中带量采购政策影响。

表1 干预前后胃肠外科各类抗菌药物使用品种变化Tab.1 Varieties changes of antibiotics used in the Gastrointestinal Surgery before and after the intervention
2.3 抗菌药物不合理使用情况
通过合理用药监测系统(PASS),统计干预前、第一轮干预后、第二轮干预后胃肠外科抗菌药物病历,预防性应用抗菌药物病历分别为2 217 份、2 068 份、2 275 份,治疗性应用抗菌药物病历分别为1 853 份、1 746 份、1 791份。
随机抽取胃肠外科各时间段预防性和治疗性应用抗菌药物的病历各200份,依据指导原则和权威指南进行用药合理性点评。统计干预前后胃肠外科围术期预防性和治疗性使用抗菌药物不合理情况。不合理用药率(%)= 点评不合理处方数/ 点评总处方数× 100%。采用SPSS 26.0 统计学软件分析,计数资料以率(%)表示,行χ2检验。P<0.05为差异有统计学意义。
由表2可知,胃肠外科围术期预防性使用抗菌药物不合理用药为品种选择不合理和用药疗程过长,治疗性抗菌药物不合理用药为初始治疗抗菌药物品种选择、抗菌药物给药频次及联合用药不适宜。干预后,预防性和治疗性使用抗菌药物的不合理用药率均呈逐年下降趋势。
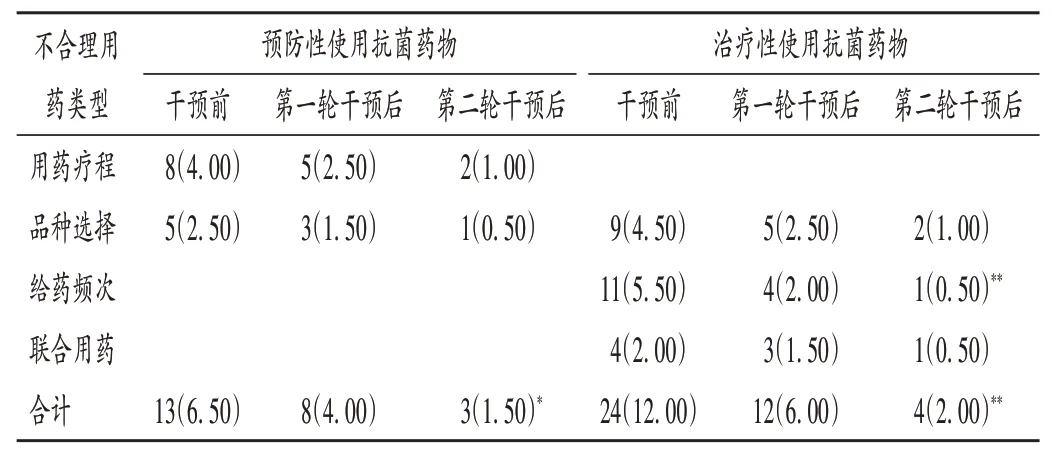
表2 干预前后胃肠外科使用抗菌药物不合理用药情况[例(%),n=200]Tab.2 Irrational use of antibiotics in the Gastrointestinal Surgery before and after the intervention[case(%),n=200]
3 讨论
抗微生物药物耐药性已成为全球公共卫生领域的重大挑战[10],我国各地区和机构之间耐药防控水平存在差异,部分常见微生物耐药问题仍在加剧,面临的形势依然严峻[11-12]。抗菌药物的不合理使用是加速细菌耐药的重要原因[13]。为加强抗菌药物临床应用管理,提高合理用药水平,近年来国家卫生健康委员会出台了多项政策文件。2020 年7 月20 日,《国家卫生健康委办公厅关于持续做好抗菌药物临床应用管理工作的通知》指出,要提高临床药师对抗菌药物临床应用管理的参与度和参与水平,充分发挥其在感染性疾病多学科会诊、制订感染性疾病诊疗指南和临床路径中的积极作用。抗菌药物不合理使用的管理和干预是医疗机构药学人员不可推卸的职责,也是临床药学服务重要的切入点。
我院探索临床药师多模式干预胃肠外科抗菌药物合理使用的实践,对进一步规范抗菌药物使用、降低科室AUD 发挥了积极作用。干预后,第3 代头孢菌素使用量占比升高,β内酰胺类抗菌药物/β内酰胺酶抑制剂使用量占比降低,提示科室在IAI 的初始治疗抗菌药物品种选择上趋于合理,此变化趋势与我院胃肠外科以社区获得性IAI为主相符。IAI的经验性治疗以第3代头孢菌素类抗菌药物部分代替第2 代头孢菌素类抗菌药物,可能是AUD降低的原因之一。
临床药师干预的实施是基于临床医师提出的具体问题得到循证医学证据解决的前提下推进的,沟通和回答医师在临床治疗中的问题对于不断优化抗菌药物选择路线图尤为重要[14]。临床药师多模式干预能有效减少“三医联动”管理模式下抗菌药物不合理使用对医师个人执业的影响,并减轻科室AUD 责任指标的压力,将指标的控制与合理用药有机结合。相比其他模式[15-17],制订胃肠外科预防性和治疗性使用抗菌药物的路线图可操作性强,有助于大多数患者抗菌药物使用的选择,医师易于接受。
我院胃肠外科抗菌药物治疗管理尚处于探索阶段,存在诸多不足。1)抗菌药物路线图能为大部分患者用药问题提供参考,但仍需与多学科诊疗模式等相结合以应对临床错综复杂的IAI 诊治;2)需进一步细化路线图,如社区获得性IAI 经验性治疗中针对疾病严重程度的评估,尚未达成公认评价标准,还需医师结合患者个体情况进行判断;3)信息化技术管控模式能有效提高监管效率[18],若能将管理规则嵌入医嘱系统,甚至运用智能化辅助决策系统,将更助于规范抗菌药物临床使用的长效管理。

