PNU-282987对颞叶癫痫模型大鼠认知功能的影响及机制Δ
李永格,周 舒,刘庆春,未小明,张 冬,马凤巧(.南阳医学高等专科学校基础医学部,河南 南阳 473000;2.昆明医科大学生物医学工程研究中心,昆明 650000)
癫痫是由脑神经元突发异常放电导致神经系统功能障碍的常见慢性脑部疾病。癫痫患者中有约30%~40%会发展成为药物难治性癫痫,临床上以颞叶癫痫(temporal lobe epilepsy,TLE)最为常见[1]。TLE 易反复发作,可引起海马神经元大量凋亡坏死,常伴随认知功能障碍,主要表现为患者学习记忆能力降低,严重威胁其身心健康[2]。研究发现,神经炎症与癫痫的发生、发展以及认知功能障碍密切相关[3]。小胶质细胞作为神经系统内参与调节神经炎症的关键免疫细胞,其过度激活会导致炎症因子的大量产生,引起中枢神经元损伤,是导致TLE的病理因素之一[4]。因此,抑制小胶质细胞活化,减轻神经炎症导致的神经元损伤,可能成为TLE的治疗新策略。
胆碱能抗炎通路(cholinergic anti-inflammatory pathway,CAP)可通过刺激迷走神经释放乙酰胆碱(acetylcholine,ACh),并与巨噬细胞等免疫细胞上的α7 烟碱型乙酰胆碱受体(α7 nicotinic acetylcholine receptor,α7nAChR)相结合来减轻机体炎症反应,是体内重要的神经免疫调节通路;其中,α7nAChR是CAP的核心信号受体,除分布在外周组织器官外,海马小胶质细胞上也有大量分布[5],激活α7nAChR 能够抑制小胶质细胞的活化[6]。核因子κB(nuclear factor-κB,NF-κB)是细胞内的信号分子,α7nAChR 被激活后,能够抑制NF-κB 的磷酸化和核迁移,降低促炎因子的表达[7]。由此可知,α7nAChR/NF-κB 信号通路具有调节小胶质细胞激活、抑制中枢炎症反应的作用。PNU-282987(分子式为C14H17ClN2O)是一种固态的、晶体状的高选择性α7nAChR激动剂,可作用于α7nAChR/NF-κB信号通路,减轻阿尔茨海默病[8]、脓毒症脑病[9]等疾病的中枢炎症反应,保护神经元[10],但其能否在TLE 中发挥作用还未见相关报道。基于此,本研究首先建立TLE模型大鼠,考察PNU-282987 对模型大鼠认知功能的影响,并基于α7nAChR/NF-κB信号通路初探其作用机制,以期为TLE的治疗提供新思路与新靶点。
1 材料
1.1 实验动物
本研究所用动物为SPF级SD雄性大鼠,共60只,体重290~310 g,由北京华阜康生物科技股份有限公司提供,动物生产许可证号为SCXK(京)2019-0008。所有大鼠均于昼夜节律自然变化、室温23~25 ℃、相对湿度50%~60%的环境下饲养,自由摄食、饮水。本实验获得南阳医学高等专科学校伦理委员会批准,批准号为南阳医专动伦[2022]第005号。
1.2 主要药品与试剂
PNU-282987(批号M06398,纯度99.37%)购自北京百奥莱博科技有限公司;甲基牛扁亭(methyllycaconitine,MLA)(α7nAChR 阻断剂,批号M-168,纯度99.03%)购自美国Sigma公司;氯化锂(批号L511)购自湖北威德利化学试剂有限公司;东莨菪碱(批号H32022184)购自徐州莱恩药业有限公司;毛果芸香碱(批号YJ102834)购自上海一基实业有限公司;肿瘤坏死因子ɑ(tumor necrosis factor-α,TNF-α)、白细胞介素6(interleukin-6,IL-6)和IL-1β 酶联免疫吸附测定(ELISA)试剂盒(批号分别为ml102828、ml002859、ml037373)购自上海酶联生物科技有限公司;RIPA 蛋白裂解液、BCA 蛋白定量试剂盒、ECL 显影液(批号分别为89900、NCI3225、32209)购自英潍捷基(上海)贸易有限公司;兔源α7nAChR 多克隆抗体、小鼠源离子钙接头蛋白1(ionized calcium-binding adapter molecule-1,IBA-1)单克隆抗体(批号分别为ab10096、ab283319)购自英国Abcam 公司;兔源NF-κB p65 多克隆抗体、兔源磷酸化NF-κB p65(p-NF-κB p65)多克隆抗体(批号分别为8242、3033)购自美国Cell Signaling 公司;辣根过氧化物酶标记的羊抗兔IgG 二抗(批号BA1055)购自武汉博士德生物工程有限公司;Alexa Fluor 594标记的羊抗小鼠IgG二抗(批号115-585-146)购自美国Jackson 公司;尼氏染色试剂盒(批号C0117)购自上海碧云天生物技术有限公司等。
1.3 主要仪器
Morris 水迷宫购自成都泰盟仪器有限公司;RT-6100 型酶标仪购自美国Rayto 公司;164-5070 型蛋白电泳仪、Chemi XRS+型凝胶成像系统购自美国BioRad 公司;EMUC7FC7型冷冻超薄切片机购自德国Leica公司;Axio Observe A1 型倒置相差荧光显微镜购自德国Zeiss公司等。
2 方法
2.1 分组、给药与造模
大鼠适应性饲养2周后开始实验。将大鼠随机分为对照组、模型组、PNU-282987 组和MLA+PNU-282987组,每组15 只。除对照组外,其余各组大鼠均复制TLE模型,具体参考文献[11]方法:先腹腔注射氯化锂(127 mg/kg)24 h后,再腹腔注射东莨菪碱(1 mg/kg)以阻断腹腔注射毛果芸香碱的外周胆碱能效应;注射东莨菪碱30 min 后,腹腔注射毛果芸香碱(35 mg/kg)。观察大鼠癫痫发作情况,按照Racine 标准判断癫痫发作程度,当其发生癫痫的级别超过Ⅳ级,持续时间超过1 h时,表明造模成功。随即给药,其中,PNU-282987组大鼠腹腔注射3 mg/kg PNU-282987[10](临用时以生理盐水溶解);MLA+PNU-282987组大鼠先腹腔注射6 mg/kg MLA(剂量根据前期预实验结果设置,临用时以生理盐水溶解)阻断α7nAChR,30 min 后再腹腔注射3 mg/kg PNU-282987;对照组与模型组大鼠腹腔注射等量生理盐水。腹腔注射时间统一在每天上午9:00,每天1次,连续2周。
2.2 大鼠癫痫发作行为观察
连续给药2 周后,观察大鼠癫痫发作行为并根据Racine标准对其进行评分,记录大鼠癫痫发作持续时间。
2.3 大鼠认知功能检测
末次给药后的第2 天,采用Morris 水迷宫实验检测各组大鼠认知水平,整个测试时间为6 d,每天测试2次。其中,第1~5 天为定位航行实验:将大鼠分别从4 个不同象限面向池壁放入水中,记录其在60 s内从入水到找到逃生平台所需要的时间,即逃避潜伏期;若在60 s 内没有找到平台,逃避潜伏期时间记为60 s。将大鼠放在逃生平台上停留20 s,增加大鼠对逃生平台的记忆力,然后进行下一象限测试。实验第6天进行空间探索实验:将逃生平台撤掉,将大鼠从逃生平台所在对面象限放入水池,自由游泳60 s,记录大鼠在平台象限停留的时间以及穿越平台的次数。
2.4 大鼠海马组织CA1区神经元病理学形态观察
采用Nissl 染色法进行观察。Morris 水迷宫实验结束后,每组随机选择5只大鼠麻醉并采用左心室灌流,断头取全脑,于4%多聚甲醛溶液中固定12 h;经脱水、包埋、切片后,取部分切片(剩余部分进行IBA-1阳性表达的检测)进行Nissl染色;以95%乙醇脱水,二甲苯透明5 min,封片;采用光学显微镜观察大鼠海马组织CA1区神经元的病理学形态。
2.5 大鼠海马组织中TNF-α、IL-6、IL-1β水平的检测
采用ELISA 法进行检测。每组随机选择5 只大鼠立即断头处死,快速取脑组织并分离两侧海马,用冰生理盐水冲洗表面,称取海马组织质量;用剪刀将海马组织剪碎,加入RIPA 裂解液,并使用超声研磨机磨碎,以15 000 r/min离心15 min,吸取上清液。严格参照ELISA试剂盒说明书方法检测大鼠海马组织中TNF-α、IL-6和IL-1β水平。
2.6 大鼠海马组织中IBA-1阳性表达细胞的检测
采用免疫荧光染色法进行检测。选取“2.4”项下的冰冻切片,室温下放置30 min,以PBS 缓冲液洗3 遍(每次5 min),滴加封闭液(5%BSA+0.3%TritonX-100),在37 ℃恒温培养箱中孵育1 h;甩去多余封闭液,滴加IBA-1 一抗(稀释度为1∶500),于4 ℃孵育过夜;以PBS洗涤3次(每次5 min)并吸干液体,滴加Alexa Fluor 594标记的二抗(稀释度为1∶200),室温下孵育1 h;以PBS避光冲洗3 次(每次5 min),滴加DAPI 复染细胞核后室温下避光孵育10 min,冲洗后用抗荧光淬灭剂封片;采用倒置相差荧光显微镜观察并采集图像,通过图像分析软件计数每平方毫米中的IBA-1阳性细胞数量。
2.7 大鼠海马组织中α7nAChR/NF-κB 信号通路相关蛋白表达水平的检测
采用Western blot 法进行检测。每组随机选择5 只大鼠,按“2.5”项下方法收集大鼠海马组织的上清液,按BCA法计算上清液中的蛋白浓度;在等量目标蛋白中加入缓冲液,煮沸,进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,转膜,加入封闭液在4 ℃下封闭过夜;加入α7nAChR、NF-κB p65、p-NF-κB p65 一抗(稀释度分别为1∶500、1∶1 000、1∶500),于4 ℃下孵育过夜;以TBST 缓冲液洗膜,加入二抗(稀释度为1∶5 000),常温下孵育50 min;以TBST 缓冲液洗膜,ECL 发光液显影,成像,使用Quantity One 软件对目的蛋白的灰度值进行分析,并计算目的蛋白灰度值与内参蛋白(GAPDH)灰度值的比值,以表示目的蛋白的表达水平。
2.8 统计学方法
采用SPSS 20.0 软件进行统计分析。计量资料以±s表示,多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验。检验水准α=0.05。
3 结果
3.1 PNU-282987对TLE模型大鼠癫痫发作行为的影响
对照组大鼠无癫痫发作。与对照组比较,模型组大鼠癫痫评分及发作持续时间均显著增加(P<0.05);与模型组比较,PNU-282987 组大鼠上述指标均显著减少(P<0.05);与PNU-282987 组比较,MLA+PNU-282987组大鼠上述指标均显著增加(P<0.05),且与模型组之间差异无统计学意义(P>0.05)。结果见表1。
表1 各组大鼠癫痫发作行为和空间探索实验结果(±s,n=15)

表1 各组大鼠癫痫发作行为和空间探索实验结果(±s,n=15)
a:与对照组比较,P<0.05;b:与模型组比较,P<0.05;c:与PNU-282987组比较,P<0.05。
组别对照组模型组PNU-282987组MLA+PNU-282987组癫痫评分/分0 4.25±0.48a 1.37±0.23b 4.02±0.41c癫痫发作持续时间/s 0 146.38±17.36a 80.19±10.12b 140.25±15.23c原平台象限停留时间/s 48.76±5.14 25.19±3.12a 37.23±3.36b 29.33±2.82c穿过平台次数/次7.26±0.74 1.96±0.13a 5.21±0.48b 2.26±0.32c
3.2 PNU-282987对TLE模型大鼠认知功能的影响
与对照组比较,模型组大鼠逃避潜伏期显著延长(P<0.05),原平台象限停留时间及穿越平台次数均显著减少(P<0.05);与模型组比较,PNU-282987 组大鼠逃避潜伏期时间显著缩短(P<0.05),原平台象限停留时间及穿越平台次数均显著增加(P<0.05);与PNU-282987 组比较,MLA+PNU-282987 组大鼠逃避潜伏期时间显著延长(P<0.05),原平台象限停留时间及穿越平台次数均显著减少(P<0.05),且与模型组之间差异无统计学意义(P>0.05)。结果见表1、表2。
表2 各组大鼠逃避潜伏期的检测结果(±s,n=15,s)

表2 各组大鼠逃避潜伏期的检测结果(±s,n=15,s)
a:与对照组比较,P<0.05;b:与模型组比较,P<0.05;c:与PNU-282987组比较,P<0.05。
组别对照组模型组PNU-282987组MLA+PNU-282987组第1天40.97±4.37 59.38±6.14a 50.28±4.89b 57.29±5.36c第2天35.74±3.84 52.03±6.68a 42.30±4.17b 51.68±5.01c第3天30.64±2.75 45.16±8.39a 36.13±3.29b 40.81±4.27c第4天21.68±3.11 36.09±6.57a 27.42±2.35b 33.28±3.16c第5天15.26±1.62 30.64±4.43a 20.22±2.71b 28.15±2.54c
3.3 PNU-282987 对TLE 模型大鼠海马组织CA1 区神经元病理学形态的影响
对照组大鼠海马组织细胞质中尼氏小体丰富且神经元排列整齐,形态完整。模型组大鼠海马组织细胞质中尼氏小体明显减少且神经元排列紊乱,部分细胞水肿,呈现空泡变性坏死,细胞结构不完整。经PNU-282987处理后,大鼠海马组织细胞质中尼氏小体明显增多,神经元排列致密,空泡变性坏死减少,损伤程度明显减轻。经MLA 阻断α7nAChR 后,PNU-282987 对癫痫大鼠海马神经元的保护作用被逆转。结果见图1。

图1 各组大鼠海马组织CA1区神经元的Nissl染色图
3.4 PNU-282987 对TLE 模型大鼠海马组织中炎症因子水平的影响
与对照组比较,模型组大鼠海马组织中TNF-α、IL-6和IL-1β 水平显著升高(P<0.05);与模型组比较,PNU-282987 组大鼠海马组织中上述指标水平均显著降低(P<0.05);与PNU-282987 组比较,MLA+PNU-282987组上述指标水平均显著升高(P<0.05),且与模型组之间差异无统计学意义(P>0.05)。结果见表3。
表3 各组大鼠海马组织中炎症因子水平的检测结果(±s,n=5,pg/mL)
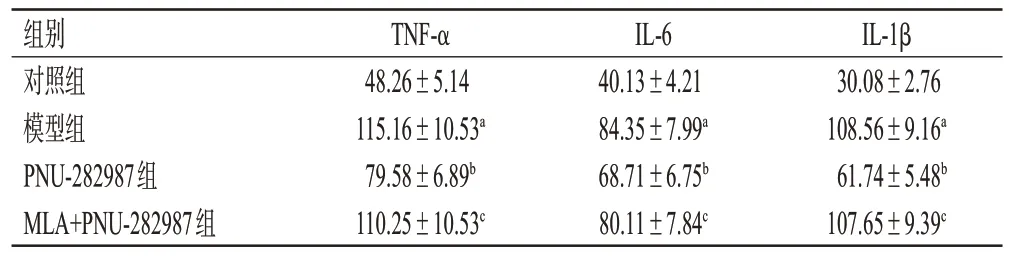
表3 各组大鼠海马组织中炎症因子水平的检测结果(±s,n=5,pg/mL)
a:与对照组比较,P<0.05;b:与模型组比较,P<0.05;c:与PNU-282987组比较,P<0.05。
IL-1β 30.08±2.76 108.56±9.16a 61.74±5.48b 107.65±9.39c组别对照组模型组PNU-282987组MLA+PNU-282987组TNF-α 48.26±5.14 115.16±10.53a 79.58±6.89b 110.25±10.53c IL-6 40.13±4.21 84.35±7.99a 68.71±6.75b 80.11±7.84c
3.5 PNU-282987 对TLE 模型大鼠海马组织中IBA-1阳性表达细胞的影响
与对照组[(10.36±2.97)个/mm2]比较,模型组大鼠海马组织中IBA-1阳性细胞数量[(56.89±8.32)个/mm2]显著增加(P<0.05);与模型组比较,PNU-282987组大鼠海马组织中IBA-1阳性细胞数量[(23.18±1.97)个/mm2]显著降低(P<0.05);与PNU-282987 组比较,MLA+PNU-282987 组大鼠海马组织中IBA-1 阳性细胞数量[(52.12±7.14)个/mm2]显著增加(P<0.05),且与模型组之间差异无统计学意义(P>0.05)。结果见图2。

图2 各组大鼠海马组织中IBA-1阳性表达细胞的荧光图
3.6 PNU-282987对TLE模型大鼠海马组织中α7nAChR/NF-κB信号通路相关蛋白表达的影响
与对照组比较,模型组大鼠海马组织中α7nAChR表达水平显著降低,NF-κB p65、p-NF-κB p65 表达水平显著升高(P<0.05);与模型组比较,PNU-282987 组大鼠海马组织中上述指标表达水平均显著逆转(P<0.05);与PNU-282987 组比较,MLA+PNU-282987 组大鼠海马组织中上述指标表达水平均显著逆转(P<0.05),且与模型组之间差异无统计学意义(P>0.05)。结果见图3、图4。

图3 各组大鼠海马组织中α7nAChR/NF-κB信号通路相关蛋白表达的电泳图

图4 各组大鼠海马组织中α7nAChR/NF-κB信号通路相关蛋白表达水平的检测结果(±s,n=5)
4 讨论
TLE为成年人中发病率最高的一种癫痫,占难治性癫痫的一半以上[12]。TLE患者通常伴有严重的认知功能障碍,临床上首选抗癫痫药物治疗[13]。但传统药物只能控制癫痫发作症状,且伴有严重的副作用,因此,积极开发治疗新药非常重要。神经炎症反应可能与癫痫的发病机制之间存在复杂的网络关系[4],寻找靶向神经炎症通路的药物可为癫痫的治疗提供新方法。
小胶质细胞作为神经系统的主要免疫效应细胞,其介导的神经炎症反应在癫痫的发展中起关键作用[14]。有文献指出,继发性癫痫患者中活化小胶质细胞数量明显增加[15],并且癫痫发作持续时间以及频率与小胶质细胞的活化程度明显相关[16]。激活的小胶质细胞有M1和M2 两种表型,其中M1 型小胶质细胞主要分泌TNF-α、IL-6等促炎因子,促进神经炎症反应,加重神经损伤;M2型小胶质细胞主要分泌IL-10、转化生长因子β等抗炎因子,抑制神经炎症反应,发挥神经保护作用[17]。α7nAChR为烟碱受体中的一种亚型,是由5 个α7 亚基构成的同源多聚体,在海马小胶质细胞上有大量分布[6]。活化的α7nAChR 可减轻小胶质细胞在脑组织中引起的炎症反应及神经损伤[18],因此,本研究以特异性α7nAChR 激动剂PNU-282987 干预TLE 模型大鼠,并通过观察大鼠癫痫发作以及Morris水迷宫实验对PNU-282987的药效进行评价。结果显示,PNU-282987 可抑制模型大鼠癫痫发作并改善其学习记忆水平,但该作用能够被MLA所逆转,说明PNU-282987发挥作用的机制与α7nAChR有关。
海马是研究癫痫伴随学习记忆障碍最合适的脑区[19]。一方面,海马与癫痫的发生、发展紧密联系,尤其是CA1 区、CA3 区是癫痫研究的常见区域[20]。另一方面,海马又是大脑中负责长期学习记忆能力、空间定位等认知功能的区域[21]。反复的癫痫发作会导致海马受损,降低海马信息处理的突触可塑性,引起长期记忆功能障碍[22]。本研究结果显示,以PNU-282987干预后,大鼠海马神经元损伤程度明显减轻,这说明PNU-282987对TLE 模型大鼠海马神经元具有保护作用。为进一步分析PNU-282987是否通过逆转小胶质细胞激活来减轻中枢炎症反应,本研究还检测了小胶质细胞标志蛋白IBA-1(其表达量直接反映小胶质细胞的活化程度[23])以及炎症因子的表达。结果显示,经PNU-282987干预后,TLE模型大鼠海马组织中IBA1、TNF-α、IL-6和IL-1β的表达均降低,并且该作用被MLA 逆转,这说明PNU-282987可通过激活α7nAChR,抑制小胶质细胞激活,进而减轻TLE模型大鼠海马组织内的炎症反应。
α7nAChR 活化后的抗炎作用与NF-κB 密切相关,NF-κB作为一种细胞内广泛表达的转录调节因子,其激活是炎症反应复杂细胞因子网络中的关键环节[24]。Lei等[25]研究发现α7nAChR介导的CAP分子机制主要归因于NF-κB 转录。因此,CAP 将通过α7nAChR 介导细胞内信号通路抑制NF-κB 核移位,减少细胞因子的表达,达到抗炎作用[26]。本研究结果显示,以PNU-282987 干预后,模型大鼠海马组织中α7nAChR表达升高,NF-κB表达降低,且该作用可被MLA逆转,这说明PNU-282987可通过激活海马组织中小胶质细胞上的α7nAChR,下调NF-κB表达。
综上所述,PNU-282987 可改善TLE 模型大鼠的认知功能障碍,其机制可能是通过激活α7nAChR/NF-κB信号通路,抑制小胶质细胞介导的炎症反应,进而减轻海马神经元损伤。

