TMEM39A在原发性胆汁性胆管炎中的作用机制
孙晓彤 韩崇旭, 王婵 任传利 张明明
1扬州大学医学院(江苏扬州 225009);2扬州大学临床医学院,江苏省苏北人民医院医学检验科(江苏扬州 225009);3东南大学生命科学与技术学院发育基因与人类疾病重点实验室(南京 210096)
原发性胆汁性胆管炎(primary biliary cholangitis,PBC)是由先天和后天免疫同时介导,并由单核细胞浸润胆管细胞,破坏小叶间胆管,导致胆汁淤积,使胆管细胞长时间处于胆汁淤积环境,从而致胆管细胞变性和坏死的疾病[1-3]。PBC 在男女之间的患病率具有差异性,患者多为中老年妇女,男女比例为10∶1[4]。PBC 目前尚无最优的治疗方法。目前治疗PBC 的药物首选是熊去氧胆酸,若熊去氧胆酸治疗效果甚微,就可用二线药物奥贝胆酸进行治疗[5-6],但无治愈作用。若患者合并其他疾病,无法选择肝移植手术,还可进行人工肝支持系统和血浆置换治疗[7]。因此研究其发病机制寻找新的治疗方法具有重要的社会意义。
PBC 是起源于胆管的炎症。由于胆汁分泌及排泄障碍可导致胆汁淤积,而肝脏长期处于胆汁淤积状态可导致肝脏的纤维化和肝硬化。胆汁酸(bile acids,BAs)是胆汁的主要成分,对胆管细胞具有细胞毒性作用。在胆汁淤积状态下,胆管细胞长期暴露在具有细胞毒性的胆汁酸中,血清胆汁酸水平继而升高。疏水性胆汁酸甘氨鹅脱氧胆酸(glycochenodeoxycholic acid,GCDC)是胆汁淤积性肝病患者血清中主要的胆汁酸,因此大多数研究都采用GCDC 来诱导细胞凋亡作为研究模型。
TMEM39A 是TMEM 家族中的一员,其蛋白序列由488 个氨基酸和8 个跨膜螺旋片段组成[8]。现已发现TMEM39A 的分子功能与自噬相关[9],遗传学研究[10]表明,TMEM39A 基因与原发性胆汁性胆管炎相关。又有研究进一步对PBC 患者和其他自身免疫性疾病分析发现,TMEM39A 在PBC 患者的血液中高表达,并显著高于其他自身免疫性疾病(系统性红斑狼疮和桥本氏病)和健康对照组体内表达,并且TMEM39A 浓度越高,其肝功能越差,预后越差。且已有研究[11]报道称,在早期和晚期PBC 受损的胆管中自噬相关蛋白即微管相关蛋白3β(LC3)的表达增高。这表明TMEM39A 水平异常在PBC 发病机制中扮演着重要作用。本研究拟模拟PBC 胆管细胞模型,对TMEM39A 在PBC 中的作用机制做初步探索,旨在为PBC 的靶向治疗提供新的策略。
1 材料与方法
1.1 细胞系培养 人肝胆管癌细胞(RBE),由东南大学刘向东教授馈赠,细胞用10%FBS RPMI-1640 培养基培养,放在5%CO2、37 ℃及饱和湿度的恒温培养箱培养。
1.2 试剂 RPMI-1640 培养基、胎牛血清购自北京全式金生物,BCA 蛋白定量试剂盒、质粒小提试剂盒、细胞计数试剂盒(CCK-8)购自南京诺唯赞生物科技有限公司,Hoechst 染色试剂盒、结晶紫染色液购自上海碧云天生物科技有限公司,兔抗人TMEM39A 多克隆抗体购自Abnova 公司,兔抗人LC3 多克隆抗体购自Proteintech 公司,GCDC、4%多聚甲醛购自Sigma-Aldrich 公司,RNA 转染试剂RNA Fit 购自汉恒生物科技有限公司。
1.3 实验方法
1.3.1 细胞活力检测 使用细胞计数试剂盒(CCK-8)检测细胞活力。将RBE细胞以每孔2 × 103个细胞接种于96 孔板中。设置control 组、GCDC(500 µmol/L 和1 000 µmol/L)组,三组处理同时培养24、48、72 h 和96 h。培养至第6 天,将新的培养基(不含GCDC)90 µL 和10 µL CCK-8 加入到孔中,在培养箱中避光孵育2 h,使用酶标仪(Biotek)在450 nm 处读吸光值。
1.3.2 细胞克隆形成实验 使用结晶紫染色液染色观察细胞克隆形成。将RBE细胞以每孔1 000个细胞接种于6 孔板中,设置PBS 组和GCDC 组,每天观察细胞生长状态,每三天更换一次培养基,培养10 d。使用4%多聚甲醛固定,结晶紫染色液染色观察。
1.3.3 细胞划痕实验 提前在6 孔板背面划线,将RBE 细胞以每孔2 × 106个细胞接种于6 孔板中,设置PBS 组和GCDC 组,培养24 h 后,加入含有PBS 和不同浓度的GCDC 的培养基,用细胞微孔成像系统(Biotek)拍照,计为0 h,24 h 后再拍照,计为24 h。比较0、24 h 划痕愈合程度。
1.3.4 Hoechst 染色实验 使用Hoechst 染色观察RBE 细胞凋亡。RBE 细胞以1 × 105个细胞/孔接种于12 孔板中,培养24 h 后,加入含有PBS 和不同浓度的GCDC 的培养基,继续培养24 h 后,使用Hoechst 染色,在倒置显微镜下观察细胞凋亡。
1.3.5 构建TMEM39A 过表达载体 通过设计合成的TMEM39A 引物,上游引物(TCAGATCTCGAGCTCAAGCTTATGCCCGGTGGAAGGAGG),下游引物(TTATCTAGATCCGGTGGATCCGTTTGCCTTGAGTTCATAACTGTTG)扩增TMEM39A 基因。将质粒pEGFP-C1 和TMEM39A 经过双酶切、同源重组、转化进大肠杆菌,在含有Kan 抗性的LB 固体平板上挑取单克隆,扩大培养12 ~ 16 h,提取重组pEGFPC1-TMEM39A 质粒,并经双酶切和测序验证重组质粒。
1.3.6 合成siRNA 及阴性对照 将TMEM39A 基因(Gene ID: 55254)提交至汉恒生物公司,由其设计和合成3 对siRNA,同时合成了一对通用阴性对照(Negative Control siRNA,si-NC),将siRNA 转染到RBE 细胞48 h。
1.3.7 蛋白免疫印迹实验 重组pEGFP-C1-TMEM-39A质粒和si-TMEM39A及si-NC转染进原发性胆汁性胆管炎的模型(用1 000 µmol/L GCDC 处理24 h的RBE 细胞)中48 h 后,用1 × PBS 洗涤1 ~ 2 次,每孔加入50 µL 的细胞裂解液,置于冰上20 min,每隔5 min涡旋10 s,低温离心机离心12 000 r/min,15 min,吸取上清,利用BCA 蛋白定量试剂盒定量,加入适量的5 × SDS loading 蛋白上样缓冲液。用12%的SDS-PAGE 的分离胶进行电泳(条件:80 V,30 min;120 V,60 min),电泳结束后,将蛋白电转至PVDF 膜上(条件:260 mA,60 min),用5%脱脂牛奶室温封闭2 h,再用1% BSA 将TMEM39A 抗体和LC3 抗体分别稀释500 和2 000 倍后于室温下孵育2 h,TBST 清洗PVDF 膜4 次,每次5 min,再以抗兔IgG 二抗(1∶10 000)于室温下孵育1 h,用TBST清洗PVDF 膜6 次,每次5 min,使用适量的高敏型ECL 发光液,使用生物分子成像仪曝光,利用Image J 软件进行灰度值分析。
1.3.8 实时荧光定量PCR 使用Trizol 试剂提取RBE 细胞中的总RNA,通过HiScript Ⅲ 1st Strand cDNA Synthesis Kit(+gDNA wiper)试剂盒逆转录合成cDNA,Actin 作为内参,每个样品设置3 个重复孔,引物由南京金斯瑞和生工生物工程(上海)股份有限公司合成,数据处理根据2-ΔΔCt为目标基因在实验组和对照组的差异倍数。
1.3.9 统计学方法 所有实验均重复3 次以上,使用GraphPad Prism7.0 软件进行统计学分析,数据均以均数±标准差表示。两组组间数据比较采用非配对t检验,P< 0.05 认为差异有统计学意义。
2 结果
2.1 TMEM39A 在原发性胆汁性胆管炎中的发现及其表达 本课题组前期协助完成对2 069 例汉族PBC 样品和6 163 例对照样品的GWAS 扫描和验证试验,证实TMEM39A(rs3732421)位点达到了GWAS显著性,见图1A。(rs3732421数据库原定位于CD80,现已更正为TMEM39A,见https://www.ncbi.nlm.nih.gov/search/all/?term=rs3732421)。通过本课题组前期研究,发现通过酶联免疫吸附测定(ELISA)检测PBC 患者和健康对照组的血液标本中的TMEM39A 外周血浓度。发现PBC 组中的TMEM39A 的浓度要高于对照组,见图1B,差异有统计学意义(P< 0.05)。

图1 在原发性胆汁性胆管炎中发现了TMEM39AFig.1 The TMEM39A gene has been identified in primary biliary cholangitis.
2.2 GCDC 对RBE 细胞活力的影响 为了研究GCDC 对RBE 细胞活力的影响,利用不同浓度的GCDC(500、1 000 µmol/L)处理RBE 细胞,处理时间为24、48、72、96 h。结果表明,随着GCDC 处理时间的延长,细胞活力逐渐降低,且GCDC 浓度升高,细胞活力降低,见图2。差异具有统计学意义(P< 0.05)。

图2 GCDC 对RBE 细胞细胞活力的影响Fig.2 Effect of GCDC on cell viability of RBE cells
2.3 GCDC对RBE细胞增殖的影响 利用细胞克隆和细胞划痕检测GCDC 对RBE 细胞增殖的影响,分别用PBS 和GCDC(500、1 000 µmol/L)处理RBE细胞。结果显示,GCDC浓度越高,GCDC 对RBE 细胞的抑制作用越明显,细胞克隆数越少,见图3A。细胞划痕实验显示,GCDC 浓度越高,细胞愈合率下降,1 000 µmol/L 的GCDC 处理的RBE 细胞愈合率降低最显著,见图3B。差异具有统计学意义(P< 0.05)。
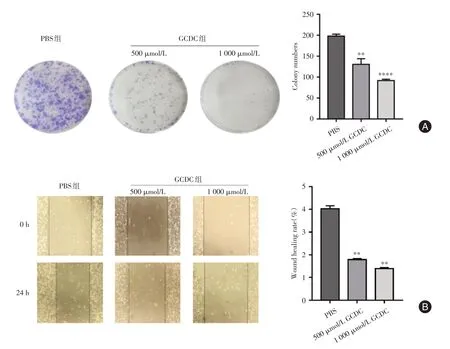
图3 不同浓度的GCDC 对RBE 细胞细胞克隆形成和愈合的影响Fig.3 Effects of different concentrations of GCDC on cell clonal formation and healing in RBE cells
2.4 GCDC 对RBE 细胞凋亡的影响 Hoechst 染色观察细胞凋亡,结果显示,在GCDC 浓度为1 000µmol/L 时,细胞凋亡指数最高,见图4。差异具有统计学意义(P< 0.05)。

图4 不同浓度的GCDC 诱导RBE 细胞发生细胞凋亡Fig.4 Different concentrations of GCDC induced apoptosis in RBE cells
2.5 成功构建TMEM39A 过表达载体 为研究TMEM39A 在原发性胆汁性胆管炎中如何调节自噬,通过PCR成功扩增出TMEM39A全基因组序列,并与pEGFP-C1 质粒构建融合表达质粒pEGFPC1-TMEM39A,并将重组质粒成功转化和提取,通过双酶切验证和测序验证重组成功,见图5A,并通过实时荧光定量PCR 确定重组质粒转染时间为48 h,见图5B。差异具有统计学意义(P< 0.05)。
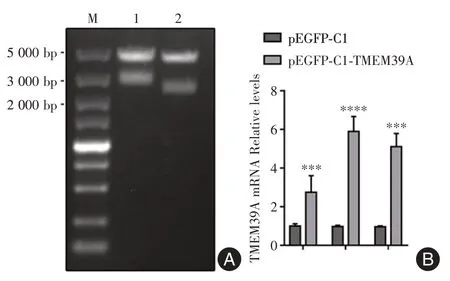
图5 基因TMEM39A 过表达载体的构建Fig.5 Construction of overexpression vector of gene TMEM39A
2.6 干扰片段的筛选 由公司合成的3对TMEM39 A 干扰片段和1 对阴性对照,将siRNA 转染至RBE细胞中,通过Western blot 和实时荧光定量PCR,筛选到1 对siRNA 的敲降趋势更明显,见图6。差异具有统计学意义(P< 0.05)。
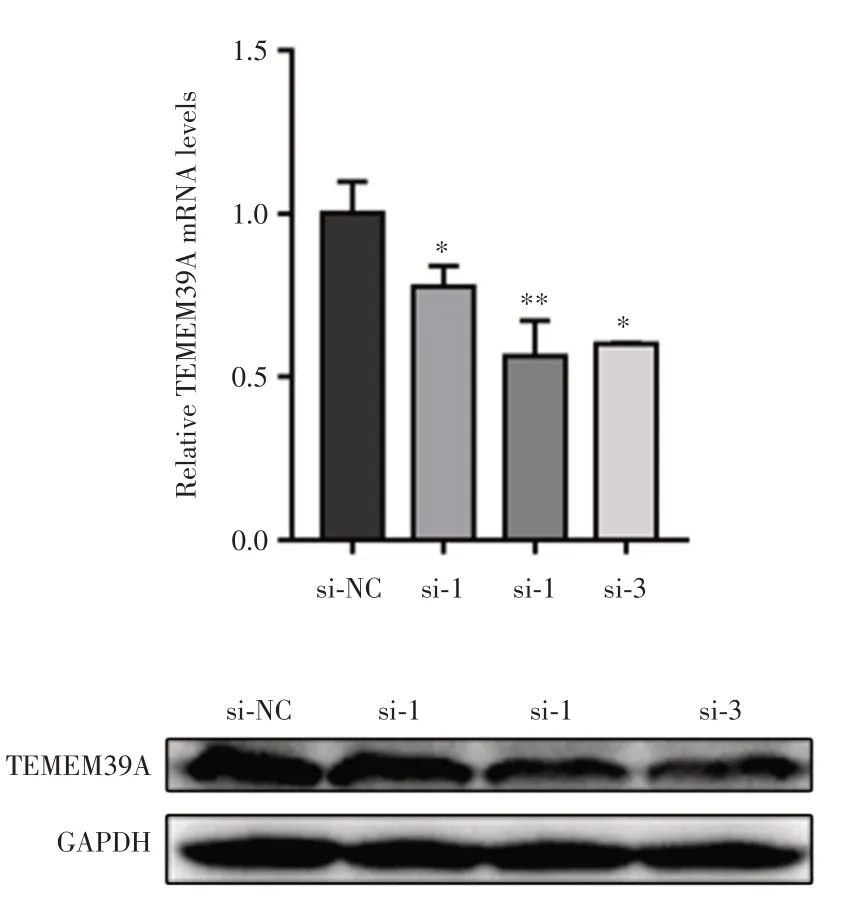
图6 转染干扰片段后TMEM39A 的表达量Fig.6 The expression of TMEM39A after transfection of interference fragment
2.7 TMEM39A 对原发性胆汁性胆管炎中自噬蛋白表达的影响 在体外根据前文所述实验结果,1 000 µmol/L GCDC 浓度处理RBE 细胞,其凋亡指数更高;同时使用1 000 µmol/L GCDC 浓度作用细胞后,观察细胞增殖率最佳时间为24 h。所以在体外利用1 000 µmol/L 的GCDC 浓度来处理细胞24 h,构建原发性胆汁性胆管炎模型,转染TMEM39A 过表达载体和TMEM39A 干扰片段,检测自噬蛋白LC3 的蛋白表达水平。结果表明,过表达TMEM39A 会促进自噬蛋白LC3 的蛋白表达量,敲降TMEM39A 会降低自噬蛋白LC3的蛋白表达量,见图7,差异具有统计学意义(P< 0.05)。
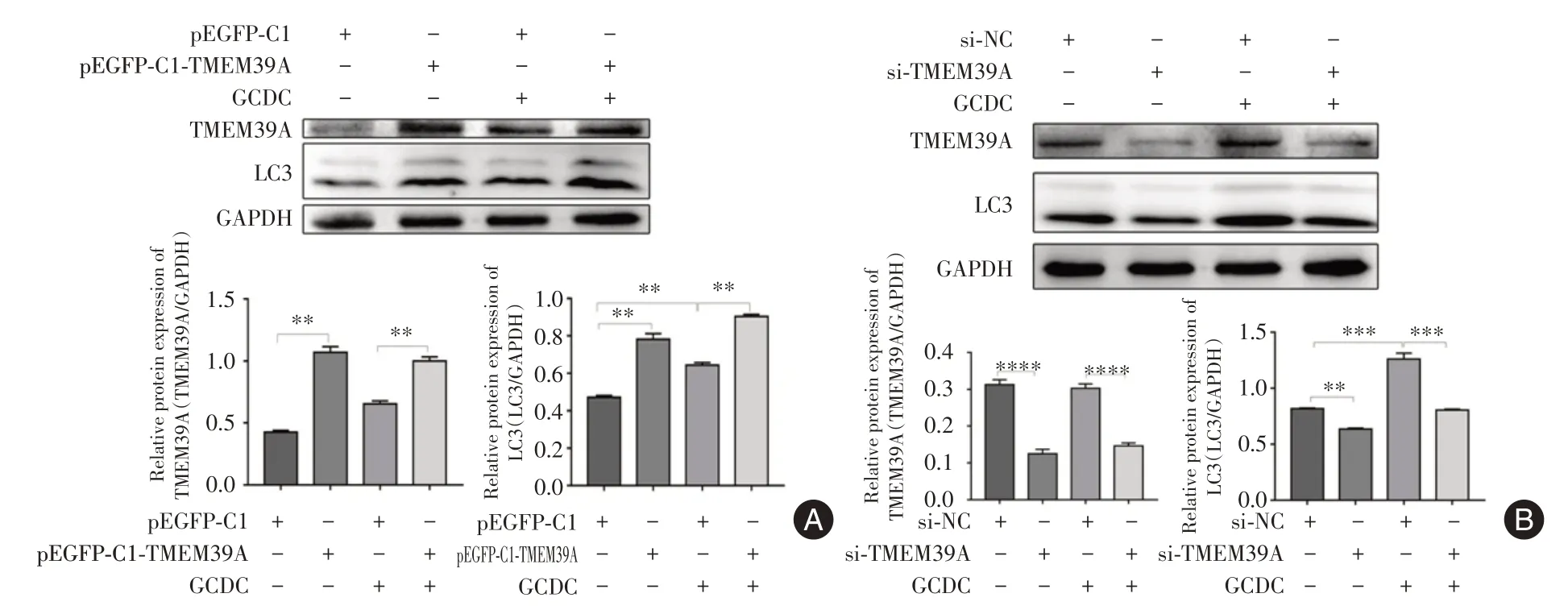
图7 TMEM39A 对原发性胆汁性胆管炎中自噬蛋白表达的影响Fig.7 Effect of TMEM39A on autophagy protein expression in primary biliary cholangitis
3 讨论
PBC 是由免疫介导的胆汁淤积性疾病,会进行性破坏胆管上皮细胞,最终导致肝硬化和肝衰竭,其临床症状多为乏力、瘙痒等,隐匿性强[12]。遗传易感性被认为是PBC发展的主要因素之一[13]。原发性胆汁性胆管炎是胆管细胞浸润在胆汁酸中,胆汁酸对胆管细胞具有细胞毒性作用。胆汁酸的合成是由胆固醇通过经典和替代途径进行的,并且由肝细胞分泌胆汁酸合成所需要的所有酶[14],而人体主要的胆汁酸包括胆酸和鹅去氧胆酸,初级鹅去氧胆酸和胆酸是在肝脏中通过多级酶的作用完成的[15-16]。而现在大多数PBC 的研究是基于胆管细胞浸润在胆汁酸中,其中经常使用的胆汁酸,即是甘氨鹅脱氧胆酸钠(GCDC),它是胆汁中的主要胆盐成分。在本研究中,即是选用GCDC 来处理胆管细胞,用于模拟原发性胆汁性胆管炎中的胆管上皮细胞在胆汁淤积的情况。通过不同的实验方法来检测不同GCDC 浓度和处理人胆管细胞的最佳时间。最后选择了GCDC 浓度为1 000 µmol/L 和处理时间为24 h 来作为后续处理细胞的条件。已有研究[17]发现,血清中的胆汁酸浓度在体内一般不会直接引起细胞毒性作用。相比之下,1 000 µmol/L 的GCDC 浓度存在广泛的细胞毒性作用,代表了体内的胆道水平。胆汁酸的积累会使肝损伤,从而引发一系列的其他的全身症状,胆汁酸流量减少会引起胆汁淤积患者的自噬[18]。
自噬是可以降解潜在毒性的细胞结构的保守的分解代谢过程[19],自噬的失调会导致严重的人体病理[18]。现在越来越多的证明表明,自噬的失调参与了PBC 的发病机制。参与慢性非化脓性破坏性胆管炎(CNSDC)的受损胆管细胞显示自噬标志物LC3 和p62/SQSTM1 的积累。LC3 在PBC 受损的胆管细胞中具有特征性表达[20],并且自噬体的增加是由于自噬受损所致。有研究表明,GCDC 会导致胆管细胞发生自噬引起自噬失调,而发生自噬的原因尚不明确,但自噬在生理上可控制内质网动力学,从而可能引起内质网应激,并且在研究中表明在PBC 的胆管细胞中可见到内质网应激标记物PDI 和GRP78 的广泛性表达[21]。
TMEM39A 是跨膜蛋白家族的蛋白,它的编码序列具有保守型,它的单核苷酸多态性与主要人类疾病相关[22]。有全基因组关联研究确定了TMEM39A中的单核苷酸多态性(SNPs)与原发性胆汁性胆管炎(PBC)的风险增加相关[10]。TMEM39A定位于内质网上,且它的的分子功能与自噬相关[9]。在本次研究中,构建了TMEM39A 过表达载体和TMEM39A干扰片段,利用RBE细胞作为研究对象,通过转染TMEM39A 过表达载体和干扰片段,观察到在RBE 细胞中,TMEM39A 过表达会促进自噬蛋白LC3 的表达。随后,又用GCDC 处理RBE 细胞,模拟胆汁淤积,再转染TMEM39A 过表达载体和干扰片段,发现在胆汁淤积的环境下,TMEM39A仍会促进自噬蛋白LC3 的表达。但是,本研究仍存在很多局限性,因实验条件的限制,未能在在原代胆管上皮细胞中,进行以上一系列实验的研究。
综上所述,疏水性胆汁酸GCDC 会诱导人胆管细胞凋亡,模拟胆汁淤积。TMEM39A 的表达增高引起胆管细胞自噬增强使胆管受损,可能是引起PBC 的机制之一。
【Author contributions】SUN Xiaotong performed the experiments and wrote the article.WANG Chan,ZHANG Mingming and SUN Xiaotong designed the study.HAN Chongxu and REN Chuanli reviewed the article.All authors read and approved the final manuscript as submitted.

