糖异平对糖耐量减低合并非酒精性脂肪肝大鼠氧化应激及炎症因子表达的影响
王玉玲 倪琳琳 赵良倩
1.山东省临沂市中医医院妇科,山东临沂 276002;2.山东中医药大学第二附属医院生殖科,山东济南 250014
随着人们生活水平的提高,代谢相关疾病发病率不断增加,糖耐量减低(impaired glucose tolerance,IGT)和非酒精性脂肪肝(non-alcoholic fatty liver disease,NAFLD)的发病率也在日益增长,有数据显示目前全球NAFLD发病率为25.24%,亚洲为27.37%[1],糖尿病人群中NAFLD的患病率为76%[2]。IGT作为糖尿病的前期阶段也是NAFLD的高危因素。有研究表明人群由IGT向2型糖尿病进展过程中脂肪肝的患病率也逐渐升高,并且程度逐渐加重[3]。在IGT合并NAFLD阶段及时干预可以降低糖尿病发病风险及NAFLD进一步向肝纤维化发展。目前大部分观点认为NAFLD发病[4]:一是胰岛素抵抗会导致肝脂肪的变性;二是氧化应激反应引起肝细胞产生脂质过氧化及激活炎性细胞因子导致脂肪性的肝炎。炎症反应是NAFLD发展中非常重要的一环[5]。脂质肝脏异常堆积使肝脏的脂质过氧化和氧化应激,导致细胞死亡激活内皮细胞使细胞因子表达增加,促进炎症反应和肝脏纤维化,促进了NAFLD的进展[6]。本研究通过观察糖异平对IGT合并NAFLD模型大鼠糖脂代谢及炎症因子和氧化应激水平的影响,探讨糖异平治疗IGT合并NAFLD的作用机制。
1 材料与方法
1.1 实验材料
SPF级雄性Wistar大鼠40只,许可证号SYXK(鲁)2022 0009,体重150~180 g,由山东大学实验动物中心提供。本研究经临沂市中医医院医学伦理委员会审批。白细胞介素-6(interleukin 6,IL-6)、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白细胞介素1β(interleukin-1β,IL-1β)ELISA检测试剂盒(美国ADL公司)。大鼠灌胃器、手术器械、5 ml与l ml注射器、ELx800酶标仪、BP310S电子天平、WKYin微量移液器、高速低温离心机3K-30、超低温冰箱725、强生ONETOUCHHorizon型血糖仪、OLYMPUS AU2700全自动血生化仪(日本OLYMPUS公司)。高糖高脂饲料(10.0%猪油、20.0%蔗糖、10.0%蛋黄粉、0.5%胆酸钠和59.5%常规饲料)定购自北京维通利华实验动物技术有限公司。糖异平(生黄芪30 g、玄参15 g、柴胡9 g、黄连9 g、白芍15 g、苍术12 g、川牛膝12 g、丹参15 g)。所用药物购于山东中医药大学附属医院,所有中药冷水泡30 min,两煎相兑后浓缩至1 g/ml(生药量)。
1.2 动物造模及给药
1.2.1 动物分组喂养 Wistar大鼠40只,雌雄分别20只,喂养7 d后,将大鼠随机分为对照组(n=10)及实验组(n=30)。其中对照组给予常规饲料喂养,实验组予高糖高脂饲料喂养。喂养期大鼠都自由喝水,每只大鼠均每天早晚分别喂养1次,每天所喂食量均为其体重的3%。
1.2.2 IGT合并NAFLD大鼠模型建立 大鼠共被喂养8周,并被禁食12 h后,自鼠尾采血测空腹血糖(fasting blood glucose,FBG);再依据大鼠体重(2 g/kg)分别给予50%浓度的高浓度葡萄糖注射液灌胃,2 h后再次自鼠尾采血测餐后2 h血糖(2 h postprandial blood glucose,2 hPG)。FPG<7 mmol/L且7.8 mmol/L≤2 hPG<11.1 mmol/L表示IGT大鼠造模成功;实验组则按照随机原则选取2只大鼠处死,并分别取大鼠肝脏常规病理切片后再行HE染色,光镜下若发现空泡样变性的肝细胞表示NAFLD大鼠造模成功,将IGT合并NAFLD建模[7]成功大鼠纳入本研究。
1.2.3 实验分组及给药剂量 选取实验组中20只造膜成功的大鼠,随机分为模型组和治疗组,每组各10只。模型组与治疗组均予以高糖、高脂饮食,对照组予以常规饮食。给药量按照“人和动物体表面积折算的等效剂量”计算而得,治疗组予以中药水煎剂12.19 g/(kg·d)灌胃,每天1次;模型组和对照组均给予等量生理盐水灌胃。干预4周。
1.3 标本采集
末次给药后禁食不禁水18 h,麻醉后腹主动脉取血,3000 r/min离心15 min,分离血清。
1.4 指标检测
①一般情况:分别观察大鼠的精神状态、活动情况、食欲、毛色及大小便等情况。②血糖(FPG、2 hPG)水平:大鼠禁食12 h后,经鼠尾采血测血糖(FPG、2 hPG)水平。③血脂水平:用全自动生化分析仪检测总胆固醇(total cholesterol,TC)、三酰甘油(triglyceride,TG)、低密度脂蛋白(low-density lipoprotein,LDL)及 高 密 度 脂 蛋 白(high-density lipoprotein,HDL)的 水 平。④炎 症 因 子:IL-6、TNF-α及IL-1β水平依照试剂盒操作书步骤进行检测。⑤氧化应激指标:丙二醛(malondialdehyde,MDA)、超氧化物歧化酶(superoxide dismutase,SOD)以及谷胱甘肽(glutathione,GSH)水平依照试剂盒操作书步骤进行检测。
1.5 统计学方法
采用SPSS 26.0统计学软件进行数据处理,计量资料用均数±标准差()表示,采用t检验,P< 0.05为差异有统计学意义。
2 结果
2.1 大鼠一般情况观察
对照组大鼠正常喂养,皮毛光泽鲜亮,反应机敏;模型组大鼠高糖高脂饮食,精神不振,反应迟滞,皮毛杂乱稀少,体重明显增加;治疗组大鼠较模型组症状轻,精神状态一般,反应较模型组大鼠灵敏,皮毛柔顺。观察期间无大鼠死亡。
2.2 各组大鼠治疗前后FBG、2 hPG水平比较
治疗前,与对照组比较,模型组FBG(t=1.427,P=0.035)、2 hPG(t=3.638,P=0.028)和治疗组FBG(t=1.326,P=0.046)、2 hPG(t=4.783,P=0.038)水平均较高,差异有统计学意义(P< 0.05);同模型组比 较,治 疗 组FBG(t=-1.578,P=0.225)、2 hPG(t=-3.108,P=0.135)水平均较低,差异无统计学意义(P> 0.05)。见表1。
表1 各组大鼠治疗前FBG、2 hBG比较(mmol/L, ± s)

表1 各组大鼠治疗前FBG、2 hBG比较(mmol/L, ± s)
注 与对照组比较,aP < 0.05;FBG:空腹血糖;2 hPG:餐后2 h血糖
组别 n FBG 2 hPG对照组 10 4.26±0.32 6.64±0.45模型组 10 4.43±0.14a 9.15±0.61a治疗组 10 4.42±0.64a 8.91±0.97a
各组大鼠在药物干预4周后,与对照组比较,模 型 组FBG(t=2.213,P=0.032)、2 hPG(t=2.940,P=0.023)和治疗组FBG(t=1.727,P=0.002)、2 hPG(t=2.681,P=0.038)水平均升高,差异有统计学意义(P< 0.05),提示大鼠存在糖代谢紊乱;同模型组比较,治疗组FBG(t= -1.928,P=0.002)、2 hPG(t=-2.263,P=0.000),差异有统计学意义(P< 0.05),表示糖异平可以有效改善模型大鼠的血糖,纠正代谢紊乱。见表2。
表2 各组大鼠治疗后FBG、2 hBG比较(mmol/L, ± s)

表2 各组大鼠治疗后FBG、2 hBG比较(mmol/L, ± s)
注 与对照组比较,aP < 0.05;与模型组比较,bP < 0.05;FBG:空腹血糖;2 hPG:餐后2 h血糖
组别 n FBG 2 hPG对照组 10 4.08±0.52 6.64±0.45模型组 10 4.12±0.56a 8.90±0.65a治疗组 10 4.11±0.39ab 7.10±0.68ab
2.3 各组大鼠治疗后TG、TC、LDL、HDL水平比较
各组大鼠在药物干预4周后,与对照组比较,模型组大鼠TG(t=6.542,P=0.028)、TC(t=4.286,P=0.045)、LDL(t=1.010,P=0.042)水平均升高,差 异 有 统 计 学 意 义(P< 0.05);HDL(t=-2.241,P=0.130)水平降低,差异无统计学意义(P> 0.05)。与对照组比较,治疗组大鼠TG(t=-7.917,P=0.009)、TC(t=-4.130,P=0.028)、LDL(t=-5.110,P=0.043)水平均降低,差异有统计学意义(P< 0.05);HDL(t=1.950,P=0.897)水平升高,差异无统计学意义(P> 0.05)。与模型组比较,治疗组大鼠TG(t=-4.501,P=0.016)、TC(t=-3.593,P=0.004)水平均降低,差异有统计学意义(P< 0.05);LDL(t=-4.236,P=0.523)水平降低,差异无统计学意义(P> 0.05);HDL(t=14.230,P=0.032)水平升高,差异有统计学意义(P< 0.05)。提示糖异平能有效降低血脂。见表3。
表3 各组大鼠治疗后TG、TC、LDL、HDL水平比较(mmol/L, ± s)

表3 各组大鼠治疗后TG、TC、LDL、HDL水平比较(mmol/L, ± s)
注 与对照组比较,aP < 0.05;与模型组比较,bP < 0.05;TC:总胆固醇;TG;三酰甘油;LDL:低密度脂蛋白;HDL:高密度脂蛋白
组别 n TG TC LDL HDL对照组 10 0.43±0.05 1.27±0.12 0.19±0.03 0.61±0.01模型组 10 0.65±0.04a 1.48±0.23a 0.23±0.02a 0.59±0.13治疗组 10 0.41±0.05ab 1.24±0.16ab 0.16±0.01a 0.67±0.14b
2.4 各组大鼠治疗后血清炎症因子比较
各组大鼠在药物干预4周后,与对照组比较,模型组大鼠的血清炎症因子IL-6(t=0.238,P=0.026)、IL-1β(t=2.602,P=0.034)、TNF-α(t=0.890,P=0.023)和 治 疗 组IL-6(t=0.669,P=0.041)、IL-1β(t=1.155,P=0.045)、TNF-α(t=0.176,P=0.039)水平均升高,差异有统计学意义(P< 0.05);同模型组比较,治疗组大鼠血清炎症因子IL-6(t=-2.027,P=0.012)、IL-1β(t=-1.791,P=0.048)、TNF-α(t=-0.922,P=0.026)水平均降低,差异有统计学意义(P< 0.05)。见表4。提示糖异平方能使机体的炎症反应有效降低。对照组 10 43.64±5.05 10.72±1.21 25.58±2.16模型组 10 95.21±9.05a24.62±1.24a79.23±5.02a治疗组 10 54.06±4.78ab12.53±1.76ab37.76±3.36ab
表4 各组大鼠治疗后血清炎症因子比较(pg/ml, ± s)

表4 各组大鼠治疗后血清炎症因子比较(pg/ml, ± s)
组别 n IL-6 IL-1β TNF-α
2.5 各组大鼠氧化应激指标比较
各组大鼠在药物干预4周后,与对照组比较,模型组大鼠氧化应激指标SOD(t=-1.103,P=0.046)、MDA(t=-1.024,P=0.031)、GSH(t=-2.901,P=0.034)和 治 疗 组SOD(t=-1.719,P=0.045)、GSH(t=-3.962,P=0.042)水平均降低,MDA(t=-2.190,P=0.044)水平升高,差异有统计学意义(P< 0.05);同模型组比较,治疗组氧化应激 指 标SOD(t=1.236,P=0.004)、GSH(t=1.045,P=0.008)水平均升高,MDA(t=3.854,P=0.030)水平降低,差异有统计学意义(P< 0.05)。见表5。提示糖异平方能有效改善机体的氧化应激反应。
表5 各组大鼠治疗后之氧化应激指标比较(mmol/ml, ± s)

表5 各组大鼠治疗后之氧化应激指标比较(mmol/ml, ± s)
注 与对照组比较,aP < 0.05;与模型组比较,bP < 0.05;MDA:丙二醛;SOD:超氧化物歧化酶;GSH:谷胱甘肽
组别 n SOD MDA GSH对照组 10 173.64±5.05 2.52±0.21 4.58±0.56模型组 10 155.21±9.05a 5.62±0.24a 2.23±0.32a治疗组 10 170.06±4.78ab 3.23±0.76ab 3.89±0.56ab
2.6 大鼠肝脏组织病理情况
光镜下可见对照组之大鼠肝组织细胞结构规则,肝索呈放射性分布,小叶边界清晰,外观肝细胞形态规则,细胞核明显,可见胞质均匀,未见沉积的脂滴,未发现浸润的炎性细胞。模型组的大鼠肝脏肝索排列不规则,肝细胞肿大,许多大小不等的脂肪空泡可见,边界欠清晰,可见浸润的炎性细胞。糖异平治疗组的大鼠肝细胞镜下见相对规整,排列尚规则,细胞内少量脂肪空泡可见,未看见坏死的肝细胞。提示糖异平能有效降低脂质在肝脏的堆积,并能使炎症反应减轻,减轻肝脏脂肪变性,对IGT合并NAFLD的肝脏起到良好的保护。见图1。
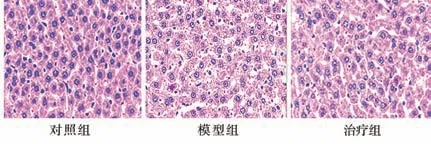
图1 大鼠肝脏组织病理情况(HE染色,40×)
3 讨论
IGT指空腹血糖正常但餐后血糖水平介于正常血糖水平和糖尿病血糖水平之间的一种特殊类型代谢状态。IGT患者是目前重要的糖尿病高危人群,每年有大量IGT患者进展为糖尿病。据报告,我国每年有1.5%~10%的IGT患者进展为2型糖尿病[8]。IGT患者中NAFLD发病率高于普通人群,IGT患者高血糖导致体内糖分解受阻,脂肪组织代谢增强,使得血浆内游离脂肪酸水平明显升高,游离脂肪酸可通过增加胰岛素分泌来诱胰岛素抵抗(insulin resistance,IR)。NAFLD发病机制目前尚无明确定论,现被广泛认为的是经典(二次打击)学说[9],认为“第一次打击”是因为胰岛素抵抗引起肝细胞内的TG合成与转运出现紊乱而导致脂质沉积,引起单纯的脂肪变性;“第二次打击”是在“第一次打击”后,肝细胞受到活性氧(reactive oxygen species,ROS)的诱导产生氧化应激反应、炎症反应甚至坏死,继而引起肝硬化的发生和发展,炎症因子在NAFLD的发生、发展中起到重要的作用[10]。核因子κB(nuclear factor-κB,NF-κB)作为一种诱导性核转录因子,当受到外界刺激时可被激活,进入细胞核参与炎症反应[11]。NF-κB活化后,可增加炎症因子IL-6、TNF-α的产生和释放,进而再次激活NF-κB,从而导致最初的炎症信号进一步放大[12]。MDA是细胞氧化代谢产物,其可反映机体的脂质过氧化物破坏程度,SOD、GSH两者均为重要的内源性的氧自由基清除剂,可对抗氧自由基,从而防止其对机体组织细胞的破坏[13-14]。现代医学对IGT合并NAFLD的治疗目前主要是通过生活方式控制、改善胰岛素抵抗及应用降脂药物等对症处理为主。IGT合并NAFLD作为一个病程中的可逆阶段积极治疗预后良好,如果疏于管理则可能进一步发展为糖尿病或肝硬化。中药治疗IGT合并NAFLD经临床观察效果满意且安全无副作用。糖异平前期临床研究表明可有效降低IGT患者餐后血糖,改善临床症状,降低炎症因子,治疗IGT安全有效[15]。本研究通过高脂高糖饲料造成大鼠IGT合并NAFLD模型,糖异平灌胃4周后观察糖异平对IGT合并NAFLD大鼠糖脂代谢及炎症因子的影响。结果显示与模型组相比糖异平组2 hPG降低,糖异平组TG、TC与模型组比较明显降低,HDL明显升高,LDL有降低趋势但差异无统计学意义。造模后模型动物血清中IL-6、TNF-α、IL-1β的含量均高于对照组。治疗组IL-6、IL-1β和TNF-α的含量均低于模型组。提示糖方平可有效抑制IGT合并NAFLD大鼠模型的炎症反应。提示糖异平通过对2型糖尿病并发NAFLD具有降低血糖血脂的作用,同时可以通过改善炎症因子的表达以及改善氧化应激状态来起到对IGT合并NAFLD的治疗作用。

