多中心肺炎克雷伯菌腹膜透析相关性腹膜炎的临床转归及治疗失败的危险因素
原慧芝 朱学研 杨立明 张晓暄 李忻阳 谢彤 翟婧竹 庄小花 崔文鹏
摘要:目的 分析肺炎克雷伯菌腹膜透析相關性腹膜炎(PDAP)的治疗结果、预后及治疗失败的危险因素,为肺炎克雷伯菌PDAP的防治提供临床证据。方法 回顾性收集2014年1月1日至 2019年12月31日在4个腹膜透析中心随访的PDAP患者临床资料,通过比较肺炎克雷伯菌PDAP与大肠埃希菌PDAP,观察两组患者治疗结果及预后。采用Kaplan-Meier法绘制技术失败的生存曲线。采用多因素Logistic回归分析肺炎克雷伯菌PADP治疗失败的危险因素。结果 4个腹膜透析中心586例患者发生1034例次PDAP,其中肺炎克雷伯菌PDAP 21例次,大肠埃希菌PDAP 98例次。肺炎克雷伯菌PDAP发生率为0.0048次/患者年。2014至2019年肺炎克雷伯菌PDAP发生率在0.0024~0.0124次/患者年。绘制Kaplan-Meier生存曲线后显示,肺炎克雷伯菌PDAP的技术失败率较大肠埃希菌PDAP更高(P=0.022)。多因素Logistic回归分析显示长透析龄是肺炎克雷伯菌PDAP当次治疗失败的独立危险因素(OR=1.082,95%CI=1.011~1.158,P=0.023)。对肺炎克雷伯菌敏感率最高的5种抗生素是阿米卡星、美罗培南、亚胺培南、哌拉西林、头孢替坦,均为100%,耐药率最高的依次是氨苄西林(81.82%)、头孢唑林(53.33%)、四环素(50.00%)、头孢噻肟(43.75%)、氯霉素(42.86%)。结论 肺炎克雷伯菌PDAP的预后较大肠埃希菌PDAP差,且长透析龄是肺炎克雷伯菌PDAP治疗失败的独立危险因素。
关键词:肺炎克雷伯菌;腹膜透析;腹膜炎
中图分类号: R459.5 文献标志码: A 文章编号:1000-503X(2023)02-0227-08
DOI:10.3881/j.issn.1000-503X.15138
Clinical Outcome and Risk Factors of Treatment Failure of Peritoneal Dialysis Associated Peritonitis Caused by Klebsiella Pneumoniae:A Multicenter Study
YUAN Huizhi ZHU Xueyan YANG Liming ZHANG Xiaoxuan4,LI Xinyang XIE Tong ZHAI Jingzhu ZHUANG Xiaohua CUI Wenpeng
ABSTRACT:Objective To investigate the treatment outcomes,prognosis,and risk factors of treatment failure of peritoneal dialysis associated peritonitis (PDAP) caused by Klebsiella pneumoniae,and thus provide clinical evidence for the prevention and treatment of this disease.Methods The clinical data of PDAP patients at four peritoneal dialysis centers from January 1,2014 to December 31,2019 were collected retrospectively.The treatment outcomes and prognosis were compared between the patients with PDAP caused by Klebsiella.pneumoniae and that caused by Escherichia coli.Kaplan-Meier method was employed to establish the survival curve of technical failure,and multivariate Logistic regression to analyze the risk factors of the treatment failure of PADP caused by Klebsiella pneumoniae.Results In the 4 peritoneal dialysis centers,1034 cases of PDAP occurred in 586 patients from 2014 to 2019,including 21 cases caused by Klebsiella pneumoniae and 98 cases caused by Escherichia coli.The incidence of Klebsiella pneumoniae caused PDAP was 0.0048 times per patient per year on average,ranging from 0.0024 to 0.0124 times per patient per year during 2014-2019.According to the Kaplan-Meier survival curve,the technical failure rate of Klebsiella pneumoniae caused PDAP was higher than that of Escherichia coli caused PDAP (P=0.022).The multivariate Logistic regression model showed that long-term dialysis was an independent risk factor for the treatment failure of Klebsiella pneumoniae caused PDAP (OR=1.082,95%CI=1.011-1.158,P=0.023).Klebsiella pneumoniae was highly sensitive to amikacin,meropenem,imipenem,piperacillin,and cefotetan,and it was highly resistant to ampicillin (81.82%),cefazolin (53.33%),tetracycline (50.00%),cefotaxime (43.75%),and chloramphenicol (42.86%).Conclusion The PDAP caused by Klebsiella pneumoniae had worse prognosis than that caused by Escherichia coli,and long-term dialysis was an independent risk factor for the treatment failure of Klebsiella pneumoniae caused PDAP.
Key words:Klebsiella pneumoniae;peritoneal dialysis;peritonitis
Acta Acad Med Sin,2023,45(2):227-234
腹膜透析作为一种肾脏替代治疗方式,对终末期肾脏病患者延缓肾功能进展、提高生活质量具有重要意义。腹膜透析相关性腹膜炎(peritoneal dialysis associated peritonitis,PDAP)为腹膜透析患者最常见的并发症之一,也是导致其技术失败的主要原因[1-2]。近年随着革兰氏阳性菌PDAP发生率的不断降低[3],加强对革兰氏阴性菌PDAP的管理十分重要。肺炎克雷伯菌作为一种革兰氏阴性菌,为住院患者产生耐药性机会性感染的常见原因,该病原菌对青霉素具有天然抗性,通常对多种抗生素具有后天抗性[4]。现阶段对于肺炎克雷伯菌PDAP的研究较少,主要为病例报道。部分病例报道提示由肺炎克雷伯菌导致的PDAP治疗效果不佳[5-10],并且国际腹膜透析协会(International Society for Peritoneal Dialysis,ISPD)指南对于其导致的PDAP也未提供单独的治疗意见[11-12]。目前唯一一项单中心临床研究来自我国台湾[13],其对肺炎克雷伯菌PDAP的临床与微生物学特点进行了分析,但缺少对肺炎克雷伯菌PDAP治疗失败的危险因素以及预后的进一步分析。本研究回顾性收集2014年1月至2019年12月4家三甲医院PDAP患者的临床资料,通过将肺炎克雷伯菌与革兰氏阴性菌中检出率最高的大肠埃希菌[14]相比较,分析肺炎克雷伯菌PDAP的临床特点及当次治疗结果,并分析肺炎克雷伯菌PDAP的预后,应用多因素Logistic回归模型探究肺炎克雷伯菌PDAP治疗失败的危险因素,为肺炎克雷伯菌PDAP的防治提供临床证据。
资料和方法
资料来源 回顾性收集2014年1月1日至2019年12月31日在吉林大学第二医院、吉林市中心医院、吉林大学第一医院二部、吉林省一汽总医院4个腹膜透析中心随访的PDAP患者临床资料,随访时间截至2020年1月31日。纳入标准:符合2016年ISPD颁布的PDAP诊断标准[11]。排除标准:(1)临床资料不完整;(2)透析液未培养;(3)透析液培养出真菌、混合菌或培养阴性。本研究已获得吉林大学第二医院医学伦理委员会的批准(伦理审查批号:2020026)。
PDAP的处理流程 及时留取患者第 1 袋浑浊透出液并在 6 h 内送检,包括白细胞计数和分类、革兰氏染色及病原学培养。尽量避免留取标本前使用抗生素。推荐使用一代头孢菌素或万古霉素联合三代头孢菌素或氨基糖苷类抗生素作为PDAP的初始治疗方案。根据药敏结果调整抗生素治疗方案。治疗时间根据腹膜透析相关感染的防治指南[15]规定2~3周,必要时适当延长。
资料收集 临床基线资料:包括年龄、性别、透析龄、是否伴有腹痛、PDAP史、抗生素应用史;原发病、合并疾病;当次PDAP发作时的实验室指标:血白细胞计数,血中性粒细胞计数,血中性粒细胞百分比,血红蛋白,血白蛋白,血清钾、钠、钙、磷;肺炎克雷伯菌药敏情况;PDAP当次治疗结果:治愈、复发、拔管、PDAP相关性死亡;长期预后:技术失败、全因死亡、维持腹膜透析。
相关定义
治愈:合理抗生素治疗2~3 周,腹膜炎症状完全缓解,腹透液转清,透出液白细胞下降至正常水平[15]。
复发:上一次腹膜炎治疗完成4周内再次发生,致病菌与上次相同或者是培养阴性的腹膜炎[11]。
PDAP相关性死亡:发生PDAP 30 d内出现的死亡[16]。
技术失败:患者因各种原因导致由腹膜透析转为长期血液透析(至少3个月)[17]。
治疗失败:表现为难治性腹膜炎或出现严重合并症需临时或永久性转血液透析治疗,或需要拔除透析管,或死亡[18]。
统计学处理 应用SPSS 25.0统计软件进行数据分析。计量资料使用夏皮洛-威尔克(Shapiro-Wilk)检验进行正态性检验。符合正态分布的计量资料以均数±标准差表示,组间比较采用t检验;不符合正态分布的计量资料以M(P25,P75)表示,组间比较采用Wilcoxon Mann Whitney检验。分类资料以频次或百分比表示,组间比较采用Symbol`@@χ2检验或Fisher确切概率法。采用Logistic回归分析肺炎克雷伯菌PADP治疗失败的危险因素,将单因素分析中P<0.50的变量纳入多因素Logistic回归模型。生存曲线采用 Kaplan-Meier法绘制生存曲线,并用Log-rank法进行检验。应用Graph Pad Prism 9.3.1软件作图。P<0.05为差异有统计学意义。
结 果
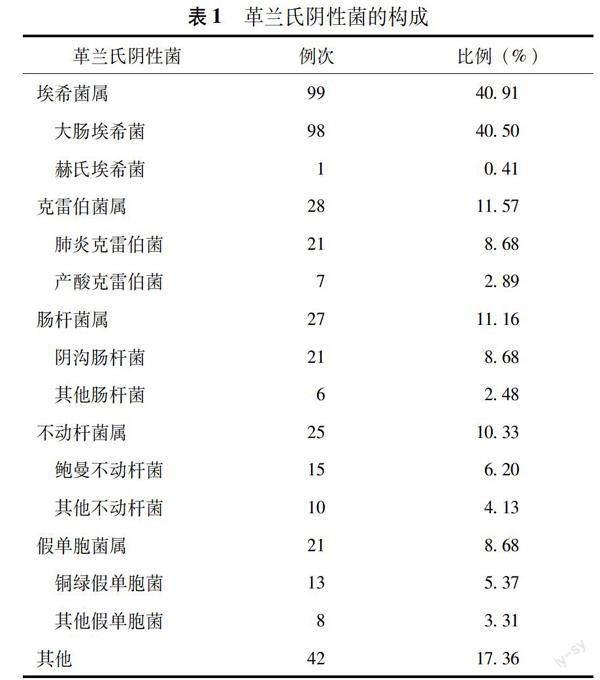
一般资料及肺炎克雷伯菌PDAP发生率 4个腹膜透析中心临床资料完整的586例患者发生1034例次PDAP,透析液未培养12例次,培养出真菌41例次、混合菌79例次,培养阴性者243例次,最终纳入659例次PDAP。革兰氏阴性菌242例次,其中肺炎克雷伯菌21例次(8.68%),大肠埃希菌构成比最高,98例次(40.50%)(表1)。共随访4339患者年,肺炎克雷伯菌PDAP发生率为0.0048次/患者年。2014至2019年肺炎克雷伯菌PDAP发生率在0.0024~0.0124次/患者年。
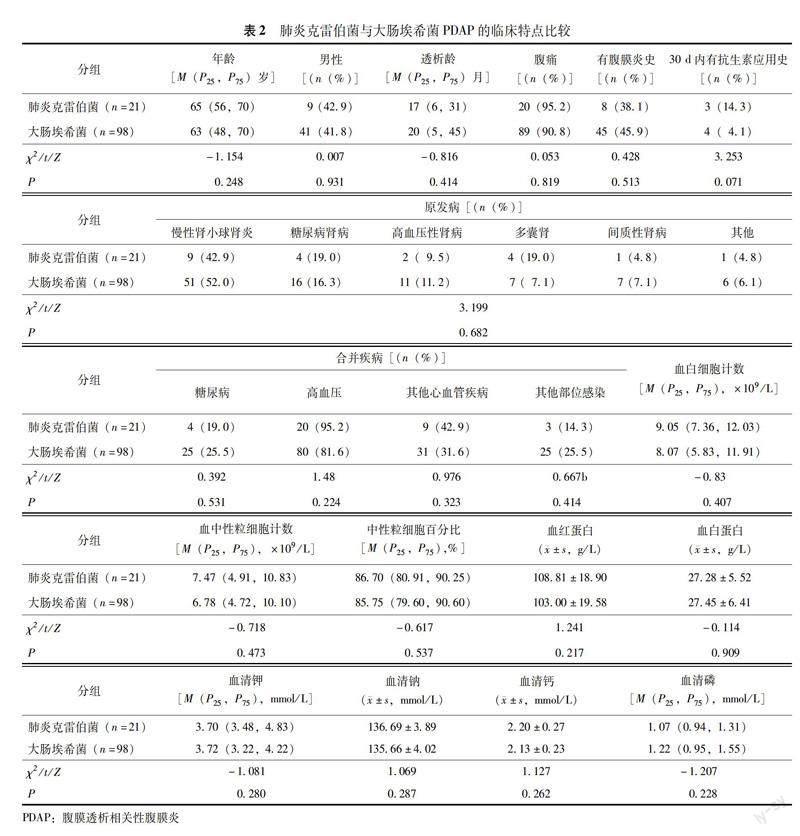
肺炎克雷伯菌与大肠埃希菌PDAP临床特征 两组患者临床基线资料、原发病、合并疾病及当次PDAP发作时的实验室指标差异均无统计学意义(P均>0.05)(表2)。
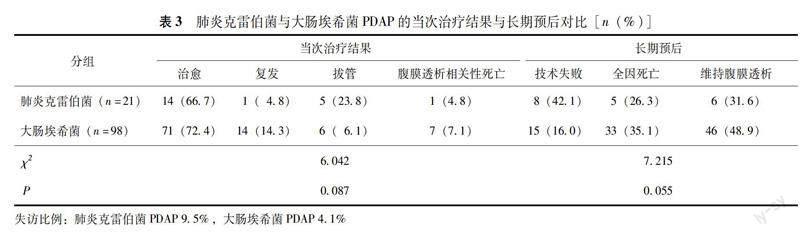
肺炎克雷伯菌與大肠埃希菌PDAP当次治疗结果及长期预后 两组患者当次PDAP治疗结果差异均无统计学意义(P均>0.05)。中位随访时间为11个月,最终两组患者在技术失败、全因死亡、维持腹膜透析的比例方面差异均无统计学意义(P均>0.05)(表3)。进一步绘制Kaplan-Meier生存曲线后显示,肺炎克雷伯菌PDAP的技术失败率更高(χ2=5.245,P=0.022)(图1)。
肺炎克雷伯菌PDAP治疗失败的危险因素 将单因素Logistic回归分析中P<0.50的指标(年龄、女性、腹膜透析龄、PDAP史、合并糖尿病)纳入多因素Logistic回归模型,结果显示长透析龄(OR=1.082,95%CI=1.011~1.158,P=0.023)是肺炎克雷伯菌PDAP治疗失败的独立危险因素(表4)。
药敏结果 肺炎克雷伯菌敏感率最高的5种药物是阿米卡星、美罗培南、亚胺培南、哌拉西林、头孢替坦,均为100%,耐药率最高的依次是氨苄西林(81.82%)、头孢唑林(53.33%)、四环素(50.00%)、头孢噻肟(43.75%)、氯霉素(42.86%)。其中多重耐药菌3例次,占14.29%。
讨 论
本研究是针对肺炎克雷伯菌PDAP的多中心临床研究,结果显示肺炎克雷伯菌PDAP的预后较大肠埃希菌PDAP差,且长透析龄是肺炎克雷伯菌PDAP治疗失败的独立危险因素。
肺炎克雷伯菌具有较厚的荚膜,大多都有菌毛,无芽孢和鞭毛,广泛存在于土壤、地表水等自然环境中。作为一种机会性致病菌,肺炎克雷伯菌主要集中在人体胃肠道,少数存在于鼻咽部[19]。通过拉丝实验,可将肺炎克雷伯菌分为经典肺炎克雷伯菌与高毒力肺炎克雷伯菌[20]。经典肺炎克雷伯菌是医院获得性感染的常见致病菌,常定植于口腔、皮肤、消化道黏膜和医疗设备的表面,在患有糖尿病和恶性肿瘤等免疫功能低下的人群中,可引起重症肺炎、泌尿系感染、呼吸道感染等[19];与经典肺炎克雷伯菌比较,高毒力肺炎克雷伯菌较易引起社区性感染,常见于健康的年轻个体,且较易引起侵袭性感染,如肝脓肿、眼内炎、脑膜炎等[21-22]。肺炎克雷伯菌的毒力因子主要包括荚膜多糖、脂多糖、菌毛及铁载体系统,帮助肺炎克雷伯菌克服机械和化学屏障,逃避宿主的体液免疫和细胞免疫的识别。
本研究显示2014至2019年肺炎克雷伯菌发生率在0.0024~0.0124次/患者年。虽然近几年腹膜透析连接技术不断提高,但对肺炎克雷伯菌PDAP缺少针对性预防措施可能为肺炎克雷伯菌PDAP发生率居高不下的原因之一。对于腹膜透析患者,肠道感染或便秘时肺炎克雷伯菌可通过肠壁或淋巴途径进入腹腔,对于同时合并肺炎或其他部位感染的患者,肺炎克雷伯菌可通过血源性途径侵犯腹膜,尚有部分患者因操作不规范,使空气或黏膜表面的肺炎克雷伯菌通过腹膜透析导管进入腹腔,而腹膜透析液是细菌的良好培养基,极易引起肺炎克雷伯菌PDAP。因此,肺炎克雷伯菌PDAP的发生可能与接触污染、导管出口处感染、便秘或结肠炎有关[23-25],及时更换污染的导管、纠正便秘及禁止不洁饮食、预防性应用抗生素是较为有效的预防措施。本研究提示在242例次革兰氏阴性菌感染中,大肠埃希菌最常见,其次为肺炎克雷伯菌和阴沟肠杆菌。本研究肺炎克雷伯菌占革兰氏阴性菌的比例低于Zeng等[26]和张道法等[27]的研究结果,可能与上述研究之间的年代与地区差异等有关。此外,本研究显示肺炎克雷伯菌及大肠埃希菌PDAP的临床基线资料、原发病、合并疾病及当次实验室指标差异均无统计学意义,这给早期识别肺炎克雷伯菌PDAP带来了困难。
本研究表明肺炎克雷伯菌组的拔管率高于大肠埃希菌组,这与Lin等[13]的研究结果一致。本研究还报道了肺炎克雷伯菌PDAP的长期预后,Kaplan-Meier生存曲线显示,肺炎克雷伯菌组的技术失败率明显高于大肠埃希菌组,可能与肺炎克雷伯菌易形成生物膜有关[19,28]。研究表明 60%~ 80%的细菌感染是由细菌形成生物膜引起的[28],肺炎克雷伯菌生物膜的形成经历了细胞的黏附、小菌落的形成、成熟和最终作为无限增殖细胞进行繁殖[19]。临床上最明显的肺炎克雷伯菌生物膜形成于导管和内部器械的内表面[29]。肺炎克雷伯菌生物膜形成可导致肺炎克雷伯菌在呼吸道、胃肠道和尿路的定植,可促进其在许多医疗条件下的定植,包括留置医疗器械、上呼吸道感染、腹膜炎和泌尿生殖系统感染[30],并促进侵袭性感染的发展(尤其是在免疫缺陷患者中)[19]。对于腹膜透析患者,腹膜透析导管无疑增加了肺炎克雷伯菌的定植机会。细菌种群也可以通过生物膜的形成在宿主内的恶劣条件下存活[31]。贾雯等[28]的研究表明,生物膜的形成与设备相关感染及慢性感染有直接关系,而菌毛、多糖、群体感应系统及外排泵均可调控肺炎克雷伯菌生物膜的形成,其中Ⅲ型菌毛的亚单位MrkA主要黏附于非生物材料表面,启动肺炎克雷伯菌在留置的导管上形成生物膜[32],从而使其对宿主防御机制的抵抗力增强,临床常规抗菌治疗无效[33-34],生物膜的形成也與肺炎克雷伯菌耐药性密切相关[19,33],并可促进细菌间耐药基因的水平传播[35-37],从而加大肺炎克雷伯菌的治疗难度,临床上可能导致难治性腹膜炎的发生,此外,肺炎克雷伯菌通过生物膜定植后产生反复感染,都成为长期预后中技术失败的重要原因。以上结果提示肺炎克雷伯菌PDAP的预后较大肠埃希菌更差,因此需要给予肺炎克雷伯菌PDAP足够的重视。中国腹膜透析相关感染防治专家组建议,对于大肠埃希菌,推荐抗生素留腹疗程达3周以减少复发率和重现率,对于肺炎克雷伯菌的抗生素使用疗程建议通常为2~3周[15];ISPD指南建议,对于肠道革兰氏阴性菌的抗生素使用疗程均为至少3周[11-12]。现阶段,对于肺炎克雷伯菌和大肠埃希菌PDAP的复发率和重现率是否存在差异缺少相关的研究,且更可能发生难治性腹膜炎可能成为肺炎克雷伯菌PDAP预后更差的原因之一,因此,需要通过进一步研究判断两组患者难治性腹膜炎的比例有无差异,是否有必要完善肺炎克雷伯菌PDAP的抗生素治疗方案还需进行进一步探索。本课题组前期研究表明,长透析龄是首次PDAP治疗失败的独立危险因素[38]。本研究显示透析龄每增加1个月,肺炎克雷伯菌PDAP治疗失败的风险增加8.2%。可能原因为长期使用非生理性腹膜透析液导致腹膜处于微炎症状态[39-41],可通过免疫和非免疫机制刺激腹腔免疫细胞产生多种炎性介质和细胞因子,破坏腹膜结构及防御功能,从而使治疗失败率升高。因此,对于长透析龄患者,更应警惕肺炎克雷伯菌PDAP。
本研究藥敏结果显示,肺炎克雷伯菌对阿米卡星、美罗培南、亚胺培南、哌拉西林、头孢替坦5种药物的敏感率均为100%,提示临床医生尽量选用。与本研究不同的是,Lin等[13]的研究结果显示肺炎克雷伯菌对头孢唑林和头孢噻肟敏感性较高,不同年代、不同地区甚至不同腹膜透析中心病原菌流行特点不同及近年对抗生素的使用指征更加严格成为本研究与Lin等[13]的研究结果不同的主要原因。耐药率最高的5种药物依次是氨苄西林、头孢唑林、四环素、头孢噻肟和氯霉素,应尽量避免。肺炎克雷伯菌可通过以下机制产生耐药性[19,42-43]:(1)细胞通透性的改变;(2)形成生物膜;(3)产生氨基糖苷类修饰酶;(4)产生超广谱β-内酰胺酶(extended-spectrum β-lactamases,ESBL);(5)产生碳青霉烯酶。其中对于指导治疗意义较大的为后两种机制。以往有学者报道过产生ESBL的肺炎克雷伯菌PDAP[9-10],对于头孢类及氨基糖苷类抗生素治疗无效者,成功的治疗方案为碳青霉烯类药物,如美罗培南、亚胺培南,是对抗ESBL分离物的最可靠的抗菌剂,因为它们对ESBL的水解活性具有抗性[43]。近年,随着临床上碳青霉烯类抗菌药物的大量使用,耐碳青霉烯肺炎克雷伯菌的检出率逐年升高,对于产生碳青霉烯酶的肺炎克雷伯菌PDAP也有报道[5-6]。而产生碳青霉烯酶的肺炎克雷伯菌几乎对所有的β-内酰胺类抗生素都耐药,替加环素和多黏菌素成为治疗耐碳青霉烯类肺炎克雷伯菌的最后选择[43-44]。以上药敏结果仅反映本地区耐药情况,临床工作中,制定抗感染方案应具有地区、腹膜透析中心特异性。
本研究存在一定局限性。(1)为回顾性研究,无法避免信息偏倚;(2)由于样本量的限制,药敏结果未进行分组,如产生ESBL类、碳青霉烯酶类。
综上,肺炎克雷伯菌PDAP发生率在2014至2019年无明显下降趋势,且早期识别具有一定的困难,对于长透析龄患者更应该警惕治疗失败的风险。相对于大肠埃希菌,肺炎克雷伯菌PDAP的技术失败率更高,以上结果均提示临床医生应积极预防肺炎克雷伯菌PDAP。
参 考 文 献
[1]Da Luz LG,Ankawi G,Digvijay K,et al.Technique failure in peritoneal dialysis:etiologies and risk assessment[J].Blood Purif,2021,50(1):42-49.DOI:10.1159/000508159.
[2]Szeto CC,Li PK.Peritoneal dialysis-associated peritonitis[J].Clin J Am Soc Nephrol,2019,14(7):1100-1105.DOI:10.2215/CJN.14631218.
[3]Huang ST,Chuang YW,Cheng CH,et al.Evolution of microbiological trends and treatment outcomes in peritoneal dialysis-related peritonitis[J].Clin Nephrol,2011,75(5):416-425.DOI:10.5414/cnp75416.
[4]Wyres KL,Lam MMC,Holt KE.Population genomics of Klebsiella pneumoniae[J].Nat Rev Microbiol,2020,18(6):344-359.DOI:10.1038/s41579-019-0315-1.
[5]Moso MA,Macesic N.Peritoneal dialysis-related peritonitis with carbapenem-resistant Klebsiella pneumoniae and vancomycin-resistant Enterococcus faecium[J].Open Forum Infect Dis,2021,8(1):ofaa525.DOI:10.1093/ofid/ofaa525.
[6]Ryanputra D,Wang D,Lee MB,et al.Peritoneal dialysis-related peritonitis from carbapenemase-producing Klebsiella pneumoniae with OXA-48 type gene[J].Perit Dial Int,2019,39(1):97-98.DOI:10.3747/pdi.2018.00234.
[7]Dhruve MJ,Bargman JM.Klebsiella pneumoniae renal abscess and peritonitis in a peritoneal dialysis patient:a novel route of infection[J].Perit Dial Int,2017,37(6):654-656.DOI:10.3747/pdi.2017.00094.
[8]Vikrant S,Guleria RC.Extended-spectrum beta-lactamase-producing Klebsiella pneumoniae causing peritonitis in a patient on continuous ambulatory peritoneal dialysis[J].Saudi J Kidney Dis Transpl,2014,25(4):888-889.DOI:10.4103/1319-2442.135202.
[9]Sandhu A,Zheng S.A case report of expanded-spectrum beta-lactamase-producing Klebsiella pneumoniae peritonitis in a patient on continuous ambulatory peritoneal dialysis[J].Perit Dial Int,2012,32(2):229-230.DOI:10.3747/pdi.2011.00108.
[10]Parchuri S,Mohan S,Cunha BA.Extended spectrum beta-lactamase-producing Klebsiella pneumoniae chronic ambulatory peritoneal dialysis peritonitis treated successfully with polymyxin B[J].Heart Lung,2005,34(5):360-363.DOI:10.1016/j.hrtlng.2004.11.001.
[11]Li PK,Szeto CC,Piraino B,et al.ISPD peritonitis recommendations:2016 update on prevention and treatment[J].Perit Dial Int,2016,36(5):481-508.DOI:10.3747/pdi.2016.00078.
[12]Li PK,Chow KM,Cho Y,et al.ISPD peritonitis guideline recommendations:2022 update on prevention and treatment[J].Perit Dial Int,2022,42(2):110-153.DOI:10.1177/08968608221080586.
[13]Lin WH,Tseng CC,Wu AB,et al.Clinical and microbiological characteristics of peritoneal dialysis-related peritonitis caused by Klebsiella pneumoniae in southern Taiwan[J].J Microbiol Immunol Infect,2015,48(3):276-283.DOI:10.1016/j.jmii.2013.10.002.
[14]Feng X,Yang X,Yi C,et al.Escherichia coli peritonitis in peritoneal dialysis:the prevalence,antibiotic resistance and clinical outcomes in a South China dialysis center[J].Perit Dial Int,2014,34(3):308-316.DOI:10.3747/pdi.2013.00012.
[15]中國腹膜透析相关感染防治专家组.腹膜透析相关感染的防治指南[J].中华肾脏病杂志,2018,34(2):139-148.DOI:10.3760/cma.j.issn.1001-7097.2018.02.010.
[16]Boudville N,Kemp A,Clayton P,et al.Recent peritonitis associates with mortality among patients treated with peritoneal dialysis[J].J Am Soc Nephrol,2012,23(8):1398-1405.DOI:10.1681/asn.2011121135.
[17]Wu H,Ye H,Huang R,et al.Incidence and risk factors of peritoneal dialysis-related peritonitis in elderly patients:a retrospective clinical study[J].Perit Dial Int,2020,40(1):26-33.DOI:10.1177/0896860819879868.
[18]易春燕,阳晓,郭群英,等.长腹膜透析龄患者首次腹膜炎的临床特征分析[J].中华肾脏病杂志,2011,27(10):715-719.DOI:10.3760/cma.j.issn.1001-7097.2011.10.001.
[19]Wang G,Zhao G,Chao X,et al.The characteristic of virulence,biofilm and antibiotic resistance of Klebsiella pneumoniae[J].Int J Environ Res Public Health,2020,17(17):6278.DOI:10.3390/ijerph17176278.
[20]Li W,Sun G,Yu Y,et al.Increasing occurrence of antimicrobial-resistant hypervirulent (hypermucoviscous) Klebsiella pneumoniae isolates in China[J].Clin Infect Dis,2014,58(2):225-232.DOI:10.1093/cid/cit675.
[21]Cubero M,Grau I,Tubau F,et al.Hypervirulent Klebsiella pneumoniae clones causing bacteraemia in adults in a teaching hospital in Barcelona,Spain (2007-2013)[J].Clin Microbiol Infect,2016,22(2):154-160.DOI:10.1016/j.cmi.2015.09.025.
[22]Kishibe S,Okubo Y,Morino S,et al.Pediatric hypervirulent Klebsiella pneumoniae septic arthritis[J].Pediatr Int,2016,58(5):382-385.DOI:10.1111/ped.12806.
[23]Szeto CC,Chow VC,Chow KM,et al.Enterobacteriaceae peritonitis complicating peritoneal dialysis:a review of 210 consecutive cases[J].Kidney Int,2006,69(7):1245-1252.DOI:10.1038/sj.ki.5000037.
[24]Troidle L,Gorban-Brennan N,Kliger A,et al.Differing outcomes of gram-positive and gram-negative peritonitis[J].Am J Kidney Dis,1998,32(4):623-628.DOI:10.1016/s0272-6386(98)70026-5.
[25]Prasad N,Gupta A,Sharma RK,et al.Outcome of gram-positive and gram-negative peritonitis in patients on continuous ambulatory peritoneal dialysis:a single-center experience[J].Perit Dial Int,2003,23(Suppl 2):144-147.DOI:10.1177/089686080302302s30.
[26]Zeng Y,Jiang L,Lu Y,et al.Peritoneal dialysis-related peritonitis caused by gram-negative organisms:ten-years experience in a single center[J].Ren Fail,2021,43(1):993-1003.DOI:10.1080/0886022X.2021.1939050.
[27]張道法,苏淑娟.腹膜透析相关性腹膜炎易感因素分析[J].临床和实验医学杂志,2018,17(9):999-1002.DOI:10.3969/j.issn.1671-4695.2018.09.032.
[28]贾雯,郭瑞林.肺炎克雷伯菌生物膜形成及调控机制的研究进展[J].中国医学科学院学报,2021,43(6):936-944.DOI:10.3881/j.issn.1000-503X.13957.
[29]Hall-Stoodley L,Costerton JW,Stoodley P.Bacterial biofilms:from the natural environment to infectious diseases[J].Nat Rev Microbiol,2004,2(2):95-108.DOI:10.1038/nrmicro821.
[30]Hassan A,Usman J,Kaleem F,et al.Evaluation of different detection methods of biofilm formation in the clinical isolates[J].Braz J Infect Dis,2011,15(4):305-311.DOI:10.1590/s1413-86702011000400002.
[31]Türkel I·,Yldrm T,Yazgan B,et al.Relationship between antibiotic resistance,efflux pumps,and biofilm formation in extended-spectrum β-lactamase producing Klebsiella pneumoniae[J].J Chemother,2018,30(6-8):354-363.DOI:10.1080/1120009x.2018.1521773.
[32]Boddicker JD,Anderson RA,Jagnow J,et al.Signature-tagged mutagenesis of Klebsiella pneumoniae to identify genes that influence biofilm formation on extracellular matrix material[J].Infect Immun,2006,74(8):4590-4597.DOI:10.1128/iai.00129-06.
[33]Rahdar HA,Malekabad ES,Dadashi AR,et al.Correlation between biofilm formation and carbapenem resistance among clinical isolates of Klebsiella pneumoniae[J].Ethiop J Health Sci,2019,29(6):745-750.DOI:10.4314/ejhs.v29i6.11.
[34]Singh AK,Yadav S,Chauhan BS,et al.Classification of Clinical Isolates of Klebsiella pneumoniae Based on Their in vitro Biofilm Forming Capabilities and Elucidation of the Biofilm Matrix Chemistry With Special Reference to the Protein Content[J].Front Microbiol,2019,10:669.DOI:10.3389/fmicb.2019.00669.
[35]Stalder T,Cornwell B,Lacroix J,et al.Evolving populations in biofilms contain more persistent plasmids[J].Mol Biol Evol,2020,37(6):1563-1576.DOI:10.1093/molbev/msaa024.
[36]Zhu L,Chen T,Xu L,et al.Effect and mechanism of quorum sensing on horizontal transfer of multidrug plasmid RP4 in BAC biofilm[J].Sci Total Environ,2020,698:134236.DOI:10.1016/j.scitotenv.2019.134236.
[37]Strugeon E,Tilloy V,Ploy MC,et al.The stringent response promotes antibiotic resistance dissemination by regulating integron integrase expression in biofilms[J].mBio,2016,7(4):e00868-16.DOI:10.1128/mBio.00868-16.
[38]趙晶,杨立明,朱学研,等.长腹膜透析龄患者首次腹膜炎的临床特征及治疗转归:基于4家医院625例患者数据[J].南方医科大学学报,2020,40(12):1740-1746.DOI:10.12122/j.issn.1673-4254.2020.12.07.
[39]Wu J,Yang X,Zhang YF,et al.Glucose-based peritoneal dialysis fluids downregulate toll-like receptors and trigger hyporesponsiveness to pathogen-associated molecular patterns in human peritoneal mesothelial cells[J].Clin Vaccine Immunol,2010,17(5):757-763.DOI:10.1128/cvi.00453-09.
[40]Ishimatsu N,Miyamoto T,Ueno H,et al.High glucose concentration-induced expression of pentraxin-3 in a rat model of continuous peritoneal dialysis[J].Histol Histopathol,2016,31(11):1251-1258.DOI:10.14670/hh-11-756.
[41]Schwenger V,Morath C,Salava A,et al.Damage to the peritoneal membrane by glucose degradation products is mediated by the receptor for advanced glycation end-products[J].J Am Soc Nephrol,2006,17(1):199-207.DOI:10.1681/asn.2005020155.
[42]陈穗宁,徐立,沈怡娟,等.肺炎克雷伯菌耐药与耐药机制的研究进展[J].中国卫生检验杂志,2021,31(24):3064-3067.
[43]陆颖,朱志军,朱梅.肺炎克雷伯菌耐药机制研究进展[J].中华医院感染学杂志,2020,30(7):1116-1120.DOI:10.11816/cn.ni.2020-190599.
[44]Yuhan Y,Ziyun Y,Yongbo Z,et al.Over expression of AdeABC and AcrAB-TolC efflux systems confers tigecycline resistance in clinical isolates of Acinetobacter baumannii and Klebsiella pneumoniae[J].Rev Soc Bras Med Trop,2016,49(2):165-171.DOI:10.1590/0037-8682-0411-2015.
(收稿日期:2022-06-01)
基金项目:吉林省卫生健康委员会基金(2018FP031)

