种植海水稻对滨海盐土化学性质和微生物群落影响
李慧君, 张伟健, 吴伟健, 李高洋, 陈艺杰,黄枫城, 黄永相, 蔺中, 甄珍*
(1.广东海洋大学滨海农业学院,广东 湛江 524088; 2.广东海洋大学化学与环境学院,广东 湛江 524088)
土壤盐渍化问题日益突出,已严重影响我国粮食安全和农业可持续发展[1]。据统计,我国盐碱土总面积约为0.36 亿hm2,占全国可利用土地面积的4.88%,并以每年1%的速度增加[1]。其中,滨海盐土面积约0.14 万hm2,占盐碱地总面积的40%。滨海盐土含有过量的氯化物、硫酸盐、重碳酸盐等成分,土壤盐分高、物理结构差、微生物数量和多样性少、养分供应不足,普通农作物难以种植[2]。因地制宜地利用滨海盐土,对我国沿海滩涂的生态修复具有重要意义。
滨海盐土改良目前主要依靠大量灌水洗盐、施加土壤改良剂(石膏、磷石膏等)、平整土地、抬高地形等一系列水利、化学和工程手段[3]。然而,滨海地区淡水资源匮乏,改良剂施用不当易造成二次污染[4]。土地整治费用高昂,加之滨海盐土地下水位高,积盐返盐现象普遍,导致上述常规技术在我国滨海地区难以大面积推广,无法达到预期改良效果。构建一套低廉、环保、可持续的滨海盐土改良技术,实现脱盐、改土、增产等多重社会和生态效益势在必行。
耐盐碱水稻(海水稻)种植已成为滨海盐土改良的有效途径之一。海水稻既耐盐碱,又抗风、抗涝,可在沿海滩涂生长。其独特的耐盐性和长期灌溉等优势可吸收淋溶土壤中的盐碱,改善盐土质量。同时,海水稻根系分泌物中的有机成分可改良土壤盐碱环境,抑制水分蒸发,控制土壤表层发生积盐返盐现象。海水稻可吸收一定盐分,从而改善土壤理化特性,加速盐分淋洗[4]。加之,种植海水稻既可显著提升土著微生物的群落结构和功能多样性,还可促进土壤养分的循环和利用,加速盐土生态功能的恢复。习近平总书记在黄河三角洲农业高新技术产业示范区考察调研时强调,要加强种植资源、耕地保护和利用等基础性研究,挖掘盐碱地开发利用潜力,将科研成果加快转化为现实生产力。袁隆平院士生前提出,为中国改良一亿亩盐碱地,早日实现亿亩盐碱地“荒滩变良田”目标。全面推广海水稻种植兼具改善生态环境和发展社会经济的双重作用,是落实“藏粮于地、藏粮于技”战略的重要途径,具有重要的经济价值、社会意义和生态效益。
前人对海水稻的耐盐性、品质、产量和抗旱性等方面进行了广泛研究[5-6],但种植海水稻对盐碱地土壤理化特性、养分循环利用、土壤微生物群落结构和功能多样性影响的研究鲜有报道。微生物是土壤生态系统的重要组成部分[7],直接参与土壤形成发育、有机质积累和矿化分解[8],土壤氮磷钾等养分转化对土壤生态系统平衡具有不可替代的作用。滨海盐碱地环境特殊,土壤中含有的微生物数量少、活性差,群落结构和功能遭到破坏,使其在滨海盐碱地生态修复中的作用薄弱,土壤养分释放和利用严重不足,难以实现农业的稳产及可持续发展。
鉴于此,本研究以广东湛江滨海盐碱地为研究对象,分别在低盐环境(盐度0.2%)和高盐环境(盐度0.6%)种植‘海稻86’,研究种植海水稻对广东粤西地区滨海不同盐碱度土壤的化学特性、有机质分解转化、养分循环利用及土壤微生物群落结构和功能多样性的影响,为滨海盐碱地的生态治理与修复及解决我国盐碱地粮食生产问题提供理论基础和技术支撑。
1 材料与方法
1.1 供试材料
本试验供试材料为‘海稻86’,生长健硕的海水稻幼苗取自广东海洋大学国家耐盐碱水稻技术创新中心华南中心水稻试验基地。模拟培养试验在广东省湛江市广东海洋大学生物技术研究所连栋温室中进行。供试土壤为滨海盐土壤,经测定盐度为0.14%。供试土壤pH 6.10,有机质含量28.70 g·kg-1,腐殖质含量15.65 g·kg-1,全氮含量1.17 g·kg-1,碱解氮含量167.73 mg·kg-1,速效磷含量28.91 mg·kg-1,速效钾含量87.86 mg·kg-1。
1.2 试验设计
盆栽试验在长度60 cm、宽40 cm、高度50 cm的无盖培养箱中进行。培养箱中装填20 kg(干土)经混匀后的滨海盐土,通过人工添加海水(盐度3.4%),将供试土壤盐度分别调节为0.2%(低盐)和0.6%(高盐),并每天测定和按需添加海水,使水稻整个培育期内土壤盐度都维持在设置盐度水平。以不种植海水稻的0.2%和0.6%盐度土壤为对照组(CK1 和CK2),以种植海水稻的0.2%和0.6%盐度土壤为处理组(S1 和S2),3 次重复。选取生长至三叶一心且长势一致的海水稻幼苗移栽到培养箱中,移栽前将海水稻根系冲洗干净,每个培养箱移栽12 株。在海水稻的整个生长期每天观察水分缺失情况,补充蒸馏水,保持液面高度与初始时期一致。
1.3 样品采集
分别在水稻幼苗期(移栽后15 d)、分蘖期(移栽后35 d)、抽穗期(移栽后55 d)、灌浆期(移栽后75 d)进行破坏性取样。随机选择3株植株将其拔出,收集海水稻根系携带的土壤80 g,将其均分为3 份。一份立即带回实验室用于土壤微生物数量和活性测定;一份置于无菌采样袋保存于-4 ℃冰箱,用于土壤化学性质的测定;最后一份保存于-80 ℃冰箱,用于土壤细菌群落结构的测定。对照组(CK1和CK2)土壤采用“五点取样法”用表面消毒的取样器进行采集,采集时间、样品保存和测定指标均与海水稻根系土壤一致。
1.4 土壤化学性质测定
土壤化学性质参照《土壤农业化学分析方法》[9]进行测定:土壤pH 采用电位法测定;有机质(soil organic matter,SOM)含量采用重铬酸钾容量法测定;腐殖质(humus,HU)含量采用焦磷酸钠萃取重铬酸钾法测定;碱解氮(available nitrogen,AN)含量采用碱解扩散法测定;铵态氮(NH+4-N)和硝态氮(NO-3-N)含量采用MgO-定氮合金蒸馏法测定;速效磷(available phosphorus,AP)含量采用碳酸氢钠浸提钼锑抗比色法测定;速效钾(available potassium,AK)含量采用醋酸铵浸提火焰光度法测定。最后用SMARTCHEM 200(意大利AMS 公司)全自动化学分析仪测定土壤中和含量。
1.5 土壤微生物数量和活性测定
在密闭容器中培养土壤24 h后,用0.1 mol·L-1NaOH 溶液捕获析出的CO2,然后用标准HCl 溶液滴定微生物活性(microbial respiratory activity,MR)。微生物生物量碳(microbial biomass carbon,MBC)和微生物生物量氮(microbial biomass nitrogen,MBN)通过氯仿熏蒸和硫酸钾萃取法进行测定[10],并通过以下公式计算。
式中,EC 和EN 分别是熏蒸土壤和非熏蒸土壤之间有机碳和全氮的差值;KEC 是有机碳的转换系数,为0.45;KEN是全氮的转换系数,为0.54。
1.6 土壤16S细菌群落结构测定
选取土壤微生物数量和活性影响最强的生长阶段,基于16S rDNA 基因高通量测序分析土壤细菌的群落结构。采用Bio Fast 土壤DNA 提取试剂盒提取土壤中的总DNA。用338F(5’-ACTCCTACGGGAGGCAGCA-3’)和806R(5’-GGACTACHVGGGTWTCTAAT-3’)通用引物进行PCR扩增,扩增区域为16S rRNA V3+V4 高变区。PCR 体系包含KOD FX Neo缓冲液5 μL、dNTP 2 μL、KOD FX Neo 0.2 μL、引物0.3 μL、模板DNA 50 ng,加去离子水至终体积10 μL。PCR 程序:95 ℃ 5 min;95 ℃30 s,50 ℃ 30 s,72 ℃ 60 s,30 个循环;72 ℃ 5 min。扩增产物用2%琼脂糖凝胶检测并回收,合格样品送上海美吉生物医药科技有限公司纯化和测序。
1.7 数据分析
使用Illumina MiSeq 高通量测序平台进行双末端测序。采用Usearch 11.0 对序列在97%的相似度水平下进行聚类获得操作分类单元(operational taxonomic units,OTUs)。使用Silva 数据库(https://www.arb-silva.de/)对OTUs 进行不同级别的分类信息标注。为了评估细菌微生物群落的丰富度和复杂性,利用QIIME 1.8.0 获得属水平上的物种组成图和聚类热图。利用SPSS 25.0进行正态性分布和方差齐性检验及单因素方差分析(one-way ANOVA),采用邓肯(Duncan’s)法进行多重比较。利用Origin 2022 绘制柱形图。同时,基于Spearman相关性分析计算土壤化学指标与优势菌群丰度的相关性,利用Origin 2022绘制热图。
2 结果与分析
2.1 种植海水稻对滨海盐土化学性质和养分的影响
种植海水稻对滨海盐土化学性质和养分的影响显著(图1)。在海水稻生育期内,种植海水稻处理土壤的pH 呈逐渐下降趋势,在灌浆期,S1 和S2 处理土壤的pH 分别为5.45 和5.77,显著低于CK1和CK2。处理组土壤的SOM含量较对照组显著降低。S1 和S2 处理的HU 含量随着海水稻的生长发育呈先上升后下降的趋势,在抽穗期达到峰值,分别为19.26 和17.42 mg·kg-1,均显著高于对照组。处理组土壤的AN 含量随着海水稻的生长逐渐增加,而对照组则相反;S1 和S2 处理土壤的AN 含量均在抽穗期达到最高,分别为180.53和164.71 mg·kg-1,较CK1 和CK2 分别显著增加65.76%和58.32%。NH+4-N 和NO-3-N 含量的变化趋势与AN 相似,S1、S2 处理在抽穗期时分别为162.51、147.86 和20.77、16.17 mg·kg-1,分别较CK1 和CK2 显著增加64.18%、61.75%和10.41%、7.76%。S1 和S2 处理土壤的AP 含量在培养期内呈逐渐上升趋势,在灌浆期时分别为40.61 和34.79 mg·kg-1,显著高于CK1 和CK2。S1 和S2 处理土壤的AK 含量在培养期内也呈上升趋势,在抽穗期时分别为98.33 和88.69 mg·kg-1,较CK1 和CK2分别显著提高13.72%和17.38%。综上表明,种植海水稻可显著降低滨海盐土pH,加速有机质的分解转化,提高土壤速效氮磷钾等养分含量。

图1 不同处理下土壤的化学性质Fig. 1 Chemical properties of soil under different treatments
2.2 种植海水稻对滨海盐土微生物数量和活性的影响
由于未种植海水稻,CK1 和CK2 土壤的MBC、MBN 和MR 变化较小;而种植海水稻的S1、S2 处理土壤的MBC、MBN 和MR 含量随着海水稻的生长发育呈先上升后下降趋势,均在抽穗期达到峰值(图2)。S1和S2处理土壤的MBC、MBN 含量均显著高于CK1 和CK2。在抽穗期,S1 处理土壤的MBC、MBN 和MR 含量较CK1 显著增加190.42%、234.13%和93.33%;S2 处理较CK2 显著增加195.33%,184.26%和108.14%。综上表明,种植海水稻可显著提高土壤微生物数量和活性。

图2 不同处理下土壤的微生物数量和活性Fig. 2 Microbial amount and bioactivity of soil under different treatments
2.3 种植海水稻对滨海盐土微生物丰度和多样性的影响
Alpha 多样性指数分析结果(表1)显示,S1和S2 处理土壤的微生物丰度和多样性与对照土壤差异显著。Richness 和Chao1 指数用于衡量物种丰度,Shannon 和Simpson 指数用于衡量物种多样性。对于Richness 和Chao1 指数,S1 和S2 处理均显著高于CK1 和CK2,且S1 处理又显著高于S2 处理。对于Shannon 指数,S1 和S2 处理与CK1 差异不显著,但均显著高于CK2。对于Simpson 指数,S1 和S2 处理均显著高于CK1 和CK2,且S1 处理又显著高于S2 处理。由此表明,种植海水稻后土壤微生物群落的丰富度和多样性显著提高,且低盐度下微生物群落结构的丰富度和多样性更高。
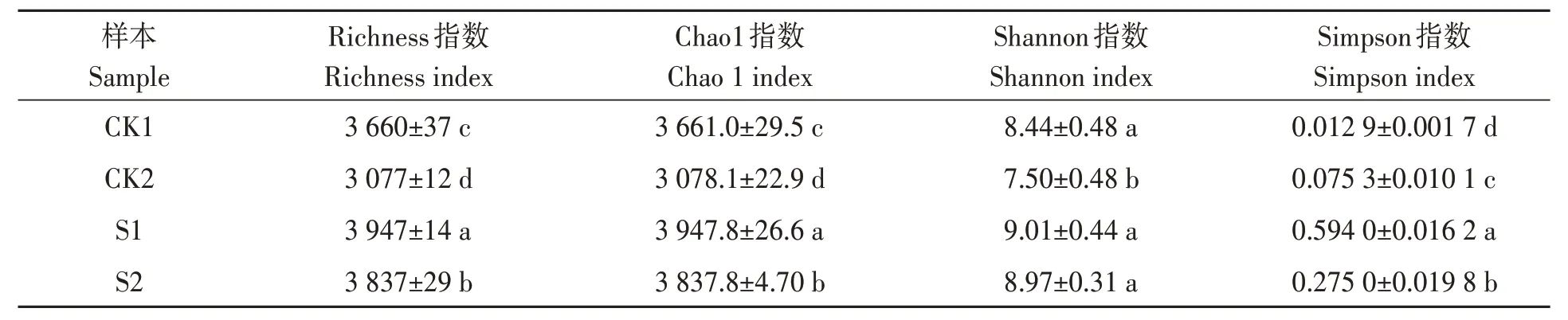
表1 种植海水稻对土壤微生物丰度和多样性的α多样性指数Table 1 Alpha diversity index of soil microbial abundance and diversity under sea rice cultivation
2.4 种植海水稻对滨海盐碱地土壤微生物群落结构的影响
图3 显示了种植海水稻对不同盐浓度盐碱土微生物群落结构的影响。所有处理样本的30 个科水平群落物种组成中,其中S1 处理top10 的相对丰度之和平均达75.01%。在科水平下,伯克氏菌科(Burkholderiaceae)、噬几丁质菌科(Chitinophagaceae)、嗜甲基菌科(Methylophilaceae)、芽单胞菌科(Gemmatimonadaceae)、鞘脂单胞菌科(Sphingomonadaceae)为优势菌科(相对丰度在5%以上)。与CK1 相比,S1 处理中伯克氏菌科、噬几丁质菌科、嗜甲基菌科、吡啶单胞菌科(Pyrinomonadaceae)、鞘脂单胞菌科、芽囊藻科(Blastocatellaceae)、亚硝化单胞菌科(Nitrosomonadaceae)的相对丰度分别显著提升75.63%、4.01%、54.67%、65.03%、99.11%、49.93%、119.75%;而芽单胞菌科、假单胞菌科(Pseudomonadaceae)的相对丰度分别显著降低21.10%、15.90%。与CK2 相比,S2 处理中伯克氏菌科、嗜甲基菌科、芽囊藻科、亚硝化单胞菌科的相对丰度分别显著提升29.83%、28.17%、148.84%、44.81%;而芽单胞菌科、噬几丁质菌科、假单胞菌科的相对丰度分别显著降低16.25%、32.36%、48.95%。吡啶单胞菌科、鞘脂单胞菌科和亚硝化单胞菌科在不同处理间的相对丰度差异较小。由此说明,种植海水稻可改变土壤中微生物群落结构,且0.2%盐度种植条件下影响更大。

图3 不同处理下的微生物群落结构组成Fig. 3 Composition of microbial community under different treatments
为了进一步了解不同处理间微生物群落结构的差异,对不同处理下土壤微生物群落结构进行聚类分析,结果(图4)表明,不同处理间的微生物群落结构分为3 大类,S1、S2 与CK1 明显分离,且S1 处理的微生物群落组成与其他处理相差最大,单独聚为一类。由此说明,种植海水稻可改善土壤中微生物群落结构和功能多样性,在低盐度下微生物群落结构改善效果更优。
2.5 种植海水稻条件下土壤微生物与土壤化学性质的相关性分析
相关分析结果(图5)表明,土壤pH与伯克氏菌科、嗜甲基菌科呈极显著正相关;土壤HU、AN、-N、-N含量与吡啶单胞菌科、芽囊藻科的相对丰度呈极显著正相关。
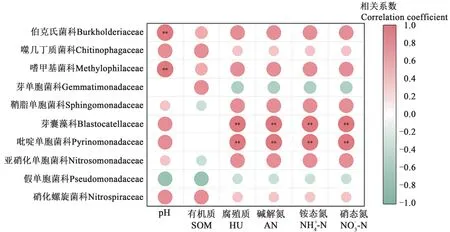
图5 土壤化学因子与科水平下优势菌的相关性分析Fig. 5 Correlation analysis between soil chemical factors and dominant bacteria at family level
3 讨论
土壤盐度是影响土壤质量的重要因素。高盐胁迫会严重影响植物生长发育[11]。滨海盐土中盐度较高,导致土壤渗透压升高,使海水稻吸水困难、生长发育迟缓[12]。本研究选用的‘海稻86’在0.2%和0.6%盐度处理下均能生长,说明其可作为盐土改良作物在盐度低于0.6%的盐土中种植,为粤西地区解决滨海盐土的推广提供了改良方案和技术支撑。尽管‘海稻86’”在高盐和低盐处理下均能生长,但低盐处理下其长势更为旺盛,且对土壤的改良效果更优,如土壤pH 更低,土壤HU、AN、AP 和AK 含量显著增加。这可能是由于高盐胁迫下土壤肥力下降,导致养分循环速率降低,从而抑制了微生物活性;另外,土壤中大量的Ca2+、Mg2+和Na+积累,造成土壤pH 升高[13],同时高水平离子胁迫对土壤微生物也会产生一定的毒害作用[3,14]。
种植水稻是我国改良滨海盐土、进行熟化脱盐的重要手段[15]。滨海盐土长期受到海水侵蚀,导致土壤板结,土层坚实[16]。水稻根系的生长发育有利于促使土壤疏松多孔,增加土壤渗透性,改善土壤物理结构,有利于土壤淋溶脱盐性能的增强[12]。研究表明,海水稻在生长过程中可吸收利用土壤中的部分盐,从而降低土壤盐分,改善土壤质量[17]。微生物活性是土壤养分循环的主要驱动力,盐胁迫可抑制微生物活性,进而影响土壤养分的转化与迁移[18]。本研究发现种植海水稻显著提高了土壤的MBC、MBN 含量及MR。在海水稻生长过程中,根系分泌有机酸、维生素和植物生长调节剂等物质,为微生物的生长和繁殖提供了充足的营养和能源[19],提高了土壤中微生物的数量和活性;此外,种植海水稻后,土壤SOM 和TN 含量减少,HU 含量升高,AN、AK 和AP 等速效养分含量显著提高。这是由于海水稻吸收利用了土壤养分,同时海水稻衰老的根系和枯叶在微生物的作用下分解转化,极大地促进了土壤养分循环。滨海盐土中原有养分在水稻根系的影响下开始逐渐释放,SOM 分解速率加快,使土壤中速效养分含量升高。本研究发现种植海水稻还可以降低土壤pH,这可能是由于水稻在生长过程中吸收利用了Na+、Mg2+、Ca2+等阳离子,且根系可释放有机酸,从而促使土壤pH 降低[20]。综上所述,种植海水稻可改善土壤物理性质,促进土壤养分的分解转化,提高速效养分含量,改进土壤质量。
水稻根系土壤蕴含着丰富多样的微生物,其中许多微生物可参与土壤养分循环和改善土壤质量。研究发现,水稻根系对细菌的富集作用具有选择性[21]。本研究表明,种植海水稻后土壤中的细菌多样性和丰富度显著高于未种植土壤,其中伯克氏菌科、噬几丁质菌科、嗜甲基菌科、吡啶单胞菌科、鞘脂单胞菌科、芽囊藻科、亚硝化单胞菌科的相对丰度显著提升。伯克氏菌科含有多种功能不同的菌属,其中属于伯克霍尔德氏科的非致病性属种可以与植物建立共生或内生关系,从而发挥重要的生态系统功能,如污染物的生物降解、抗菌化合物的产生、促进必要的养分吸收和植物生长等[22]。噬几丁质菌科可以降解木质素,分解多糖[23-24]。种植海水稻后土壤中噬几丁质菌科的相对丰度显著升高,有利于加快SOM的降解[25],促进养分释放。嗜甲基菌科参与CH4氧化以及反硝化作用,促进土壤碳、氮养分循环。水稻根系产生的微氧环境以及土壤硝酸盐含量的升高有利于提高嗜甲基菌科的相对丰度和活性[26-27]。鞘脂单胞菌科是一种重要的氮循环微生物[28],具有应对逆境的能力,在生物修复、生物降解等方面发挥重要作用。吡啶单胞菌科可体现土壤健康状况,其丰度的提高说明土壤质量得到改善。芽囊藻科与植物吸收氮素效率有关[29]。亚硝化单胞菌科是进行氨氧化作用的重要菌[30-31],可将NH+4转化为NO-3,促进土壤氮循环。研究表明,吡啶单胞菌科、芽囊藻科为兼性厌氧型细菌[25,29],在有氧条件下生长良好,在缺氧环境中仅能维持生存;亚硝化单胞菌科为好氧型细菌[32]。水稻根系的生长发育增加了土壤中的氧气含量,进而提高了吡啶单胞菌科、芽囊藻科和亚硝化单胞菌科的相对丰度。
分析土壤化学性质和微生物群落结构间的关系发现,土壤pH与伯克氏菌科和嗜甲基菌科呈极显著正相关(P<0.01),说明种植海水稻降低了土壤pH,极大地提高了伯克氏菌科和嗜甲基菌科的数量和活性,进而对水稻自身的健康生长和土壤C、N 循环起到正向作用[33]。土壤HU、AN、NH+4和NO-3含量与吡啶单胞菌科和芽囊藻科呈极显著正相关(P<0.01)。水稻生长促进土壤中AN 和HU含量,有利于吡啶单胞菌科和芽囊藻科的生长发育。吡啶单胞菌科和芽囊藻科丰度的提高反过来又加快了土壤中的氮循环,对土壤质量的提高起到强化作用。

