固体储氢材料的研究进展
刘木子,史柯柯,赵强,李晋平,刘光
(太原理工大学化学工程与技术学院,气体能源高效清洁利用山西省重点实验室,山西 太原030024)
进入21 世纪以来,随着人口增长和全球能源消费的增加,特别是在工业、交通、医疗等领域,人类对能源的需求与日俱增[1]。鉴于不可再生能源化石燃料受到人类社会的依赖型应用,随之而产生的环境污染和能源危机等问题使得人们不得不寻求一种清洁、高效的可再生能源来代替传统化石能源的使用[2]。氢能作为一种二次可再生能源,被视为21 世纪最具发展潜力的清洁能源之一,其最具吸引力的特性之一是它的高能量密度,这将氢与其他传统燃料区分开来并使其成为优秀的燃料和能量载体[3]。
由于氢气在常温常压下是所有能源中密度最低的,且易燃、易爆、易扩散,所以氢气的储存和运输已成为制约氢能规模化应用的瓶颈问题。开发安全、高效、经济的氢气储运技术是发展氢能经济的关键环节。理想储氢技术,需满足含氢质量分数和体积密度高、循环寿命长、安全性高等条件。此外,还应尽量降低储氢成本,提高充放氢速率。目前氢的存储方式主要有三种:高压气态储氢、低温液态储氢和固体材料储氢。高压气态储氢技术成熟、结构简单、充放氢速度快、成本及能耗低,但缺点是体积储氢密度低、安全性能差,存在氢气泄漏和爆炸的风险,目前主要应用于轻质高压储氢罐和氢燃料电池。低温液态储氢单位体积储氢密度大、安全性相对较好,缺点是氢液化并保持极低的温度所造成的能耗极大,且由于巨大的内外温差,系统会持续蒸发损失。此外,低温液态储氢对储氢容器要求较高[4-5],目前主要用于军事航天领域。
相比于高压气态储氢和低温液态储氢,固体材料储氢能很好地解决传统储氢技术的储氢密度低和安全系数差的问题[6]。固体材料储氢机理总体上可分为两类,即物理吸附储氢和化学吸收储氢。物理吸附储氢材料包括碳质吸附材料、金属有机骨架和沸石等。氢气被吸附在材料的微孔、骨架或管结构上,不伴随化学反应的发生。对于化学吸收储氢,材料主要有各类金属合金、金属氢化物、配位氢化物以及氢气水合物[7-9]等,有化学反应的发生,氢气被存储在金属氢化物的合金晶格中。在目前的储氢方式中,固态储氢系统是最可靠、最安全、最高体积效率的储氢方式。寻找和研制高性能的储氢材料,成为固态储氢的当务之急,也是未来储氢发展和乃至整个氢能利用的关键。目前许多储氢材料研究致力于满足美国能源部设定的氢储存目标,即达到6.5%的质量储氢密度和0.05kg H2/L 体积容量。国际能源署提出理想储氢材料的性能目标为:质量储氢密度>5.5%,放氢温度<423K,循环寿命>1000次。储氢材料除了需要具有高的重量和体积容量外,理想的体系还应在近环境温度下表现出快速的吸附动力学、高可逆性、高稳定性和高成本效益。
截至目前,大多数文章都只涉及固态储氢材料领域某个方面,诸如基于碳基、配位氢化物或水合物等特定类型和具体应用的综述。因此,本文目的在于对目前的固态储氢材料发展状况进行全面总结,重点是金属基储氢材料中最有研究发展潜力的镁基储氢材料,并对其改性方法和技术进行评述。此外,本文比较了不同材料储氢的机理与方式,并对比分析其优缺点,针对固体储氢材料,指出今后的研究重点和方向,并对未来发展进行了展望。
1 物理吸附类储氢材料
物理吸附类储氢材料的工作原理是运用范德华力对氢气的吸附作用,因其在特定条件下对氢气具有良好、可逆的热力学吸附、脱附性能而受到广泛研究。提高材料对氢气的吸附作用使氢分子更容易、更牢固地吸附在微孔材料的表面或孔腔中,已成为进一步提高物理吸附储氢材料储氢量的一条重要途径。
1.1 碳基储氢材料
炭材料具有可变微孔和较大的有效比表面积,其储氢特点为安全性高、成本低、寿命长以及吸放氢条件合适。因为物理吸附的机理,所以改变碳质材料比表面积、孔径大小可以有效提高储氢量。
1.1.1 活性炭
活性炭又称炭分子筛,因其成本低、储氢量高、稳定性高、使用寿命长、易规模化生产而成为一种极具潜力的储氢材料。
Sethia 等[10]制备了一系列不同孔径的高含氮超微孔活性炭并研究了它们在77K下对氢气的吸附效果,由于孔隙率增加,活性炭显示出较高的吸氢率。其中吸附效果最好的活性炭吸氢量为2.96%(质量分数),是迄今为止任何合成材料衍生活性炭在77K 和0.1MPa 的最高吸氢量。研究发现氢吸附容量与超微孔体积呈线性关系,但与总表面积或总孔体积均不呈线性关系。超微孔体积主要控制77K时的氢吸附,但在较高压力下,大孔材料的比表面积对氢吸附也有一定的促进效果。
除了以合成材料为前体制备的微孔炭材料外,许多基于天然材料合成的活性炭也表现出优异的吸氢能力。通过碳化处理后经KOH 活化处理,有机前体将转化为多孔活性炭。以天然大麻茎衍生的活性炭在77K和0.1MPa下的吸氢量为3.28%(质量分数)[10-11],是所知天然前体材料衍生活性炭中的最高吸氢量。Heo等[12]在稻壳碳化后使用KOH处理和活性炭合成工艺合成了以稻壳为原料的活性炭,发现当稻壳与KOH 的比例为1∶1 时,在0.1MPa、77K时储氢能力达到最高的2.85%(质量分数)。
有研究指出,活性炭材料的储氢性能与微孔体积成正比[13],且与温度和压力有一定的关系,温度越低,压力越大,则储氢能力越优秀[14]。除此之外,活性炭的物质状态也会影响其储氢容量和吸放氢速率,纤维状活性炭的吸放氢速率甚至比颗粒状快十数倍。不仅如此,活性炭表面酸度也是影响因素之一,表面酸度越高,储氢容量越大。针对实际应用来说,因为活性炭在低温、高压下才能表现出高吸氢能力,开发潜力较差,不适合氢能规模化应用。
1.1.2 碳纳米管
碳纳米管(CNT)具有良好的化学和热稳定性以及中空结构,在结构上碳纳米管可以看作是石墨烯片层卷曲而成,故可分为单壁碳纳米管和多壁碳纳米管。氢在碳纳米管中的吸附为单分子层吸附,研究人员发现在相同条件下不同碳纳米管的储氢容量有差异,不同温度和压力条件下同一种碳纳米管的储氢容量也不同。
碳纳米管在常温下的储氢能力不够理想,吸氢能力大多在1%(质量分数)以内,对碳纳米管进行活化处理可以在一定程度上改善碳纳米管的储氢性能。Elyassi等[15]通过化学催化气相沉积方法制备了多壁碳纳米管,发现在室温和中等压力条件下经氢氧化钾活化后的多壁碳纳米管的氢吸附能力从0.67%提高到了1.24%(质量分数),吸附能力的显著增强是由于氢氧化钾活化后存在的缺陷表面,通过这种方式,氢分子可以很容易地通过范德华力吸附在缺陷位点和多壁碳纳米管的内部空间中。此外,经氢氧化钾活化后的多壁碳纳米管拥有更高的比表面积、微孔体积以及更低的结晶率,这些因素似乎在提高氢吸附能力方面发挥了重要作用。
碳纳米管作为典型的碳质多孔材料,在低温和高压环境下能够表现出较高的储氢能力。Ye 等[16]经实验测得纯度为98%的单壁碳纳米管在80K、12MPa 的条件下,其储氢容量高达8.25%(质量分数)。此外,控制碳纳米管的直径也能够获得较大的储氢容量,对于直径约为2nm的CNT-H络合物,其氢化率接近100%,并且在室温下是稳定的,这意味着特定的碳纳米管可以通过形成可逆的C—H键来具有超过7%(质量分数)的储氢容量。然而,制备小纳米尺度的碳纳米管的工艺方法和过程较为复杂且成本偏高,在某些方面并不适合大规模推广。
由于CNT 的储氢机制尚不明确,它的吸氢率也一直备受争议,其在低温或高压条件下表现出较高的储氢容量,而在中等温度和压力条件下的储氢能力则大大降低。据此,Liu 等[17]在重新审视碳纳米管的储氢性能之后认为其12MPa 压力和室温下小于1.7%(质量分数)的储氢容量,可以成为其他储氢材料的有效添加剂以改变动力学性能,但已不再值得研究纯碳纳米管对于实际应用尤其是车载应用的氢吸附。
1.1.3 碳纳米纤维
碳纳米纤维(CNF)表面具有分子级的微孔,比表面积大,同时碳纳米纤维的层间距远大于H2分子的动力学直径,因此可以吸附大量氢气,且碳纳米纤维内部有中空管结构,可以像碳纳米管一样使得H2凝结在其中,进一步提高了储氢性能。
碳纳米纤维的储氢能力强烈依赖于结构。Zhu等[18]研究发现对碳纳米纤维的预处理会在很大程度上影响其吸附氢气的能力,高度石墨化的碳纳米纤维、合适的结晶状态、表面裸露的边缘以及氧化基团的缺失都有利于氢的吸附。在室温和10MPa 条件下,最大吸氢量可达4%(质量分数)。Jiménez等[19]通过实验和理论预测表明碳纳米纤维高吸氢能力的关键因素是存在大量尺寸分布较窄的微孔,吸附氢的最佳微孔径是氢分子直径的两倍(氢直径=0.29nm,最佳孔径=0.6~0.7nm)。
最近,Chen等[20]为了克服炭材料吸氢性能受弱物理吸附的阻碍,采用纳米多孔结构、掺杂杂原子和修饰金属纳米颗粒等策略来增加比表面积、储氢位点数量和金属催化活性。通过静电纺丝、水热处理和碳化工艺合成了锂氟共掺杂多孔碳纳米纤维(Li-F-PCNF),其中全氟磺酸聚合物不仅是提高氢吸附密度的氟源,还可以通过离子交换方法抑制了锂纳米颗粒在碳化过程中的团聚。此外,多孔碳骨架赋予Li NPs均匀的分布、有效的空间限制和更高的比表面积。结合氟和锂之间的高电负性间隙有利于氢分子的电子被多孔碳纳米纤维吸引,多种效应协同增强了氢的吸附能力,在0℃和10MPa 吸氢量可达2.4%(质量分数)。该策略代表了一种高度新颖的方法,用于合成的Li-F-PCNF 复合材料预计可以成为电化学和燃料电池领域的重要潜在材料。
根据目前的研究来看,碳纳米纤维对氢气的吸附在低温常压条件下与总微孔体积具有良好的相关性,具体来说与材料的孔隙率有很大关系,而在室温和高压条件下的吸氢量既取决于微孔体积,也取决于微孔尺寸分布。此外,目前碳纳米纤维的制备工艺还处在实验室阶段,其生产成本高,循环使用寿命短,距离工业推广还有很长的路要走。从应用的角度来看,碳纳米纤维和碳纳米管一样都不是很有前途的氢载体。
1.2 无机多孔储氢材料
沸石是众多无机多孔储氢材料(沸石、海泡石、硅藻土等)中作为储氢材料研究最多的,沸石分子筛价格低廉、技术成熟,有着规整的孔道和可观的内表面积,能够选择性吸附气体,是一种具有发展潜力的储氢材料。Li等[21]研究了碱金属阳离子(Li+、Na+、K+) 完全交换的低硅 铝X 型沸石(LSX)的储氢性能,结果表明低硅铝X 型沸石的吸氢量强烈依赖于阳离子半径和裸露部位阳离子的密度,而氧阴离子仅是次要的吸附中心。根据离子半径预测,H2与阳离子的相互作用能大小顺序为Li+>Na+>K+。Li-LSX 在298K 和10MPa 时的吸氢量仅为0.6%(质量分数)。文章进一步在氢解离催化剂和沸石之间建立了碳桥,以促进氢原子的析出,发现储氢量提高到了1.6%(质量分数)。
沸石的储氢量取决于微孔结构,而微孔结构又与合成沸石分子筛的阳离子以及骨架直接相关。沸石在低温下较大的氢容量是因为在低温下沸石的孔道直径接近氢分子的动力学直径,因此未来的发展方向应聚焦于确定沸石储氢的最佳孔道直径,并据此合成制备高储氢能力的沸石分子筛材料。
1.3 金属有机框架储氢材料
金属有机框架简称MOFs,是由有机配体和金属离子或团簇通过配位键自组装形成的具有分子内孔隙的有机-无机杂化材料。由于在金属有机框架中有金属原子裸露,氢与金属原子有较强的相互作用,提高了其储氢性能。MOFs 材料孔隙率高、孔结构可控、比表面积大、化学性质稳定、制备过程简单,是固态储氢材料的一个新热点。
Yaghi 教授课题组[22]报道了具有储氢功能并由有机酸和锌离子合成的MOFs 材料——MOF-5,首次报道了MOF-5 的氢存储能力,发现MOF-5 在77K、0.1MPa 条件下的质量储氢能力只有1.3%(质量分数),在298K、2MPa条件下质量储氢能力小于0.2%(质量分数)[23]。Sagara 等[24]研究得出了MOF-5 与氢气的作用机理,发现孔角处是MOF-5与氢气作用的最强位点。MOF-5 吸附性能跟氢气分子所接触的苯环数有关,与金属配位点无关。结合红外实验进一步说明在饱和配位的MOF 中决定吸附作用的主要是芳香配体,跟金属离子本身是没有必然联系。
MOF-5 常温下较低的储氢能力不尽人意,研究者通过同时改变MOF-5 的有机联合体和金属离子得到了与MOF-5 具有类似结构的多金属微孔有机配合物(MMOMs)[25-26],通过改变MOF-5 的有机联合体得到了具有网状结构的MOF-5 类似化合物(IRMOFs)[27],以期能够改善MOFs材料的储氢性能。Férey 等[25-26]制备了一系列金属羧酸盐类MMOMs 材料,研究发现以铬和铝为金属中心的MIL-53-Cr 和MIL-53-Al 在77K、1.5MPa 环境下的吸氢量分别可达3.1%和3.8%(质量分数),相比较MOF-5 而言储氢能力有了大幅提升。MOF-177是一种典型的IRMOFs 材料,Li 等[27]气体吸附实验表明其在298K 和10MPa 下氢吸附容量约为0.62%(质量分数),通过添加H2解离催化剂并使用桥联技术建立用于氢溢出的碳桥,在同样条件下 的可逆氢吸附能力提高至1.5%(质量分数)。Saha 等[28]通过改进工艺合成的MOF-177 在77K 和10MPa 环境条件下测得其拥有11.0%(质量分数)的超额吸附量和19.67%的绝对吸附量,而这在目前所有物理吸附剂中是最高的。
近期,Musyoka 等[29]将石墨烯材料中有利于储氢的性质转移到MOF 材料中,制备了锆基金属有机骨架(rGo/Zr-MOF)复合材料,掺入rGO 不会干扰MOF材料的结晶,且复合材料较原始Zr-MOF材料比表面积有所增加,储氢容量从1.4%增加到了1.8%(质量分数),这种增强可以归因于rGO片层与氢的相互作用以及类石墨烯材料的存在可能引起的孔空间扩展。
目前为止,人们已经研究了近百种MOF 的储氢性能,其中有3 种MOFs 在液氮下的储氢能力已经得到证实[30]:MOF-5(5.1%)、均苯三甲酸铜MOF 材料HKUST-1(3.6%)、MIL-53(4.3%)。经验和模拟实验都表明,MOFs 中氢气是以分子态被吸附的,金属氧簇是其优先吸附位点,但其吸附机理还有待于进一步研究。MOFs 材料的主要优点是它们的可逆和高速氢吸附过程,缺点是常温下储氢量过低,在极低的温度下才表现出良好的氢吸附能力。目前有关MOFs材料储氢的理论模型和计算都在不断发展之中,但是仍有许多问题需要攻克,相信这些问题的解决会将MOFs材料在工业化、实用化道路上推进一大步。
2 金属基储氢材料
储氢合金是指在一定温度和氢气压力下,能可逆地大量吸收、储存和释放氢气的金属间化合物。合金储氢机理简述就是:在一定的温度和压力下,金属和氢气接触会发生反应,生成金属氢化物来进行储氢,金属氢化物经加热又可以释放出氢,由此实现合金的循环储氢。
2.1 镁基储氢材料
镁由于其丰富的储量、较高的理论储氢量(7.6%)和体积储氢密度(110kg/m3H2)、低廉的成本价格,且单质镁可以在高温条件下与氢气反应生成MgH2,故MgH2/Mg 体系被认为是最有潜力的储氢体系之一。镁和氢之间的可逆反应可用式(1)来描述,其氢化反应示意图如图1。
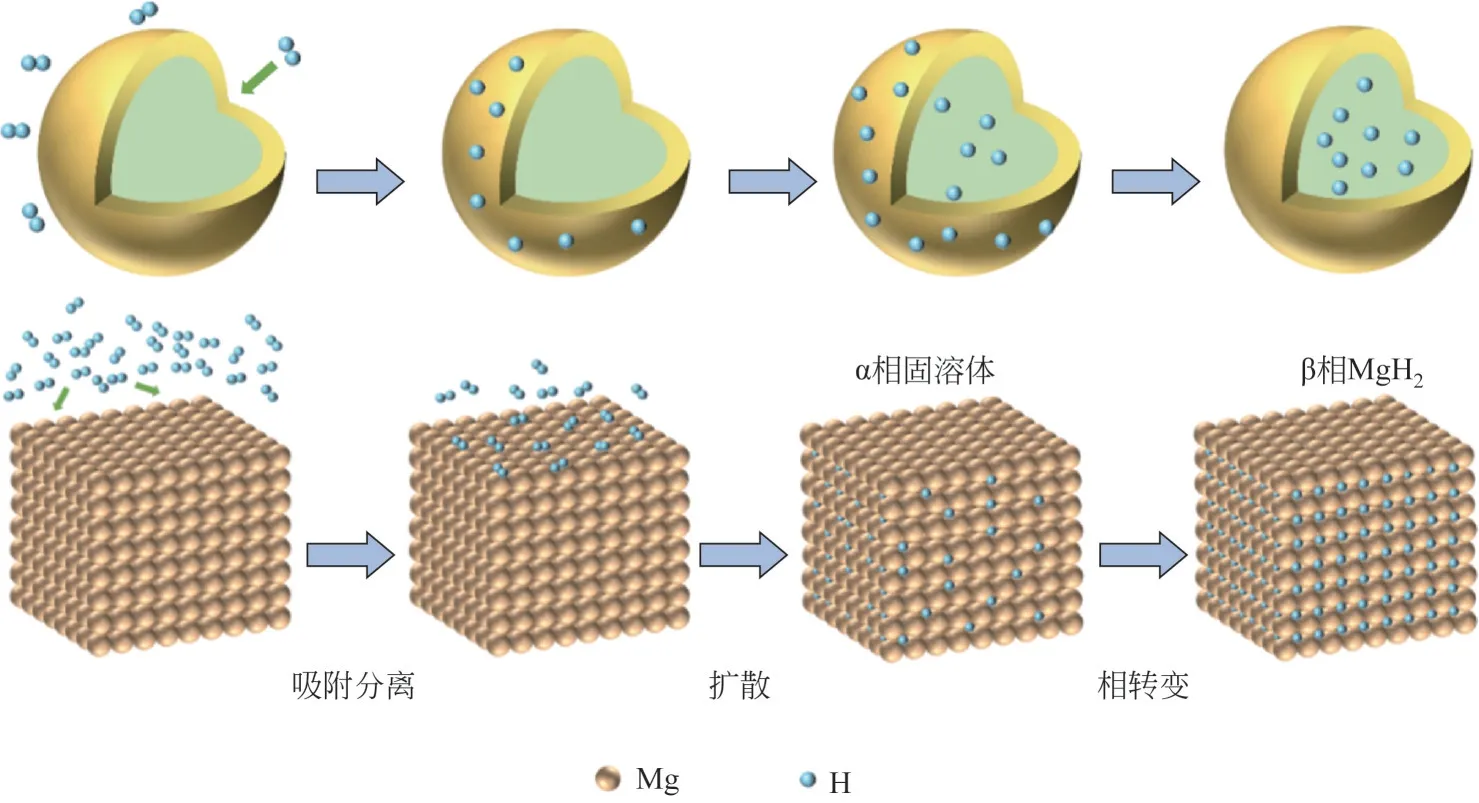
图1 金属(镁)基储氢材料的氢化反应过程释义图
尽管在过去的几十年中MgH2被认为是一种潜在的轻质低成本储氢材料,然而,由于其高热力学稳定性(ΔH=76kJ/mol) 和较差的动力学性质,MgH2只能在高温下(≥300℃)才有优异的吸附氢性能,且在吸放氢循环中,MgH2/Mg颗粒的团聚和长大导致循环稳定性差。因此,为了使MgH2在储氢应用中得到广泛应用,必须调整其热力学和动力学性能。镁基储氢材料的吸脱氢反应热力学和动力学与储氢性能关系示意如图2。目前在改善MgH2/Mg 体系储氢性能方面,多使用纳米化、合金化、添加催化剂、复合轻金属配位氢化物等方法。
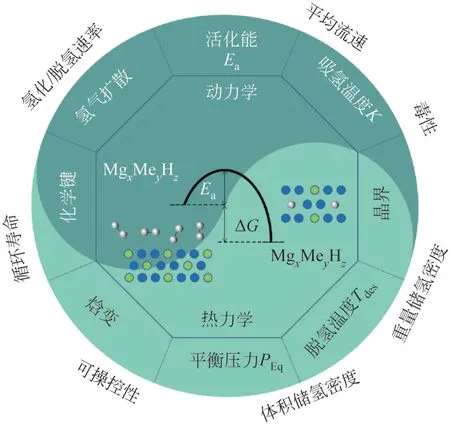
图2 镁基储氢材料的吸脱氢反应热力学和动力学与储氢性能关系示意
2.1.1 纳米化
镁基储氢材料的动力学性能在很大程度上取决于镁基材料的粒径,因为纳米化能够缩短氢的扩散和离解途径,增大材料表面自由能,当尺寸小于几纳米时甚至改变了热力学性能。Qu 等[31]计算出纳米晶Mg膜在25℃下的氢扩散系数为6.52×10-19m²/s,远高于粗晶Mg的1.1×10-20m²/s。将粒径减小到纳米级还可以大大增加比表面积,从而提供更多的成核位置和活性位点,促进氢沿着MgH2/Mg界面或氢化物内部边界和缺陷快速扩散。
高能球磨是一种广泛应用于制备储氢材料的纳米化技术,可以减小材料的颗粒和微晶尺寸,完美分散添加剂,并提供新鲜的和高活性的表面。研究人员的理想是制备可控且尺寸均匀的纳米镁基材料,然而高能球磨的缺点是不能精准控制材料的粒径分布在特定的范围内[32],而且易引入杂质,当球磨时间过长还易引起材料的团聚和长大,使得材料的循环稳定性减低。Varin 等[33]研究了粒径、晶粒尺寸和γ-MgH2相的存在对机械研磨生产的纳米晶MgH2的解吸性能的影响,测得的氢解吸起始温度和峰值解吸温度随着氢化物平均粒径的减小而开始缓慢下降,当粒径减小到某个临界阈值时,解吸温度开始下降得更快。在球磨10h 或更长时间的MgH2粉末的微观结构中,亚稳态的γ-MgH2氢化物与稳定的纳米晶β-MgH2共存。定量证据表明,精制粉末颗粒尺寸和存在于粉末颗粒内γ-MgH2相,是造成MgH2氢化物的氢解吸温度显著降低的原因。但是在多次吸放氢循环过程后,由于颗粒粗化导致纳米颗粒团聚,MgH2通过球磨所获得的改善效果会慢慢消失。
化学还原法是通过化学反应还原前体获得镁纳米晶体的一种方法。Liu等[34]用萘化锂化学还原二正丁基镁制备了纳米Mg颗粒。通过调节反应物比例,在一定程度上控制成核和生长过程,合成了8~350nm 不同尺寸的纳米镁。随着平均粒径的减小,高锂/萘比生成的纳米粒子能够在低温(<150℃)下吸氢,并具有更快的放氢动力学。最近,Zhang等[35]利用金属氢化物和氯化物在四氢呋喃中溶解度的巨大差异,通过超声辅助在没有支架或支撑的情况下成功获得了尺寸主要为4~5nm 的超细MgH2纳米颗粒。通过控制超声处理的时长可以获得所需纳米尺度的MgH2颗粒,而且暴露于超声波而产生的湍流和微流有助于反应物的碰撞,同时阻止过量的晶体生长,避免纳米粒子团聚。由于热力学不稳定和动力学障碍的减少,该MgH2纳米颗粒在30℃下的可逆储氢容量高达6.7%(质量分数),且在经过50次吸附氢循环后容量保持率仍高达99%。
气相沉积法是基于电弧产生高温使金属瞬间蒸发, 在氢气等气体作用下使金属原子经历蒸发、形核、长大、凝聚等一系列过程的一种制备纳米材料的方法,可以用来沉积大多数金属及合金材料。Saita等[36]高压化学气相沉积法合成了一种高纯度针状单晶纳米纤维MgH2,该法制备的MgH2通过纤维径向的反应路径短,纤维在氢化和脱氢后能够保持其形状,因此氢吸附率较高,可逆氢存储量能够达到与理论值相同的7.6%(质量分数)。Chen等[37]利用纳米限域通过气相沉积法将V 修饰的Mg 纳米颗粒限制在1nm 碳壳中,得到了Mg-V@C 体系复合材料,其吸放氢反应示意图如图3。由于碳壳超薄,Mg-V@C 纳米复合材料的负载量可以达到94%以上,最大储氢容量高达6.6%(质量分数),并且可以在200℃/300℃下实现超过5.2%(质量分数)的可逆加氢/脱氢循环,十个连续循环后氢气容量和动力学没有下降,加氢和脱氢的表面活化能分别降至41kJ/mol和67kJ/mol H2。通过分析V在不同温度下加氢和脱氢过程中的催化机理,推导出储氢性能的改善归因于碳壳的纳米限制效应导致的高比表面积、低扩散距离和大量成核位点,结合VH2/V2H纳米颗粒在吸放氢过程不同温度下作为氢泵的催化作用,二者的协同作用改善了材料的储氢性能。气相沉积法制备并改善镁基储氢材料显示了一个巨大的优势,即完全去除了气-固相反应中的活化处理和限速步骤,因为气态金属和氢分子之间的大碰撞频率可以快速合成金属氢化物,且合成的金属氢化物可以迅速沉积温度较低的基底上。与常规方法制备的镁基储氢材料相比,该方法制备的材料其储氢性能应该更为优异[36]。

图3 Mg-V@C加氢/脱氢过程示意图
2.1.2 合金化
将镁与过渡元素、部分主族元素形成合金可以有效地改善MgH2/Mg热力学性质,通过削弱氢和金属之间的结合强度来调整吸附和解吸性能。总的来说,合金化改性的原理是镁与其他元素形成热力学不稳定的合金相,储氢时反应路径发生改变,从而降低了吸放氢反应温度。尽管合金化可以一定程度降低储氢材料的反应焓变,改善动力学性能,但是相比于纯镁,镁基储氢合金的储氢量会不同程度地降低。
Mg-Ni是研究最多的镁基储氢合金,镍的加入对镁氢化物的形成起催化作用,加快了氢化反应速度。在常温常压下,MgNi2一般不发生吸氢反应,因此Mg-Ni 体系储氢合金主要是指Mg2Ni。Reilly等[38]于1968年就通过熔炼法制备了Mg-Ni合金并研究其氢化行为,发现Mg2Ni 在2MPa、300℃下很容易与H2反应生成其氢化物Mg2NiH4,该氢化物脱氢焓变约为64kJ/mol,较纯镁而言显著降低,然而其3.6%(质量分数)的氢容量与纯镁相比却有所减少。Mg2NiH4中的Ni-H 键相互作用弱于MgH2中的Mg—H 键是导致Mg2NiH4脱氢焓变较低的根本原因。Khan 等[39]通过球磨2MgH2-Ni(摩尔比)粉末并在高压下进行压缩,制备了平均尺寸20~50nm的纳米晶Mg2Ni。压缩2MgH2-Ni 颗粒获得的纳米晶Mg2Ni因Mg2NiH4的分解而具有单步氢吸收和脱附过程,因此显示出相当低的吸氢焓(约57.47kJ/mol)、脱氢焓(61.26kJ/mol),且在375℃时具有非常快的氢吸收动力学,在不到5min 的时间内吸收了约3.44%(质量分数)的氢气。研究者们为了进一步改善Mg-Ni系合金的储氢性能,常添加第三种元素部分取代Mg 或Ni。这些元素的添加可抑制Mg 在合金表面的氧化,从而提高Mg-Ni系储氢合金的循环寿命。Cao等[40]用Ag部分取代Ni制备了不同银含量的Mg85Ni15-xAgx合金,由于Ag 在共晶Mg2Ni 相中的固溶和Mg2NiH4的协同作用,通过调整溶解在共晶Mg2Ni 中的银含量来改变Mg2Ni 晶格参数这一手段,合金表现出优异的脱/吸氢动力学性能,275℃下3min 内储氢量为4.91%(质量分数),在60min内最大吸收量为5.84%(质量分数)。合金氢化物的脱氢活化能和起始脱氢温度与Mg85Ni15相比都显著下降。Xuan 等[41]通过掺杂Na 增加Mg2Ni 相间晶界面积和位错密度显著改善了合金的氢化性能。晶胞的膨胀和位错与Na的引入有关,且Ni催化剂的协同作用和合金表面存在的Na+离子的正电性质有助于提高H—金属键合强度,从而促进氢的吸附/解离。
除Mg-Ni体系外,Mg-Fe体系也是一类重要的镁基储氢合金。Mg-Fe体系里一种比较有吸引力的金属氢化物是Mg2FeH6,其质量分数和体积储氢密度分别高达5.5%和150kg/m3。但由于Mg-Fe 体系没有稳定的化合物,Mg2Fe 相很不稳定性,因此Mg2FeH6通常是MgH2与Fe 在高压氢气压力下高温反应得到。Zhang等[42]烧结通过氢等离子体-金属反应制备的Mg、Fe 纳米颗粒成功制备了纯纳米结构的Mg2FeH6,在350℃和约100Pa 压力下样品6min内快速解吸5.0%(质量分数)的氢气,较小的活化能和有利的热力学表明Mg2FeH6是一种有前途的移动应用储氢材料。
其他过渡金属也可以与Mg 构成Mg-TM 合金。Zolliker 等[43]首次合成Mg2CoH5氢化物,其脱氢和吸氢的焓变分别为86kJ/mol 和60kJ/mol,氢气容量约为4.5%(质量分数)。Kyoi 等[44]通过球磨法合成了三元Mg7TiHx氢化物,最大储氢容量为5.5%(质量分数),添加Ti 显著增强了氢吸附动力学。Zhong等[45]在Mg 中添加Al 发现在344℃和2MPa 的氢气压力下2000s 内可以吸收6%(质量分数)的氢气,且其中5.5%(质量分数)的氢气是在600s 内吸收完成,添加Al 后解吸活化能从纯Mg 的100kJ/mol降低到Mg90Al10合金的56kJ/mol。
除了过渡金属,添加稀土元素(La、Nd、Ce、Pr)制备的Mg-RE 也是一类具有代表性的储氢合金,稀土元素的添加显著改善了镁基合金的氢化和脱氢动力学。Ouyang 等[46]通过感应熔炼法合成了Mg3RE合金,合金在氢化后会生成相应稀土氢化物REHx,掺杂了稀土元素的镁基合金极易产生非晶结构,而非晶结构为氢的扩散提供了快速通道,由此导致了快速氢化/脱氢动力学。此外,有进一步的研究结果表明,Mg3RE 的结构在氢化/脱氢循环后保持不变并稳定存在,循环储氢能力也有了大幅提高。
2.1.3 添加催化剂
掺杂催化剂已被证明可以显著提高MgH2的动力学性能,而不会过度损失其储氢容量。催化剂的加入可以有效地降低反应能垒,从而加快吸放氢速率。
2.1.3.1 过渡金属
理论研究证实,具有特殊三维轨道态的过渡金属更倾向于与氢原子形成共价键,这意味着催化剂作为活性位点可以在其表面加速氢分子的解离和重新结合,增强MgH2的氢吸收/解吸动力学[47]。
近期,Lu等[48]使用电弧等离子体法结合固相法合成了核壳纳米结构的Mg@Pt 复合材料,Pt 的“溢出”效应修饰改善了Mg 超细颗粒的吸氢动力学,降低了氢解离能,高倍透射表明Mg 上的纳米Pt 颗粒在吸氢后先转变为H 稳定的Mg3Pt,然后生成MgH2。理论计算则表明H 稳定的Mg3Pt 是MgH2脱氢的“氢泵”,在脱氢后重新转变为Pt,可逆储氢能力大大提升。通过这种作用,氢化Mg@Pt 复合材料的脱氢动力学得到改善,初始脱氢温度下降。Mg@Pt 材料吸氢/解吸过程中的相形貌变化及催化机理如图4(a)。
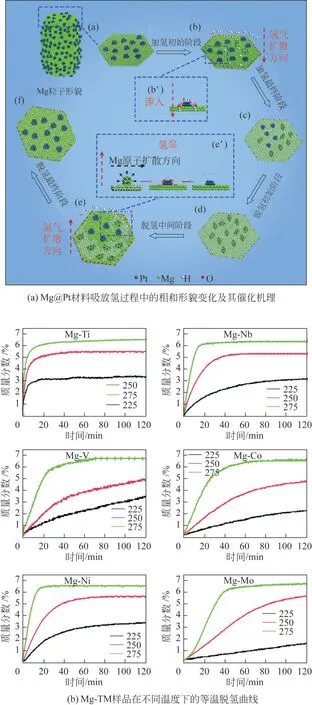
图4 镁基材料相形貌变化、催化机理及等温脱氢曲线 [48-49]
Cui 等[49]使用球磨结合化学还原法合成了一系列核壳结构的Mg-TM(TM=Ti、Nb、V、Co、Mo或Ni)复合材料。根据图4(b)所示样品在不同温度下的等温脱氢曲线结合DFT计算得出催化剂对脱氢的催化作用(高动力学速率,小表面活化能)的大小顺 序 为Mg-Ti>Mg-Nb>Mg-Ni>Mg-V>Mg-Co>Mg-Mo。掺Ti 样品在270℃和2MPa 下5min 内吸氢量达到5.5%(质量分数),在275℃下10min内脱氢量达到6.35%(质量分数)。该研究表明氢释放速率随着过渡金属电负性的增大而降低,且由于金属失去/获得电子的能力随着电负性的增加而降低,因此电负性最小的Ti 与Mg 构成的Mg-Ti 体系表现出最好的脱氢性能是合理的。此外,过渡金属Ti的原子大小与Mg相似,因此一些Mg原子很可能被Ti 取代,导致界面上的MgH2结构发生变形,而这种变形可能会导致存在更多有利于原子氢扩散的空位。不仅如此,这种变形可能会引起应变,从而产生更高的Mg-Ti能态,使得氢解吸的能垒变小。上述所有的影响因素都证明了Ti 是较为优异的过渡金属催化剂。
多元过渡金属也被研究者引入MgH2/Mg体系以改善储氢性能。Zhang等[50]制备了不同Ni/Cu摩尔比的NiCu固溶体并通过球磨将其掺杂到MgH2中以改变其吸氢性能,性能最为优异的在205.8℃时开始解吸氢气,在300℃下15min内可以释放5.14%(质量分数)的氢,在250℃下30min内能重新吸收4.37%(质量分数)的氢。理论计算表明,H和Ni/Cu之间的强相互作用导致MgH2的稳定性减弱,Mg—H 键的结合强度降低,脱氢性能增强。近期,Liu等[51]制备了一种均匀负载在竹节状碳纳米管上的Co/Pd双金属催化剂,在相对较低的温度下改善了MgH2的氢吸收和解吸性能。该文章首次提出并详细讨论了“双向催化剂”Co/Pd的特殊机理(图5)。在加氢过程中,元素Pd 对加速氢原子在Pd/Mg 界面的优先扩散起着主导作用,而在脱氢过程中,Mg2Co 和Mg2CoH5以及Mg-Pd 合金之间的相变成为关键因素,通过促进降低扩散势垒释放氢原子。此外,C均匀分布在Mg、Co、Pd外部,有效地防止了颗粒的团聚,具有优异的循环稳定性。复合材料在250℃下能够在10s内迅速吸收6.68% H2,即使在低至50℃的温度下,也能在100s 内迅速吸收1.91%H2,氢解吸活化也从178.00kJ/mol 降低至76.6kJ/mol。

图5 Co/Pd@B-CNTs“双向催化”机理示意图
从大量过渡金属催化剂改善MgH2储氢性能的研究中不难看出,过渡金属原子对Mg 吸放氢的影响与元素的电负性有一定关系。电负性较高的过渡金属单原子如V、Cr、Fe、Mn、Co、Nb、Cu 和Zn等可显著提升Mg的动力学性能,而电负性低于1.6的过渡金属单原子如Sc、La、Ce 和Ti 等由于元素较为活泼,易发生氧化和团聚现象,不能有效提升Mg 吸放氢的动力学性能。因此,在选择合适的过渡金属催化剂时,除了要考虑到吸放氢过程的活化能、焓变甚至是元素价格外,元素电负性也应该成为考量因素之一。
2.1.3.2 金属氧化物
金属氧化物在氢化过程中可原位获得金属基活性位点从而催化Mg 吸放氢反应,因此也可以用作改善MgH2储氢性能的催化剂。有课题组系统研究了金属氧化物TiO2和V2O3对MgH2储氢性能的影响[52-53],其中多孔炭结构负载的TiO2可以通过增加转移通道而加速氢在块状MgH2中的扩散,从而有助于进一步提高TiO2的催化活性。纳米V2O3@C 复合材料掺杂使得MgH2在275℃时,20min 内可以释放出大约6.4%(质量分数)的氢气。即使在室温条件下,脱氢样品也能再吸收氢气。V的存在在随后的加热脱氢/加氢过程中几乎保持不变。进一步的理论计算表明,V 的存在促进了Mg—H 键的断裂,导致V 催化的MgH2脱氢温度显著降低,动力学显著提升。
金属氧化物种类众多,其中Nb 氧化物是最有效的MgH2催化剂之一。Nb2O5可充当分散剂,细化MgH2颗粒;铌元素和氢元素相互作用能高,可以提高氢气的吸附性能;Nb2O5可以增强氢分子在Mg/MgH2表面的分裂和原子氢向Mg/MgH2晶格中的传输[54]。最近,Wang等[55]用石墨烯引导成核生长方法制备了N 掺杂的Nb2O5纳米棒使得初始脱氢温度降至170℃,有效氢容量为6.2%(质量分数)。该复合体系在室温下可实现高达6.0%(质量分数)的加氢,动力学屏障与无催化添加剂的MgH2对比降低40%。DFT 理论计算表明石墨烯负载的Nb-N-O 结构促进了Mg—H 和H—H 键长伸长、键强度减弱,结合实际催化物质NbN0.9O0.1与石墨烯之间存在的协同效应,是催化效果如此优异的主要原因。吸放氢性能曲线如图6。

图6 MgH2、MgH2掺杂 N-Nb2O5@C的吸放氢性能曲线
Zou课题组[56-58]在将稀土金属氧化物掺入MgH2/Mg 体系作为催化添加剂方面研究较为透彻。课题组通过电弧等离子法制备了一系列核壳结构的镁基稀土储氢纳米复合材料,并对其物相组成、微观结构和吸氢性能进行了研究。吸放氢性能最为优异的Mg-La2O3纳米复合材料的吸氢活化能降低至41.98kJ/mol H2,储氢量达到6.635%(质量分数),在250℃下15min 内吸氢4.81%(质量分数)。由于稀土金属氧化物的氢扩散通道作用,这些复合材料吸氢动力学都有较大提升。
有研究发现多元金属氧化物也能改善MgH2/Mg体系的储氢性能。Xian 等[59]将超薄二维TiNb2O7纳米片掺入MgH2使得放氢温度降低至178℃,最高可释放出7.0%(质量分数)的H2,在150℃和5MPa H2压力下,脱氢产物在15min内几乎完全氢化。循环稳定性高,30 次循环后容量保持率为96%。多孔高比表面积、低结晶度TiNb2O7相结构在研磨后有少量转化为TiO 和NbO2,这两种氧化物对MgH2也有一定的催化作用。DFT 计算表明MgH2和TiNb2O7之间存在强烈的电荷转移,改变了Mg 和H的电荷分布,结合Nb 和Ti 复合氧化物之间较强的协同效应,大大削弱了Mg—H 键,导致表面活化能和吸放氢动力学势垒显著降低。CoFe2O4纳米粒子在催化MgH2储氢性能方面也有明显效果。MgH2-CoFe2O4开始脱附温度降低至160℃,大约可释放6.32%(质量分数)的氢气,反应产物Co3Fe7、MgO和Co是影响MgH2储氢性能的主要相[60]。
2.1.3.3 其他金属化合物
除却过渡金属和金属氧化物外,金属和卤族元素形成的金属氟化物、硫化物等以及碳氮化物(MXenes)也可用作催化剂以改善镁基储氢材料的动力学,其催化性能受到研究者们的广泛研究。
金属氟化物仅具有催化作用,不会改变形成焓,但会显著增加吸收/解吸动力学性能。这种效应可能是因为F阴离子的存在削弱了Mg—H键,导致了MgF2的形成并提供了一个富电子中心来捕获过渡金属原子。此外,F阴离子还可以调整过渡金属原子的电子结构,以影响其解离/复吸的活性。Lin等[61]发现添加CeF4显著降低了MgH2的氢解吸温度和表观活化能,氢解吸温度和表面活化能都有大幅下降,CeF4/MgH2界面处形成的Ce-F-Mg 物质以及由高价Ce 阳离子诱导的电子转移是改善效果优异的根本原因。Fu 等[62]制备了三元过渡硫化物MgH2-FeNi2S4,在吸放氢过程中原位生成Mg2NiH4/Mg2Ni 起到“氢泵”的作用,协同MgS、Fe 的催化作用改善了MgH2/Mg 的储氢性能。复合材料300℃下1h内吸氢6.09%(质量分数),3MPa氢气压力和100℃下吸氢4.02%(质量分数),脱氢活化能降低至65.5kJ/mol。
MXenes 是其他金属化合物储氢材料中一种新兴的储氢体系。由于二维MXenes的部分金属性质,它为材料提供了一个很好的吸附分子氢的机会。目前已有大量关于二维MXene储氢的研究报道。Zhu等[63]报道了Ti修饰的3D Ti3C2Mxene对MgH2储氢性能的改善。复合材料MgH2@Ti-MX 初始脱氢温度显著下降,脱氢速率较纯MgH2相比大大提高,在没有明显的动力学损失的情况下能保持较高可逆储氢容量以及良好的循环稳定性。纳米约束效应和镁与钛的多相界面,特别是原位生成的催化剂TiH2,是材料具有优异吸氢性能的主要原因。Huang 等[64]将分散在单层MXene 上由MOF 衍生的Ni 纳米颗粒作为催化剂引入MgH2,脱氢活化能由145.08kJ/mol降至54.97kJ/mol,复合材料的吸放氢速率以及循环稳定性大大提升。DFT 计算揭示原位形成的Ti0降低了Mg2Ni 和Mg2NiH4之间相互转变的形成能,以致增强了所谓的“氢泵效应”。这种“氢泵效应”以及MXene 对Ni/Mg2Ni/Mg2NiH4的纳米限制构成的协同作用改善了MgH2的动力学和循环稳定性。
2.1.3.4 非金属添加剂
在非金属添加剂中,碳基材料是最常用的材料,并且碳材料本身在MgH2/Mg中可以起到防止颗粒团聚的作用。目前碳质添加剂多作为载体来负载MgH2或其他催化物质,复合催化剂结合了两者的优点,对MgH2/Mg体系的储氢性能有显著提升。
Wu等[65]研究了镁/碳体系和镁/非碳体系的储氢性能,发现所有碳添加剂在提高镁的氢容量和脱氢/氢化动力学方面都比氮化硼纳米管或石棉等非碳添加剂更具有优势。在300℃下,所有Mg/C复合材料的氢容量在10min 内均达到6.2%(质量分数)以上。Gu 等[66]通过原位反应和高温还原自组装制备了双活性金属Ni 和Al 掺杂的石墨烯复合材料,此类复合材料的最大吸氢量在200℃时可达5.7%(质量分数),在100℃左右的脱氢温度下脱氢效率高达96%~97%。
2.1.4 复合轻金属配位氢化物
轻金属配位氢化物由于都是由轻质元素组成,其理论储氢容量要比其他传统的固体储氢合金高很多,因此将轻金属配位氢化物与MgH2构建复合材料可以显著增加体系的储氢容量。MgH2-LiBH4复合体系是活性氢化复合物反应氢化体系的代表,通过协同作用改善了放氢动力学性能,而储氢容量不会大量衰减。Pinkerton 等[67]研究了MgH2-LiBH4的储氢机理,脱氢温度和脱氢焓变较纯LiBH4和MgH2均显著降低,且反应速率较快,在400℃左右可逆吸放氢容量最高能达到10%(质量分数)。该复合体系在放氢的同时会生成LiH 和MgB2,而MgB2正是体系可逆储氢的关键物质。
最近,Lin等[68]将MgH2与LiBH4和Li3AlH6复合,实现了超8.0%(质量分数)的高可逆氢容量,该金属氢化物在276℃开始释放氢气,然后在360℃完全脱氢。脱氢后的MgH2+LiBH4/Li3AlH6复合材料在300℃以下可以充分再吸收氢气,具有优异的循环稳定性。吸放氢行为的显著改善可归因于脱氢产物降低了脱氢活化能和增加了氢扩散速率。同时,LiBH4和Li3AlH6可以使MgH2失稳,这在热力学方面显著降低了脱氢焓变。特别是脱氢产物在加氢后能够可逆地转变为MgH2、Li3AlH6和LiBH4,有助于保持高循环容量。
遗憾的是,即使复合轻金属配位氢化物在一定程度上改善了热力学性能,但动力学性能仍然不能够应用于实际,因此在这种情况下掺杂金属添加剂或纳米化来进一步改善动力学过程是有必要的。Fan等[69]将非晶态TiB2和NbB2纳米粒子作为LiBH4-MgH2体系的催化剂发现,非晶态纳米TiB2掺杂的复合体系材料在400℃下仅需6min即可释放9%(质量分数)的氢气。非晶态TiB2稳定性极佳,在球磨过程和随后的脱氢/加氢循环中能够保持稳定,并作为催化活性物质促进2LiBH4-MgH2体系的脱氢和吸氢反应。
2.1.5 镁基固态储氢系统难点与应用
近年来,国内外在固态储氢应用和新型储氢材料的研发方面取得了诸多进展(表1)。上海交通大学带头研制出中国首个70kg 级Mg基固态储氢装置,并开发了“氢行者”一体化氢能源系统,首次实现了 Mg基储氢合金体系的示范化应用。澳大利亚Lavo 公司基于金属氢化物设计出了Lavo 氢能储存系统,该系统关键的氢存储步骤通过将氢与固体材料(如镁纳米粒子)结合形成氢键金属氢化物来实现,目前已将一种包含镁和其他常见材料的吸氢金属合金成功地应用于LAVO™氢电池储能系统的储氢模块。

表1 镁基储氢材料的吸放氢性能对比
根据目前报道不难发现镁基储氢系统的工程产业化仍处起步阶段,许多瓶颈问题亟待解决。首先,镁基储氢的综合性能还不能满足目前最火热的车载储氢的要求。一些成熟体系的镁基储氢材料重量储氢率仍然偏低,吸放氢速率较慢,循环性能不达标,距离规模应用仍有一段距离。其次,镁基储氢装置既是一个反应器,也是一个热交换器,在进行吸放氢反应的同时,伴随着热量的变化。反应过程中产生的热量向外部传递,所需要的热量也要由外部导入,热量的传递很大程度上决定了吸放氢反应的速度。技术层面的不成熟导致的体积膨胀问题、传热问题、氢气流动问题还没有解决。还有就是成本偏高,固态储氢多处于示范应用、实验室或中试阶段,制造批量小,成品率偏低,承压容器、阀门管道等配件价格高,导致固态储氢系统的成本偏高。最重要的一点是目前对固态储氢系统耦合集成其他应用系统的设计不完善,目前的优化设计模型大多未考虑吸放氢过程的物性参数动态变化的情况,模拟结果难以直接用于大容量镁基固态储氢系统的优化设计。
本文作者团队最早在1993 年采用粉末冶金法生产镁镍合金,方法简单易行,制备的Mg2Ni活性高,组分均匀。此后研究转向将催化剂掺入MgH2构建复合材料体系以改善储氢性能,揭示了石墨烯基催化材料对MgH2体系制氢过程中氢的吸附/解离、结构演变规律及其制氢动力学机制。发现富缺陷、多活性位点及纳米尺寸效应等协同催化是促进MgH2复合体系在较温和的条件下实现优异制氢动力学性能的内在本质。本文作者团队还致力于电解水制氢体系研究,以低Ir、低Pt为原材料的电解水催化剂的研发及低能耗、长程稳定的电解水制氢为目标,研发新型低成本电极材料,降低槽压,提升能量效率,实现长时间稳定运行。在现阶段,提供安全、便捷及规模化氢气供应体系,开发新型镁基复合储氢材料及镁基固态储氢系统,设计耦合镁基储氢系统与终端应用,制氢-储氢-用氢一体站集成化设计,是本文作者团队的重点研究发展方向。
2.2 钛基储氢材料
钛及其合金是一种很有潜力的储氢材料,但缺点之一是容易生成一层致密的TiO2膜,因而需要较高的活化温度和气体压强。此外,钛基合金还容易受到水和氧气等杂质毒化,且在吸放氢过程中存在严重的滞后现象。因此,需要改善合金的活化性能,扩大其适用范围,使之具备更好的实用价值.
Ti-Fe 合金储氢容量为1.8%(质量分数),是一种性能优良、成本低廉的贮氢材料。其活化困难、抗毒化能力差等缺点可以采用Mn、Co、La等元素部分取代加以改善。Yuan 等[95]研究了La 替代Ti 对Ti-Fe 型Ti-Fe-Mn 基合金显微组织、储氢动力学和热力学的影响。研究表明La 没有改变合金的相组成,La 的部分取代促进合金中微缺陷(位错、晶界)的形成,从而促进氢扩散,储氢动力学性能得到改善。除了Ti-Fe合金,其他钛基合金材料均是AB2型Laves 相。Ti-V 合金是钛基储氢材料的潜在候选者。Balcerzak[96]首次使用机械合金化方法获得BCC 固溶体相,通过不同化学成分和生产方法研究了Ti-V 合金的加氢和脱氢性能。Ti1.5V0.5合金在室温下表现出较高的储氢能力,达到约3.67%(质量分数)。结构测试表明储氢性能与晶格参数直接相关,由于富Ti 合金的晶格参数大于富V 合金,故富Ti 合金的储氢能力大于富V 合金,但是富V 合金的氢化物又比富含 Ti 的氢化物稳定性低。需要注意的是,V的价格是Ti的8倍,选择合适的钛基合金储氢材料还需要多方面考虑。
近年来对于多元Ti基合金储氢材料的研究开发也十分活跃。Chen等[97]研究了Ti-V-Mn 合金的晶体结构与储氢性能,发现Ti-V-Mn 合金中BCC 相和C14Laves 相的比例可以通过V 含量来调节。其中V40Ti23Mn37具有最好的储氢性能,298K时其最大吸氢能力为3.5%(质量分数),解离焓为34.88kJ/mol。Zhou等[98]开发了高密度Ti-Zr-Mn-Cr-V基储氢合金并系统研究了Zr替代Ti和Cr替代Mn对显微组织和储氢性能的影响。Zr 取代Ti 储氢能力逐渐增加,而平台压力急剧下降;Cr取代Mn脱氢/加氢平衡压滞后显著改善,而平台压和储氢能力小幅下降。开发的合金中性能最优异的合金Ti0.95Zr0.05Mn0.9Cr0.9V0.2质量储氢密度为1.78%(质量分数),体积储氢密度为118.33kg/m3。循环100 次后仍以C14相结构的形式存在,脱氢/加氢和储氢的平台压力容量几乎保持恒定,具有出色的稳定性。
2.3 稀土基储氢材料
稀土储氢合金的动力学性能和稳定性较好且储氢容量较高,在镍氢电池上的应用取得巨大成功后,稀土成为固定式氢燃料储氢载体重要选择方案之一,极具发展前景和应用潜力。AB5型的LaNi5是稀土基储氢合金的代表,也是应用前景最好的一类。LaNi5作为储氢材料的优点有容易活化、吸放氢速度快、滞后小、平衡压适中、抗毒化能力强;其缺点是稳定性不足、多次循环后容易退化、粉化现象严重、价格昂贵导致经济性较差。
为了对LaNi5的储氢性能进行改善,达到特定应用所需的吸附和解吸条件,通常使用部分元素取代的方法,使用第三组分元素如Fe、Al、Cu、Mn、Co 等部分取代Ni,可以降低氢平衡压力。Zarynow等[99]早在1991 就测定了LaNi4.5T0.5氢化物(T=Fe、Co和Cu)的动力学,脱附速率大小顺序为Ni>Cu>Co>Fe,由于平台压力也以相同的顺序下降,因此得出结论:对于具有相似的结晶和电子性质的合金,反应速率与氢化物的稳定性成反比。研究人员用Al 取代Ni,发现随着铝含量的增加,合金的晶胞体积显著增大,从而降低了脱附平台压力,然而铝掺杂的LaNi5合金的储氢容量却有所下降[100-101]。据此Zhao等[102]对Al掺杂的LaNi5合金进行氟化和钯沉积处理,改变了Al掺杂的LaNi5合金储氢容量下降的现象。不仅如此,合金的储氢容量反而有所提升,而且沉积钯的氟化合金还提高了对氧化性气体和杂质气体的抵抗力,使得抗毒化能力得到增强。相对而言,Co掺杂的AB5型合金的不利影响相对小于Al 掺杂。最近,Zhu 等[103]和Liu 等[104]研究了LaNi5-xCox的循环稳定性和储氢性能。研究表明,Co 替代Ni 后形成的合金具有较好的晶体结构、较大的颗粒尺寸、较长的循环寿命和较高的循环稳定性,储氢容量没有下降,且经过1000 次循环后,LaNi4.5Co0.5的循环稳定性优于对比样LaNi5。研究者也探索了混合稀土元素如Pr、Ce、Gd、Sm 部分取代La对LaNi5储氢性能的影响。其他稀土元素替代La 减小了晶胞尺寸,使平衡压力升高,生成焓降低,从而促进储氢量的增加。
LaNi5储氢合金成本较高,给工业应用带来了困难,所以出于经济性考虑研究者渐渐将目光转向相对廉价的MmNi5储氢合金。在富La 的MmNi5系合金中,MmNi5合金[( La+ Nd) ≥70%]不仅保持了LaNi5合金的优良特性,而且储氢量和动力学特性都优于LaNi5,相较而言MmNi5合金更具有实用价值[105]。
2.4 其他金属基储氢材料
在众多金属材料里,锆系合金和钒基合金在固体储氢材料领域皆有一定的应用。锆系合金可用通式AB2表示,主要包括Zr-Mn 体系、Zr-V 体系、Zr-Cr 体系,结构多为C14、C15Laves 相,具有反应速度快、吸氢量大、循环寿命长和没有滞后效应等优点;缺点是合金成本高、稳定性较差且较难活化。锆基合金储氢材料虽然初期活化较困难、高速放电效果差,成本高。但由于其较为出色的储氢量和循环寿命长的优势,有望成为下一代Ni-MH 电池的高容量负极材料。
钒金属氢化物储氢容量可达3.8%(质量分数),更重要的是,其可以在常温常压下进行可逆吸放氢循环,这使得钒系固溶体成为一种较为火热的储氢材料。早前有研究发现,钒基合金储氢循环的稳定性与V的含量有一定关系,钒含量越高,循环稳定性越有优势,而有效储氢容量基本保持不变。但是V 昂贵的价格会使得合金成本大大增加,仅适用于实验室阶段,不适合大范围实际应用。
3 配位氢化物储氢材料
配位氢化物储氢材料的质量储氢密度和体积储氢密度在现有固态储氢材料中是最高的,起初被认为是一种单向储氢材料,热力学稳定、动力学缓慢、可逆储氢性能极差,并不是研究者的首选。一直到1997 年,Bogdanović 等[106]研究发现添加Ti 可以使得NaAlH4在中等温度压力条件下实现吸放氢可逆循环,具有潜在实用价值和应用前景,由此带动了其他配位氢化物储氢体系的研究和开发。
3.1 铝氢化物
3.1.1 NaAlH4储氢体系
NaAlH4是迄今为止金属铝氢化物中研究最为充分的材料,也是仅有的可商业化生产的几种金属铝氢化物之一。多步反应是配位氢化物吸放氢反应的显著特点,且每一步反应条件不同,这为配位氢化物增加了难度。据此需要对NaAlH4储氢体系吸放氢性能进行改善才能发挥出它巨大的应用潜力,添加催化剂有一定的改善作用,但遗憾的是目前具体的催化机理尚不清楚,仍需进一步研究。
Ti 基类催化剂在众多添加剂中表现出最好的催化效果,在提高NaAlH4的吸放氢动力学性能与热力学性能的同时,还可以改善其可逆循环性能。Anton[107]的研究揭示了脱氢速率与阳离子半径之间的关系,催化剂最佳阳离子半径比介于Al(Ⅲ)和Na(Ⅰ)之间,而Ti离子半径刚好介于二者之间,这就是为什么Ti基添加剂催化效果最好的原因之一。Li等[108]对商用NaAlH4掺杂高效TiN催化剂的储氢性能以及可逆性进行了系统研究。TiN-NaAlH4体系的起始脱氢温度和多步脱氢活化能均大幅下降。球磨和掺杂可能破坏了NaAlH4的稳定性,导致NaAlH4的脱氢动力学增强,在190℃下,吸附氢能力可达5.44%(质量分数)。最近,Zhang等[109]将尺寸为2~4nm 的非晶态碳负载的TiB2纳米粒子用作NaAlH4储氢的高活性催化剂,稳定的催化性能与原位生成的Ti-Al 合金密切相关,有利于H—H 键和Al—H键的解离和复合。另外碳结构可能通过产生新的氢转变位,对提高吸放氢速率起到重要作用。TiB2@C 的加入使得NaAlH4的起始脱氢温度降低至75℃,比原始NaAlH4相比降低了100℃。在140℃下,60min内可脱出5.04%(质量分数)的实际氢容量,体系可逆循环性能较为优异,经过20次循环后,氢容量几乎没有变化,远远高于卤化钛或二氧化钛催化的结构。
3.1.2 LiAlH4储氢体系
LiAlH4体系是配位铝氢化物另一个重要,其理论储氢容量高达10.5%(质量分数)。LiAlH4的放氢反应可以分为三步,其第一步反应是在低于LiAlH4熔点的情况下进行的,故该步反应为放热反应,因而阻碍了反应产物加氢过程,且第三步反应温度较高。这些因素极大限制了LiAlH4的实际应用。
催化剂掺杂是改性LiAlH4较为常用的方法,多价态过渡金属催化剂如Ni、Ti、Co、Fe 、Mn、V和 Nb 是研究最多的。Li 等[110]将TiN 用作催化剂掺杂进LiAlH4并研究了储氢性能。TiN 催化剂有效降低了LiAlH4的脱氢反应活化能和脱氢温度,提高了脱氢动力学。脱氢起始温度从151℃降至90℃,最大放氢容量能够达到7.1%(质量分数)。TiN 掺杂量越大,脱氢温度越低,但相应的脱氢容量也会跟着下降。Xia等[111]将二维Ti3C2作为催化添加剂引入LiAlH4。结果表明Ti3C2可以显著提高LiAlH4的脱氢性能。结合DFT计算发现由于Al-H团簇的去杂化,二维Ti3C2可以显著降低LiAlH4单元中Al—H键的解吸能垒,加速Al—H键的断裂和界面电荷转移。有研究者发现将ScCl3掺入LiAlH4也能够起到改善效果,其催化机理在于部分LiAlH4在研磨过程中与ScCl3反应生成的ScH2,ScH2可以作为促进LiAlH4脱氢过程的催化剂。
此外,金属复合氧化物也被用作催化添加剂来改善LiAlH4储氢性能。Sazelee等[112]研究了BaFe12O19对LiAlH4脱氢性能的影响,结果表明,原位形成的Fe、LiFeO2和无定形Ba 或含Ba 物质可以作为活性物质,因为它们具有高的表面活化性并且在LiAlH4表面上有较大的成核位点,这是储氢能力得到改善的根本原因。Wei等[113]通过引入钛基双金属氧化物(NiTiO3和CoTiO3)和六方氮化硼(h-BN)来改善LiAlH4的脱氢过程。LiAlH4掺杂NiTiO3@h-BN 最佳样品的多步氢释放温度和放氢反应的活化能都远低于无添加剂样品。180℃下25min内释放6.21%(质量分数)的氢气,300℃下的释放氢气总量高达7.11%(质量分数)。进一步的DFT计算表明,原位形成的AlNi3和NiTi可以降低LiAlH4单元的Al—H键的解吸能垒,并通过界面电荷转移和Al-H 团簇的去杂化加速Al—H键的破坏。不仅如此,计算还表明NiTi 可以增强H2的吸附和分解,促进H2分子在储氢过程中的活化。
目前对LiAlH4进行改性的方式多是掺杂催化添加剂,催化添加剂的引入较为有效地降低了体系的放氢温度且同时改善了放氢动力学性能,但其具体作用机制尚待进一步查明。较差的可逆性是制约LiAlH4体系实际应用的最大障碍,目前的研究极少有报道LiAlH4体系的可逆吸放氢行为,且已有的报道中氢气容量较低,完全达不到实际应用的标准,所以对于可逆吸放氢的探索是今后研究的重中之重。
3.1.3 其他储氢体系
在铝氢化物体系中,还有一些研究较少的材料有KAlH4和Mg(AlH4)2。相比于其他配位铝氢化物,KAlH4较低的理论储氢容量不占据任何优势,但是能够在无任何催化剂的情况下进行可逆吸放氢,因此研究如何在较低反应温度下实现无催化剂可逆储氢应是KAlH4用作储氢材料未来发展的重点。而Mg(AlH4)2虽然理论储氢容量较高,能够达到9.3%(质量分数)的储氢容量。但目前大量研究都证实其可能不适合作为可逆储氢介质,因此想要将Mg(AlH4)2应用于实际还需要更加深入的研究工作,开发新的合成技术,探索新的手段来实现可逆储氢。
3.2 硼氢化物
3.2.1 LiBH4储氢体系
配位硼氢化物理论储氢量普遍较高,LiBH4更是高达18.5%(质量分数)。理论上LiBH4受热分解放氢并伴随LiH 和B 的生成,分解产物LiH 的放氢温度过高,一般不作储氢考虑。在金属配位硼氢化物中,H原子主要以共价键的方式与B结合,所形成的配位体进而与金属阳离子以离子键形式结合。由于组成元素原子间的强键合作用及高取向性, 金属硼氢化物吸放氢反应通常面临着严重的热力学和动力学问题。从已有研究来看,纯LiBH4吸放氢温度较高,放氢速度缓慢,可逆性较差,难以满足工业生产中的应用要求。如何在降低吸放氢温度、提高吸放氢动力学的同时改善硼氢化物的可逆储氢性能是所有研究者要面对的问题。
过渡金属催化剂可有效降低金属硼氢化物的活化能垒,显著改善体系的动力学性能和可逆储氢能力。Xu 等[114]研究了石墨烯负载的Pd 催化剂对LiBH4可逆储氢性能的影响。由于石墨烯和Pd粒子的共同作用,即使在极低的催化剂含量下,Pd-G催化剂机械球磨也能显著提高LiBH4的脱氢性能和动力学。掺杂Pd-G 催化剂的LiBH4的脱氢反应焓变从纯LiBH4的74kJ/mol 降低至43kJ/mol,在30 次吸放氢循环后储氢容量为6.6%(质量分数),由此可见使用Pd-G 催化剂对LiBH4进行去稳定化是LiBH4催化吸放氢的一种有前景的方法。金属氧化物也是高效催化剂种类之一。Li等[115]在LiBH4体系中原位引入高活性TiO,复合体系的脱氢起始温度和峰值脱氢温度相比纯LiBH4都有所下降,储氢容量和循环储氢能力都有提升,最高储氢容量可达9%(质量分数),循环10 次后储氢容量为6.7%(质量分数),保持率为74.4%。TiO与LiBH4反应生成的Li3BO3和TiH2,对LiBH4的脱氢和加氢具有高活性催化作用,原位引入导致表观脱氢活化能明显降低,也明显降低了高热稳定性中间体Li2B12H12的表观活化能。此外,原位引入TiO后,随着元素的均匀分散,体系的粒径减小,循环过程中的聚集减少。这些因素都有助于显著改善反应动力学和循环稳定性。
许多卤化物也可以与LiBH4反应以改善从LiBH4的氢释放热力学和动力学。Tu 等[116]研究了NbCl5和六方氮化硼(h-BN)的协同效应,共掺杂的催化效果比仅掺杂 NbCl5或h-BN 要好得多。原位形成的NbH@h-BN 是异相成核位点,不仅减少了LiBH4的活化能势垒,而且缩短了LiBH4分解的固液相之边界移动距离,导致脱氢温度降至377℃,在400℃下10min 释放的氢气量为10.78%(质量分数),明显高于NbCl5或h-BN单独催化的放氢量。
就储氢的化学机理而言,通过纳米化来调控材料颗粒尺寸和结构亦是一种有效改善硼氢化物储氢性能的方法。最近,Ye 等[117]通过原位固相反应在LiBH4和Al之间建立石墨烯包裹的失稳反应,从而提高了LiBH4的储氢能力。由于LiBH4和Al 的粒径均显著减小到纳米级并紧密接触,仅需36min即可实现容量为4.49%(质量分数)的完全脱氢。更重要的是,由于石墨烯的空间限制作用,经过5次加氢和脱氢循环后,可很好地保持4.49%(质量分数)的可逆储氢量。Zhang等[118]采用单锅溶剂热法成功地合成了具有多孔结构的纳米级自支撑LiBH4,结果表明分级多孔纳米LiBH4的脱氢发生在熔融之前。由于颗粒尺寸和多孔结构大大减小,有效地防止了起泡,从而有助于氢气循环。纳米LiBH4在大约190℃开始脱氢,在350℃下300min内脱氢约为11.3%,脱氢后的纳米LiBH4在400℃,16.5MPa H2下总吸氢量达到12.1%(质量分数),表现出优异的可逆储氢性能。材料合成反应示意图如图7。
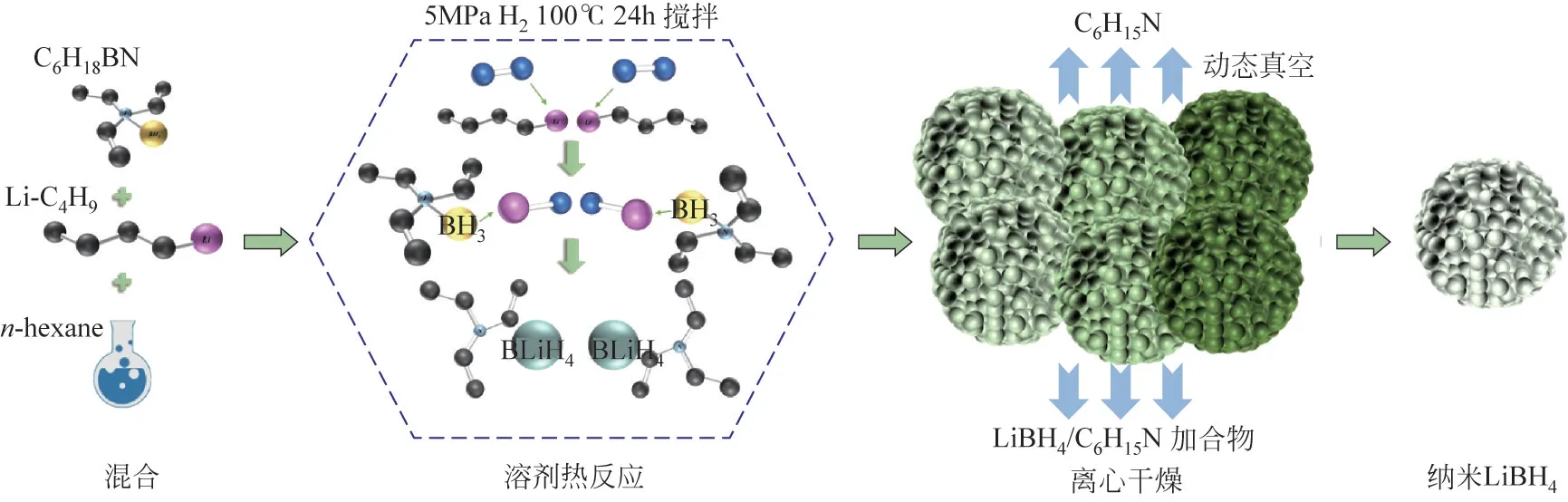
图7 纳米LiBH4合成及反应示意图
3.2.2 NaBH4储氢体系
NaBH4热分解温度超过500℃,正因为其热分解温度过高,热分解析氢效率偏低且反应条件苛刻,目前对于其热分解反应研究较少,研究多集中在它的水解放氢,但其水解反应副产物偏硼酸钠水合物不溶于水并伴随有热量的释放,抑制了放氢反应的继续进行,进而降低了NaBH4的放氢量。因此,通过催化剂促进NaBH4的水解放氢反应是一个常用的改进策略。Zhang等[119]成功 地合成了一种由碳纳米球负载的超细双金属Pt-Co纳米颗粒高效催化剂,用于从 NaBH4水解中析出氢。在制备过程中通过调节溶剂来调节Pt-Co纳米颗粒在碳纳米球表面上的生长,所制备的 CNSs@Pt-Co催化剂在动力学和热力学测试以及催化性能测试中表现出极高的催化活性值,即使经过5个循环,制氢转化率仍为100%。Delmas 等[120]和Netskina 等[121]研究了Co-B催化剂对NaBH4水解制氢反应的催化效果。二者都认为催化核心粒子表面的一层氧化膜在提高反应产氢速率方面起到重要作用。Delmas 的研究表明由于氧化层还原放热和水解反应的协同效应,再加上硼化钴催化剂的高效率,在室温下能观察到一个放氢增强区,NaBH4和H2O迅速发生反应放出H2,产氢量达到8.7%(质量分数)H2。Netskina的研究表明催化剂前体Co3O4的一个显著特征是不完全还原性,这一特性导致活性颗粒稳定在未还原的氧化物表面上。在基于NaBH4的颗粒中使用这种催化剂导致氢化物介质中氧化钴的额外还原,并形成额外的活性硼化钴相,这就是氢气产生速率增加的原因。
不得不提的是,NaBH4水解析氢反应是不可逆的,且NaBH4再生成本高限制了其大规模应用。据此Ouyang 等[122]首次开发了一种经济方便的NabH4再生方法,再生机理为中间产物MgH2通过H-配体逐步取代(OH-)基团的过程。真正的水解副产物(NaBO2·2H2O 和NaBO2·4H2O)代替脱水偏硼酸钠在室温和常压下用Mg 再生NaBH4。因此,解决了干燥NaBO2·xH2O获得NaBO2过程中的热浪费问题。该法成本相比以MgH2为起始试剂降低了34 倍,NaBH4的最高转化率可达68.55%。
3.2.3 其他储氢体系
在其他配位硼氢化物中,有关Mg(BH4)2的研究较少,但其也是一类极具发展前景的配位硼氢化物。Mg(BH4)2理论质量储氢密度可达14.8%(质量分数),镁电负性比锂高,因而镁配位氢化物稳定性低于锂配位氢化物,故Mg(BH4)2热分解温度低于LiBH4,但是Mg(BH4)2分解放氢和LiBH4一样是一个十分复杂的过程,过程涉及多种未知中间产物。目前多构建配位氢化物之间的不稳定复合体系来改善Mg(BH4)2的吸氢热力学以及可逆储氢性能。Liu等[123]研究了Mg(BH4)2-NaAlH4复合体系的储氢性能和储氢机理。结果表明,球磨后的Mg(BH4)2-2NaAlH4样品在101~530℃下经过三步反应放出约9.1%(质量分数)的氢气。加氢过程中,脱氢后的样品在400℃、100atm 的氢气压力下,通过复杂的反应过程可获得6.5%(质量分数)的氢气。实验表明在中等温度和氢气压力下,Mg(BH4)2-NaAlH4复合体系的可逆储氢性能非常具有应用前景。
3.3 碱金属氨基化物
在碱金属氨基化物储氢体系中,LiNH2是一种很好的储氢材料,Pinkerton 等[124]首次报道了2LiNH2-LiBH4复合体系放氢过程形成的四元氢化物Li3BN2H8具有11.9%的理论储氢容量,250℃下放氢容量超10%(质量分数)。但在放氢的同时会伴随着少量氨气的释放,因此想要将LiNH2实际应用,氨气问题必须得到解决。Ichikawa 等[125]研究了在LiNH2和LiH 的球磨混合物中添加少量的Fe、Co、Ni金属纳米粒子以及Ti、V氯化物对氢气脱附性能的催化作用,其中添加1% TiCl3(摩尔分数)的产物表现出最优异的放氢性能,在150~250℃中脱附了5.5%~6%(质量分数)的氢气,且反应速度较快,反应速率在3次循环之前几乎没有变化。可逆性也较为可观,在至少3 次循环之前仍高于5%(质量分数)。Wei 等[126]探究了掺杂少量LiBH4对Li-N-H 体系储氢性能的改善效果。氢气脱附的起始温度和结束温度在掺入LiBH4后均向低温移动,且NH3的释放受到明显抑制。在250℃下,LiBH4掺杂样品在30min 内可释放出约4% H2,约4.8%(质量分数)H2可在2min内重新吸附。LiBH4与LiNH2反应生成的四元氢化物(LiNH2)x(LiBH4)(1-x)可以通过生成离子液体相使LiNH2从固态转变为熔融状态,削弱了N—H键,从而有助于提高吸氢性能。
NaNH2-NaBH4也是一类研究较多的氨基化物复合体系。有研究表明,在储氢性能和应用前景方面,NaNH2-NaBH4复合体系比LiNH2-LiBH4更具有优势[127]。该体系可以在适当温度范围内放出大部分的氢气,且不会伴生大量副产物氨气,热稳定性也低于配位硼氢化物。Bai 等[128-129]通过球磨技术和掺杂Co-B 催化剂制备了NaNH2-NaBH4复合体系材料,使得放氢反应活化能大幅下降,较纯NaNH2-NaBH4复合材料分别下降至76.4kJ/mol 和70kJ/mol,与纯NaNH2-NaBH4相比降幅均超过50%。
4 水合物储氢材料
气体水合物是主体分子水与客体分子,如甲烷、二氧化碳等在高压、低温环境下自发形成的一种笼型晶体化合物[130]。不同于上述固态储氢材料,水合物通过水分子间氢键作用而形成的不同三维笼型结构“捕获”氢气分子,并通过分子间作用力使笼内结构更加稳定。水合物固态储氢原料是水,充气和放气过程环境友好可逆,成本低,且一般情况下1m3水合物可容纳160~170m3标准状态气体。这些特性使得水合物在气体储运方面相较传统气体储运技术有着明显的优势,也因此被视为一个具有巨大应用潜力的储氢方向[131-132]。对于纯水体系,氢气水合物的相平衡条件极为苛刻,这极大影响了水合物储氢的商业应用与发展,据此水合物形成促进剂进入了研究者的视野,当体系中加入水合物形成促进剂后,形成氢气水合物的相平衡条件会发生显著变化。
目前氢气水合物促进剂根据生成水合物结构类型的不同可分为sⅠ型、sⅡ型、sH 型以及半笼(sc)型。在上述四种促进剂中,氢气较难在sⅠ型水合物中稳定存在[133],半笼型的氢气水合物的生成温度和压力最温和,但是其储氢量最低。sH 型促进剂水合储氢量最高,但反应条件最为苛刻。从水合物储氢相平衡所需的温度、压力以及储氢量综合考量来看,sⅡ型促进剂是最为理想的储氢载体,并且其也是目前研究最为深入的水合物促进剂。
4.1 sⅡ型氢气水合物
目前应用最广泛的sⅡ型水合储氢促进剂有四氢呋喃(THF)、环戊烷(CP)和丙烷(C3H8)等。sⅡ型水合储氢促进剂因为本身参与水合物的构成,所以在其使水合物形成相平衡条件变得更温和的同时,也会占据一部分氢分子的空间,并且其自身还会形成水合物笼状结构,使得整体水合物储氢密度有所下降。
Lee 等[134]在研究储氢量与THF浓度之间的关系时,发现在 12MPa、270K 环境条件下THF 的浓度低于摩尔分数5.56%的化学计量浓度时,储氢量会有所增加,在摩尔分数0.15%时达到最大储氢量4.03%(质量分数)。THF 浓度值下限为摩尔分数0.1%,低于0.1%则无促进作用。Nguyen 等[135]利用原位共焦拉曼显微光谱研究了氢分子在THF 水合物中的扩散并探讨强酸对这一扩散过程的影响。高氯酸的共包合促进了氢分子在水合物结构中的插入,由于酸性添加剂的加入,氢扩散系数(在270K 和20MPa 下测量)提高了2 倍。但在提高储氢密度和速率的同时,二元 THF+H2水合物的稳定性问题也不容忽视。Lang 等[136]将THF-H2水合物的分解分为快速解离、缓慢解离和稳定解离三个阶段。THF-H2水合物的解离速率与温度并不是简单的线性关系,存在着一个温度异常区(253<T<268K),表现出延迟分解,称为“类似自保存”现象。研究结果为氢水合物的储运、高压储氢和低压保存提供了切实可行的途径。
Chen 等[137]探究了在中等压力下提高环氧环戊烷(ECP)水合物储氢能力和储氢速率的几种强化方法。结果表明随着ECP 水合物粒径的减小,储气容量和储气速率逐渐增大。将ECP 水合物颗粒分散在不锈钢网上后,储气容量进一步提高到0.64%(质量分数)。水合物粒径的减小可以增大气固界面面积,提高气体吸附速率和吸附量。不锈钢网格隔板具有良好的导热性能,降低了水合物生成热的影响,分散了水合物颗粒,缩短了氢在孔隙中的扩散距离,提高了储氢能力。最近,Ghaani等[138]在研究中采用非平衡分子动力学模拟分析了180~273K下C3H8+H2水合物储氢动力学以及氢气进入该框架的吸收过程,在2.5MPa和274.65K条件下储氢容量约为1.04%(质量分数),接近理论预期储氢容量1.13%(质量分数),并证明了形成具有最大表面体积比的水合物才能最大限度地提高储氢能力和气体吸收动力学。尹凯东[139]在丙烷-氢气水合物同步生成过程中发现,水合物储氢密度随氢气浓度升高而升高,最高储氢密度可达1.27%(质量分数)。在丙烷水合物诱导储氢过程中发现温度低于260K 时温度和压力对水合物储氢能力没有显著影响,但在270K 时升高压力或降低温度都会大幅增加水合物的储氢能力,在240K、60MPa 时储量达到最高的1.455%(质量分数)。
4.2 其他类型氢气水合物
半笼型水合物也是一类研究较多的以季铵盐为代表的用于储氢的水合物,四丁基溴/氟化铵(TBAB/TBAF)作为典型的半笼型水合物受到了颇多研究。Treuba 等[140]考察了压力、TBAB/TBAF 浓度和水合物形成方法对水合物成核、生成速率和H2储存容量的影响,结果表明高压和溶质浓度对动力学有利。在16MPa、281.15K 环境条件下摩尔分数为3.7%和2.6%的TBAB 溶液H2储量分别是0.046%和0.031%(质量分数)。摩尔分数为3.4%的TBAF 在13.0MPa 氢气环境下生成的水合物储氢密度最大可达到0.024%(质量分数)。拉曼光谱显示,氢气在TBAF 溶液中的溶解度高于氢气在TBAB 溶液中。半笼形水合物在接近环境压力和温度条件下就能捕获气体分子,这种独特的储气效果使得其备受关注。但是较低的储氢密度限制了工业化的应用,目前仍需要进一步有针对性地研究,才能实现完全可行的储氢。
sH 型水合物每一个大客体分子有五个小笼,因此在理论上相比于sⅡ型水合物有更高的储氢密度,是比较有潜力的储氢水合物。Wang 等[141]采用分子动力学模拟研究了sH 型氢气水合物的扩散行为,得出水合物储氢过程受两种扩散过程的影响:一是气相向水合物的扩散,边界层上的512笼将阻止氢扩散到水合物相;二是氢从水合物逸出到气相。当氢分子的动能较低时,氢分子更容易在水合物笼内稳定,从而提高了水合物的储氢能力。总的来说,模拟结果表明当氢分子从环境中获得较少能量时,大部分氢分子可以稳定地存在于同一个水合物笼中,不易移动,从而提高了水合物的储氢能力。对于sⅡ型水合物来说,分子直径较大的促进剂分子更倾向于占据水合物大笼,H2分子占据中小笼,据此sH 型水合物具有多种类型水合物中最高的储氢量,但是sH 型水合物合成与储存需要更高的压力与更低的温度,这限制了其储氢应用。
s Ⅰ型水合物促进剂大多为气体促进剂。Omran 等[142]通过理论计算研究了sⅠ氢气水合物中H2、CH4和CO2吸附的相互作用。计算结果表明sⅠ水合物稳定性的顺序为CO2>CH4>H2,在H2-CO2和H2-CH4混合体系中,不同气体在同一笼内的异质占有可以提高H2水合物的稳定性。CO2或CH4的存在可通过减小笼的变形,促进氢向大笼和空笼扩散。Liu等[143]运用第一性原理计算模拟了H2-CH4二元水合物在不同温度和压力下的储氢容量和结构稳定性。热力学和力学分析表明,H2-CH4二元水合物最稳定结构的摩尔比为0.353∶1,储氢量为3.43%(质量分数),储气量为9.14%(质量分数)。随着压力的增加,水合物的稳定性增加,在270K左右观察到水合物的自保护效应,水合物结构表现出最好的稳定性。在实际应用中,该效应可用于氢气的储存和运输。sⅠ型氢气水合物在热力学上稳定性较低,氢气在sⅠ型水合物中稳定存在,但由于水合物可用于氢气占用的小笼子数量相对较少,故储氢密度较低,sⅠ型水合物储氢在水合储氢中应用前景不大。
5 结语与展望
物理吸附类储氢材料吸附过程不发生化学变化,储氢方式简单,但在常温或高温下性能不稳定且质量储氢密度较低,材料制备复杂,机理认识不够,制约了物理吸附类储氢材料的应用前景。故物理吸附类储氢材料应朝着常温、常压、高可逆性和高容量等方向发展。配位氢化物储氢材料实际达到的氢容量与理论高质量、高体积储氢密度有很大差距,较低的动力学性能和可逆储氢容量以及对储氢机理的认识不足是该类材料的主要限制因素,因此阐明催化和掺杂机理以实现高效催化应该是目前配位氢化物的重要研究方向。尽管水合物储氢理论量较大,但是实际储氢密度不足,提高水合反应速率和强化传质是今后努力的方向。金属基镁基储氢材料是综合性能最为优异的储氢材料,然而其高吸放氢热力学和低动力学性能依旧是目前迫切需要解决的问题。目前任何单一的改性方法都不可能克服所有问题来实现镁基储氢材料的规模化应用。纳米化、催化剂改性以及构建复合体系,多种改性方法结合,多种效应协同,在现有改进技术的基础上开发新的改进手段,或者研发新实验方案将多种改性方法结合起来以期实现材料的优势互补,应是镁基储氢材料研究的重点方向。
绿氢是氢能应用的初衷,应充分利用绿氢特性,构建绿氢供应链,简化供氢流程,降低供氢成本。未来在“双碳”政策大背景下,构建清洁低碳、安全高效的能源体系,促进氢能产业高质量发展的进程中,固态储氢运氢技术将发挥不可替代的作用。针对固态储氢尤其是镁基储氢产业化问题,材料研发是难点,系统集成是关键,产品应用是目标。利用纳米化和催化剂协同效应规模化稳定化开发低成本、长寿命、具备低吸放氢温度和高氢容量的镁基复合储氢材料是研究重点。解决镁基储运氢系统体积膨胀问题、传热问题以及氢气流动问题,拥有高储氢密度、高传热性能、低氢气流通阻力的固态储运氢系统是整个集成一体化系统中至关重要的一环。将镁基储氢系统耦合加氢站、氢燃料电池系统等具体应用终端并对其进行理论模型优化设计,然后面向社会需求,是整个镁基储氢体系规模化体系化应用的最后一步。
鉴于目前氢能应用广阔的前景,绿色制氢-镁基固态储氢-加氢站/氢燃料电池/氢化工集成一体化系统应是未来镁基储运氢技术的应用方向。前端通过风电、光电技术等产生的电力电解水制取绿色氢气,中端通过镁基储运氢系统储备氢能源,末端应用给氢燃料电池车供氢或进行氢-电转换,为未来中国能源体系变革、交通运输方式低碳化转变奠定基础。在未来,解决了储运难题,镁基固态储氢技术的应用不仅是备受关注的氢燃料电池汽车,还包括加氢站、氢能发电、工业应用及建筑应用等,不仅可以作为建筑热电联供电源、微网的可靠电源与移动基站的备用电源,还能够与数字化技术结合,在诸多领域发挥重要作用。

