颅内动脉瘤破裂蛛网膜下腔出血病人早期发生神经源性肺水肿危险因素分析
许佑冬,刘正东
非外伤性蛛网膜下腔出血常继发于颅内动脉瘤破裂[1]。全球动脉瘤破裂蛛网膜下腔出血(aSAH)的发病率为每10万例中有2~16例,中低收入国家的发病率几乎是高收入国家的2倍[2]。aSAH不仅可发生神经系统相关并发症,如再出血、脑缺血、脑积水、癫痫等,还可引起全身多系统并发症,如神经源性肺水肿(NPE)、神经源性心肌损害、低钠血症和贫血等;这些并发症的发生显著增加aSAH病人的死亡率,其中NPE是aSAH的致命的并发症[3]。NPE是急性中枢神经系统损伤直接导致的肺间质、肺泡水肿,而不能用其他原因解释的急性缺氧性呼吸衰竭。关于NPE的流行病学资料很少,而且往往基于病例报告或病例数量较少的研究。本研究通过回顾性收集2019年1月至2022年2月入住我院的115例aSAH病人的临床资料,分析其发病情况、临床特征、临床结局,并采用统计学方法筛选出可能与入院24 h内发生NPE相关的危险因素。
1 资料与方法
1.1 一般资料 对我院2019年1月至2022年2月收治的139例aSAH病人进行回顾性分析,排除既往有心肺肾疾病(n=8),入院时出现心脏骤停(n=2),脑干反应消失(n=3),住院时间小于24 h(n=6),无明显SAH出血源(n=3),肺水肿合并心肌收缩力受损(n=2)的病人。最终,115例病人被纳入本研究。根据入院24 h内是否发生NPE分为发生NPE组及未发生NPE组。回顾性收集2组病人的性别、年龄、基础疾病、临床特征(入院时病情严重程度、心率、血压、实验室指标、是否入住重症监护室、是否机械通气)、动脉瘤位置和大小,以及临床结局。由于研究的回顾性,放弃了知情同意的要求。
1.2 NPE诊断 aSAH由头颅CT检查诊断,动脉瘤的位置及大小由CTA或脑血管造影确定。NPE诊断标准:(1) 临床表现如呼吸急促、呼吸困难、发绀、粉红色痰液、双肺湿性啰音;(2)胸部影像学(X线片、CT、超声)表现的双肺弥漫性渗出改变;(3) 通过询问病史及临床辅助检查排除心源性及其他引起急性呼吸窘迫综合征的因素,尤其注意与吸入性肺炎鉴别。诊断由2名主治或以上的医师确定。
1.3 评分系统 入院时使用蛛网膜下腔出血Hunt-Hess分级以及Fisher分级评估严重程度,出院时使用Modified Rankin scale(mRS)评分评估病人预后[4]。Hunt-Hess分级Ⅳ~Ⅴ级以及Fisher分级Ⅲ~Ⅳ级被定义为严重级别。出院时mRS评分0~3分定义为良好结局,4~6分定义为不良结局。
1.4 统计学方法 采用t检验、χ2检验、秩和检验、logistic回归模型和ROC曲线分析。
2 结果
2.1 临床资料 115例病人纳入研究,年龄35~86岁,平均(60.86±12.21)岁,其中男44例,女71例。115例中有14例病人在入院24 h内发生NPE,发生率为12.2%。发生NPE组病人年龄低于未发生NPE组,但2组间差异无统计学意义(P>0.05)。发生NPE组病人入住重症监护室比例、机械通气比例均高于未发生NPE组(P<0.05)。发生NEP组病人出院时mRS评分为良好比例低于未发生NPE组(P<0.05)(见表1)。
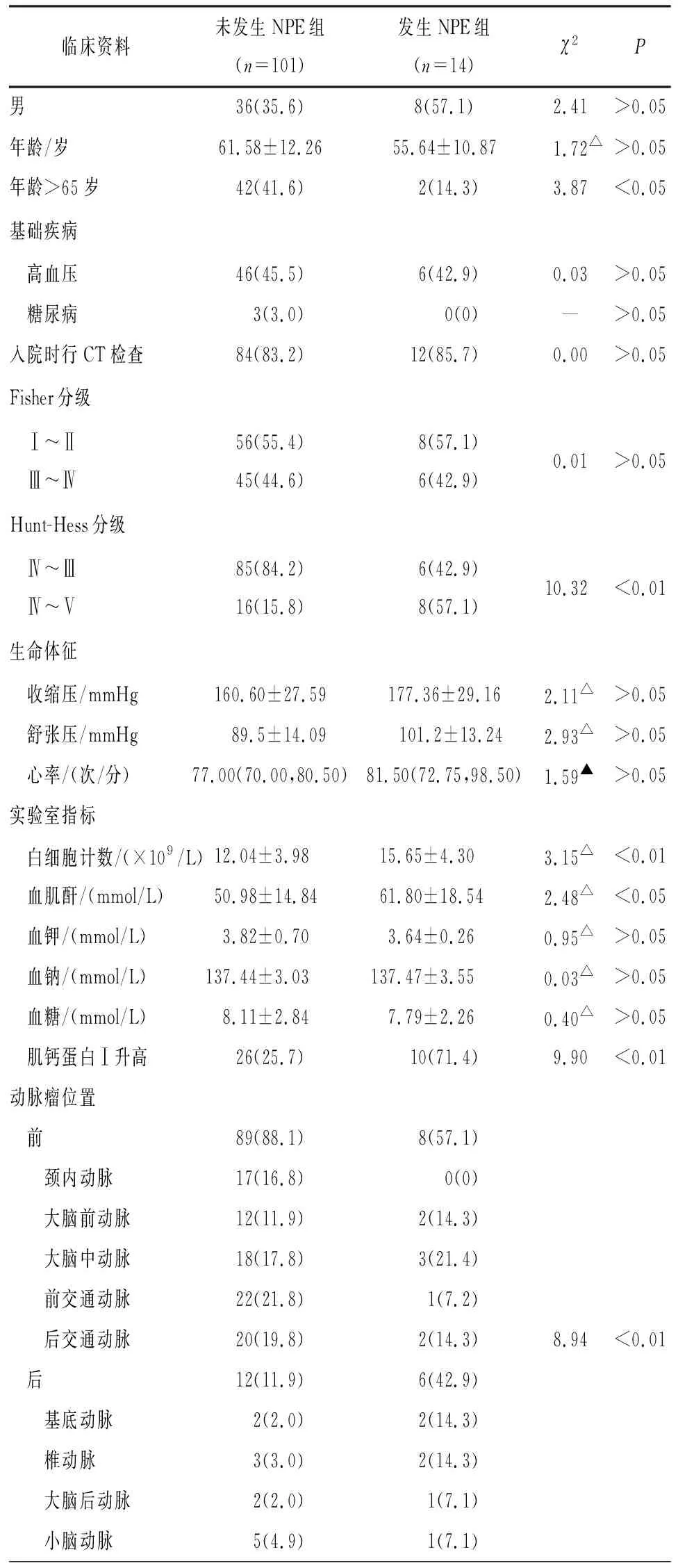
表1 2组病人临床资料的比较[n;百分率(%)]
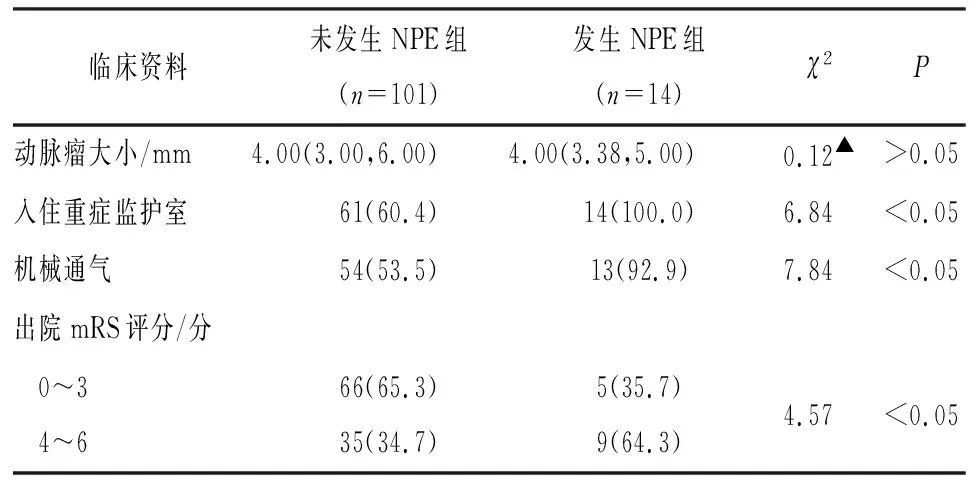
续表1
2.2 aSAH病人入院24 h内发生NPE单因素分析 单因素分析显示,与未发生NPE组相比较,发生NPE组病人年龄>65岁占比较少(P<0.05),入院时Hunt-Hess分级Ⅳ~Ⅴ级病人占比更高(P<0.01),肌钙蛋白Ⅰ升高的病人占比更高(P<0.01),后循环动脉瘤发病率更高(P<0.01)。2组病人性别、基础疾病、入院时血压、心率水平、实验室指标(白细胞计数、血肌酐、血钾、血钠、血糖)以及动脉瘤大小差异均无统计学意义(P>0.05)(见表1)。
2.3 aSAH病人入院24 h内发生NPE多因素logistic回归分析 以年龄、入院时Hunt-Hess分级、肌钙蛋白Ⅰ、 后循环动脉瘤为自变量,以病人发生NPE作为因变量进行多因素 logistic 回归分析,结果显示Hunt-Hess分级Ⅳ~Ⅴ、肌钙蛋白Ⅰ升高、动脉瘤位置(后循环)是aSAH病人入院24 h内发生NPE的独立危险因素(P<0.05)(见表2)。
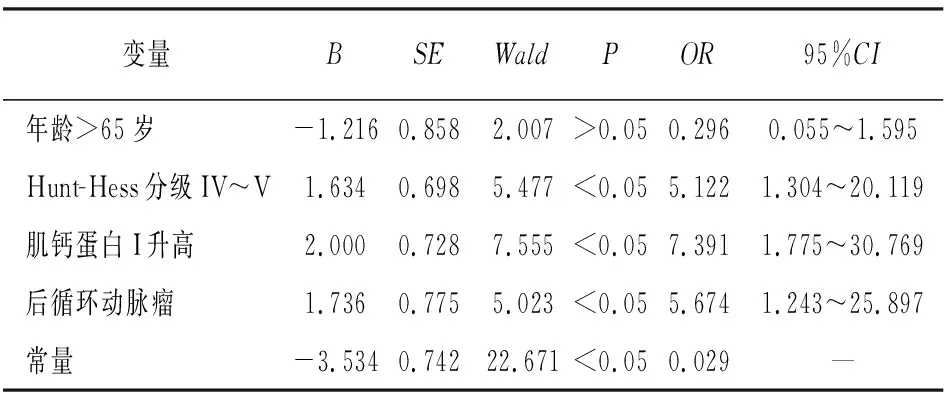
表2 aSAH病人入院24 h内发生NPE多因素logistic回归分析
2.4 联合检测因子模型的构建 将Hunt-Hess分级Ⅳ~Ⅴ、肌钙蛋白Ⅰ升高、后循环动脉瘤分别作为协变量X1、X2、X3,得出联合检测因子模型表达式为:logit (P)=-3.524+1.634X1+2.000X2+1.736X3。
2.5 联合检测因子模型的ROC曲线分析 ROC曲线分析,结果显示,联合检测因子模型预测aSAH病人发生NPE的曲线下面积(AUC)为0.828(95%CI:0.693~0.963),敏感度为64.3%,特异度为92.1%,优于各项单一指标(见表3)。
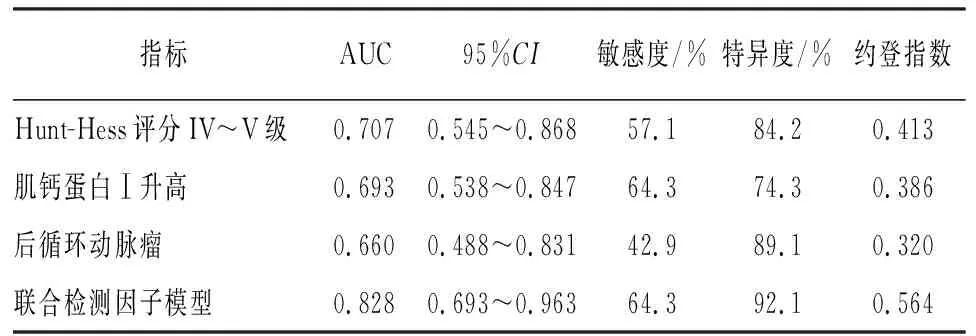
表3 预测神经源性肺水肿发生的ROC曲线分析
3 讨论
NPE定义为中枢神经系统损伤后迅速发生的并且不能用其他原因解释的可逆性低氧性呼吸衰竭,可继发于多种神经系统损伤:SAH、颅脑外伤、脑中风、癫痫等,而NPE在aSAH病人中的发病率明显高于其他类型脑损伤病人[5-8]。由于缺乏特异性诊断标志物及确切的诊断标准,先前的研究报道aSAH后NPE的发病率有较大差异(4.6%~31%)[9-11]。本研究中aSAH病人中NPE的发病率为12.2%。CHEN等[10-11]研究同样纳入aSAH在入院24 h内发生NPE的病人,NPE发生率分别为14.9%和15.8%,本研究与之类似。
研究[9]显示,入院时更严重的蛛网膜下腔出血分级与NPE的发生有关;本研究亦显示,入院时Hunt-Hess分级Ⅳ~Ⅴ级是NPE发生的独立危险因素。NPE的发生考虑与颅内压升高及交感神经系统激活,儿茶酚胺类激素分泌增加有关。目前多主张以下两种理论:理论之一是血流动力学理论,循环儿茶酚胺类激素突然增加导致系统阻力增加而引起的肺容量负荷增加;另一种理论是肺血管通透性增加,脑损伤颅内压升高通过兴奋交感神经、释放细胞因子从而使肺血管通透性增加,引起的大量富含蛋白质的血液渗出引起肺水肿,使病人通气血流比例失调[12]。因此,NPE病人常表现为急性缺氧性呼吸衰竭,需机械通气治疗,本研究结果与之一致。
肌钙蛋白Ⅰ是一种心肌损伤标志物,本研究显示NPE组病人肌钙蛋白Ⅰ升高比例明显高于未发生NPE组,与NASTASOVIC等[13]研究一致,提示肌钙蛋白Ⅰ升高对NPE的发生有一定的预测作用。心肌损伤亦考虑与交感神经激活有关,一方面儿茶酚胺类激素分泌增加直接引起心肌损伤;另一方面,由于外周血管阻力增加,增加左心后负荷,导致心肌损伤[14]。心肌损伤严重时可影响心肌收缩力,引起心力衰竭。为排除心源性肺水肿的影响,本研究所有诊断NPE病人均行床旁心脏彩超检查,发现2例同时存在肺水肿及心肌收缩力下降病人,入组分析时已排除此类病人。
在本研究中,后循环aSAH发生NPE的风险更高。先前也有研究[9]提示后循环aSAH更易发生NPE。大脑特定部位(下丘脑以及延髓)受损可诱发NPE,而下丘脑、延髓主要由后循环供血,这些特定部位损伤会导致肺血管压力的增加、肺静脉收缩、肺血管充血和肺毛细血管内皮细胞损伤,从而导致肺间质、肺泡内富含蛋白液体积聚以及肺泡出血,从而临床上表现为呼吸困难、咳粉红色泡沫痰等。
本研究对logistic回归分析得出的3项独立影响因素,量化各因素的贡献度,得出联合检测因子模型:logit (P)=-3.524+1.634X1+2.000X2+1.736X3,该模型AUC为0.828 (95%CI:0.693~0.963),敏感度为64.3%,特异度为92.1%,优于各项单一指标,表明构建的联合监测因子模型具有较好的预测效能。
NPE易在aSAH后早期发生,本研究中最早在aSAH后3 h影像学检查发现NPE,WATANABE等[11]同样报道NPE最早影像学表现在aSAH后2.5 h,最长不超过72 h。另外,WEIR[15]研究显示,在aSAH病人中,临床NPE诊出率为31%,远低于尸解NPE诊出率71%,意味着有很大比例病人临床症状不突出,未及时发现,故应加强对aSAH病人早期是否发生NPE排查的意识。aSAH病人常见的并发症有脑血管痉挛、脑梗死[16-17],故早期多主张适当液体正平衡;但若合并神经源性肺水肿或心功能受损,液体正平衡可导致肺水肿、心功能损害加重,此时需要更严格的液体管理,一方面避免心肺损伤加重,另一方面避免继发脑梗死。床旁超声具备无创、实时,无需搬运等优点,可用于早期识别NPE,同时评估心肺功能,并可在后续治疗中动态评估,在临床应用中值得推广;肺水肿的超声表现为前胸壁B线,随B线的增多,意味着肺水肿严重程度增加[18-20]。
本研究的优势在于所有发生NPE病人早期均入住ICU,由2名主治或以上医师行床旁超声检查,排除了同时合并心肌受损病人,从而排除心源性肺水肿的干扰。另外,本研究病人入院时同时行头颅、胸部CT检查的有83.5%,可提高诊断率。然而,本研究也有些不足之处,首先,aSAH病人特别是重型病人常出现意识障碍,合并吸入性肺炎,可出现急性呼吸窘迫综合征,临床上常难以鉴别。本研究主要通过是否有呕吐史、病变位置(NPE病变多为双肺对称性分布,肺门处明显;吸入性肺炎多为双肺下叶,右肺多见)、痰液性状(NPE多为粉红色泡沫样痰,吸入性肺炎多为脓痰)鉴别。其次,入组时排除了既往有心肺肾基础疾病的病人可能会高估发病率及临床结局。另外,可能有部分NPE发生在24 h之后未进行统计研究。最后,本研究为回顾性研究且阳性病例较少,仍需大样本多中心前瞻性研究进一步验证NPE的危险因素。
综上所述,aSAH病人NPE的早期发生率为12.2%,后循环动脉瘤是aSAH病人早期发生NPE的重要危险因素。此类病人入院时临床分级更加严重,常伴肌钙蛋白Ⅰ升高。早期识别aSAH,并严格血流动力学管理,可能有助于改善病人预后,临床医生应加强对NPE的排查意识。

