mNGS 在鹦鹉热衣原体肺炎中的应用价值*
马晶,杨舒婷,杨敏,黄国虹,王昌敏(新疆维吾尔自治区人民医院临床检验中心,乌鲁木齐 830001)
鹦鹉热衣原体(Chlamydiapsittaci,Cps)是人兽共患病病原体,其感染的肺炎约占社区获得性肺炎的1%[1-3]。鹦鹉热衣原体肺炎发病率低,临床症状特异性低。常规检测方法包括血清学及分子生物学检验等[4-5],上述检测方法周期长、阳性率低,易受抗生素治疗的干扰,不能满足临床快速、准确诊断的需求,导致临床对鹦鹉热衣原体肺炎诊断困难,常被漏诊或误诊。由于宏基因组二代测序技术(metagenomics next generation sequencing,mNGS)[6-8]具有无偏倚、广覆盖的优势,目前已广泛应用于临床,提高了鹦鹉热衣原体的检出率,从而使临床医师能够对其进行及时有效的针对性治疗。本文回顾性总结了17 例鹦鹉热衣原体肺炎患者的临床资料,分析其临床病理参数及实验室检查指标,以期为诊断及治疗鹦鹉热衣原体肺炎提供参考。
1 材料和方法
1.1 研究对象 对2021 年7 月至2022 年8 月由新疆维吾尔自治区人民医院收治的且经mNGS 检测为鹦鹉热衣原体肺炎患者17 例进行回顾性分析,男11 例,女6 例,年龄33~78 岁。对其一般资料、基础疾病及临床病理参数进行汇总。纳入标准:(1)患者临床资料完整。(2)患者均经mNGS检出鹦鹉热衣原体。排除标准:(1)合并其他系统感染者。(2)合并其他恶性肿瘤者。
1.2 主要仪器及试剂 BC-6800PLUS 全自动细胞分析仪(深圳迈瑞生物医疗电子公司),ACL TOP750 LAS 全自动血凝分析仪(北京沃芬医疗器械商贸公司),c16000 全自动生化分析仪(美国Abbott 公司),cobas e411 电化学发光分析仪(德国Roche 公司),MGISEQ-2000 测序仪(深圳华大智造科技公司),C1000 梯度PCR 仪(美国Bio-Rad公司),QubitTM4 浓度测定仪、Invitrogen QubitTMdsDNA HS Assay 试剂盒、Invitrogen QubitTMssDNA HS Assay 试剂盒(美国赛默飞公司),病原破壁试剂盒(溶壁酶)、核酸提取或纯化试剂、基因组DNA 片段化试剂盒、测序反应通用试剂盒(武汉华大智造科技公司)。
1.3 标本采集 患者在抗菌药物使用前,空腹采集静脉全血标本2 mL,EDTA-K2抗凝,8 h 内4 ℃、1 600×g离心10 min,收集300 μL 血浆。肺泡灌洗液或气管抽吸物按照无菌操作要求留取1 mL。标本置于-70 ℃保存。
1.4 血液学指标检测 采用BC-6800PLUS 全自动细胞分析仪检测血常规各项参数,ACL TOP750 LAS 全自动血凝分析仪检测凝血指标,c16000 全自动生化分析仪和cobas e411 电化学发光分析仪检测生化指标。血液学各指标参考区间:白细胞计数:[WBC:(3.5~9.5)×109/L,电阻抗法];中性粒细胞百分比(NEUT%:40%~75%,电阻抗法);淋巴细胞百分比(LY%:20%~50%,电阻抗法);C 反应蛋白(CRP:0~8 mg/L,免疫比浊法);纤维蛋白原(Fib:2.0~4.0 g/L,凝固法);D-二聚体(D-D:0~0.5 mg/L,免疫比浊法);丙氨酸氨基转移酶(ALT:9~60 U/L,速率法);天冬氨酸氨基转移酶(AST:15~45 U/L,速率法);肌酸激酶(CK:50~310 U/L,速率法);乳酸脱氢酶(LDH:120~250 U/L,速率法);肌钙蛋白T(cTnT:0~0.014 ng/mL,电化学发光法);B 型钠尿肽(BNP:0~100 pg/mL,化学发光法);清蛋白(Alb:40~55 g/L,比色法)。
1.5 mNGS 检测 取患者的肺泡灌洗液或气管抽吸物450 μL,加入7.2 μL 溶壁酶温浴(30 ℃、10 min),加入玻璃珠进行物理破壁,混合震荡后取300 μL 进行DNA 提取,阴、阳性质控品处理同实验标本。提取后的DNA 使用QubitTM4 浓度测定仪测定浓度,取43 μL 浓度检测合格的核酸标本进行酶切片段化、构建文库(末端修复、接头连接及PCR扩增)。按照QubitTMdsDNA HS Assay 试剂盒说明书进行文库浓度的质控,根据检测后的浓度将构建好的文库按照等质量进行pooling,将pooling 混合后的文库经环化形成单链环形结构,再经滚环复制(RCA)生成DNB 纳米球,制备好的DNB 纳米球加载至测序芯片,使用MGISEQ-2000 测序仪进行测序。测序数据下机后去除低质量的序列以获得高质量的数据。通过BWA(BWA:http://bio-bwa.sourceforge.net/)比对,高质量数据中比对上人参考基因组序列的数据去除,剩下的数据在去除低复杂度reads 后与华大PMDB 病原数据库进行比对,获得能够匹配到某种病原体的序列数,根据序列数的高低以及临床其他检测判读可能的病原体。对于实验检测结果,先根据序列数的多少及种属的排列位置,选取排名靠前的种属且有致病性的病原体,结合临床症状和其他实验检测结果,综合判定致病微生物[6-10]。
2 结果
2.1 鹦鹉热衣原体肺炎患者基本信息与临床病理参数 17 例诊断为鹦鹉热衣原体肺炎患者中,除6例无基础病史外,其余均有高血压、脑梗等病史。5例有鸟类、禽类接触史,3 例不详。临床表现除2 例外其余均有发热现象。见表1。

表1 17 例鹦鹉热衣原体肺炎患者的临床病理参数
2.2 各项实验室检查结果 17 例患者中,有3 例患者白细胞计数升高,6 例患者中性粒细胞百分比明显增高,17 例患者C 反应蛋白、纤维蛋白原、D-二聚体均升高,11 例患者乳酸脱氢酶和7 例患者B 型钠尿肽升高,15 例患者淋巴细胞百分比和14 例患者清蛋白降低。见表2。

表2 17 例鹦鹉热衣原体肺炎患者实验室检查结果分析
2.3 鹦鹉热衣原体肺炎患者mNGS 检测结果 17例鹦鹉热衣原体肺炎患者的mNGS 检测结果见表3。其中9 例患者只检出鹦鹉热衣原体,另有部分患者还检出金黄色葡萄球菌、鲍曼不动杆菌等细菌,烟曲霉等真菌以及疱疹病毒。
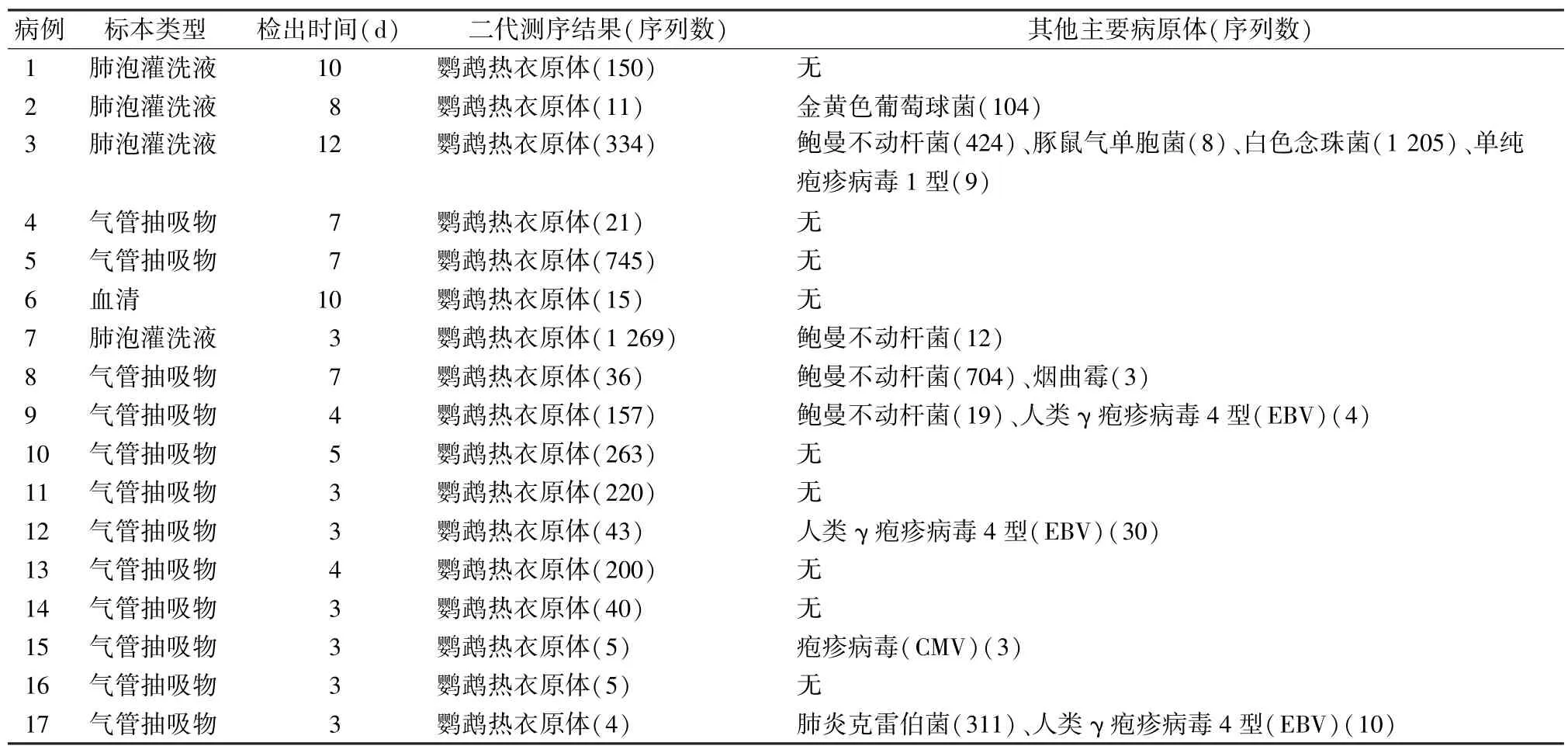
表3 17 例鹦鹉热衣原体肺炎患者mNGS 检测结果
3 讨论
鹦鹉热衣原体是人畜共患病病原体[11],主要宿主为鹦鹉、鸽子等鸟类。人类多因吸入鸟类排泄物的气溶胶引起肺炎[12],患者年龄多集中于中年人,且男性发病率高于女性[13]。本研究中感染者平均年龄为57 岁;男性占比64.71%,女性占比35.29%;其中29%的感染者有鸟类接触史;88%的感染者有发热症状,符合该病的流行病特征[14]。由于该病临床症状不典型,因此对于有鸟类或禽类接触史的发热患者,需警惕鹦鹉热衣原体感染,尽早进行诊断。
研究表明,鹦鹉热衣原体肺炎患者通常白细胞计数正常或轻微升高、中性粒细胞百分比、C 反应蛋白、降钙素原、肌酸激酶、乳酸脱氢酶明显升高。如果合并系统性疾病,患者可出现转氨酶升高、低蛋白血症、低钠血症和肾功能损害[15]。本研究的实验室检查结果证实,患者的白细胞计数、C 反应蛋白均升高,可作为感染的客观指标。而淋巴细胞百分比下降,提示鹦鹉热衣原体可能易于在免疫功能低下的宿主中引起感染。
本研究中17 例患者mNGS 检出鹦鹉热衣原体核酸序列,结合临床表现及接触史明确诊断为鹦鹉热衣原体肺炎。患者从出现临床症状到检出鹦鹉热衣原体平均时间为5 d,部分病例检出鹦鹉热衣原体核酸序列数较多,这可能与检测的标本类型、病情严重程度等有关。本次研究中还检出其他病原体,但需结合患者临床病理参数、实验室检查结果及检出的序列数等综合判定是否为感染的致病菌。17 例患者在mNGS 检测结果显示为鹦鹉热衣原体感染后,根据患者病情严重程度、治疗效果、病程时间等选择性加用其他抗菌药物治疗,均好转出院。这充分说明应用mNGS 技术在17 例患者的诊治过程中显示出了特有的优势,提高了鹦鹉热衣原体肺炎诊断的准确性,提示临床应尽早进行精准的抗感染治疗,减少不必要抗菌药物的使用,改善了患者预后。然而,目前mNGS 技术的结果解读尚无统一的标准,致病菌和背景菌区分较难。本次实验纳入的病例数较少,这是本研究的不足之处,后期将继续扩大样本量对其进行更深入研究,以期更好地指导临床诊断及治疗。

