CXCL16 对霍奇金淋巴瘤HRS 细胞与Treg 淋巴细胞关系的影响
杨 画,寻 阳,刘 芳,吴鸿发,汤红平
(1.佛山科学技术大学 医学院,广东 佛山 528225;2.干细胞转化研究中心,香港 999077;3.南方医科大学附属深圳妇幼保健院 病理科,深圳 518028)
霍奇金淋巴瘤(Hodgkin’s Lymphoma,HL)是最常见的淋巴系统恶性肿瘤之一,其中,经典型的霍奇金淋巴瘤(Classical Hodgkin-Lymphoma,CHL)可分为4 种组织学类型:淋巴细胞为主型、结节硬化型、混合细胞型和淋巴细胞耗竭型[1]。CHL 的特征性病理形态表现为肿瘤细胞-里德-斯特恩伯格(Hodgkin Reed-Sternberg,HRS)细胞与异质性非肿瘤炎性细胞混合存在。CHL 中的HRS 细胞仅占肿瘤组织的不到1%,其余绝大部分组成均为非肿瘤性的炎性细胞[1]。CHL 背景炎症细胞主要由CD4+T 淋巴细胞,特别是CD4+CD25+双表达的调节性T(T regulatory,Treg)淋巴细胞构成[2]。而细胞因子和趋化因子在HRS细胞与其肿瘤微环境之间关系中发挥了重要作用。
CXC型趋化因子配体16(C-C-X Motif Chemokine Ligand 16,CXCL16),亦被称为趋化因子CXCL16,最早被发现在动脉粥样硬化、肝炎、狼疮性肾炎、风湿免疫、艾滋病等免疫疾病或炎症相关疾病中发挥作用[3]。近年来,随着研究的深入,CXCL16 在多种恶性肿瘤中的表达及其功能受到越来越多的关注。我们前期发现HL 组织和细胞水平均为高表达CXCL16。本研究拟进一步探讨CXCL16 在HL 肿瘤细胞与Treg 淋巴细胞相互关系中的作用,从免疫学角度为HL 的发生、发展及预后评估提供新的相关指标。
1 材料与方法
1.1 材料
1.1.1 细胞株
人HL 细胞株L428 由南方医科大学(广东省分子肿瘤病理重点实验室)保存并馈赠。外周血经过肝素抗凝处理后进行单核细胞(Peripheral Blood Mononuclear Cells,PBMC)的提取。新鲜外周血提供自广东省肇庆市中心血站。
1.1.2 主要试剂
1640 培养基、FBS 及青霉素-链霉素双抗均购自Gibco 公司(美国),DMSO 购自吉诺公司(中国,广州),磁珠分选试剂盒(Pan CD4+CD25+T cell isolation kit II)购自美天妮公司(德国),重组人可溶性CXCL16(soluble CXCL16,sCXCL16)蛋白购自R&D 公司(美国),重组人白细胞介素3(Interleukin-3,IL-3)蛋白购自Protech 公司(美国),CCK8 细胞增殖试剂盒购自同仁公司(日本),Transwell 小室(孔径8%μm)、共培养小室(聚碳酸酯微孔膜孔径0.4 μm)均购自Corning 公司(美国)。
1.2 方法
1.2.1 生物信息学分析
选取“Tumor B-cell lymphoma Xiao 420-MAS5.0-U133p2”公开数据库,使用R2:Genomics Analysis and Visualization Platform 进行分析,绘制Kaplan-Meier 生存曲线。
1.2.2 免疫磁珠法分选CD4+CD25+Treg 淋巴细胞
人外周血单核细胞的分离采用常规的密度梯度离心法。根据磁珠试剂盒说明书操作对PBMC 细胞进行磁珠分选。随后,将分选所获得的CD4+CD25+双表达的Treg 淋巴细胞移入培养箱内过夜。次日加入植物凝集素,继续培养并观察淋巴细胞状态。
1.2.3 L428 细胞与Treg 淋巴细胞共培养
分直接共培养与间接共培养。直接共培养是将CD4+CD25+双表达的Treg 淋巴细胞与L428 细胞按1∶100 的比例加入培养瓶。间接共培养是选取共培养小室(0.4%μm),将L428 细胞和CD4+CD25+Treg淋巴细胞分别置于下室和上室中。定时记录细胞形态、大小及生长情况,观察其相互影响。
1.2.4 Treg 淋巴细胞趋化试验
Treg 淋巴细胞首先使用无血清的1640 培养基饥饿4 h,再将Transwell 小室置入含1640 基础培养基的24 孔板中,分别加入不同浓度sCXCL16,Transwell 试验趋化Treg 淋巴细胞至下室,CCK8 法检测下室细胞OD 值。
1.2.5 L428 细胞和Treg 淋巴细胞间接共培养
根据前期报道[4],试验组Treg 淋巴细胞先置于共培养小室内,24 孔板内放置L428 细胞,随后,将共培养小室轻轻放入24 孔板内。Treg 淋巴细胞和L428 细胞可以通过孔膜进行物质交流,但细胞不能穿过小孔产生直接接触。对照组上室小室内不放置Treg 淋巴细胞,24 孔板内同样放置L428 细胞。每24 h 利用CCK8 细胞增殖试剂盒检测上、下室细胞OD 值。
1.2.6 IL-3 对L428 细胞增殖能力的影响
检测前将L428 细胞密度调整为1×104/mL。对照组为常规培养基培养的L428 细胞。试验组为加入重组人IL-3 的培养基,IL-3 设置三个浓度梯度组,分别为10 μg、20%μg 和50 μg。每天采用CCK-8细胞增殖试剂盒检测各组细胞OD 值。
1.3 统计学处理
应用GraphPad Prism 6 及SPSS 13.0 统计分析软件对所获得的试验数据进行统计学分析,采用单因素方差分析。方差齐使用LSD 法分析,方差不齐使用Dunnea T3 法分析。
2 结果
2.1 CXCL16 表达与HL 患者预后的关系
通过https://hgserver1.amc.nl/cgi-bin/r2/main.cgi 网址检索R2:Genomics Analysis and Visualization Platform 中HL 组织样本中差异表达基因的数据库,确定其中CXCL16 的表达水平,再根据CXCL16 基因表达丰度绘制Kaplan-Meier 预后关系曲线,并用对数秩检验进行统计分析。结果显示,CXCL16 的表达量与患者的总生存期长短呈负相关(P=0.030),提示CXCL16 表达较高的HL 患者预后不良(见图1)。
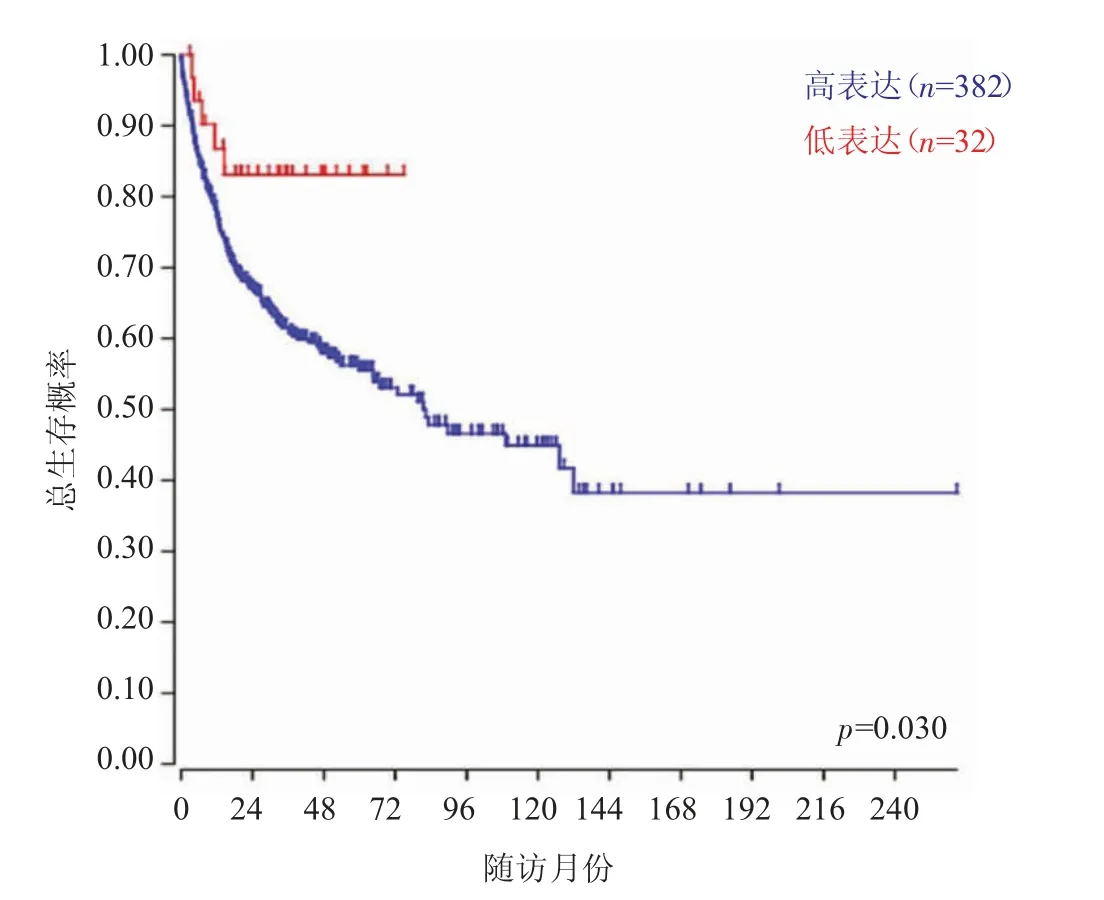
图1 CXCL16 表达与HL 患者预后关系(Kaplan-Meier 曲线)
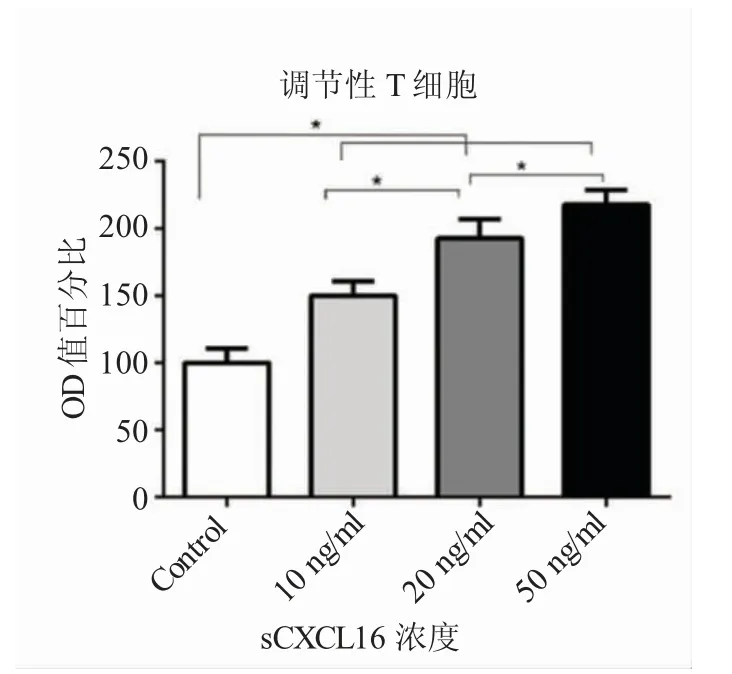
图2 不同浓度sCXCL16 对Treg 淋巴趋化能力比较(*P<0.05)
2.2 CXCL16 对Treg 淋巴细胞的趋化作用
试验按照如下分组:对照组(裸细胞)、sCXCL16-10 ng/mL、sCXCL16-20 ng/mL 和sCXCL16-50 ng/mL。结果显示:加入sCXCL16 的试验组下室Treg 淋巴细胞OD 值均显著高于对照组,存在统计学差异(均P<0.05);试验组下室Treg 淋巴细胞OD 值与加入sCXCL16 浓度呈正相关,不同浓度组间存在统计学差异(均P<0.05)。试验结果提示,sCXCL16 对Treg 淋巴细胞具有趋化作用,且趋化能力存在剂量效应,能随着CXCL16 浓度增加而相应增加。
2.3 Treg 与L428 细胞共培养观察
2.3.1 L428 细胞与Treg 淋巴细胞直接共培养中细胞形态变化
试验组为L428 和Treg 淋巴细胞共培养组,对照组为单独L428 培养组。倒置显微镜下观察24 h 至72 h 的细胞生长状态。结果显示,24 h 后可见试验组L428 细胞(图3B)成团性稍高于对照组单独培养的L428 细胞(图3A);72 h 后试验组的L428 细胞(图3D)成团性显著高于对照组,且单个细胞数量明显少于对照组(图3C)。直接共培养提示,Treg 淋巴细胞可促进L428 细胞增殖中成团性的出现和维持。
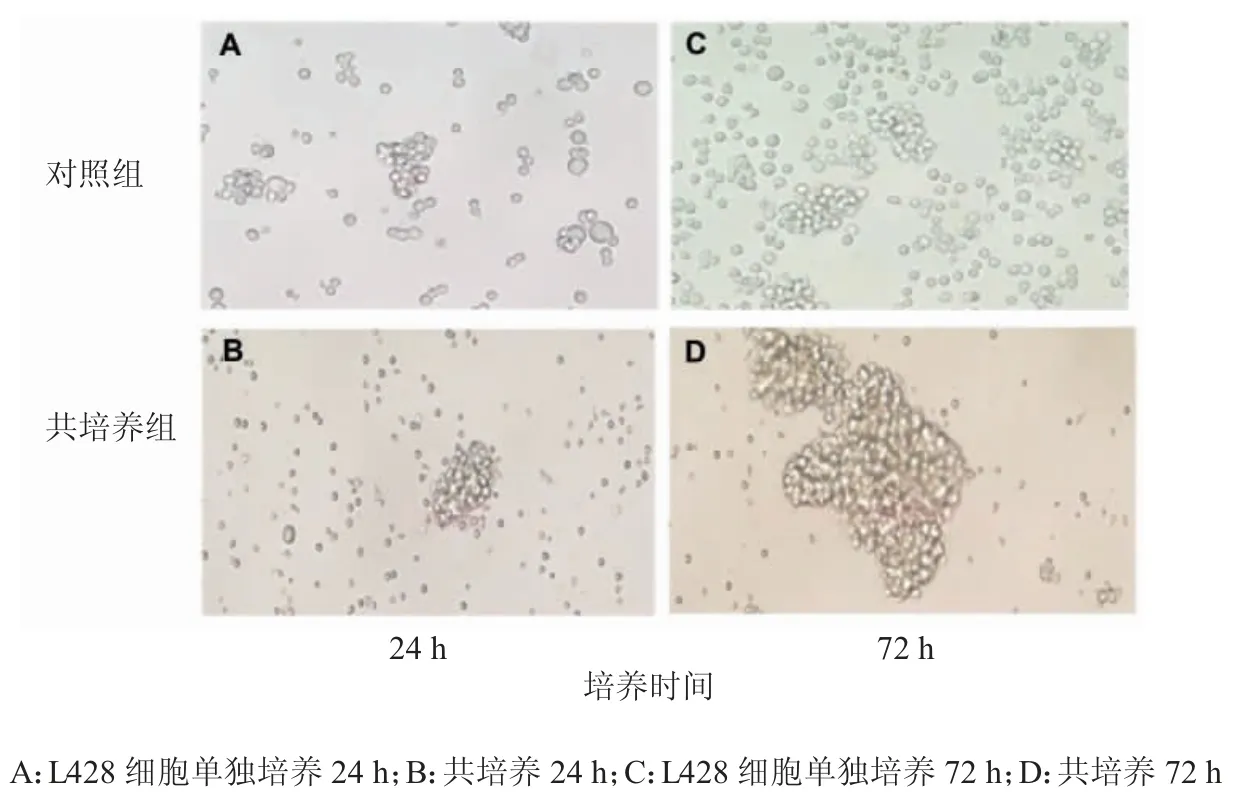
图3 L428 细胞与CD4+CD25+Treg 淋巴细胞直接共培养
2.3.2 L428 细胞与Treg 淋巴细胞间接共培养细胞增殖能力的检测
试验组为间接共培养的L428 细胞和CD4+CD25+双表达的Treg 淋巴细胞,对照组对单独培养的L428 细胞和CD4+CD25+双表达的Treg 淋巴细胞。结果显示,除第1、2 天外,第3~5 天试验组L428 细胞(图4A)和Treg 淋巴细胞(图4B)的OD 值均高于对照组(均P<0.05)。提示,间接共培养条件下L428 细胞和Treg 淋巴细胞能互相促进增殖。
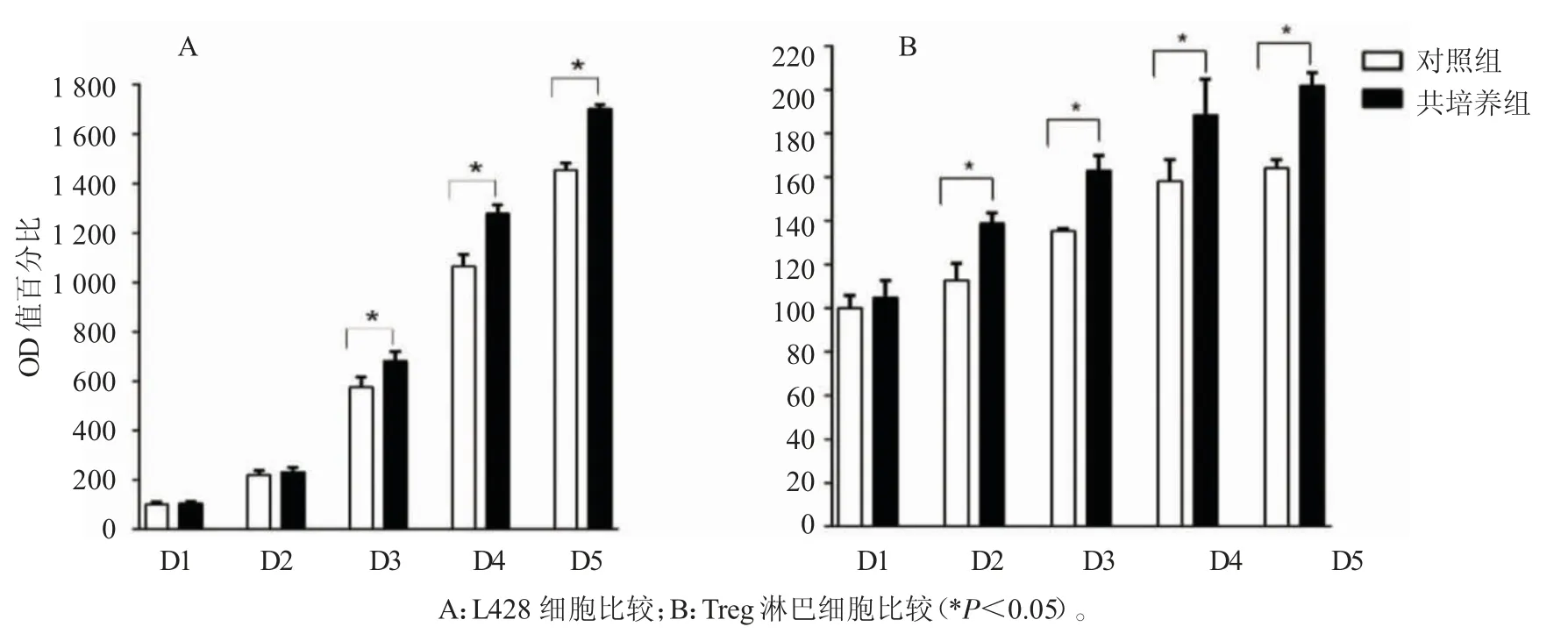
图4 L428 细胞与CD4+CD25+Treg 淋巴细胞进行间接共培养后的增殖能力的检测
2.4 IL-3 能促进L428 细胞体外增殖
体外增殖试验分为4 组:对照组、IL-3(10%μg/mL)组、IL-3(20 μg/mL)组和IL-3(50%μg/mL)组。第1、2 天(D1、D2)各组间差异不显著(见图5A、B),从第3 天到第5 天(D3~D5)各试验组与对照组开始出现统计学差异(P<0.05),且除了D3 的10%μg/mL 与20%μg/mL 组间(P=0.137)以及D5 的20%μg/mL 与50 μg/mL 组(P=0.141)未见明显差异外,其余各试验组间均有统计学差异(均P<0.05)(见图5C~E)。细胞增殖曲线同样显示重组人IL-3 可促进L428 细胞体外增殖,而且IL-3 浓度越高,其对L428 细胞增殖促进能力越强(图5F)。
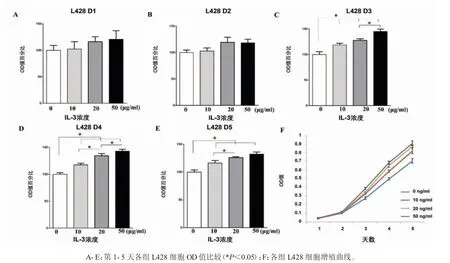
图5 不同浓度IL-3 对L428 细胞增殖的影响
3 讨论
肿瘤微环境是肿瘤的关键特征,是肿瘤生存、发展和免疫耐受与逃避的基础[5]。经典型霍奇金淋巴瘤病理形态学特征具有特异性,即背景细胞绝大部分成为是炎性细胞,如中性粒细胞、T 淋巴细胞、B 淋巴细胞等,只有不到1%的诊断性HRS 细胞。HRS 细胞不仅可以分泌包括细胞因子和趋化因子在内的多种因子,也可以通过所分泌的细胞因子和/或趋化因子,吸引和维持对自身存活和生长有利的背景细胞,如中性粒细胞、T 淋巴细胞、B 淋巴细胞、巨噬细胞、嗜酸性粒细胞、成纤维细胞及肥大细胞等。这些被吸引而来的炎性细胞也能够分泌大量细胞因子,反作用于HRS 细胞。因此,细胞因子/趋化因子与背景细胞二者之间形成一个能够相互作用的分子网络,共同维系HRS 细胞的存活并促进HRS 细胞的增殖[6-7]。趋化因子CXCL16 已被证实在多种恶性肿瘤中的表达,并且与肿瘤发生、发展密切相关[8-11]。经过文献调研,CXCL16 与HL 的关系的研究鲜见报道。我们前期基于公共基因芯片数据库GEO 进行数据分析,发现CXCL16 在HL 中高表达,这与Hanamoto 等[12]在HL 来源细胞株发现的CXCL16 表达结果一致。本研究中,我们首先通过生物信息学分析明确CXCL16 与HL 不良预后密切相关。提示CXCL16 及其受体CXCR6 可能参与了HL 肿瘤微环境细胞因子和趋化因子分子网络。
根据已有报道,肿瘤微环境中CD4+CD25+双表达的Treg 淋巴细胞在HL 的发生、发展中发挥了重要作用。CD4+CD25+双表达的Treg 淋巴细胞不仅能够直接维持HRS 细胞的存活并促进HRS 细胞的增殖,还能通过局部免疫抑制作用,帮助HRS 细胞免受免疫监视和逃避免疫清除[13]。与正常人相比,HL患者外周血中CD4+CD25+双表达的Treg 淋巴细胞数量不仅显著增加[14]。而且Treg 淋巴细胞的数量也与患者的预后呈负相关:HL 患者的Treg/ 辅助性T 细胞的比值越高,无病生存期(Disease-Free Survival,DFS)则越短[15]。本研究结果显示,外源性添加人重组的可溶性CXCL16 蛋白后,对Treg 淋巴细胞具有显著的趋化作用,并与剂量呈正相关。随后我们将L428 细胞与CD4+CD25+双表达的Treg 淋巴细胞进行直接共培养和间接共培养,发现Treg 淋巴细胞不仅能够促进L428 细胞的成团性生长并提高其增殖能力,而且L428 细胞也能反作用于Treg 淋巴细胞,提高其增殖能力。上述结果提示HRS 细胞可能通过分泌CXCL16 吸引和富集Treg 淋巴细胞,并通过与后者相互作用,以诱导产生和维持对自身有利的肿瘤微环境。
文献调研发现,肿瘤微环境中的Treg 淋巴细胞分泌IL-3 后,HRS 能够吸引IL-3 作用于自身的IL-3 受体,进而发挥作用[16-17]。因此,IL-3 可能是HRS 细胞与肿瘤微环境中的Treg 细胞进行“分子对话”中重要介质之一。我们接下来便观察了IL-3 对HRS 细胞增殖的影响。研究结果发现,添加重组人IL-3 可促进L428 细胞的体外增殖能力,而且与IL-3 浓度呈正比。Varricchi G 等人指出,IL-3 是肿瘤微环境中重要的炎性介质,能增强人体免疫系统对于疾病的天然响应。除了本研究中的Treg 淋巴细胞,还有多种炎性细胞,如细胞毒性T 淋巴细胞、中性粒细胞及辅助性T 细胞等均可生成和分泌IL-3%[18]。值得注意的是,IL-3 不仅可以作用于HRS 细胞,对Treg 淋巴细胞本身也有作用[19]。由于Treg 淋巴细胞不仅是HRS 细胞周围数量最多的,而且也是最直接接触HRS 细胞的背景细胞,所以,Treg 淋巴细胞产生和分泌的IL-3 对HRS 细胞的作用非常值得淋巴瘤领域的学者关注。
综上所述,本研究推测HL 肿瘤细胞可高表达CXCL16,进而趋化Treg 淋巴细胞,趋化而来的Treg淋巴细胞可通过分泌IL-3 促进HRS 细胞的增殖;同时,HRS 细胞也能反作用于Treg 淋巴细胞促进其增殖能力。上述的环状机制可能直接影响霍奇金淋巴瘤的进展和患者预后,并为研究HL 肿瘤微环境分子网络提供全新的理论依据。然而,由于HL 微环境背景细胞复杂,趋化因子CXCL16 对于HL 其他背景细胞,如其他T 淋巴细胞、B 淋巴细胞、中性粒细胞、肥大细胞及嗜酸性粒细胞等的作用如何,尚待后续研究进一步证实。

