基于代谢的中药配伍减毒研究进展
陈惠玲 王奇 王建新 卓越
中药配伍是古人根据长期的实践经验得出的临床用药规律,其最早出现在《神农本草经》所提出的“七情配伍”原则中,正如文中所言:“若有毒宜制,可用相畏相杀者。”[1]合理的配伍不仅可以增强药效、提高疗效,还可以减少或消除毒副作用,使药物的使用更加安全[2]。但是,传统中医药理论主要从性味归经、七情等方面阐释中药配伍减毒原理,这些理论缺少现代科学分析的支持,因此,用现代科学技术阐明配伍降低毒性的分子机制是解决中药毒性问题的关键。中药成分在体内经过吸收、分布、代谢、排泄(absorption, distribution, metabolism, excretion,ADME)的过程是其发挥药理作用的基础,疗效和毒副作用容易受代谢过程的影响。通过合理的配伍可以影响有效成分及毒性物质在体内代谢过程,从而达到增效减毒的作用。同时,也可调节毒性物质引起的内源性物质紊乱。本文将以某些常见的有毒中药为切入点,基于代谢的角度去探讨常见有毒中药配伍的减毒机理,为有毒中药的研究及临床的合理应用提供新的思路。
1 常见通过配伍减毒的中药组合回顾
通过数据挖掘[3]可以发现,高频数出现的有毒中药主要包括附子、雷公藤、半夏、川乌等中药,而与之配伍减毒的组合里甘草往往排在前面。见表1。
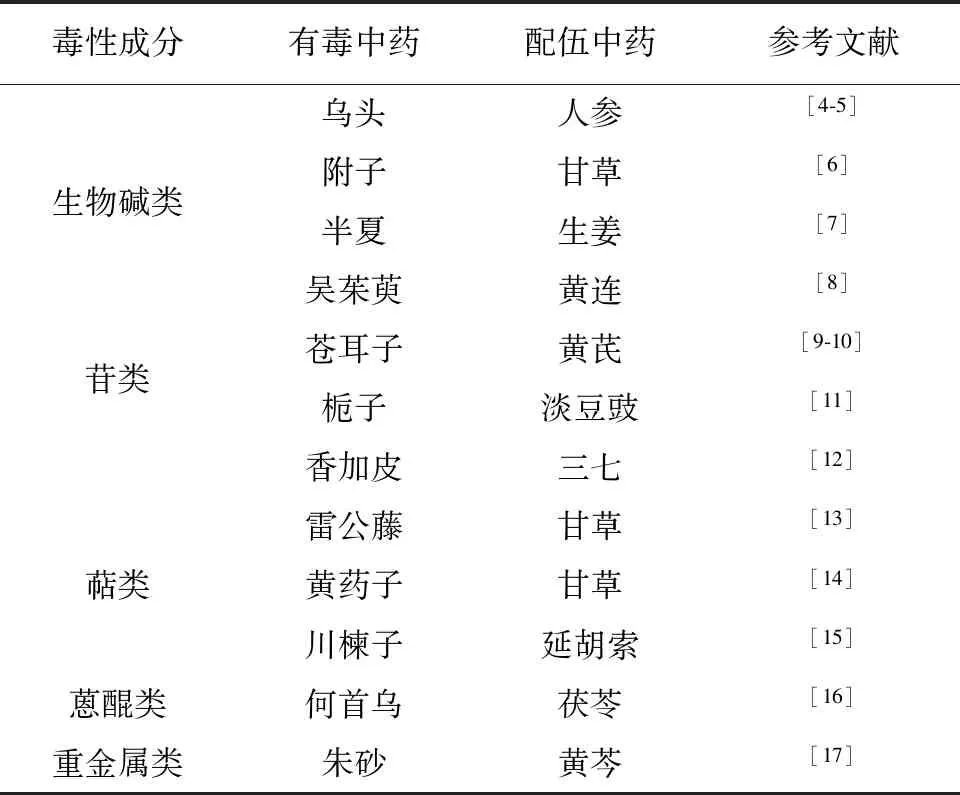
表1 常见的中药配伍减毒组合
2 配伍作用影响外源性物质代谢
某些含生物碱类或苷类的中药具有毒性,然而其有毒成分经药物代谢酶的催化后可变成低毒性代谢产物快速排出体内。某些含萜类中药本身无毒,但其体内的特殊成分经药物代谢酶的催化后可转化成潜在的毒性化合物, 对肝脏造成直接或间接损伤[18]。药物代谢酶主要包括细胞色素P450超家族酶(cytochrome P450, CYP450),尿苷二磷酸葡萄糖醛酸转移酶(uridine diphosphate glucuronyltransferases, UGTs)、磺酸化酶以及脂酶[19],它们在药物代谢中起着重要的作用。传统中药具有多种化合物的特点,其疗效是多种成分协同作用的结果[20],而联合用药后药物活性的变化可能是由于其他药物引起的体内CYP450酶水平的改变,即代谢相互作用[21]。因此配伍作用对代谢酶的抑制或诱导可能影响到一些外源性和内源性物质的代谢,进一步影响机体的平衡状态。
2.1 中药配伍影响外源性物质代谢减轻含生物碱类成分的毒性
某些生物碱能侵害机体的神经中枢系统或产生肝脏毒性,如乌头属的生物碱主要作用于神经系统和心血管系统,过量使用可致室性心律失常和心脏骤停而死亡[22-23]。乌头可分为川乌和草乌,最早记载于《神农本草经》,在明代以前都被统称为乌头。人参与乌头常配对使用,Xu等[4]人基于超高效液相色谱—串联质谱法(UHPLC-MS/MS)法发现在人参的主要活性成分人参皂苷Rg1(ginsenoside Rg1)的参与下,乌头碱的药代动力学行为被改变,其被更快代谢成低毒性的单酯生物碱。原理在于Rg1加强了CYP450酶的活性,使得大毒性的双酯型二萜生物碱快速转化成低毒性的单酯型二萜生物碱[24],且单酯型二萜生物碱还具有较好的抗炎活性,可以达到减毒增效的效果[5](图1)。
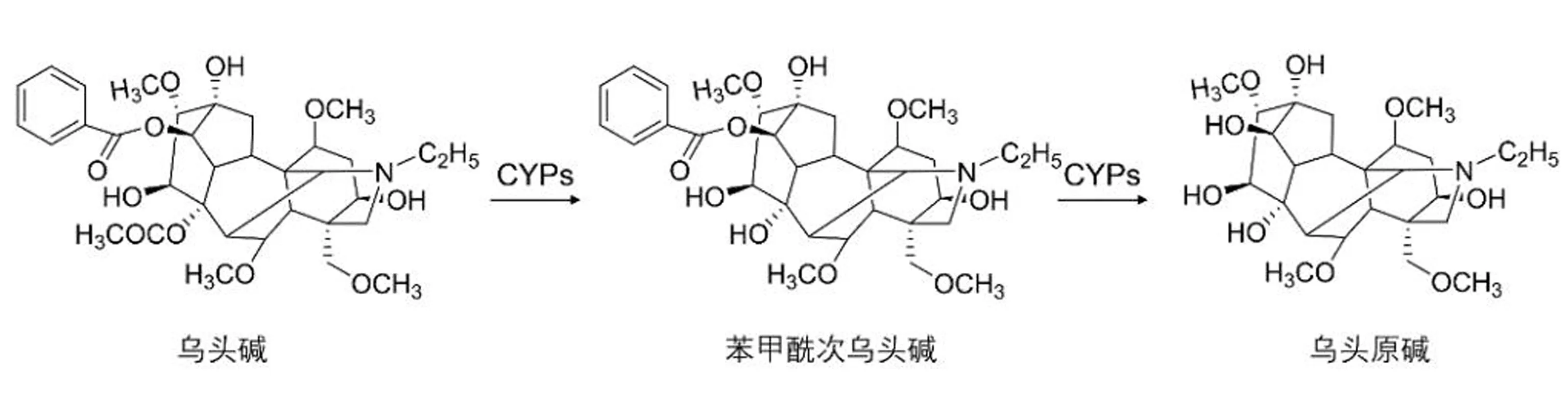
图1 乌头碱的减毒过程
附子是中医临床常用药,具有回阳救逆、补火助阳、散寒止痛的作用,对其使用不当可造成对心脏和神经系统的损害。附子体内的双酯型二萜类生物碱,是发挥功效的活性成分,也是致毒的“罪魁祸首”[25-26]。Ni等[6]人同样利用液相色谱—串联质谱法(LC-MS/MS)的技术证明甘草配伍附子后可提高附子体内毒性生物碱成分的代谢,起到降低附子毒性的作用。其原理与上述乌头减毒的原理一致,都是将剧毒的双酯型二萜生物碱催化转变为毒性较弱的单酯型生物碱,再排出体内。
吴茱萸是常用温里药材,但也具有明显的肝肾毒性[27-28]。有研究总结吴茱萸的毒性机制之一为吴茱萸次碱的仲胺结构被CYP450酶催化为活性代谢物[29],并与大鼠肝细胞中的蛋白质共价结合生成药物—蛋白质共价键加合物,而加合物可能通过损害被修饰蛋白质的生理功能或通过免疫介导机制引起毒性。与吴茱萸最常配伍运用的中药当属黄连,中医经典药方左金丸、戊己丸中皆可见其身影。而黄连与吴茱萸配伍可减少吴茱萸活性代谢产物的生成,以降低吴茱萸对人体的毒害作用,原因在于黄连可显著抑制CYP450酶活性[8]。
有研究表明半夏总生物碱能够对小鼠造成呼吸抑制、抽搐、呕吐等显著的急性毒性反应,提示生物碱可能是半夏的毒性物质基础[30-31]。奚丽君等[7]发现半夏与生姜合用可以让半夏有毒成分在体内快速代谢,实现降低半夏毒性的目的。
2.2 中药配伍影响外源性物质代谢减轻含萜类成分的毒性
黄独别名黄药子,在我国有着悠久的药用历史,临床上常用于治疗缺碘所致甲状腺肿大、多种癌症及呼吸道感染等症[32]。黄独素B(diosbulbin B,DIOB)是一种含呋喃的二萜内酯,也是黄药子的主要有效及毒理成分[33]。DIOB在CYP450酶的催化作用下代谢生成亲电子中间体顺—烯二酮,这种活性中间体可以与蛋白质发生共价键结合进而破坏蛋白质的功能,最终产生肝毒性[34-36](图2)。黄药子肝毒性与剂量和时间有一定的相关性,一定剂量范围内的中毒是可逆的,因此,临床上常通过药物配伍来减弱其毒性[32]。甘草是与黄药子配伍的常用中药,两者配伍后DIOB在体内的代谢被抑制,活性中间体的数目也相应减少,原因在于甘草抑制CYP2E1、CYP3A4的mRNA表达[14],最终减轻了黄药子引起的肝脏毒性。
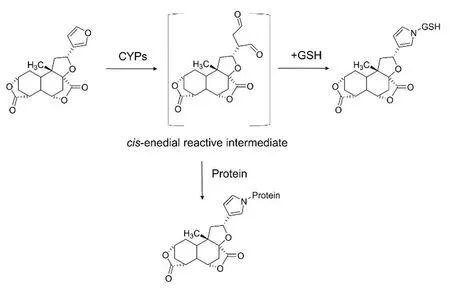
图2 黄药子的致肝毒性机理
雷公藤甲素(triptolide, TP)是目前公认的雷公藤特征活性成分,也是主要毒性成分,对肝脏有明显的毒副作用[37]。它在进入体内后可以经CYP450酶催化生成亲电子中间体,再与大分子物质共价结合引起脂质过氧化,从而诱发肝细胞死亡[36,38](图3)。《本草图经》中记载:“甘草能解百毒,为众药之要”,甘草中的主要成分甘草酸能保护肝脏,因此甘草是雷公藤减毒增效研究中比较受关注的一味中药[39]。张锐等[13]人同样利用LC-MS/MS研究了在甘草介入下雷公藤甲素和雷公藤内酯酮的部分代谢产物,认为是甘草可以加快雷公藤二萜内酯的代谢和转化,从而以更安全高效的代谢产物在体内发挥疗效。
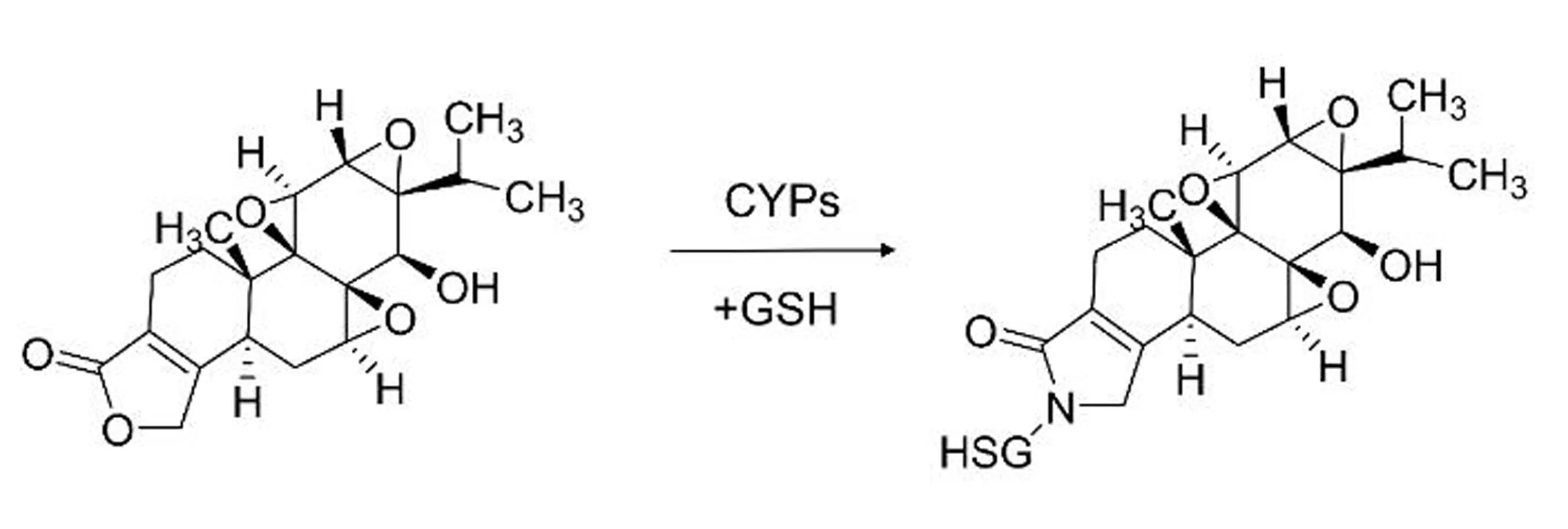
图3 雷公藤甲素与GSH结合模式
2.3 中药配伍影响外源性物质代谢减轻含苷类成分的毒性
苍耳子的肝毒性成分包括苍术苷和羧基苍术苷和毒蛋白类,使用不当或长期使用可造成对肝肾和心脏方面的损害[40]。武斌等[9-10]发现黄芪配伍苍耳子后大鼠体内的谷丙转氨酶(glutamic pyruvic transaminase,ALT),谷草转氨酶(glutamic oxaloacetic transaminase,AST)水平均可见下降,且肝脏病变程度也显著变低,推断黄芪可以通过诱导CYP450酶从而加快苍耳子毒蛋白在体内的代谢,以此减轻苍耳子造成的毒性。
3 配伍作用影响内源性物质代谢
中药可通过多靶点、多通路来干预内源性代谢产物达到治疗疾病的作用。内源性物质的测定对于获取不同生物体中的生物成分、代谢途径和疾病生物标志物等重要的生物信息具有重要意义[41]。大量研究表明中药配伍可引起内源性代谢产物的变化,研究有毒中药及其配伍后内源性代谢产物的变化,可从整体观评价配伍作用的疗效及安全性,进一步促进机制的研究。
3.1 中药配伍影响内源性物质代谢减轻含蒽醌类成分的毒性
何首乌内含二苯乙烯苷、蒽醌类、鞣质和磷脂等多种成分[42],其中的蒽醌类成分如大黄素等可造成肝脏损害[43]。服用何首乌中毒严重时可导致肝衰竭[44]。Gao等[16]人基于超高压液相色谱飞行时间质谱仪(UPLC/QTOF-MS)的代谢组学技术分析茯苓对何首乌的减毒作用,发现何首乌配伍茯苓后可以通过调控不同氨基酸的水平使得精氨酸和脯氨酸代谢、初级胆汁酸生物合成和鞘脂代谢等代谢途径回归平衡状态,从而起到对肝脏的保护作用。
3.2 中药配伍影响内源性物质代谢减轻含萜类成分的毒性
川楝子味苦,性寒,有小毒,川楝素作为其体内主要的活性成分可对肝脏、肾脏、消化系统和生殖系统造成损害[45]。熊印华等[15]运用气相色谱—质谱联用法(GC-MS)等代谢组学手段,从脂肪酸代谢轮廓的角度研究了延胡索对川楝子的减毒作用,发现体循环中延胡索联合川楝子组的脂肪酸的代谢轮廓接近正常组水平。与单独给药组相比,延胡索联合川楝子组的C22:6n3和C20:4n6等脂肪酸量均显著升高,推测延胡索可以上调C22:6n3水平,抑制C20:4n6级联的炎症代谢通路保护肝脏,这可能是延胡索减轻川楝子肝毒性的分子作用机制之一。
3.3 中药配伍影响内源性物质代谢减轻含苷类成分的毒性
香加皮性温、味苦,有毒,内含C21甾体类、强心苷类、三萜类等多种化合物,杠柳毒苷既是其强心的活性成分,也是其产生心脏毒性的毒性成分,若使用不当可损害心脏[46-47]。Wang等[48]人采用GC-MS的代谢组学方法,探索三七中的有效成分三七皂苷对杠柳毒苷的减毒机理,发现三七皂苷可以通过提高琥珀酸苏氨酸、丙氨酸和脯氨酸等内源性代谢产物的水平进而影响三羧酸循环、能量代谢和花生四烯酸代谢,加快杠柳毒苷在体内的代谢,有效降低杠柳毒苷导致的心脏毒性栀子除了具有良好的药用效果,本身对内脏也有一定的毒性作用,其中又以肝毒性损害为主。京尼平苷是栀子中含量最高的环烯醚萜苷类物质[49],也是栀子产生肝毒性的重要物质,且口服给药的毒性比腹腔给药的更强[50-51],而京尼平作为京尼平苷在肠道菌群作用下中的代谢产物,容易与氨基酸等大分子共价结合,引起更严重的毒性反应[52]。罗羽莎[11]利用代谢组学技术从肠道菌群的角度揭示了淡豆豉降低栀子肝毒性的机制,发现淡豆豉与栀子配伍后可通过增加丁酸含量去抵抗栀子导致的肝损伤。原因是丁酸可通过增强肝细胞Nrf2肝细胞核的表达及加长其作用时间来维持肠道屏障的完整性,继而保护京尼平引发的肝损伤。
3.4 中药配伍影响内源性物质代谢减轻含重金属类成分的毒性
朱砂是我国一味传统中药,起安神、镇惊等作用,临床上常被用来治疗失眠、多梦等疾病[53]。然而,朱砂的汞含量极高,即使是小剂量使用也能造成对神经系统和肝肾的损害[54]。有学者[17]利用氢核磁共振(H-NMR)等代谢组学技术,发现黄芩可能通过黄芩苷调节与能量代谢、胆碱代谢、氨基酸代谢和肠道菌群相关的内源性代谢产物来改善肝脏代谢功能。具体表现为:与单独给药组相比,朱砂与黄芩联合给药后可降低大鼠体内缬氨酸、丙氨酸和牛磺酸的水平,积极促进三羧酸循环等一系列代谢途径,从而缓解朱砂对肝肾的损害。
4 讨论
外源性和内源性物质的代谢转变需要药物代谢酶的参与。作为在药物代谢中较为关键的酶类,CYP450酶是研究中药配伍减毒机理中关键的存在。药物对CYP450酶的诱导或抑制可能引发药物间相互作用,导致药物治疗失败或产生毒性。此外,中药对Ⅱ相代谢酶的影响也不容忽视。大部分中药通过口服进入体内,其有效成分再通过肠道的吸收从而发挥药效。中药配伍可通过对II相酶如UGTs的诱导[55]或抑制[56]从而影响肠内代谢环节,继而影响原型药成分及代谢产物等有效成分对药效的整体作用[57]。因此,评估候选药物和新药与代谢酶之间的潜在相互作用,已成为药物开发过程和监管机构指南中不可或缺的一部分[58]。同时加强中药对代谢酶作用的研究不仅有助于了解外源性和内源性物质的代谢变化,也有益于中药新药开发。
药物到达机体的作用部位离不开吸收和分布这两个重要步骤,药物的吸收效率也直接影响到药物在体内的发挥[59]。而草药间的相互作用可以发生在ADME的各个环节[60]。某些有毒的中药如雷公藤,与三七[61]、甘草[62-63]等配伍后可通过降低其毒性成分雷公藤甲素在体内的吸收、分布及加快雷公藤内酯的排泄来达到减毒的效果。因而可知,中药配伍减毒的机制与ADME的各个环节有着紧密的联系,研究不同药物成分在体内ADME过程有助于阐明配伍减毒增效的具体机制。
中药具有多成分、多靶点、多作用、多途径等复杂特征,其体内活性成分是发挥“药效”的物质基础和关键[64],配伍后药物之间的相互作用或药物对代谢酶的影响可能会介入物质基础的代谢与转变。利用代谢组学技术,如选择具有良好选择性、高分辨率的UPLC/QTOF-MS法[65],定性或定量分析配伍前后物质基础的变化,有利于找到配伍作用的靶点及阐明其机制[66]。另一方面,有毒中药配伍减毒的作用机制之一是进入体内的活性成分可以借助直接或间接作用干涉交集区域靶点,抵抗或削弱有毒成分的生物效应,从而发挥减毒作用[67]。而网络药理学从“多基因—多靶点—复杂疾病”的整体模式出发,与中医药的整体观念相符合,是阐明中药复方的理论研究及配伍规律的可靠工具[68]。因此,借助代谢组学技术,结合网络药理学内容对中药复方进行整体、多层次和多水平的研究[69],为阐明中药配伍减毒研究提供更科学、更全面的依据。

