固定与透膜方法对免疫荧光检测肝脏冷冻切片中胰岛素的影响*
张杰, 陆仲夏, 李欣宇, 刘路馨, 路新枝
固定与透膜方法对免疫荧光检测肝脏冷冻切片中胰岛素的影响*
张杰, 陆仲夏, 李欣宇, 刘路馨, 路新枝△
(中国海洋大学医药学院,山东 青岛 266003)
探讨不同的固定与透膜方法对免疫荧光检测小鼠肝脏冷冻切片中胰岛素的影响,为研究胰岛素在肝脏中的代谢及胰岛素与其他分子的相互作用提供技术支持。采用切片前固定或切片后固定,制作小鼠肝脏组织冷冻切片。通过间接免疫荧光技术检测5种固定与透膜方案对小鼠肝脏组织冷冻切片中胰岛素荧光染色的影响。(1)方案1采用4%多聚甲醛固定联合0.5% Triton X-100透膜检测,肝血窦和肝索结构清晰,胰岛素荧光信号主要分布于细胞质膜和细胞质;(2)方案2采用4%多聚甲醛固定联合0.5% saponin透膜检测,肝血窦和肝索结构清晰,切片整体的荧光信号非常微弱,且荧光信号主要分布于细胞质膜附近;(3)方案3采用丙酮一步固定与透膜检测,肝血窦不清晰,部分肝细胞出现肿胀,胰岛素荧光信号主要分布于细胞质膜附近;(4)方案4采用甲醇一步固定与透膜检测,肝血窦不清晰,细胞间界限模糊,胰岛素荧光信号出现明显的核易位;(5)方案5采用4%多聚甲醛(含5%冰醋酸)一步固定与透膜检测,肝血窦和肝索结构清晰,胰岛素荧光信号主要分布于细胞质膜和细胞质。方案1和5适于肝脏冷冻切片中胰岛素的检测。
胰岛素;肝脏;固定;透膜;冷冻切片;免疫荧光
在中国,90%以上的糖尿病患者为2型糖尿病患者[1],胰岛素抵抗和胰岛素分泌不足是2型糖尿病的主要发病机制[2]。肝脏与2型糖尿病的发生息息相关,一方面肝脏是胰岛素作用的重要靶器官,胰岛素通过调控肝糖原合成与分解、以及糖异生途径来维持血糖的稳定[3];另一方面肝脏是胰岛素的主要代谢器官,由胰岛组织释放的胰岛素约有80%由肝脏代谢分解[4],因而任何影响肝脏中胰岛素生理功能或胰岛素代谢的因素都将影响血糖的变化,甚而导致糖尿病的发生。此外,肝脏作为机体主要的解毒器官,肩负着机体内药物、毒素、病原菌等的脱毒和清除任务,而共同的代谢场所使上述物质干扰胰岛素代谢或者与胰岛素发生相互作用的机率大大增加。因此,建立胰岛素在肝脏中的检测方法,将为评价胰岛素的代谢以及胰岛素与其他分子间的作用提供重要的技术支撑。
肝细胞作为胰岛素主要的靶细胞和代谢细胞,其占肝脏细胞总数的60%~80%,直径为15~30 μm[5-6]。胰岛素进入肝细胞的途径分为受体介导的内吞和非受体介导的内化过程,如胞饮[7-8]。通过使用125I或纳米金标记的胰岛素,证实进入肝细胞的胰岛素可分布于内质网、高尔基体、线粒体、核膜和细胞核等处[9-10]。然而,受制于标记物对胰岛素结构或生物活性的影响[11],以及实验动物自身产生的胰岛素无法直接进行标记,建立新的肝脏中胰岛素的原位检测方法迫在眉睫。
免疫荧光技术是一种利用荧光标记的抗体来检测特定抗原的技术,其将抗原抗体反应的特异性和敏感性与显微示踪的精确性相结合。目前,常用免疫荧光染色同时原位检测多种抗原,以荧光显微图像的共定位情况对相关的生物学现象进行描述[12]。共定位检测可将分子间的相互作用、相对位置关系、空间距离等数据可视化和直观化,提供了一种推断体内分子间相互作用的方法[13]。因此,通过免疫荧光技术检测生理条件下胰岛素的空间分布和可能的分子间相互作用,将有利于诠释2型糖尿病的发生机制。
固定、透膜和染色是免疫荧光实验的三个主要步骤。在免疫荧光实验中,有效的透膜和保留细胞结构之间存在着微妙的平衡[14]。除了抗体的品质,固定剂和透膜剂的选择也会明显影响染色结果[15-16]。本研究中,我们主要探究5种固定和透膜组合对肝脏组织冷冻切片中胰岛素荧光染色的影响,为体内研究胰岛素的分布、代谢和其他分子间的相互作用提供技术支持。
材料和方法
1 动物
SPF级C57BL/6小鼠,雄性,6~8周龄,18~20 g,由济南朋悦实验动物繁育有限公司提供,许可证号为SCXK(鲁)2019-0003。
2 主要试剂和仪器
4%多聚甲醛和抗荧光淬灭剂购自武汉赛维尔公司;Triton X-100和山羊血清购自北京索莱宝公司;Saponin购自上海源叶公司;蔗糖和丙酮购自中国国药集团化学试剂公司;甲醇和冰醋酸购自天津富宇公司;Optimal cutting temperature compound(OCT)包埋剂和免疫组化笔购自Biosharp;重组Anti-Insulin抗体、重组Anti-p53 (acetyl K382)抗体和山羊抗兔IgG抗体(Alexa Fluor®488)购自Abcam;4',6-二脒基-2-苯基吲哚(4',6-diamidine-2-phenylindole, DAPI)和重组的人胰岛素购自Sigma-Aldrich。冷冻切片机和激光扫描共聚焦显微镜购自Leica。
3 主要方法
3.1动物处理小鼠禁食不禁水18 h后,实验组小鼠腹腔注射葡萄糖溶液,剂量为2 g/kg,8 min后采用颈椎脱臼法处死小鼠并摘取小鼠肝脏组织。阴性对照组小鼠,不注射葡萄糖溶液。
3.2组织处理将小鼠肝脏组织的左外侧叶切成1 cm×1 cm×1 cm的方块,采用切片前固定或切片后固定的方式处理肝脏组织块,使用冷冻切片机于-20 ℃切片,切片厚度设置为5 μm。肝脏组织切片的固定与透膜方案详见表1。

表1 固定与透膜方案
3.2.1方案1和2肝脏组织块先用4%多聚甲醛溶液于4 ℃固定20 h,随后将其置于20%蔗糖溶液中过夜沉淀脱水。使用OCT于-20 ℃包埋组织块,待包埋剂完全凝固后,进行切片。分别使用0.5% Triton X-100或0.5% saponin透膜。当使用0.5% saponin透膜时,在切片封闭、抗体孵育和切片清洗过程中所用的溶液均需要添加saponin。
3.2.2方案3和4将肝脏组织块立即置于OCT包埋剂中,使用液氮迅速使包埋剂凝固。包埋后的组织块置于冷冻切片机中,待其温度降至-20 ℃时,进行切片。使用在4 ℃冰箱预冷的丙酮或甲醇处理组织切片,进行一步固定与透膜。
3.2.3方案5肝脏组织块先用4%多聚甲醛溶液(含5%冰醋酸)于室温固定4 h,随后将其置于20%蔗糖溶液中过夜沉淀脱水。使用OCT于-20 ℃包埋组织块,待包埋剂完全凝固后,进行切片。
3.3免疫荧光染色方案
3.3.1方案1~4的染色步骤10%山羊血清封闭1 h。然后滴加稀释后的胰岛素Ⅰ抗(1∶200),将切片于4 ℃过夜孵育。使用PBS缓冲液摇洗7 min,重复6次后,滴加稀释后的荧光Ⅱ抗(1∶200),将切片于室温避光孵育2.5 h。使用PBS缓冲液摇洗7 min,重复6次后,滴加DAPI染色液,室温孵育10 min。使用PBS缓冲液摇洗7 min,重复4次后,滴加少量抗荧光淬灭剂并封片。使用激光扫描共聚焦荧光显微镜观察切片,并拍照记录。
3.3.2方案5的染色步骤将Ⅰ抗的孵育方式调整为室温14 h;将Ⅱ抗的孵育方式调整为室温6 h。其余步骤与3.3.1中的相同。
3.4抗体特异性检测利用抗原阻断法,即将抗Insulin抗体与重组人胰岛素按照摩尔比1∶2预先孵育后再检测切片中胰岛素,以确定胰岛素Ⅰ抗的特异性,并采用重组抗p53(acetyl K382)抗体作为同型对照,以检测抗体Fc片段的非特异性结合。通过仅加荧光Ⅱ抗,不加胰岛素Ⅰ抗,以检测荧光Ⅱ抗的非特异性结合。
3.5图像获取切片使用Leica TCS SP8 STED 3X激光扫描共聚焦显微镜(Leica Microsystems)和LAS X软件(Leica Microsystems CMS GmbH)进行拍摄和调节,软件版本3.5.5.19976。图像处理使用Adobe Photoshop 2021软件(Adobe Systems)和ImageJ 8.0软件(National Institutes of Health)进行处理。
结果
1 抗体特异性检验结果
如图1所示,与阳性对照组相比,阴性对照组未检测到明显的荧光,表明重组Anti-Insulin抗体特异性良好;同型对照组的阴性结果说明重组Anti-Insulin抗体Fc段无非特异性结合,表明封闭方法是合适的;荧光Ⅱ抗对照组也未检测到明显的荧光,可以排除荧光Ⅱ抗的非特异性结合;自发荧光对照组同样未检测到明显的荧光,可以排除组织切片自发荧光的影响。
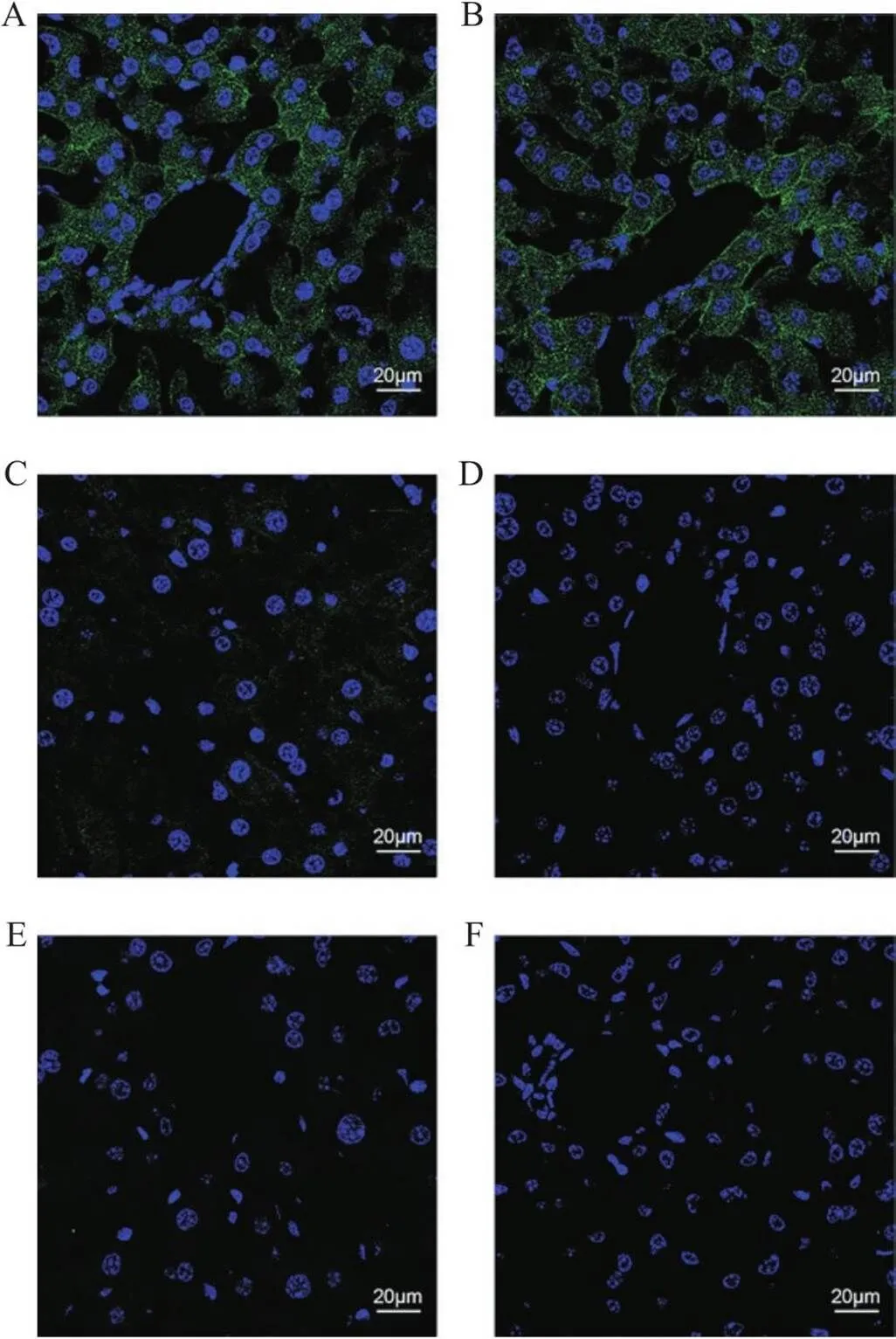
Figure 1. Antibodies specificity verification. A~B: positive control group; C: negative control group; D: fluorescent secondary antibody control group; E: isotype control group; F: autofluorescence control group. Compared with the positive control group, the images in the negative control group, fluorescent secondary antibody control group, isotype control group, and autofluorescence control group exhibited significantly weaker fluorescence intensity. The sections were immunostained with anti-insulin antibody (A~C), anti-p53 antibody (E), goat anti-rabbit IgG (Alexa Fluor® 488) antibody (A~E), and DAPI (A~F). n=3.
2 各方案免疫荧光染色结果
方案1的检测结果如图2所示,肝细胞大小正常,肝血窦和肝索结构清晰。肝细胞中胰岛素荧光信号主要分布于细胞质膜和细胞质中,细胞核内存在较弱的荧光信号。
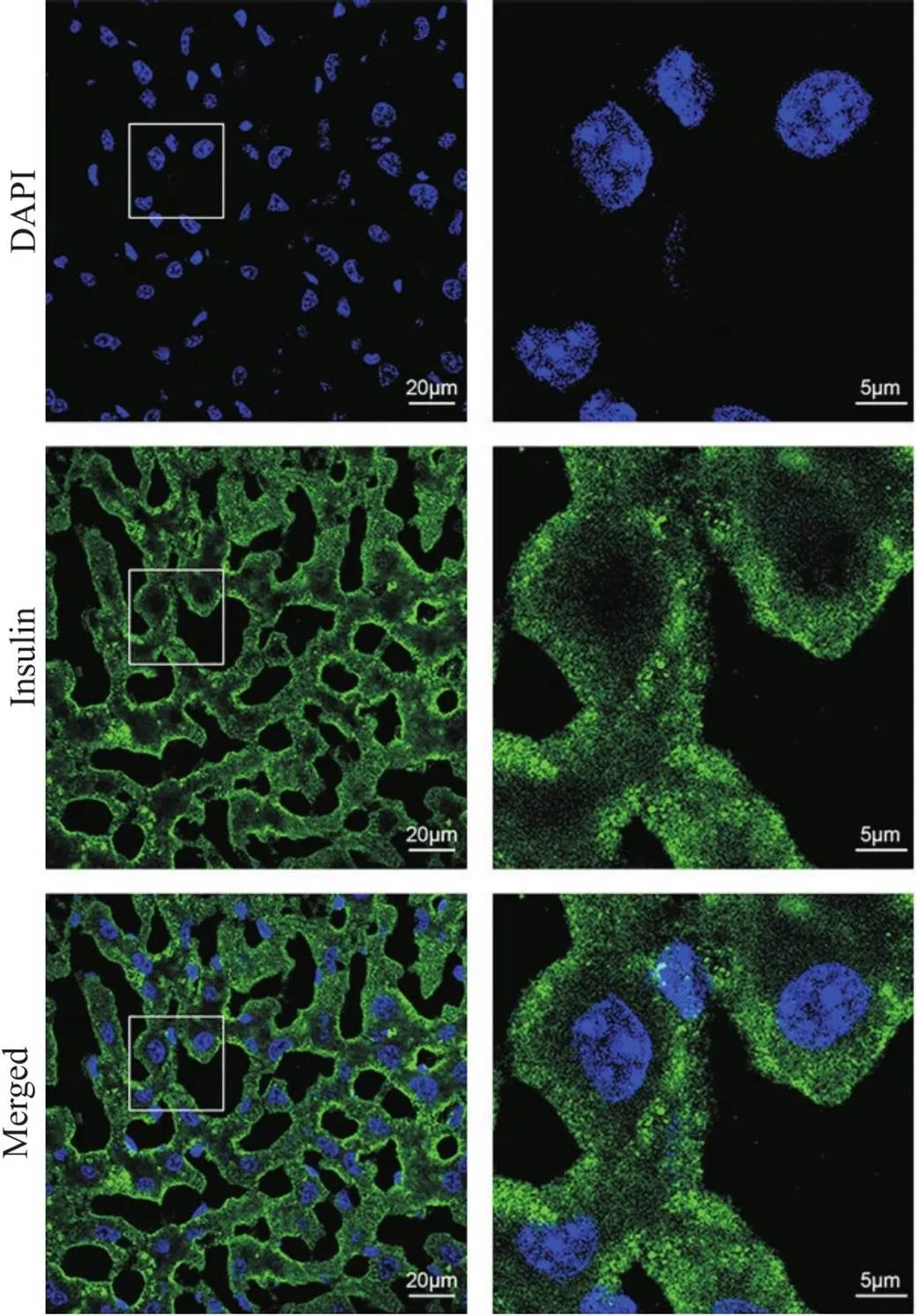
Figure 2. Immunofluorescence staining of insulin using the 4% paraformaldehyde fixation and 0.5% Triton X-100 permeabilization protocol. The sections were immunostained with anti-insulin antibody, goat anti-rabbit IgG (Alexa Fluor® 488) antibody, and DAPI (green, insulin; blue, nucleus). The images on right provide a magnified view of the images on left. n=3.
方案2的检测结果如图3所示,肝细胞大小正常,肝血窦和肝索结构清晰。组织切片整体荧光非常弱,胰岛素荧光信号主要分布在肝细胞质膜附近,胞质中有微弱的胰岛素荧光信号,细胞核内未检测到胰岛素荧光信号。
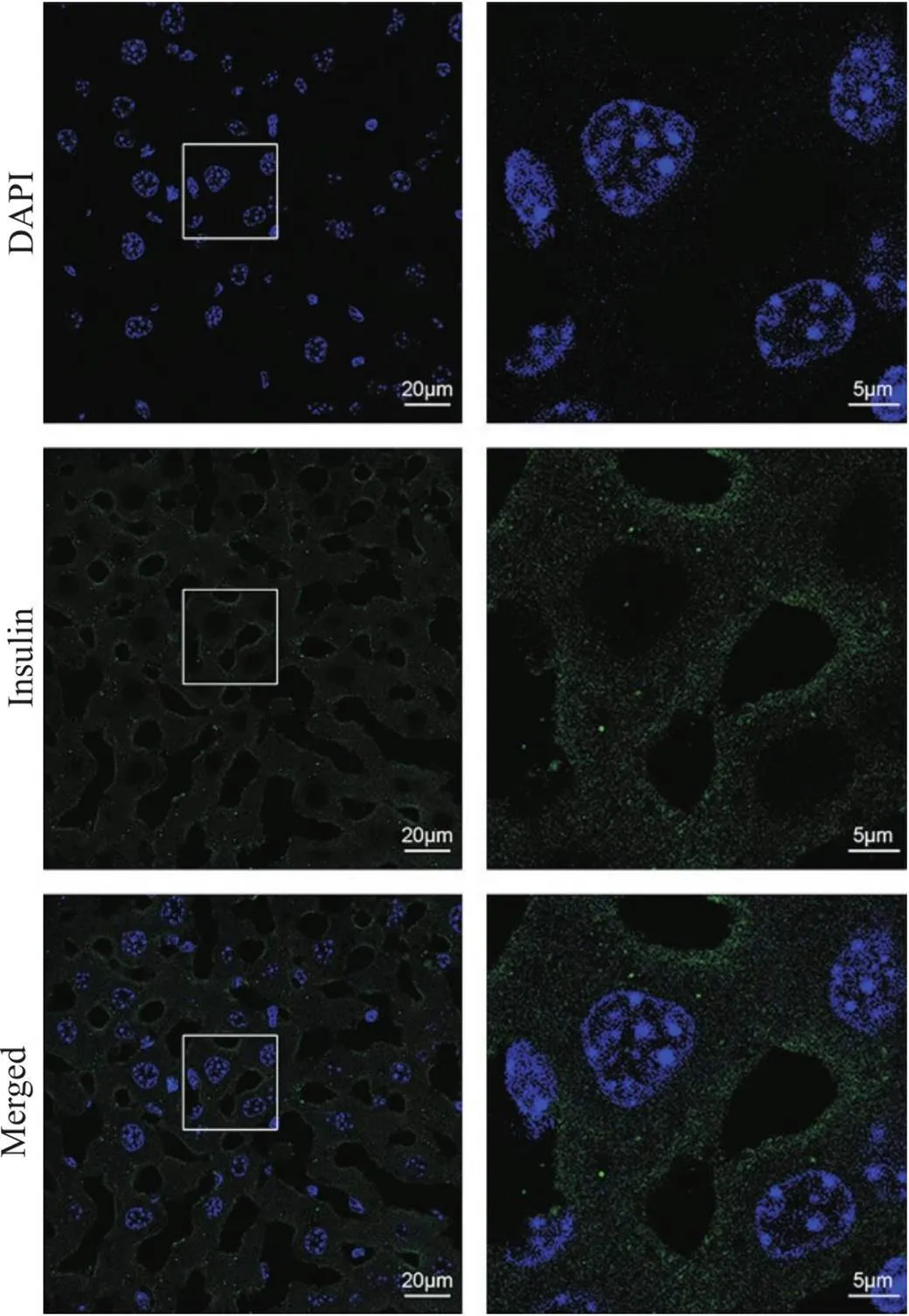
Figure 3. Immunofluorescence staining of insulin using the 4% paraformaldehyde fixation and 0.5% saponin permeabilization protocol. The sections were immunostained with anti-insulin antibody, goat anti-rabbit IgG (Alexa Fluor® 488) antibody, and DAPI (green, insulin; blue, nucleus). The images on right provide a magnified view of the images on left. n=3.
方案3的检测结果如图4所示,部分肝细胞出现肿胀,肝血窦结构不清晰,可见少量冰晶造成的孔洞。胰岛素荧光信号主要分布于肝细胞质膜附近,细胞质和细胞核有微弱的胰岛素荧光信号。
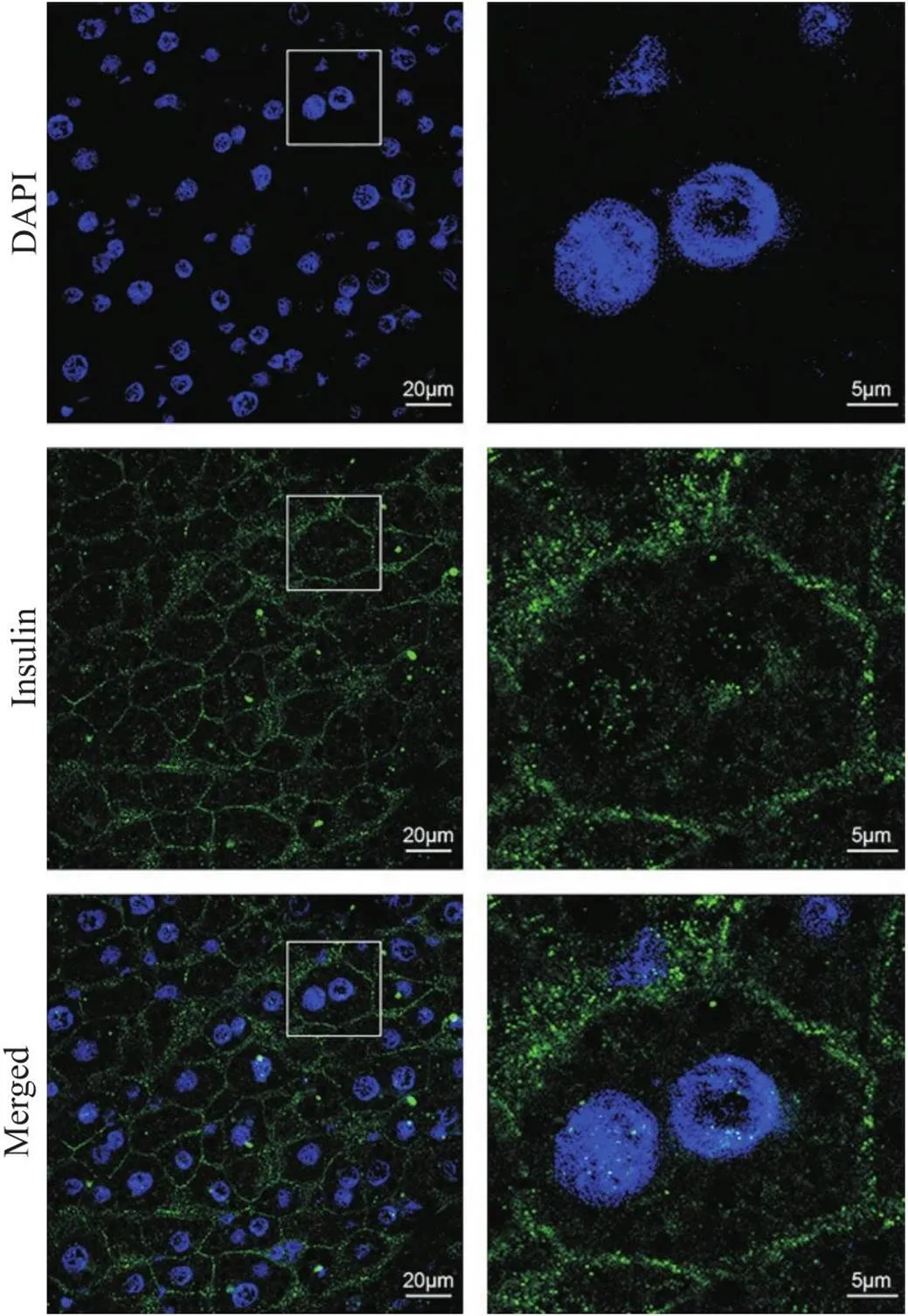
Figure 4. Immunofluorescence staining of insulin using the acetone one-step fixation and permeabilization protocol. The sections were immunostained with anti-insulin antibody, goat anti-rabbit IgG (Alexa Fluor® 488) antibody, and DAPI (green, insulin; blue, nucleus). The images on right provide a magnified view of the images on left. n=3.
方案4的检测结果如图5所示,肝血窦结构不清晰,细胞间界限模糊,细胞大小较难确定。胰岛素荧光信号广泛分布于组织切片中,细胞核中存在强烈的点状荧光信号。
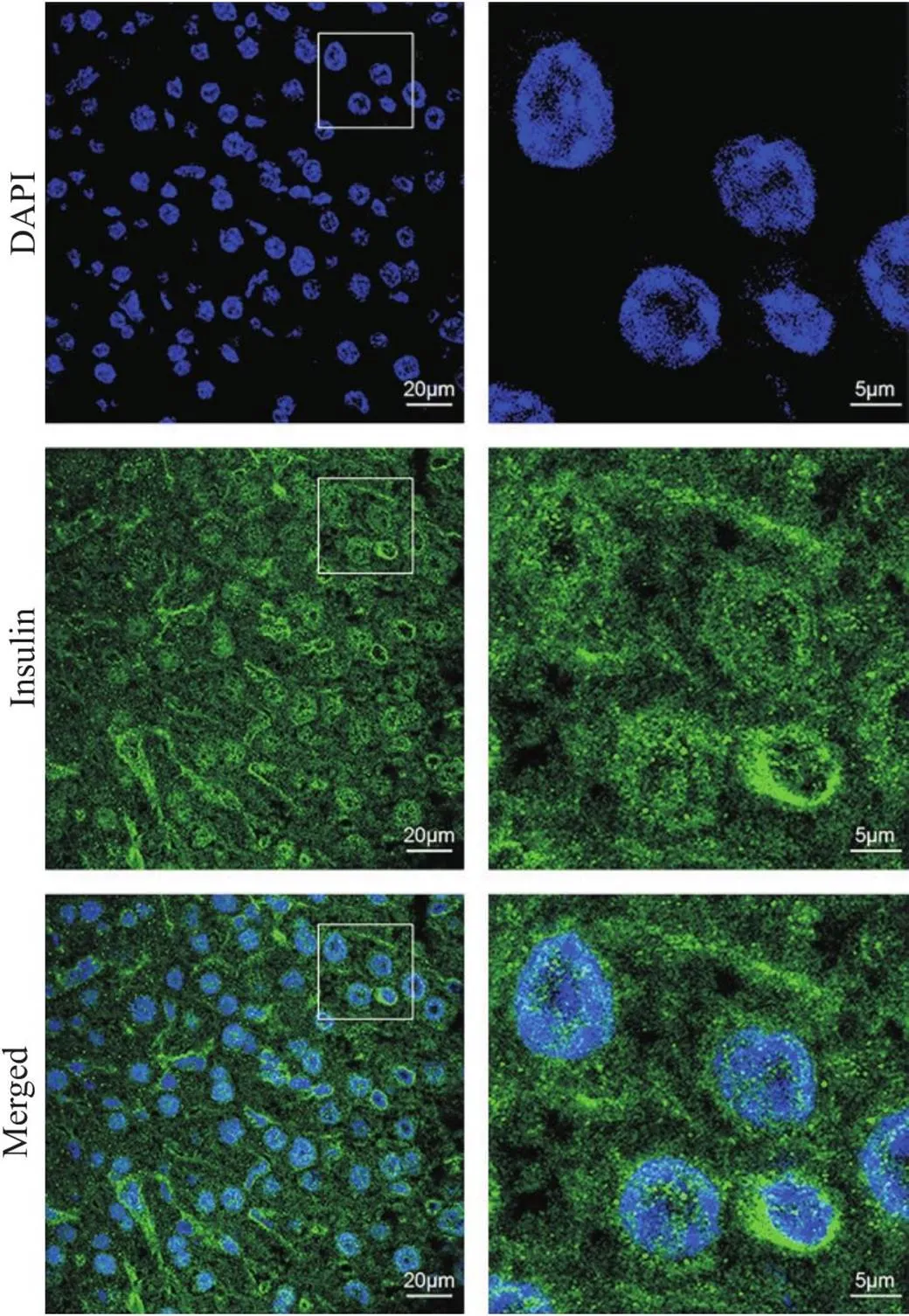
Figure 5. Immunofluorescence staining of insulin using the methanol one-step fixation and permeabilization protocol. The sections were immunostained with anti-insulin antibody, goat anti-rabbit IgG (Alexa Fluor® 488) antibody, and DAPI (green, insulin; blue, nucleus). The images on right provide a magnified view of the images on left. n=3.
方案5的检测结果如图6所示,肝细胞比方案1和2组织切片中的肝细胞略大,肝血窦和肝索结构清晰。胰岛素荧光信号分布于肝细胞质膜和细胞质,细胞核处也能检测到少量胰岛素荧光信号,且荧光信号具有聚集性。
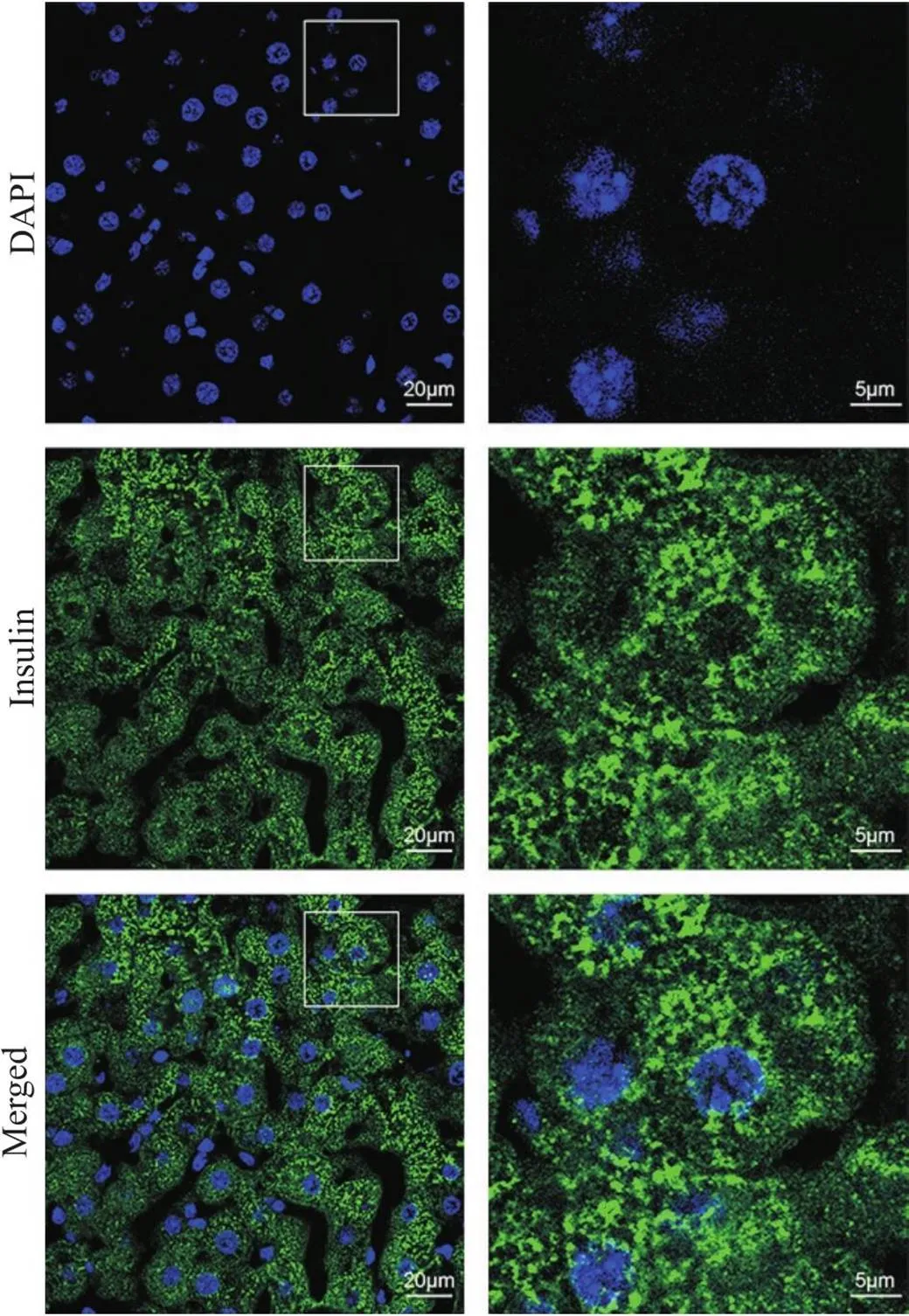
Figure 6. Immunofluorescence staining of insulin using the 4% paraformaldehyde (containing 5% glacial acetic acid) one-step fixation and permeabilization protocol. The sections were immunostained with anti-insulin antibody, goat anti-rabbit IgG (Alexa Fluor® 488) antibody, and DAPI (green, insulin; blue, nucleus). The images on right provide a magnified view of the images on left. n=3.
3 各方案免疫荧光染色结果比较
染色结果比较见表2和表3,从组织形态来看,采用方案3和4时,肝血窦结构均不清晰,采用方案3时,部分肝细胞出现肿胀,采用方案4时,细胞间界限模糊。采用方案1、2和5时,组织形态良好。从染色效果来看,采用方案3时,细胞质中的胰岛素荧光信号出现明显丢失;采用方案4时,胰岛素荧光信号被明显重新分布至细胞核中;采用方案2时,切片整体荧光非常微弱。采用方案1和5时,染色效果较好。
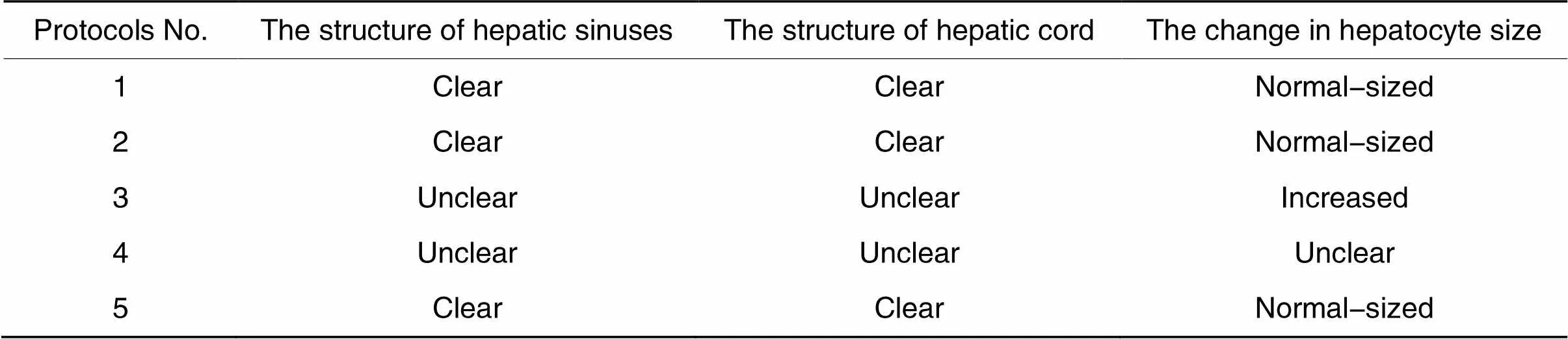
表2 组织形态比较

表3 荧光染色结果比较
讨论
本研究采用免疫荧光技术探索肝脏中胰岛素的检测方法,该方法可以克服预标记技术对胰岛素结构和生理活性的影响[11],同时该方法既适于检测外源胰岛素,也适于检测机体释放的内源胰岛素。由于免疫荧光技术不仅能定量抗原分子,还能推断分子间相互作用[13],因而本研究可为评价药物、毒素或其他分子对胰岛素在肝脏中的代谢、与胰岛素的相互作用提供了技术支撑。
免疫荧光实验中,为了使荧光染色结果准确反映抗原的亚细胞定位,必须满足两个要求:一是抗原必须保留在标本内的原始位置;二是抗原表位必须充分暴露以结合抗体。迄今,已有多种固定和透膜方案被用于免疫荧光实验,通常认为这些方法能满足抗原保留和表位可及性的要求。然而,Hannah等[17]指出实际上这两个要求很少能同时满足。因此,固定剂和透膜剂的选择将影响抗原的分布和检测效果。
多聚甲醛固定联合Triton X-100透膜是免疫荧光实验中常用的方法之一。多聚甲醛的醛基通过形成亚甲基桥来固定蛋白质,且不改变蛋白质的三维结构[18]。但是多聚甲醛的这种交联作用降低了细胞膜的通透性,因此必须使用适当的透膜剂在细胞膜上打孔,以使大分子抗体进入细胞内。Triton X-100作为透膜剂能溶解细胞膜上的脂质[19],其对核膜也有一定的通透作用[20],从而使抗体既能够识别细胞质内抗原,也能识别细胞核内的抗原。此外,由于Triton X-100是一种强去污剂,它具有溶解某些蛋白质的能力,如脂肪分化相关蛋白、47 kD尾连蛋白、牛血清白蛋白和乳酸脱氢酶等[15,17,21],进而影响它们的细胞定位,造成这些蛋白定位异常。根据文献报道,Triton X-100能结合胰岛素[22],同时细胞核中存在胰岛素的结合位点[23],这也可能导致在细胞核处检测到假阳性荧光信号。因此,对于Triton X-100处理检测到细胞核中存在微弱的胰岛素荧光信号,目前尚无法确定是属于正常分布还是被重新分布至细胞核。
Saponin是一种温和的非离子型去污剂,可以溶解细胞膜上的胆固醇。Saponin主要影响胆固醇含量高的细胞膜,如细胞质膜,而胆固醇含量低的内质网膜、核膜和线粒体膜,受影响较小[19]。此外,saponin的透膜过程是可逆的,在抗体孵育和洗涤的溶液中必须加入saponin,否则细胞膜将会重新闭合[24],而过多的saponin使用也会导致某些蛋白被溶解丢失或重新分配[25-27]。在本研究中,采用方案2检测时,切片整体荧光明显下降。我们推测主要原因是saponin透膜能力弱造成的,也不排除saponin对胰岛素具有溶解作用,使其随清洗液一起被清除。
有机试剂如丙酮和甲醇也常用于免疫荧光实验。有机试剂在凝结蛋白质的同时,可以溶解细胞膜上的脂质,因而可以同时完成细胞固定和细胞膜通透[19]。与Triton X-100相似,丙酮和甲醇也能破坏细胞核膜[28],可以用于细胞质和细胞核内的抗原检测。无论是丙酮还是甲醇都存在提取某些蛋白质的作用[19]。例如丙酮能提取出细胞核内的含缬酪肽蛋白,相反甲醇则会使某些抗原优先集中在细胞核周围[21],但是相关机理目前尚不清楚。本研究观测到了丙酮和甲醇对胰岛素的提取作用,丙酮处理导致细胞质中胰岛素的荧光信号降低,而甲醇使部分胰岛素重新分布至细胞核内。肝脏组织存在较多的水分,采用方案3和4检测时,发现细胞出现肿胀和界限模糊,推测可能是由于组织未经过脱水处理,在液氮速冻过程中细胞内液膨胀造成细胞体积增大[29-30],也可能与有机溶剂的使用温度有关[31],但确切机制有待阐明。
短链脂肪族羧酸可以调节醛类固定剂对蛋白质的交联作用,使多聚甲醛形成的亚甲基交联桥更为松散,从而增加细胞的通透性[18]。多聚甲醛与短链脂肪酸尤其是冰醋酸联合使用同样能达到一步固定和透膜作用。同时,该方法也避免了使用去污剂和有机溶剂的干扰。相较于方案1的结果,本方案检测到部分的胰岛素荧光信号具有聚集性,证明Triton X-100确有溶解胰岛素的作用。同时,由于Triton X-100容易破坏内体的结构[32],方案5适合检测内体中的胰岛素。
综上所述,本研究通过制作肝脏组织冷冻切片,探究了5种固定与透膜组合对胰岛素免疫荧光染色的影响,结果显示4%多聚甲醛固定联合Triton X-100透膜或4%多聚甲醛(含5%冰醋酸)一步固定与透膜比较适合于检测内源性的胰岛素在肝脏组织冷冻切片中的空间分布。
[1]中华医学会糖尿病学分会. 中国2型糖尿病防治指南(2020年版)[J]. 中华糖尿病杂志, 2021, 13(4):315-409.
Diabetes Society of Chinese Medical Association. Chinese guidelines for the prevention and treatment of type 2 diabetes (2020 Edition)[J]. Chin J Diabetes, 2021, 13(4):315-409.
[2]杨坡,李艳红,韩扬卓,等. 禁食疗法减轻2型糖尿病作用机制的研究进展[J]. 中国病理生理杂志, 2021, 37(6):1146-1152.
Yang P, Li YH, Han YZ, et al. Mechanism of fasting treatment to attenuate type 2 diabetes mellitus[J]. Chin J Pathophysiol, 2021, 37(6):1146-1152.
[3]张利众,赵瑞景,刘建坤,等. 吡咯烷二硫代氨基甲酸酯对2型糖尿病大鼠肝糖原合成的影响[J]. 中国病理生理杂志, 2010, 26(12):2442-2446.
Zhang LZ, Zhao RJ, Liu JK, et al. Effects of pyrrolidine dithiocarbamate on synthesis of hepatic in diabetic rats[J]. Chin J Pathophysiol, 2010, 26(12):2442-2446.
[4] Najjar SM, Perdomo G. Hepatic insulin clearance: mechanism and physiology[J]. Physiology (Bethesda), 2019, 34(3):198-215.
[5] Li J, Chen C, Xia T. Understanding nanomaterial-liver interactions to facilitate the development of safer nanoapplications[J]. Adv Mater, 2022, 34(11):e2106456.
[6]李继承,曾园山. 组织学与胚胎学[M]. 第9版. 北京:人民卫生出版社, 2018:149-151.
Li JC, Zeng YS. Histology and embryology[M]. 9th ed. Beijing: People's Medical Publishing House, 2018:149-151.
[7] Mcclain DA. Mechanism and role of insulin receptor endocytosis[J]. Am J Med Sci, 1992, 304(3):192-201.
[8] Harada S, Loten EG, Smith RM, et al. Nonreceptor mediated nuclear accumulation of insulin in H35 rat hepatoma cells[J]. J Cell Physiol, 1992, 153(3):607-613.
[9] Goldfine I D, Jones AL, Hradek GT, et al. Electron microscope autoradiographic analysis of [125I]iodoinsulin entry into adult rat hepatocytes: evidence for multiple sites of hormone localization[J]. Endocrinology, 1981, 108(5):1821-1828.
[10] Harada S, Smith RM, Jarett L. Mechanisms of nuclear translocation of insulin[J]. Cell Biochem Biophys, 1999, 31(3):307-319.
[11] Vu T, Taylor MJ, Singh H,et al. Synthesis and identification of biologically active mono-labelled FITC-insulin conjugate[J]. J Fluoresc, 2022, 32(2):569-582.
[12] Zinchuk V, Zinchuk O, Okada T. Quantitative colocalization analysis of multicolor confocal immunofluorescence microscopy images: pushing pixels to explore biological phenomena[J]. Acta Histochem Cytochem, 2007, 40(4):101-111.
[13] 关苑君,容婵,梁翠莎,等. 共聚焦和超分辨率显微荧光图像的共定位分析浅谈[J].电子显微学报, 2020, 39(1):90-99.
Guan WJ, Rong C, Liang CS, et al. Colocalization analysis of confocal and super resolution microscopy fluorescence images[J]. J Chin Electr Microsc Soc, 2020, 39(1):90-99.
[14] Stadler C, Skogs M, Brismar H, et al. A single fixation protocol for proteome-wide immunofluorescence localization studies[J]. J Proteomics, 2010, 73(6):1067-1078.
[15] Ohsaki Y, Maeda T, Fujimoto T. Fixation and permeabilization protocol is critical for the immunolabeling of lipid droplet proteins[J]. Histochem Cell Biol, 2005, 124(5):445-452.
[16] Shibata T, Tanaka T, Shimizu K, et al. Immunofluorescence imaging of the influenza virus M1 protein is dependent on the fixation method[J]. J Virol Methods, 2009, 156(1-2):162-165.
[17] Hannah M J, Weiss U, Huttner W B. Differential extraction of proteins from paraformaldehyde-fixed cells: lessons from synaptophysin and other membrane proteins[J]. Methods, 1998, 16(2):170-181.
[18] Fernández J, Fuentes R. Fixation/permeabilization: new alternative procedure for immunofluorescence and mRNAhybridization of vertebrate and invertebrate embryos[J]. Dev Dyn, 2013, 242(5):503-517.
[19] Jamur MC, Oliver C. Permeabilization of cell membranes[J]. Methods Mol Biol, 2010, 588:63-66.
[20] Goidl JA. Insulin binding to isolated liver nuclei from obese and lean mice[J]. Biochemistry, 1979, 18(17):3674-3679.
[21] Melan MA, Sluder G. Redistribution and differential extraction of soluble proteins in permeabilized cultured cells. Implications for immunofluorescence microscopy[J]. J Cell Sci, 1992, 101(4):731-743.
[22] Siposova K, Sedlak E, Kozar T, et al. Dual effect of non-ionic detergent Triton X-100 on insulin amyloid formation[J]. Colloids Surf B Biointerfaces, 2019, 173:709-718.
[23] Goldfine ID, Smith GJ. Binding of insulin to isolated nuclei[J]. Proc Natl Acad Sci U S A, 1976, 73(5):1427-1431.
[24] Fischer AH, Jacobson KA, Rose J, et al. Fixation and permeabilization of cells and tissues[J]. CSH Protoc, 2008, 2008:pdb.top36.
[25] Ciechomska IA, Tolkovsky AM. Non-autophagic GFP-LC3 puncta induced by saponin and other detergents[J]. Autophagy, 2007, 3(6):586-590.
[26] Krutzik PO, Nolan GP. Intracellular phospho-protein staining techniques for flow cytometry: monitoring single cell signaling events[J]. Cytometry A, 2003, 55(2):61-70.
[27] Pillion DJ, Recchia J, Wang P, et al. DS-1, a modifiedsaponin, enhances ocular and nasal absorption of insulin[J]. J Pharm Sci, 1995, 84(11):1276-1279.
[28] Hoetelmans RW, Prins FA, Cornelese-Ten Velde I, et al. Effects of acetone, methanol, or paraformaldehyde on cellular structure, visualized by reflection contrast microscopy and transmission and scanning electron microscopy[J]. Appl Immunohistochem Mol Morphol, 2001, 9(4):346-351.
[29] 胡锦林,王灿铭,郭振英. 固定液对冷冻切片质量的影响[J].临床与实验病理学杂志, 2015, 31(6):706-707.
Hu JL, Wang CM, Guo ZY. Effect of the fixed solution on the quality of frozen sections[J]. J Clin Exp Pathol, 2015, 31(6):706-707.
[30] 胥维勇,杨群. 影响冷冻切片质量因素的分析[J]. 中国组织化学与细胞化学杂志, 2003, 12(2):228-229.
Xu WY, Yang Q. Analysis of factors affecting the quality of frozen sections[J]. Chin J Histochem Cytochem, 2003, 12(2):228-229.
[31] Cinar O, Semiz O, Can A. A microscopic survey on the efficiency of well-known routine chemical fixatives on cryosections[J]. Acta Histochem, 2006, 108(6):487-496.
[32] Scheffler JM, Schiefermeier N, Huber LA. Mild fixation and permeabilization protocol for preserving structures of endosomes, focal adhesions, and actin filaments during immunofluorescence analysis[J]. Methods Enzymol, 2014, 535:93-102.
Effects of fixation and permeabilization protocols on immunofluorescence detection of insulin in liver frozen sections
ZHANG Jie, LU Zhongxia, LI Xinyu, LIU Luxin, LU Xinzhi△
(,,266003,)
To investigate the impacts of various fixation and permeabilization methods on the immunofluorescence detection of insulin in frozen sections of mouse liver, as well as to offer technical assistance for investigating insulin metabolism and the interactions between insulin and other molecules in the liver.Frozen sections of mouse liver were obtained using either pre-sectioning or post-sectioning fixation. The effects of five different fixation and permeabilization protocols on insulin fluorescence staining were examined in these liver sections using the indirect immunofluorescence technique.(1) In protocol 1, using 4% paraformaldehyde fixation paired with 0.5% Triton X-100 permeabilization resulted in well-defined structures of hepatic sinuses and hepatic cords. Insulin fluorescence signals were predominantly found in the cytoplasmic membrane and the cytoplasm. (2) In protocol 2, following 4% paraformaldehyde fixation coupled with 0.5% saponin permeabilization, clear structures of hepatic sinuses and hepatic cords were seen. However, fluorescence signals across the sections were relatively weak and primarily localized near the cytoplasmic membrane. (3) With protocol 3, utilizing the one-step fixation and permeabilization with acetone led to unclear hepatic sinuses and some hepatocytes exhibiting swelling. Insulin fluorescence signals were mainly concentrated near the cytoplasmic membrane. (4) For protocol 4, using the one-step fixation and permeabilization with methanol resulted in indistinct hepatic sinuses, unclear cellular boundaries, and noticeable nuclear translocation of insulin fluorescence signals. (5) In protocol 5, employing the one-step fixation and permeabilization with 4% paraformaldehyde (inclusive of 5% acetic acid) resulted in sharply outlined structures of hepatic sinuses and hepatic cords. Insulin fluorescence signals were primarily located in the cytoplasmic membrane and the cytoplasm.Protocols 1 and 5 are deemed suitable for detecting insulin in liver frozen sections.
insulin; liver; fixation; permeabilization; frozen section; immunofluorescence
R587.1; R363
A
10.3969/j.issn.1000-4718.2023.09.023
1000-4718(2023)09-1716-08
2023-06-25
2023-09-01
国家重点研发计划专项(No. 2018YFC0311105)
Tel: 0532-82032067; E-mail: luxinzhi@ouc.edu.cn
(责任编辑:宋延君,李淑媛)

