小麦DH高效生产技术体系在云南的研究与应用
杨忠慧,杨木军,李绍祥,丁明亮,刘 琨,顾 坚,李宏生
(云南省农业科学院粮食作物研究所/国家小麦改良中心云南分中心,云南昆明 650205)
双单倍体(doubled haploid, DH)技术可使杂合育种材料在一个世代纯合稳定,该技术与分子育种技术整合,可构建精准、快速的高效育种技术体系,成倍提高育种效率[1-3]。另外,通过对小麦单倍体胚进行基因编辑并结合DH技术,可降低小麦基因组的复杂性,提高基因(组)编辑效率[4]。
建立高效DH生产技术体系是DH 技术在作物育种中广泛应用的前提。小麦×玉米远缘杂交技术具有单倍体胚产生频率较高、稳定性较好、不产生白化苗以及无严格基因型限制等优点,目前已在国内外小麦遗传育种中成功应用[5-6]。该技术的主要缺点是小麦和玉米一般在不同季节种植,需在人工气候室来实现两者花期相遇;其次是产生的单倍体胚或单倍体苗无染色体组自然加倍,需人工加倍处理;此外,染色体加倍化学试剂(如秋水仙素)毒性较大,加倍溶液需妥善处理。
自Zenkteler等[7]和Laurie等[8]报道小麦×玉米杂交产生小麦DH的技术规程以来,经各国学者不断研究与改进,目前主要包括以下步骤:麦穗去雄、授玉米花粉、激素处理、单倍体胚诱导发育、单倍体胚接种培养并萌发成单倍体苗、单倍体苗的染色体加倍。其中,得胚率(指小麦小花用玉米花粉授粉后,获得可供接种培养的单倍体胚产生频率)、成苗率(指单倍体胚接种后能萌发形成单倍体苗的百分率)、加倍率(指单倍体苗经染色体加倍处理后,能收获自交结实种子的双单倍体的百分率)是评价DH技术成熟度的3个关键指标。
为提高小麦×玉米杂交产生小麦DH的效率,2000年以来,本团队借助云南昆明自然条件下小麦(冬性和半冬性小麦需春化预处理)和玉米可同季种植、4月至12月花期可相遇的有利条件,在国内外相关研究的基础上,以简化技术规程、提高DH生产效率、适于育种应用为目标,持续系统地开展了小麦×玉米杂交生产小麦DH的相关研究,初步建立了小麦DH批量生产技术体系[9-14],并促进了该技术在小麦遗传育种中的应用。本文总结了过去20年该技术在云南省的研究进程及其在国内小麦遗传育种中的应用进展,以期为DH技术在小麦遗传育种中的广泛应用提供帮助。
1 小麦DH生产技术规程的研究改进
DH技术在育种中需要大批量甚至规模化生产小麦DH,因此必须考虑DH的生产效率和单位成本。本团队在国内外报道的小麦×玉米杂交产生小麦DH的操作规程基础上,借助云南昆明的自然生态条件,对小麦DH生产技术规程进行了研究、简化和改进。
1.1 昆明自然条件下小麦和玉米的可杂交期研究
昆明气温年较差小,夏季和秋季气候温和,自然条件下春性小麦材料一年四季均可播种。本团队从2002年2月9日至2003年2月1日利用7个本地春性小麦品系在昆明每隔7 d播种一期,连续播种52期,每期都能正常生长发育至成熟(数据未发表)。半冬性、冬性小麦材料经春化预处理后在昆明夏播即可正常抽穗,冬播或春播则无需进行春化处理。因此,昆明具有开展小麦×玉米杂交生产小麦DH的有利自然条件。
2003年小麦与玉米的花期同步试验结果表明,昆明自然条件下小麦与玉米的可杂交期为5月上旬至10月上旬,共180 d[11]。由于春性和经过春化处理的冬性、半冬性小麦材料在昆明自然条件下一年四季均可种植,因此延长玉米花粉供给时间即可增加小麦与玉米的可杂交期。昆明1月和10月虽然白天气温超过20 ℃,但平均气温较低,分别只有10 ℃和17 ℃左右(http://data.cma.cn/),在此期间,自然条件下种植的玉米生长缓慢,开花少甚至不开花。近年来,本团队于1月和10月在温室大棚分期种植玉米,保证了玉米前期能够正常生长;开花期温度在20 ℃以上,能够正常开花(无需收获玉米籽粒),进一步把小麦与玉米的可杂交期延长到每年4月中旬至12月下旬,甚至次年1月初;此外,大棚种植的玉米与自然条件下生长的玉米相比,其单倍体诱导效率也没有明显差异。
半冬性和冬性小麦材料除经过春化处理后可以在昆明夏播外,也可以在昆明冬播或1~2月春播,此阶段播种小麦的抽穗期一般在4月中旬至5月中旬,可与早期播种的玉米花期相遇。此外,北方麦区的冬性小麦材料也可在当地正季播种,于第二年拔节期前后挖苗移栽至昆明,与早期播种的玉米花期相遇(数据未发表)。
1.2 高得胚率基因型玉米的筛选
国内外研究表明,玉米基因型对小麦×玉米杂交产生的单倍体胚得胚率有显著影响[5,15]。本团队用糯、甜糯、甜、超甜等不同类型的玉米品种作为花粉供体进行试验,结果表明,相同玉米类型而基因型不同的玉米品种间单倍体胚得胚率的差异大于不同类型玉米间的单倍体胚得胚率。因此,筛选高得胚率玉米品种的关键是筛选玉米基因型而非玉米类型[16]。
1.3 高效授粉方法的筛选
DH技术用于育种时需对大量麦穗进行授粉。根据文献报道,用画笔、刷子或毛笔等蘸取玉米花粉给麦穗逐朵小花的授粉效率较高[17](图1A),一般每人每小时可授粉40~50穗。实际应用中每天常有300~500个麦穗需要授粉,而较高的玉米花粉活力持续时间一般只有约3 h,因此常规授粉方法难以满足需要[18]。

A:逐朵小花授粉;B:整穗“滚粉”授粉;C:“滚粉”授粉后玉米花粉覆盖小麦柱头。A:Pollinating one-by-one with a brush; B: Whole ear “rolling pollination”; C: Maize pollens on wheat stigmas after rolling pollination.图1 改进后的授粉方法及授粉效果Fig.1 Improved pollination methods and pollination effect
根据昆明自然条件下可大量种植玉米以及玉米花粉充足的特点,本团队发明了“滚粉”授粉法(图1B):待去雄麦穗基部小花柱头呈羽毛状散开时,于当天上午10:00~11:30采集新鲜玉米花粉,滤去花药后将花粉置于折叠纸中,将1~2个麦穗直接置于玉米花粉中以整穗为单位进行“滚粉”(或向上轻抖1~2次玉米花粉,让花粉自由下落于麦穗柱头),1~2秒即完成授粉,取粉和授粉配合,每小时至少可授粉600~800个麦穗,授粉效率大幅提高。该授粉方法简单快速,授粉效果好,授粉后玉米花粉几乎覆盖整个柱头(图1C),基本无需再次套袋,省工省时[12,14]。
1.4 激素处理与割穗离体培养
小麦×玉米杂交后补充激素,是产生单倍体胚的必要条件[15]。常用的激素处理方法为授粉结束后立即在穗下节注射2,4-D,4 h或24 h后再次逐朵小花滴注2,4-D,浓度一般为50~100 mg·L-1[11,15,19-21]。但由于这种处理方式复杂且效率较低,Matzk等[22]将该方法进行了改进,即授粉20~24 h后用50~100 mg·L-1的2,4-D溶液喷施或浸施整个麦穗。
因小麦×玉米杂交后的受精、合子形成过程以及单倍体幼胚生长发育过程均易受温度、湿度、光照等多种环境因素的影响,授粉后杂交穗若继续在田间母体植株上生长,会导致得胚率较低或不稳定。Riera-Lizarazu等[23]将授玉米花粉后的麦穗从田间母体植株上生长改为割穗离体培养,获得了显著的改进效果。
2014年,本团队对不同的培养方法进行了比较,结果表明,割穗离体培养的得胚率是田间自然生长的3倍[12],且杂交穗离体培养的同时,简化了激素处理方式,即授粉24 h后把所有麦穗剪回室内,再集中喷施2,4-D溶液,同时还研制了颖果结实率和得胚率均较高的麦穗离体培养液配方[24],从而形成了完整的离体培养方案[12],具体为:授粉24 h后将杂交穗沿地面根部剪回室内,集中喷施100 mg·L-1的2,4-D溶液,再插入到麦穗离体培养液中置于人工气候箱(宁波江南仪器RXZ-1500B)培养(温度23℃,相对湿度80%,光照8 000 Lx,每天光照14 h),每3 d更换一次营养液,培养14 d左右结束。2021年,本团队再次优化了割穗离体培养的麦穗离体培养液配方及培养程序[25],使得胚率和颖果千粒重进一步提高(图2和表1)。
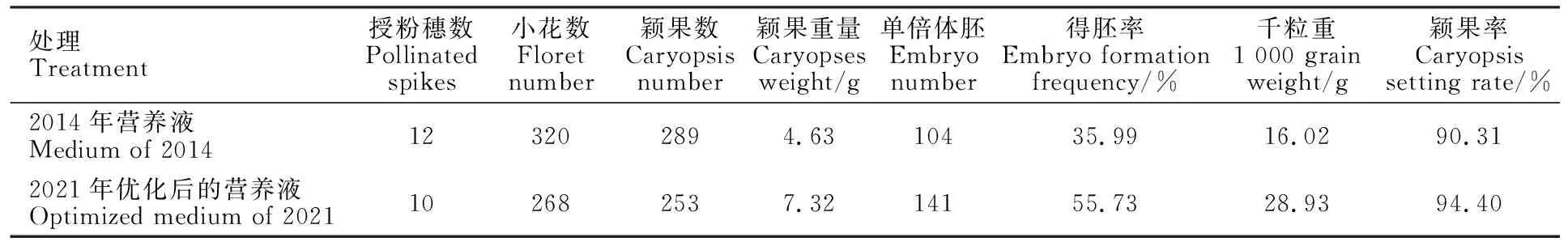
表1 不同营养液试验结果Table 1 Experiment result of different medium
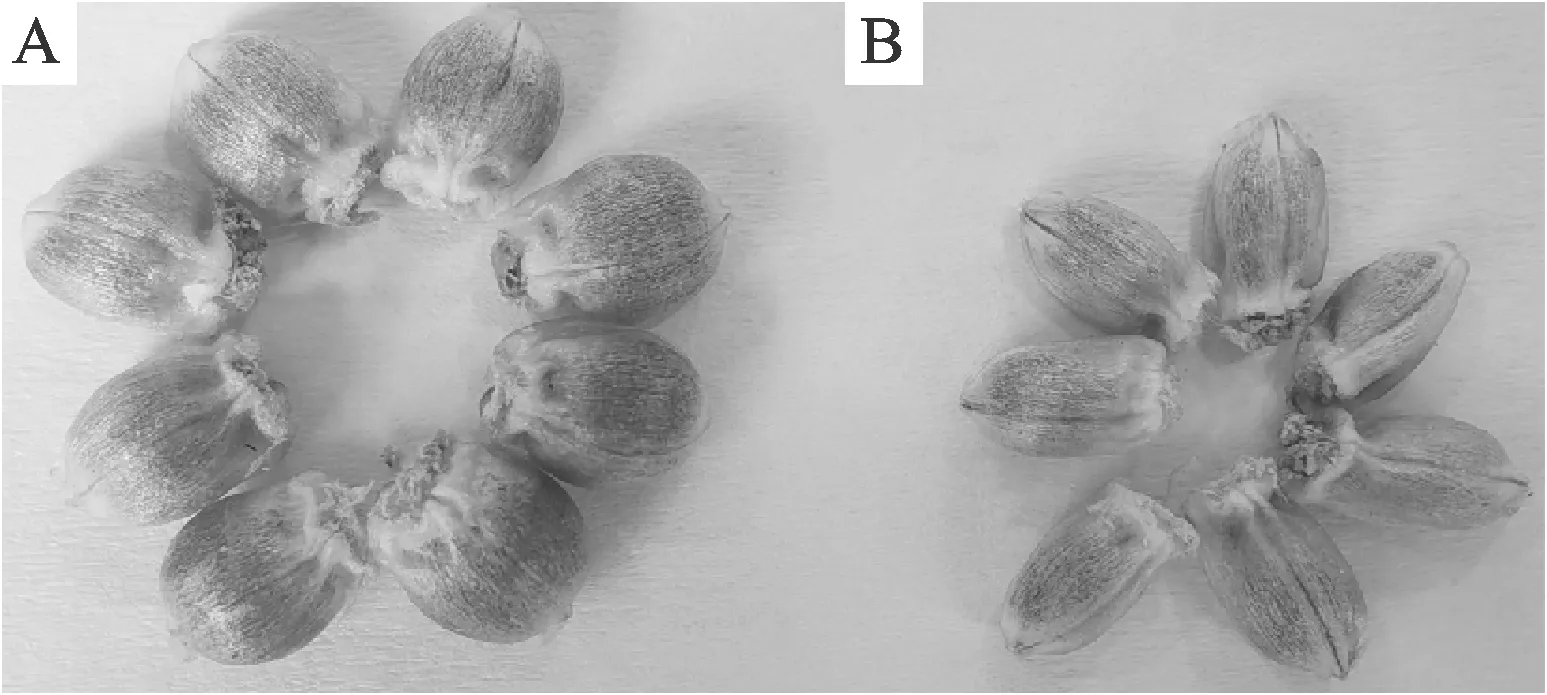
A: 2021年麦穗离体培养液新配方培养的颖果;B:2014年麦穗离体培养液配方培养的颖果。A: Caryopses cultivated with new formula of 2021; B: Caryopses cultivated from previous formula of 2014.图2 割穗离体培养液改进前后的颖果质量对比Fig.2 Comparison of caryopsis quality before and after medium improvement
因此,激素处理与割穗离体培养结合,不仅简化了操作程序,而且提高了得胚率及其稳定性。2016-2021年间,用于生产DH的1 900余份小麦材料(来自云南省及国内其他省份共33个科研育种单位以及孟加拉国、巴基斯坦、埃及、德国)中,几乎所有材料的得胚率均在15%以上,最高可达70%,平均值约25%左右(未发表)。
1.5 有胚颖果的筛选及胚挽救
小麦×玉米杂交产生的颖果有四种类型:有胚无胚乳、胚和胚乳均有、有胚乳无胚、胚和胚乳均无。前人报道的小麦×玉米杂交的双受精率可达10%~26%[20,26-27],但本团队发现,胚和胚乳均有的颖果仅约占1%(未发表),因此必须对单倍体幼胚进行胚挽救才能获得单倍体苗。
小麦×玉米杂交诱导单倍体胚的麦穗经过14 d离体培养后,幼胚直径一般可达到0.5~1.0 mm,此时为最佳胚挽救时期[11]。把小麦×玉米杂交产生的颖果从麦穗上剥离下来,经过消毒、灭菌后,在解剖镜下从颖果中剥取单倍体胚接种于1/2 MS或B5培养基中进行胚挽救。由于只有约25%的颖果中含有单倍体胚,因此,本团队设计了一种有胚颖果预识别装置[28],能直接检测杂交穗上剥离下来的颖果是否含有胚(图3),将有胚颖果挑选出来,再进行消毒、灭菌、剥胚和接种。通过验证,发现该装置准确率>95%,利用该装置使接种效率提高了2~3倍。

箭头指示有胚颖果。Arrows indicate embryonic caryopsis.图3 有胚颖果的预筛选结果Fig.3 Pre-screening result of caryopses with embryo
1.6 染色体加倍
由于小麦与玉米杂交产生的小麦单倍体植株无法自然加倍,只有通过染色体加倍处理才能获得能正常结实的双单倍体[14,29]。秋水仙素是最常用、效果最稳定的染色体加倍试剂,本团队采用浸根法进行加倍处理,加倍率为50%~90%[14],不同材料间存在显著差异,可能与加倍处理时单倍体苗的细胞分裂时期不同有关[30]。具体操作方法:从培养瓶中取出带分蘖的单倍体植株,洗净后将植株分蘖节置于500 mg·L-1的秋水仙素液面下2~3 cm,处理5 h,然后用自来水冲洗3~4 h。浸根法影响生殖细胞染色体倍性的可能途径为:秋水仙素通过根吸收和分蘖节渗透方式进入单倍体小麦植株体内,并扩散至各分蘖的茎节原基分生组织,导致其处于有丝分裂中期的单倍体细胞加倍成二倍体细胞,这些二倍体细胞中的部分细胞后来发育成二倍体花粉母细胞和胚囊母细胞,通过减数分裂形成正常的雌、雄配子,自交授粉后即可收获双单倍体种子;同时,部分茎节原基分生组织细胞受秋水仙素的作用不明显,或受秋水仙素作用明显但细胞未处于分裂中期,这些细胞发育形成的花粉母细胞和胚囊母细胞仍为单倍体,减数分裂时染色体分离紊乱,难形成正常的雌、雄配子,导致单倍体植株染色体加倍失败。目前本团队正研究秋水仙素处理植株分蘖节时,茎节原基等相关分生组织在细胞有丝分裂前期和中期分裂指数与加倍率的关系(国家基金项目32001549),为进一步改进加倍处理方法、提高加倍效率提供科学依据。
1.7 加倍苗移栽与套袋隔离
加倍处理后的单倍体植株若直接移栽至大田,其成活率较低。本团队将加倍苗先移栽至苗盘,待完全成活后再移栽至大田[31],显著提高了幼苗的成活率。
经多年实践,本团队发现小麦单倍体植株在染色体加倍处理过程中,因所处发育时期不同,导致植株部分麦穗雌、雄蕊加倍不同步(未发表)。因此,在构建用于遗传研究的DH群体时,为避免单株间相互串粉,需对每个单株进行套袋隔离。由于需套袋的麦穗较多,工作量大,本团队还设计了一种用于提高小麦单株隔离效率的防护装置[32],抽穗前即可分株套袋隔离,一次可完成1个单株所有主穗和分蘖穗套袋,同时还可观察植株的发病情况以及是否加倍成功,待植株开花结束后可回收该隔离装置、重复利用。
2 小麦DH批量生产技术体系的验证
通过多年持续、系统地研究改进,本团队已基本建立了小麦×玉米杂交高效生产小麦DH的技术规程,平均得胚率约25%(15%~70%,以平均每穗授粉20个小花估算)、成苗率62%(50%~80%)和加倍率62%(50%~90%),为该DH技术的育种应用奠定了基础。
2016-2021年间,本团队利用国内外共1 900余份小麦材料累计生产出10.5万个小麦DH株系(表2),其中春性、半冬性和冬性材料各822、657和427份,均能通过该技术获得DH。其中2021年产生的单倍体在2022年共获得3.1万个DH,初步实现了小麦DH的批量生产。
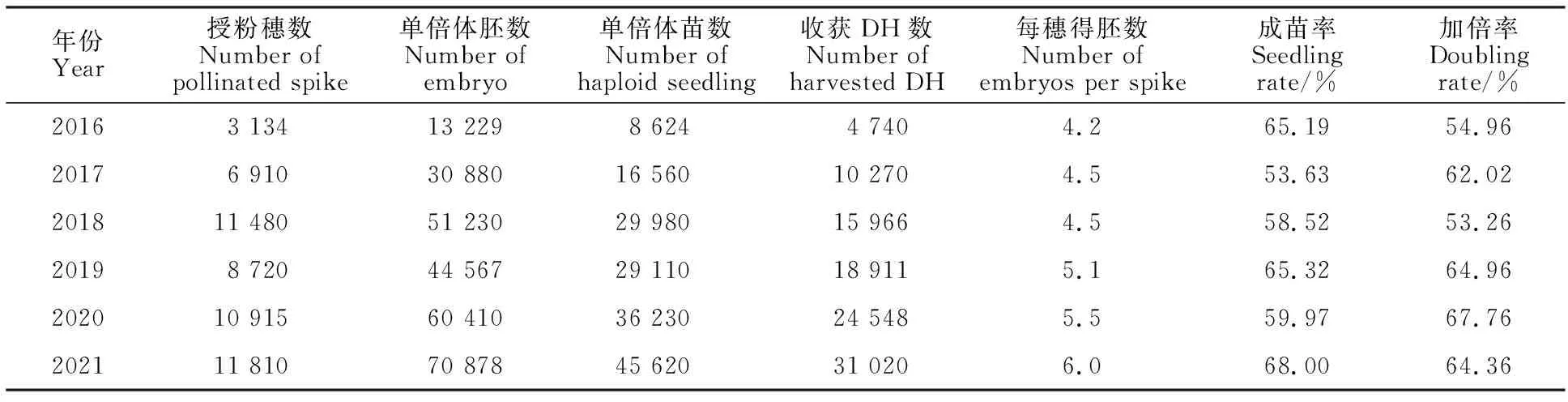
表2 2016-2021年小麦DH生产技术主要参数统计表Table 2 Technical parameters of wheat DH production during 2016-2021
3 DH批量生产技术的初步应用
构建DH作图群体是DH技术在小麦遗传研究上的主要用途。2016年以来,本团队先后为国内21个科研单位构建了64个小麦DH群体。
创造、选择和固定优异变异是作物育种的三大环节。DH技术可加快固定优异变异进程,从纯合稳定的DH品系中筛选候选品种或优异资源,减少了对育种经验的依赖。同时DH技术还可克服复合杂交、远缘杂交等育种杂交后代分离世代长、稳定性低等不良因素,提高育种效率[33]。
利用小麦×玉米杂交的DH技术,国外已育成了大量优良小麦品种并推广应用[34];国内陈新民等[35]于2010年也育成了中麦533。2014年以来,本团队已将DH技术全面应用于加速常规杂交育种、远缘杂交(包括遗传、生态和地理远缘)、矮败小麦群体改良的育种进程,并初步构建了基于小麦DH技术的高效育种技术体系(图4)。与抗条锈病基因分子标记结合,2021年育成并审定了云麦110、云麦112等小麦新品种;另有3个品种2023年推荐审定;一批冬性小麦和春性小麦杂交的抗病优良品系正参加生产试验或区域试验;5年内育成了24个优良温光敏核不育系(其中省级鉴定4个)和1 064份恢复系材料,而且育种试验用地至少减少了1/3。2016-2021年间,为河南、山东、安徽、江苏、河北、山西、北京、湖北、四川、贵州、云南等省份(直辖市)33个单位新品种的快速选育和抗病资源的快速创制提供技术支持。
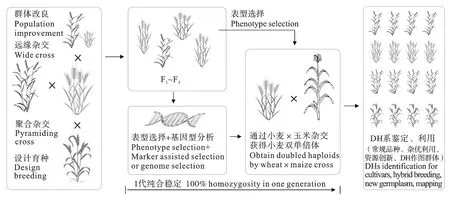
图4 基于DH技术的小麦高效育种技术体系Fig.4 Efficient wheat breeding strategy based on DH technique
2015-2019年间,孟加拉国、巴基斯坦、埃及的小麦育种者在昆明于10月下旬或11月上旬播种本国的强春性小麦育种材料,次年2月配制杂交组合或3月选择优良单株,4月上旬收获后立即在昆明夏播,当年11月即可获得DH系,从播种亲本、配制杂交组合到获得DH纯系只需1年(未发表),充分发挥了DH技术在加速育种进程中的优势。
4 小结与展望
通过小麦×玉米杂交产生小麦双单倍体是一个集田间和室内操作于一体的系统性工程。尽管其基本原理和操作规程早已有大量研究报道,但整个操作规程涉及众多技术细节,建立成熟稳定的大批量DH生产技术体系仍需要大量研究和实践验证。借助昆明得天独厚的自然条件,通过20多年的持续研究改进,本团队基本建立了小麦DH高效生产技术规程,初步实现小麦DH的批量生产和育种应用。今后还需继续完善相关技术细节,不断提高得胚率、成苗率、加倍率等关键技术指标,建立规模化、低成本的小麦DH生产技术规程,促进该技术在小麦遗传育种上更广泛地应用。
除小麦×玉米杂交外,禾本科多年生植物白茅(Imperatacylindrica)也能够替代玉米与小麦杂交,高效获得小麦单倍体[36]。近年来,利用基因编辑技术创制的单倍体诱导系已成功用于生产小麦DH,如敲除小麦着丝粒组蛋白基因CENH3的同源基因TaCENH3α-B和TaCENH3α-D,可获得7%的小麦单倍体产生率[37],其诱导机制最先在拟南芥中被发现,并在普通大麦和球茎大麦杂交诱导获得普通大麦单倍体的研究中得到验证。普通大麦与球茎大麦杂交F1杂合子中CENH3基因丢失导致染色体失活,获得的单倍体只保留了普通大麦的染色体组[38]。基于玉米单倍体诱导机理,在小麦中敲除MTL/ZmPLA1/NLD的同源基因,其突变体的单倍体诱导率为5.88%~15.66%[39];同时敲除TaMTL-4A/4B/4D基因后,小麦单倍体获得频率可达到11.8%~31.6%[40]。这些新方法为高效生产小麦DH,促进DH技术在小麦遗传育种上的广泛应用开辟了新途径。

