冬小麦miR172响应抗寒的特征分析
王多佳,王政委,任志鹏,彭瞰看,田 宇,张 达,徐庆华,苍 晶
(东北农业大学生命科学学院,黑龙江哈尔滨 150030)
低温是影响小麦生长发育、分布及产量的重要因素之一。东农冬麦1号(Dn1)是我国首个能在黑龙江省高寒地区安全越冬(返青率>85%)的强抗寒性(可耐-30 ℃低温)冬小麦品种[1],研究其响应低温胁迫的分子机制,对选育耐寒性小麦品种具有重要的理论意义。
miRNA(microRNA)是一类来自真核生物自身基因组的非编码小分子RNA,长度一般为21~25 nt,在转录后调控基因表达,对植物的生长发育、非生物胁迫应答等过程均发挥重要作用[2]。miRNA家族中,miR172是最早被发现同时也是被研究最透彻的成员之一[3],其靶基因主要编码AP2/ERF (APETALA2/ethylene responsive factor)类转录因子。AP2/ERF转录因子为植物所特有,几乎参与植物生长发育的各个环节[4]。研究发现,miR172/AP2模块不仅参与植物生长发育过程(包括花器官发育、块茎、根瘤形成等[5-7]),也参与植物衰老以及响应逆境等过程[8]。在小麦中,miR172不仅可通过控制驯化基因Q的表达调控穗型发育[9];也可负调控其靶基因AP2的表达,参与小麦渗透胁迫响应[10]。但有关miR172介导作物响应低温胁迫机制的研究鲜有报道。
Dn1作为强抗寒性冬小麦品种,含有大量与抗寒相关的miRNA。本课题组前期利用构建的不同温度(5 ℃、-10 ℃、-25 ℃)下 miRNA高通量测序数据库,获得了显著差异表达的miR172,本研究对其靶基因进行预测,并采用生物信息学、qRT-PCR、瞬时表达等技术分析Dn1中miR172/AP2模块调控小麦抗寒机制,以期为培育强抗寒性冬小麦品种提供帮助。
1 材料与方法
1.1 试验材料
冬小麦品种为东农冬麦1号(Dn1),由东北农业大学小麦育种实验室提供。烟草品种为本氏烟,由东北农业大学植物生理与分子生物学研究室提供。大肠杆菌DH5α、农杆菌EHA105和植物表达载体 PBI121-GUS等由本课题组保存。
1.2 大田取样
将Dn1种子于2018年9月8日播种于东北农业大学试验地,种植方法参考田 宇等[11]的报道。待麦苗长至三叶期,大田自然降温连续10 d平均最低温度为5 ℃(对照温度,2018年10月15日)、0 ℃(2018年11月02日)、-10 ℃(2018年11月23日)和-25 ℃(2019年1月14日)时,选取长势一致的麦苗,剪取分蘖节,置于-80 ℃保存,备用。
1.3 Dn1中tae-miR172的前体pre-tae-miR172及其靶基因Ap2的克隆与生物信息学分析
1.3.1pre-tae-miR172及Ap2的克隆
根据本实验室前期建立的Dn1miRNA数据库与已公开的miRNA数据库miRBase(http://www.mirbase.org/)中的小麦miRNA数据,获得tae-miR172的前体和成熟体序列。从小麦基因组数据库Wheat URGI(https://wheat-urgi.versailles.inra.fr/)获取靶基因的DNA序列和蛋白序列。用Prime Primer 5.0软件设计克隆tae-miR172的前体pre-tae-miR172及其靶基因Ap2的特异性引物(表1)。利用Plant Genomic DNA Kit(康为世纪,泰州)提取Dn1分蘖节总DNA,以总DNA为模板,以pre-tae-miR172-F/R为引物,利用2×Taq Master Mix(Dye)扩增pre-tae-miR172,PCR反应体系为20 μL,包括DNA模版1 μL,上、下游引物各1 μL,2×Taq Master Mix (Dye) 10 μL,ddH2O 7 μL。PCR反应程序:94 ℃ 5 min;94 ℃ 30 s,56 ℃ 30 s,72 ℃ 1 min,35个循环;72 ℃ 10 min。用Ultrapure RNA Kit试剂盒(康为世纪,泰州)提取Dn1分蘖节总RNA,利用Hi Script III 1st Strand cDNA Synthesis Kit (+gDNA wiper)试剂盒(诺唯赞,南京)将RNA反转录为cDNA,以cDNA为模板,以Adn1-F/R为引物,利用2×Taq Master Mix (Dye) 扩增靶基因Ap2,PCR反应体系同上。PCR反应程序:94 ℃ 5 min;94 ℃ 30 s,58 ℃ 30 s,72 ℃ 1 min,35个循环;72 ℃ 10 min。
1.3.2 生物信息学分析
根据tae-miR172的前体和成熟体序列在小麦基因组数据库Wheat URGI获取tae-miR172的染色体位置。利用WebLOGO(http://weblogo.berkeley.edu/logo.cgi)对miRNA成熟体序列进行碱基保守性分析。利用在线软件RNAfold Web Sever(http://rna.tbi.univie.ac.at/cgi-bin/RNAfold.cgi)对miRNA前体进行茎环结构预测。利用psRNAtarget(http://plantgrn.noble.org/psRNATarget/analysis)和PRND(http://structuralbiology.cau.edu.cn/PNRD/)对tae-miR172的潜在靶基因进行预测。利用Pfam数据库(http://pfam.xfam.org/)分析其蛋白结构域。用ProtParam软件预测AP2蛋白的理化性质。下载pre-tae-miR172和AP2基因CDS上游2 000 bp的序列,利用 PlantCARE分析启动子区域的顺式作用元件。
1.4 植物表达载体的构建
在扩增pre-tae-miR172和AP2的上、下游引物5’端加上包含酶切位点的15 bp重组位点序列,分别 为5’-ACGGGGGACTCTAGAGGATCC-3’和5’-GGACTGACCACCCGGGGATCC-3’,以此新的引物进行PCR扩增,反应体系和反应程序同1.3.1。将PCR扩增产物进行胶回收。用BamHI对pBI121-GUS载体进行单酶切,使用诺唯赞公司的ClonExpress○RUltra One Step Cloning Kit将pre-tae-miR172和Ap2分别连接到酶切后的pBI121-GUS表达载体上,转入大肠杆菌DH5α后进行摇菌,然后送哈尔滨博仕生物有限公司进行测序,最终构建pBI121-pre-tae-miR172和pBI121-AP2载体。
1.5 烟草瞬时表达试验
参考彭瞰看[12]的方法将构建的表达载体pBI121-pre-tae-miR172和pBI121-AP2分别转化EHA105农杆菌。然后将含有PBI121-pre-tae-miR172、pBI121-AP2的农杆菌菌液以及含有重组质粒pBI121-pre-tae-miR172和pBI121-AP2的等体积混合农杆菌菌液(OD600分别为0.5)进行烟草叶片瞬时表达试验,以pBI121-GUS为对照。进行烟草叶片注射时,选择生长状态良好且颜色深绿的植株顶端附近2~3片叶。用注射器(去掉针头)吸取1 mL农杆菌菌液从叶片背部轻轻注射菌液。每次试验后更换手套以防污染。注射后,将幼苗在25 ℃下孵育5 d。按照Jefferson等[13]的方法,对三种处理中的GUS进行组织化学染色和定量检测。所有处理均3次重复。
1.6 pre-tae-miR172和Ap2dn1的qRT-PCR分析
用Ultrapure RNA Kit提取冬小麦分蘖节RNA,用miRNA 1st stand cDNA Synthesis ikit试剂盒(Vazyme,南京)合成cDNA,用ChamQ SYBR qPCR Master Mix(Vazyme,南京)对pre-ttae-miR172和Ap2进行qRT-PCR,分别以小麦U6和Actin为内参,以qAP2dn1F/R以及tae-miR172-F和mRQ3’ Primer为引物(表1)。PCR反应体系和反应程序均参照试剂盒说明书,利用2-ΔΔCT法计算pre-tae-miR172及Ap2的相对表达量。
1.7 数据统计
用Microsoft Excel 2018进行数据分析,用Graphpad Prisim 6.0软件进行one-way或two-way方差分析(ANOVA)。
2 结果与分析
2.1 tae-miR172前体pre-tae-miR172的克隆及生物信息学分析结果
对pre-tae-miR172进行克隆并测序,发现pre-tae-miR172的长度为396 nt(图1A)。URGI数据库分析表明,tae-miR172位于小麦1B染色体上,其上、下游1 000 bp之间不存在mRNA,属于基因间miRNA。对Dn1和中国春小麦的pre-tae-miR172序列进行比对,发现Dn1中该序列缺失21 nt,推测是由于品种差异性造成的(图1B)。用WebLogo软件分析miR172成熟体序列的保守性,发现miR172序列非常保守(图1C)。RNAfold软件预测发现,pre-tae-miR172形成了一个稳定的二级茎环结构(图1D),其热力学系综合最小自由能为-113.10 kcal·mol-1。Dn1中miR172的这些序列特征与拟南芥中miR172的序列特征基本相似,说明miR172的功能非常保守。下载tae-miR172前体序列上游2 000 bp序列,利用PlantCARE预测启动子区域的顺式作用元件,结果(表2)表明,tae-miR172启动子区域除含有核心元件外,还含有响应激素(脱落酸、生长素和赤霉素)和逆境胁迫(干旱)以及与生长代谢(厌氧诱导和响应光)相关的元件。
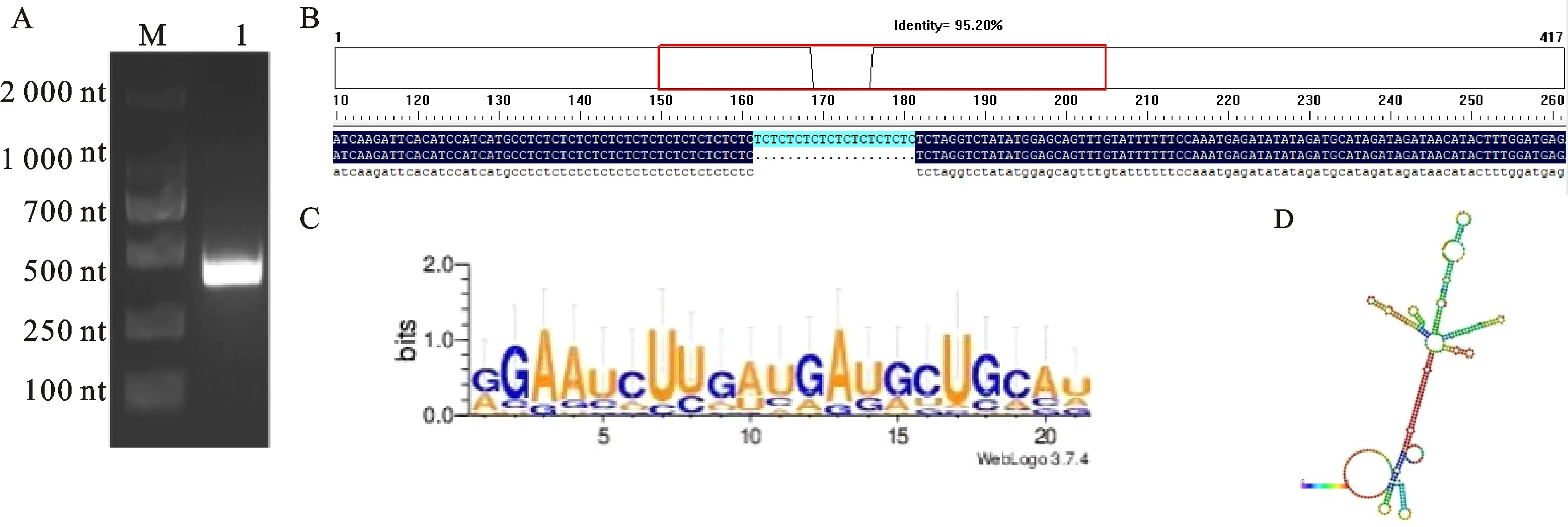
A:pre-tae-miR172的克隆结果;M:DL2000;1:pre-tae-miR172;B:pre-tae-miR172 测序结果对比;C:miR172碱基保守性分析;D:pre-tae-miR172的RNA二级结构。A: Amplicon of pre-tae-miR172; M: DL2000; 1: pre-tae-miR172; B: Sequence alignment of pre-tae-miR172; C: Motif analysis of tae-miR172; D: RNA secondary structure analysis of pre-tae-miR172.图1 pre-tae-miR172的克隆及生物信息学分析结果Fig.1 Cloning and bioinformatics analysis result of pre-tae-miR172

表2 pre-tae-miR172和Ap2dn 1启动子区域的顺式作用元件Table 2 Analysis of cis-acting elements in promoter region of pre-tae-miR172 and Ap2dn 1
2.2 tae-miR172靶基因的克隆及生物信息学分析结果
psRNAtarget和PRND在线软件预测发现,tae-miR172的靶基因登录号为TRIAECS5DO2G486600.2。从小麦基因组数据库Wheat URGI获取靶基因的DNA序列并设计引物Adn1-F/R。以Dn1分蘖节cDNA为模板,克隆靶基因序列,发现其长度为1 650 bp(图2A),其中CDS序列长度为1 350 bp(图2B)。利用Pfam数据库分析其蛋白结构域,发现其含有两个AP2结构域(图2C),将该靶基因命名为AP2dnl。生物信息学分析表明,AP2dnl蛋白分子量为11.088 kDa,等电点为4.93。亚细胞定位预测发现,AP2dn1蛋白位于细胞核中。PlantcARE软件分析表明,与pre-tae-miR172启动子区域含有的元件相比,AP2dn1启动子区域含有茉莉酸响应元件CGTCA-motif和光响应元件sp1,而不含有生长素响应元件AuxRR-core和核心启动子元件CATT-box(表2)。

A:AP2dn1的克隆结果;B:AP2dn1测序结果比对;C:AP2dn1结构域预测。A: Amplicon of AP2dn1; B: Sequence alignment of AP2dn1; C: Domin prediction of AP2dn1.图2 AP2dn1基因的克隆及生物学分析结果Fig.2 Cloning and biological analysis results of AP2dn1 gene
2.3 tae-miR172靶基因AP2dn1的烟草瞬时表达验证
利用1%的琼脂糖凝胶对BamHI酶切后的pBI121-GUS载体进行检测,以未酶切的载体为对照(图3A),发现酶切后的载体比未酶切的载体小,证明该载体被线性化。随后将pre-tae-miR172和Ap2dn1连接到酶切后的PBI121-GUS载体上,利用1%的琼脂糖凝胶对重组载体pBI121-pre-tae-miR172和pBI121-AP2dn1进行菌落PCR检测(图3B和3C),发现均获得了大小正确的条带,表明两个片段已被正确插入。将测序正确的菌液重新活化,并提取质粒。
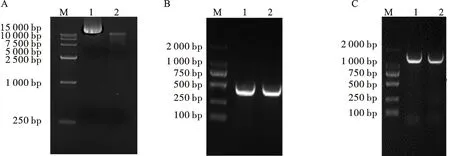
A:酶切载体电泳图;图A中,M:DL15000;1:未酶切的pBI121-GUS载体;2:酶切后的pBI121-GUS载体。B:pBI121-pre-tae-miR172的菌落PCR结果;C:pBI121-AP2dn1的菌落PCR结果。图B和C中,M为DL2000,1和2为两个重复。A: Electrophoresis of enzyme digested vector;In figure A, M is DL15000, 1 is pBI121-GUS vector without digestion; 2 is pBI121-GUS vector with digestion. B: Colony PCR results of pBI121-pre-tae-miR172; C: Colony PCR results of pBI121-AP2dn1. In figures B and C, M is DL2000, 1 and 2 are two replicates.图3 pBI121-GUS 载体构建电泳图Fig.3 Construction of pBI121-GUS vector
利用农杆菌介导的遗传转化法,在烟草叶片上瞬时表达含有GUS基因的pBI121-GUS、pBI121-pre-tae-miR172和pBI121-AP2dn1载体。发现单独接种含有pBI121-GUS载体的叶片经组织化学染色后显示为蓝色,有GUS表型;单独接种含有pBI121-AP2dn1载体的叶片,由于AP2dn1与GUS基因上游融合,表现出与pBI121-GUS载体相似的表型;在接种含有pBI121-pre-tae-miR172载体的叶片中,GUS基因由于被tae-miR172前体剪切,因此染色后的叶片没有观察到GUS表型;在pBI121-pre-tae-miR172和pBI121-AP2dn1共转化的叶片中,GUS的组织化学染色深度明显降低(图4)。这说明tae-miR172靶向AP2dn1。
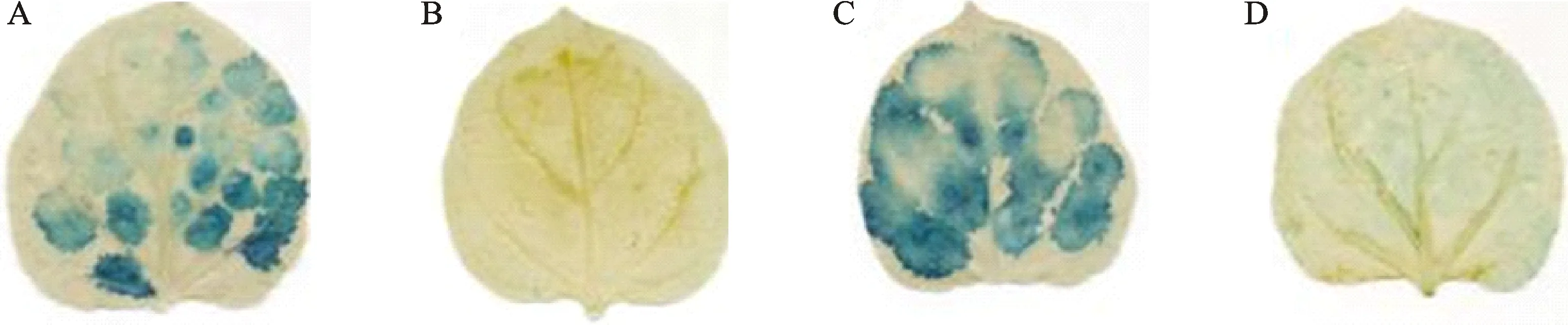
A:pBI121-GUS;B:pBI121-pre-tae-miR172;C:pBI121-AP2dn1;D:pBI121-pre-tae-miR172和pBI121-AP2dn1的混合物。A: pBI121-GUS; B: pBI121-pre-tae-miR172; C: pBI121-AP2dn1; D: The mixture of pBI121-pre-tae-miR172 and pBI121-AP2dn1.图4 通过组织化学染色观察到的GUS表型Fig.4 GUS phenotype observed by histochemical staining
2.4 低温胁迫下Dn1中pre-tae-miR172和AP2dn1的表达模式
利用qRT-PCR技术分析pre-tae-miR172及AP2dn1在5 ℃、0 ℃、-10 ℃和-25 ℃四个温度下的表达模式。结果表明,pre-tae-miR172的表达量随着温度的降低呈先升后降的变化趋势,0 ℃时表达量最高,-25 ℃时表达量最低(图5A)。AP2dn1的表达量变化趋势与pre-tae-miR172相反,随着温度的降低呈先降后升的变化趋势,在-25 ℃表达量最高,0 ℃表达量最低(图5B)。推测tae-miR172负调控AP2dn1的表达。
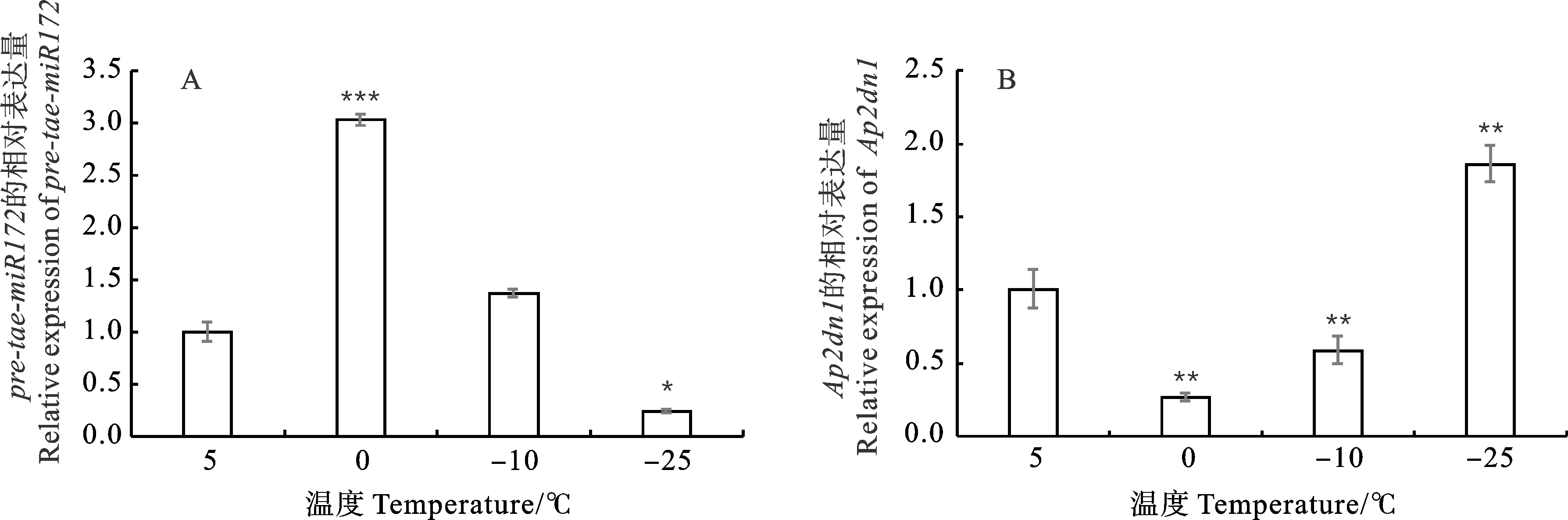
*、**和***分别表示与对照温度(5 ℃)间在0.05、0.01和0.001水平上差异显著。*, ** and *** indicate significant difference compared with control temperature(5 ℃) at 0.05, 0.01 and 0.001 levels, respectively.图5 低温胁迫下Dn1分蘖节中pre-tae-miR172(A)和AP2dn1(B)的表达模式Fig.5 Expression patterns of pre-tae-miR172(A) and AP2dn1(B) in tiller nodes of Dn1 under cold stress
3 讨论
miR172是一个非常保守的miRNA,参与植物不同生长发育过程。在拟南芥(Arabidopsisthaliana)中,miR172与miR156相互作用,通过调控拟南芥中SPB和AP2基因的表达来控制发育时间[14-15]。在大岩桐(Sinningiaspeciosa)中,miR172通过调控AP2基因的表达来影响花器官的发育[16]。另外,miR172在植物抗逆过程中也具有重要作用,如拟南芥miR172参与对干旱胁迫的响应;大豆(Glycinemax)miR172调控根系对盐胁迫的敏感性[17];香蕉(Musanana)miR172参与对寒冷胁迫的响应[18]。迄今为止,小麦miR172响应低温胁迫的研究尚未见报道。在本研究中,tae-miR172前体pre-tae-miR172的表达量随着温度的降低呈先升后降的趋势,在0 ℃时达到峰值,随后逐渐下降,到-25 ℃时最低,说明Dn1中tae-miR172对低温胁迫的响应非常灵敏,推测在Dn1抗寒过程中起调节作用。
本研究通过生物信息学预测到tae-miR172的靶基因为AP2家族基因AP2dn1,通过烟草瞬时表达试验,说明tae-miR172负向调控AP2dn1基因的表达,这与Jung等[5]和梅 林等[19]的研究结果一致。利用qRT-PCR技术分析AP2dn1在不同温度下的表达模式,发现AP2dn1与冬小麦抗寒有关,并起正向调控作用。由于Dn1中AP2dn1响应低温胁迫的过程也可能受细胞内激素、光照、温度、水分等因素的调控,具体调控机制有待进一步探究。
根据低温胁迫程度的不同,低温胁迫可以划分为冷害(0~20 ℃)和冻害(<0℃)。两种低温胁迫都会改变植物的细胞结构、生理代谢以及蛋白活性等,从而影响植物的生长发育[20]。植物在应对冷害胁迫和冻害胁迫时存在不同的调控模式,本研究Dn1中miR172/AP2的调控模式在两种低温胁迫下存在差异,推测抗寒小麦品种Dn1中miR172/AP2模块响应冷害和冻害的机制不同,需要进一步验证。

