加强学科理解 谨防思维定势
——以几道高考题为例
廖旭杲
(浙江省宁波市鄞州中学,浙江 宁波 315104)
从教多年的教师们,对于高中化学里的一些基本概念和规律说是滚瓜烂熟也不为过;选考化学的学生进入考场前,经过几轮的复习,对多数化学规律耳熟能详,比如:高沸点酸(如浓H2SO4)不考虑其挥发;因为NaHCO3溶解度小,所以可以析出结晶;浓度增加速率增大,温度升高速率增大,水解程度很微弱,等等,其实,这些结论都有一定成立条件和依存条件,无视一定的条件与情境,生搬硬套,则会出现偏差,并因此失分.高考题中有不少问题瞄准的就是这一类容易因理解不深而生误解的知识,兹举数例说明之.
1浑浊是因为溶解度小吗?


图1 氢键的形式
破坏这种氢键需要水分子提供额外的能量,使得NaHCO3的晶格能增加,溶解时吸热,且溶解度下降.能否用实验加以验证呢?
例1对碳酸氢钠溶液进行一系列实验,结果见表1,根据现象得出的结论不正确的是( ).

表1 NaHCO3系列实验结果
解析往饱和Na2CO3溶液中通入CO2,溶液变浑浊,可说明NaHCO3溶解度小于Na2CO3吗?
Na2CO3与CO2生成NaHCO3,反应为:

假设有1 mol Na2CO3(106 g)参与反应,将生成2 mol NaHCO3(168 g),溶质质量明显增多,同时溶剂水还减少了18 g,所以呈现浑浊现象,并不能说明是因生成物的溶解度小导致,溶质增多、溶剂减少等因素都会导致有固体析出,所以由现象得不出该结论.
2 浓硫酸会挥发吗?
例2(2020年7月·浙江选考·28·Ⅱ)某兴趣小组为验证浓硫酸的性质进行实验,如图2所示.实验中观察到的现象有:蒸馏烧瓶内有白雾,烧杯中出现白色沉淀.请回答:

图2 验证浓硫酸的性质实验装置图
(1)将浓硫酸和浓盐酸混合可产生HCl气体的原因是____.
(2)烧杯中出现白色沉淀的原因是____.
解析烧杯中出现白色沉淀肯定是H2SO4过来了,问题是H2SO4是怎么过来的?是硫酸自己挥发吗?是被HCl带过来的吗?还是被水蒸气带过来的?
此小题的解释靠谱一点的是:
①因浓硫酸吸水且放热,导致HCl挥发,挥发出来的HCl气体会将H2SO4带出,与Ba(NO3)2作用生成BaSO4.
②因浓盐酸稀释浓硫酸,放出大量的热,挥发出来的水蒸气将H2SO4带出来.
也有可能,反应放热使H2SO4-H2O共沸混合物挥发出来.
③还有一种观点认为是反应放热,使浓硫酸挥发出来,不可信,因为浓硫酸的沸点较高(如纯硫酸的沸点为338 ℃左右),而这里是水溶液,水的沸点限制了体系的温度不可能升高到338 ℃.但是,不同浓度的硫酸沸点不一样,一般地硫酸的沸点随浓度降低而降低.如质量分数为98.3%的浓硫酸,沸点为338 ℃;浓度50%,其沸点为124 ℃;浓度5%,其沸点为101 ℃;这里硫酸不断被稀释,其沸点不断降低,最终会与水蒸气一起挥发出去.
总之,不可武断地认为高沸点酸(如浓H2SO4)不考虑其挥发,它们或许可以借“力”挥发.
3 是压强的因素导致平衡移动吗?
人教版《化学反应原理》第二章第二节“化学平衡”里安排有实验2-2,讨论压强对化学平衡的影响:
【实验2-2】如图3所示,用50 mL注射器吸入20 mL NO2和N2O4的混合气体(使注射器的活塞位于Ⅰ处),将细管端用橡胶塞封闭.然后把活塞拉到Ⅱ处,观察管内混合气体颜色的变化.当反复将活塞从Ⅱ处推到Ⅰ处及从Ⅰ处拉到Ⅱ处时,观察管内混合气体颜色的变化,并将结果填于表2.

表2 讨论压强对化学平衡的影响

图3 压强对化学平衡的影响
常规解释是:从Ⅰ拉到Ⅱ处,体积骤然扩大一倍,c(NO2)浓度瞬间减小一半,颜色变浅,随后平衡

受压强影响开始向左移动,颜色变深,但比开始时的浅.
但是有资料[1]表明:从Ⅰ拉到Ⅱ处,体积骤然扩大一倍,但压力也是瞬间减小一半,因压力变化导致的平衡

移动(向左移动颜色变深)也随之完成.随后颜色的渐变是因为温度的缘故.
因为体系对外做功,温度降低,对于该放热反应,温度降低,平衡正向移动,所以导致c(NO2)浓度减小,颜色逐渐变浅.
综合起来,最终颜色比开始时浅.
同理,从Ⅱ推到Ⅰ处,外界对体系做功,温度上升,平衡逆向移动,导致c(NO2)浓度增加,颜色逐渐变深.
根据2011年全国化学竞赛初赛试题编拟了一道高考模拟题:
例3已知

在瞬间即可达成化学平衡.NO2和N2O4混合气体体积由V压缩至V/2时,相关数据变化见表3,下列说法不正确的是( ).

表3 改变体积导致体系状态的变化
A.体积由V压缩至V/2时,NO2的物质的量减少
B.正反应和逆反应的活化能均较低
C.体积缩小后混合气体的颜色加深
D.其它条件不变,温度升高,该反应正向移动
解析V压缩至V/2时,n(NO2)由1.28×10-2Vmol增加到1.40×10-2Vmol,故A错误.
题中信息明示瞬间达成平衡,说明速率很快,故Ea、E′a均较低,B正确.
体积缩小后c(NO2)增大了,所以混合气体的颜色加深,C项正确.
其它条件不变,温度升高,c(NO2)增大了,说明该反应正向移动,D正确.
4 浓度越大速率越大吗?
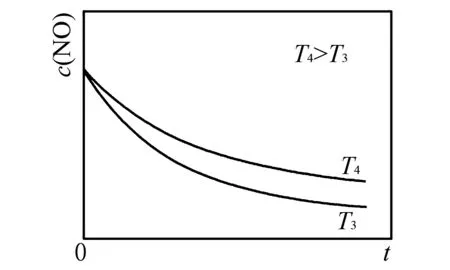
例4(2022年6月·浙江选考·20)恒温恒容的密闭容器中,在某催化剂表面上发生氨的分解反应:

测得不同起始浓度和催化剂表面积下氨浓度随时间的变化,见表4,下列说法不正确的是( ).

表4 不同起始浓度和催化剂表面积下氨浓度随时间的变化
A.实验①,0~20 min,v(N2)=1.00×10-5mol·L-1·min-1
B.实验②,60 min时处于平衡状态,x≠0.40
C.相同条件下,增加氨气的浓度,反应速率增大
D.相同条件下,增加催化剂的表面积,反应速率增大
解析A项,注意所给氨浓度的数量级.
实验①,0~20 min,Δc(NH3)=(2.40-2.00)×10-3mol·L-1=0.400×10-3mol·L-1
实验①,0~20 min,Δc(N2)=0.200×10-3mol·L-1
实验①,0~20 min,v(N2)=1.00×10-5mol·L-1·min-1,A项正确.
B项:

2.40×10-30 0
(2.00×10-3) (1.00×10-3) (3.00×10-3)
0.40×10-3(1.00×10-3) (3.00×10-3)
采用验算法,假如实验②,60 min时x=0.40,则

1.20×10-30 0
(0.80×10-3) (0.40×10-3) (1.20×10-3)
0.40×10-3(0.40×10-3) (1.20×10-3)
Qc=(0.40×10-3)×(1.20×10-3)3/(0.40×10-3)2=4.32×10-6
显然,Qc 也可以采用虚拟容器法考虑,把实验③想像成发生在两个一模一样的容器中,则每个容器相当于实验②,假设实验②平衡时c(NH3)=y×10-3mol·L-1,则压缩前实验③中平衡时(NH3)=2y×10-3mol·L-1,但把实验③中两个虚拟容器压缩成一个容器时,相当于加压,平衡逆向移动,剩余NH3增多,即2y增大到0.40,即2y<0.40,y<0.20,所以平衡时x≠0.40,B正确. C项,从实验①、②的前期来看,每隔20 min,c(NH3)减少0.400×10-3mol·L-1,速率恒定为1.00×10-5mol·L-1·min-1,可见该反应速率与起始c(NH3)无关,C项错误.实际上该反应是一零级反应,反应速率与催化剂的活性中心数目有关,当催化剂活性中心都吸附饱和了,增加浓度是徒劳的. D项,对照实验①③可以看出,相同条件下,增加催化剂的表面积,反应速率增大,D项正确. 例5(2020年1月·浙江选考·29(2))NO氧化反应: 分两步进行,其反应过程能量变化示意图如图4所示. 图4 反应过程-能量变化示意图 ①决定NO氧化反应速率的步骤是____(填“Ⅰ”或“Ⅱ”). ②在恒容的密闭容器中充入一定量的NO和O2气体,保持其它条件不变,控制反应温度分别为T3和T4(T4>T3),测得c(NO)随t(时间)的变化曲线如图5所示. 图5 c(NO)随t(时间)的变化曲线图 转化相同量的NO,在温度____(填“T3”或“T4”)下消耗的时间较长,试结合反应过程能量图(图4)分析其原因____. 解析从反应过程-能量图(图4)来看,第Ⅰ步反应的活化能小,其反应速率较快;第Ⅱ步反应的活化能较高,反应速率较慢,是总反应的决速步骤.分析总反应的速率只需分析第Ⅱ步反应的速率. 影响第Ⅱ步反应的速率的因素有两个,一是温度,二是浓度. 温度升高,第Ⅱ步反应的速率增大,总反应速率增大. 影响第Ⅱ步反应的速率的浓度有c(N2O2)和c(O2).其中N2O2是第Ⅰ步反应的产物.升温,第Ⅰ步反应更快速地达到平衡,且促使反应Ⅰ的化学平衡逆向移动(由于ΔH1<0),导致中间产物c(N2O2)减小;又N2O2是第Ⅱ步反应的反应物,c(N2O2)减小使得第Ⅱ步反应速率减小,导致总反应速率减小. 以上两因素对速率的影响是矛盾的,它们相互斗争,结果如何?可以执果索因: c(N2O2)减小对第Ⅱ步反应速率的影响(减慢反应速率)大于温度升高对第Ⅱ步反应速率的影响(加速反应速率),因此,温度升高,第Ⅱ步反应的反应速率减慢,则总反应 的反应速率就降低. 或者这样解释:温度升高,对第I步反应逆反应速率的加速幅度大于对第Ⅱ步反应正反应速率的加速幅度(因为第I步反应逆反应的活化能大于第Ⅱ步反应正反应的活化能). 常见的基元反应,活化能都是正的,但在非基元反应中,表观活化能可以是任意值,包括负值.比如本题中的反应: 从“能量-反应过程”图中可以看出该反应的表观活化能为负值,所以反应 的反应速率(或NO的转化率)随温度升高而降低. 参考答案:①Ⅱ ②T4ΔH1<0,温度升高,反应Ⅰ平衡逆移,c(N2O2)减小;浓度降低的影响大于温度对反应Ⅱ速率的影响 例6(2022年1月·浙江选考·20)AB型强电解质在水中的溶解(可视作特殊的化学反应)表示为 其焓变和熵变分别为ΔH和ΔS.对于不同组成的AB型强电解质,下列说法正确的是( ). A.ΔH和ΔS均大于零 B.ΔH和ΔS均小于零 C.ΔH可能大于零或小于零,ΔS大于零 D.ΔH和ΔS均可能大于零或小于零 解析水溶液包括溶质和溶剂水,从溶质的角度,溶解过程多是熵增的过程,但从水的角度,因为要形成水合离子,水分子在电荷高、半径小的离子周围形成规则的扩散层变得有序起来,溶解过程中水的混乱度往往是降低的,即熵减.总的熵是增是减取决于这两方面的大小: ΔS=(S溶质-S固)+(S溶剂-S水) 物质易溶还是难溶,取决于焓和熵的较量.如Ca3(PO4)2的溶解热为-51 kJ· mol-1(放热)却依然难溶于水,就是因为溶解过程的熵变小于零,所以使得吉布斯自由能ΔG=ΔH-TΔS>0.而CaCl2是易溶的,虽然溶解也是熵减的过程(ΔS=-44.8J·K-1· mol-1),但其溶解热高达-81.75 kJ· mol-1,焓主导致易溶[2]. 例7(2023年1月·浙江选考·15)碳酸钙是常见难溶物,将过量碳酸钙粉末置于水中达到溶解平衡: [已知Ksp(CaCO3)=3.4×10-9,Ksp(CaSO4)=4.9×10-5,H2CO3的电离常数Ka1=4.5×10-7,Ka2=4.7×10-11],下列有关说法正确的是( ). C.向体系中通入CO2气体,溶液中c(Ca2+)保持不变 D.通过加Na2SO4溶液可实现CaCO3向CaSO4的有效转化 上层清液中物料守恒: 即x=y+z+w 电荷守恒: 即2x+a=2y+z+b 质子守恒: 即a+z+2w=b 即xy=3.4×10-9 KW=c(H+)·c(OH-)=1×10-14 即ab=1×10-14 即az/w=4.5×10-7 即ay/z=4.7×10-11 联立以上诸方程,运行Mathematica解得: c(Ca2+)=x=1.11×10-4 c(H2CO3)=w=2.22×10-8 c(H+)=a=1.24×10-10 c(OH-)=b=8.07×10-5 通入CO2,发生反应: 正向移动,故溶液中c(Ca2+)增大,故C错误;也可认为通入的CO2与CaCO3发生反应: 有可溶的碳酸氢钙生成,故c(Ca2+)增大. 要判断D选项: 先求转化反应 的平衡常数K值: =6.94×10-5 其次,该转化反应要能发生,需Qi 这里犯的错误是单方面考虑了: 而没有考虑: 真实的反应是这两个方面的迭加,应该综合考虑. 综上,本题答案选B. 看似简单的一道选择题,考生失分严重,多数选D.未选B的原因可能是部分老师过分强调盐类水解的程度微弱,而学生迷信结论,不敢越雷池一步,错失验证真伪赢得分数的机会.至于D选项,也是听信只要Qi>Ksp,沉淀即可生成,而不知具体问题具体对待,是思维僵化的体现. 类似的“另有隐情”的规律还有很多,尤以电化学里为甚,诸如放电规律一定是Cl->OH-吗(Nernst方程等)?Zn-Cu原电池中为什么Cu电极上有气泡逸出(超电势等)?诸多事例提醒师生平日学习时既要基于知识内在结构进行完整性理解,又要基于知识结构化进行关联性理解,防止一些负迁移[1].考场上面对新问题,理应具体问题具体分析,如果刻舟求剑,思维定势,一味依赖已有经验,硬性照搬原有规律,则易得出错误的结论.正所谓:老枝干出新芽,似曾谋面相识;老模型深思考,谨防思维定势.5 温度越高速率越快吗?






6 物质溶解过程一定是熵增过程吗?

7 水解都很微弱吗?







