对制备3D打印纳米羟基磷灰石与丝蛋白复合骨组织工程支架的性能测试
石巍然 米丽·提列克 吴素君 管娟
随着社会老龄化问题的加剧,每年因骨质疏松、骨髓炎等疾病导致骨缺陷或损伤的患者快速增加[1]。虽然生物体骨组织有一定的自愈合能力[2],但是在受到严重和大范围损伤时,自愈合能力明显不足[3-4]。骨组织工程(tissue engineering,TE)被认为是目前临床治疗方案骨移植的替代策略。其目标是通过结合细胞、生物材料支架和信号因子创建3D 微环境来恢复骨组织的功能。理想的生物材料支架有望推动骨组织工程实现更安全、高效的骨组织修复[5-7]。天然蚕丝及其丝蛋白(silk fibroin,SF)具有优异的生物相容性、生物降解性和可调控的力学性能,丝蛋白材料结合生物3D 打印技术,可以获得骨组织工程支架。为了平衡微观形貌、力学性能等多方面性能需求,研究人员从材料组成、制备工艺、结构设计等方面开展了大量研究。Inzana等[8]研究的低温3D 打印磷酸钙支架为制备合成骨移植替代物带来了巨大的希望,其支架性能优于传统支架;Farokhi 等[9]探 讨 了SF 和 羟 基 磷 灰 石(hydroxyapatite,HAp)两种材料在骨组织工程中应用的优势,指出复合了纳米相的HAp-SF 支架在体外和体内试验中获得了促进骨细胞生长和骨组织修复的有益结果。尽管高浓度纯丝蛋白水溶液作为生物3D 打印墨水在支架的力学性能和降解性能方面有优势,但其粘度相对低且剪切变稀行为明显,打印过程中成型性能不佳。因此,基于丝蛋白生物墨水3D 制备骨组织工程支架仍极具挑战,而基于羟基磷灰石与丝蛋白复合体系的挤出式3D 打印工艺也很少报道。本研究采用挤出式3D 打印和冷冻成型工艺制备丝蛋白基骨组织工程支架,分析了纯丝蛋白墨水和纳米羟基磷灰石/丝蛋白混合墨水的流变行为,解析支架的分子结构、微观形貌和力学性能,为3D 制备生物相容性和力学性能优异的骨组织工程支架提供了参考经验。
资料与方法
一、材料
桑蚕茧购自上海复向生物科技有限公司;甲醇(CH3OH)、乙醇(CH3CH2OH)购自北京现代东方科技发展有限公司;碳酸氢钠(NaHCO3)购自Sigma-Aldrich 试剂公司;溴化锂(LiBr)、纳米羟基磷灰石[Ca10(PO4)6(OH)2]、透析袋(截留分子量MWCO 分别为3500、8 000-14 000 Da)、聚乙二醇(PEG,分子量为100 000)购自麦克林试剂公司。
二、方法
1. 再生丝蛋白溶液的制备:丝蛋白提取自桑蚕茧,丝蛋白溶液制备的操作步骤按照文献[10]实验流程。蚕茧块在沸腾的0.02 M NaHCO3溶液中脱胶1 h,并用蒸馏水清洗。在45 ℃烘箱干燥后,将脱胶丝置于在9.3 M溴化锂水溶液中,在40 ℃溶解30 min,所得溶液灌入透析袋(MWCO 8 000~14 000 Da)用蒸馏水透析3 d,换水12次以上,除去离子。所得丝蛋白水溶液以8 000 rpm 的速度离心15 min,去除不溶性杂质,保留上层清液放在冰箱冷藏待用,7 d 内使用。丝蛋白溶液的浓度标定采用称重法。采用聚乙二醇溶液反透析的方法获得高浓度丝蛋白溶液。将低浓度的纯丝蛋白溶液倒入透析袋(MWCO~3 500),浸入质量分数约为15 wt%的PEG 溶液(Mw~100 000)中,浓缩至目标浓度(13 ± 0.5)wt%、(15 ±0.5)wt%、(17 ± 0.5)wt%和(19 ± 0.5)wt%。
2. 冷冻支架定型液的制备:丝蛋白水凝胶墨水经挤出后沉积在低温平台上冷冻成型,冷冻支架需经过定型液的进一步处理,使丝蛋白发生构象转变生成不溶的β-折叠构象,从而固定支架形状。采用的丝素蛋白构象转变诱导剂主要是醇类,定型液中组分的质量配比为:80%甲醇、10%乙醇、10%去离子水。
3. 丝蛋白溶液流变性能测试:流变性能测试在DHR-2 流变仪上进行,采用室温流动模式,剪切速率范围为0.1~1 000 s-1,获得丝蛋白墨水及丝蛋白/纳米羟基磷灰石混合墨水的粘度-剪切速率曲线;采用室温动态震荡模式,频率范围为0.1~100 Hz,获得墨水的模量-频率曲线。
4. 丝蛋白支架的3D 打印制备:丝蛋白支架制备采用Fisnar 点胶机,配置低温恒温箱控制打印平台温度为-13 ℃。丝蛋白溶液经过3 000 rpm 离心5 min 后,用胶头滴管把中层均匀无气泡的部分移进点胶机针筒,针头直径为0.21 mm。打印时,挤出压力为0.8、1.2、1.6、2.0、2.4 bar,针头移动速率为3、4、5、6 mm. s-1。打印程序由Roboedit 软件设定,行间距为1 mm,90°正交打印形成16 行 × 16 列的20 层3D 支架,在平台上冷冻成型。利用显微镜测量支架中横纵向样条尺寸,根据尺寸保真度优选挤出压力和打印速率打印参数。3D 支架打印及冷冻完成后,小心快速转移到定型液中静置5 min,诱导构象转变固定成型。定型3D 支架一部分浸泡在乙醇溶液中以湿态保存,另一部分经冷冻干燥后以干态保存。
5. 丝蛋白/纳米羟基磷灰石支架的制备:将5 g蔗糖溶于45 g 超纯水配置质量分数为10%的蔗糖溶液,加入1 g 纳米羟基磷灰石,用磁转子搅拌得到纳米羟基磷灰石的蔗糖悬浊液。取150 g 低浓度初生丝蛋白水溶液与之混合,得到丝蛋白/纳米羟基磷灰石混合墨水,采用聚乙二醇溶液反透析的方法获得高浓度混合墨水,丝蛋白/纳米羟基磷灰石复合支架的3D打印制备方法和定型方法同上。
6. 扫描电子显微镜表征:微观形貌表征采用扫描电子显微镜,二次电子模式,加速电压为20 kV。经冷冻干燥的纯丝蛋白3D 支架和丝蛋白/羟基磷灰石复合3D支架预先经喷金处理。
7. 傅里叶变换红外光谱(fourier transform infrared,FTIR)表征:分子结构表征采用傅立叶变换红外光谱仪测试,在表面衰减全反射(attenuated total refraction,ATR)模式下,将样条紧贴于ATR 晶体表面,采集纯丝蛋白和复合两种样条的红外光谱,波数范围650~4 000 cm-1,累积扫描32次。FTIR样品制备采用上述纯丝蛋白以及丝蛋白/羟基磷灰石复合墨水,打印连续无间隙平板,经过定型及冷冻干燥处理后,切成薄片试样。利用Peakfit 软件对吸收谱中的酰胺Ⅰ区进行高斯分峰拟合,设定小峰的半峰宽为5 cm-1,采用文献[11]方法,根据峰中心位置判定构象归属为Silk Ⅰ(包含无规线团、螺旋和β-转角)、Silk Ⅱ(β-折叠)两种,对各个拟合峰的面积进行汇总计算,获得两种构象占比。
8. X 射线衍射(X-ray diffraction,XRD)分析晶型:使用D/MAX2200pc 型衍射仪,在10°~70°的2θ范围内,以6 °/min的扫描速率对支架样品进行测试分析。XRD 测试样品制备方式为:用刀片将制备的支架切下一片2 mm 左右厚度的片状样,将其压制成致密的薄片,即可进行XRD测试分析。
9. 压缩力学测试:压缩力学测试在DMA Q800型动态热机械分析仪上进行,将纯丝蛋白3D 支架以及丝蛋白/羟基磷灰石复合3D 支架切割成横截面为4 mm × 4 mm 的方柱样品,置于压缩夹具中,在0.01 N 预紧力下测试样品高度(约为2 mm),压缩时,压缩应变率速率为1%/min,压缩应变为80%。压缩弹性模量在所得压缩应力-应变曲线中,取1%~3%应变段采用线性拟合获得。每组测试5个样品,压缩弹性模量以均值表示。
结 果
一、纯SF及nHAp/SF混合墨水的流变性能
纯SF 和nHAp/SF 混合墨水的粘度-剪切速率关系即粘度随着剪切速率的增加而下降,体现一定的剪切变稀行为。纯SF 和SF/nHAp 混合墨水的粘度-剪切速率关系(图1A),由于质量浓度过高(>17 wt%)的丝蛋白溶液在保存和进一步混合过程中极易发生自主凝胶化反应,因此本研究选取了~15 wt%质量分数的丝蛋白溶液作为纯丝蛋白支架打印墨水。振荡模式下,墨水的储能模量(G′)和损耗模量(G″)与频率的关系曲线可看出,15 wt%丝蛋白溶液在<0.1 Hz 的低频率下就发生从弹性固体到粘性液体的转变,表明纯丝蛋白溶液在较宽的动态剪切频率范围都可以进行挤出式3D打印(图1B)。
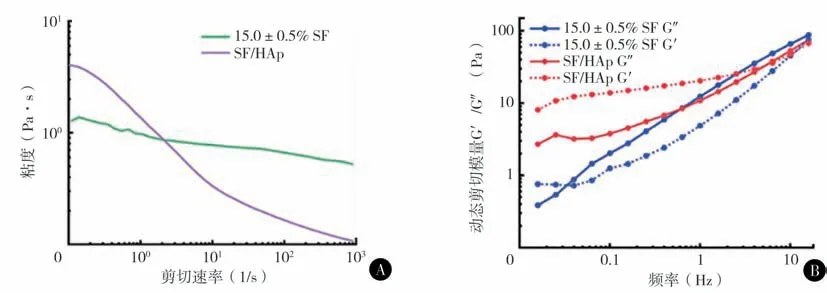
图1 A 丝蛋白质量浓度为15%的SF和SF/nHAp墨水的粘度-剪切速率关系曲线 B 丝蛋白质量浓度为15%的SF和SF/nHAp墨水的动态剪切模量G′/G″-频率的关系曲线
二、nHAp/SF混合墨水的3D打印工艺
挤出式3D 打印的两个重要工艺参数是挤出压力和打印速率。为保证三维支架结构的保真度和结构稳定性,需调节两个参数使挤出单丝直径控制在一个合适的范围。打印平台温度设定为-13 ℃,SF/nHAp复合单丝直径随打印速率和挤出压力的变化(图2)。
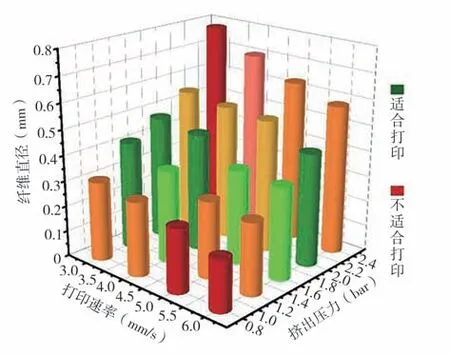
图2 nHAp/SF 混合墨水打印的纤维直径-打印速率/挤出压力关系图 绿色表示单丝及支架结构保真度高、打印效果好,红色表示保真度低、打印效果差
三、SF支架及nHAp/SF支架的微观形貌
冷冻成型的纯丝蛋白3D 支架的截面显示,每根圆形样条中包含疏松多孔的结构,放大后能看到片层结构(图3)。nHAp/SF 复合3D 支架表面放大之后能看到褶皱结构和不均匀孔洞分布,截面形貌相对致密,放大之后能观察到团聚的羟基磷灰石(图4)。

图3 15 wt% 纯丝蛋白3D支架微观形貌 A,B 纯丝蛋白3D支架截面形貌 C~E 样条表面形貌 图4 A,B SF/nHAp复合3D支架截面形貌 C,D 样条表面形貌 E 纳米羟基磷灰石颗粒及团聚体形貌
四、SF及nHAp/SF支架的分子结构
两种丝蛋白3D支架在酰胺Ⅰ区、酰胺Ⅱ区、酰胺Ⅲ区出现了中心位于1 624 cm-1、1 526 cm-1、1 233 cm-1的吸收峰,对应于β-折叠为主的构象结构。XRD 图显示nHAp/SF 复合支架中虽然引入了羟基磷灰石,但羟基磷灰石的特征峰并不明显,仅在2θ = 30°略高(图5)。
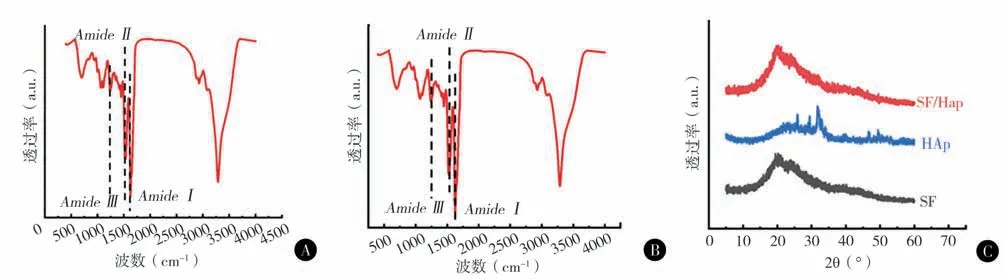
图5 傅里叶变换红外光谱(ATR模式)检测纯丝蛋白及nHAp/SF 支架的吸收谱 A 15 wt%纯丝蛋白支架的红外光谱及酰胺Ⅰ区拟合曲线 B nHAp/SF复合支架的红外光谱及酰胺Ⅰ区拟合曲线 C SF3D支架、nHAp/SF 3D支架、HAp粉末的XRD图
五、SF及nHAp/SF支架的力学性能
压缩模量根据所得压缩应力-应变曲线,取1%~3%应变段采用线性拟合获得。纯丝蛋白3D 支架的压缩模量为(331 ± 164) kPa,压缩强度为(160 ±90) kPa。nHAp/SF复合3D支架的压缩模量是(118 ±66) kPa,压缩强度(120 ± 20) kPa,比纯丝蛋白3D支架的模量和强度明显更低(图6)。
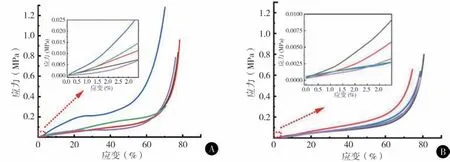
图6 纯丝蛋白支架及nHAP/SF 支架的压缩应力-应变曲线 A 15 wt%丝蛋白支架的压缩应力-应变曲线 B nHAp/SF 支架的压缩应力-应变曲线
讨 论
一、纯SF及nHAp/SF混合墨水的流变性能
nHAp/SF 混合墨水的流变性能相比纯SF 墨水发生了较大的变化,混合墨水的剪切变稀行为更加显著,从低剪切速率下更高的粘度,迅速下降到了高剪切速率下的极低的粘度。一方面,纳米颗粒的引入会增加高分子流动变形的阻力,提高墨水在低剪切速率下的粘度;另一方面,纳米颗粒导致高分子链更容易缠绕、团聚,体现为粘度增加的效果。此外,研究表明HAp 中的Ca2+、PO43-与丝蛋白分子链上的酰胺基、氨基和羧基等基团产生静电或共价作用,使混合墨水在低剪切速率下表现出更高的粘度[12]。本研究中nHAp/SF 混合墨水的初始模量明显提升,在宽频率范围内,均呈现G′>G″的弹性固体性质,当频率>1 Hz 时,才能达到粘性液体状态。因此,混合墨水由于更高的粘度和更偏于固体的性质,其挤出式3D 打印工艺上,相较纯丝蛋白墨水不利于挤出但利于成型。
二、nHAp/SF混合墨水的3D打印工艺
研究发现由于挤出胀大效应,单丝直径比针头直径0.30 mm大,且随打印速率增大而减少、随挤出压力增大而增大。对应单丝直径在0.30~0.40 mm适合打印的参数范围是:打印速率4.0~4.5 mm/s,挤出压力1.10~1.40 bar。
三、SF支架及nHAp/SF支架的微观形貌
冷冻成型的纯丝蛋白3D 支架的截面显示,每根圆形样条中包含疏松多孔的结构,放大后能看到片层结构,可能与冷冻成型温度梯度有关。样条表面是多孔片层结构,孔洞大小不一,尺寸在几微米到几十微米之间。该形貌与文献报道的丝蛋白水凝胶3D 支架的微观形貌特征一致[13]。nHAp/SF 复合3D 支架的样条表面形貌相比于纯丝蛋白支架更加光滑平整,层状结构不再明显,孔洞减少。
四、SF及nHAp/SF支架的分子结构
通过分峰解析1 600~1 700 cm-1对应的酰胺Ⅰ区吸收谱带,可以获得丝蛋白材料的构象组成[11]。结果表明,复合支架中β-折叠构象含量相对更高,推断纳米羟基磷灰石的引入可能促进了丝蛋白形成更多的β-折叠构象。羟基磷灰石是天然骨组织里无机盐的主要成分,其晶体属于六方晶系,呈片层/针状沿着Ⅰ型胶原蛋白c 轴层叠[14]。XRD图中羟基磷灰石的特征峰并不明显可能是由于纳米羟基磷灰石过少信号被主体丝蛋白信号遮盖。
五、SF及nHAp/SF支架的力学性能
3D支架的压缩过程主要包括三个阶段:线性粘弹区、恒应力平台、应力急增区[15]。压缩弹性模量根据所得压缩应力-应变曲线中,取1%~3%应变段采用线性拟合获得。本研究显示纯丝蛋白3D 支架的压缩模量模量和强度相较以往报道的同等孔隙率的丝蛋白基支架更高,如Li 等[16]发现的SF/海藻酸钠交联网络支架的压缩模量仅为16.0 kPa,另有人使用纳米二氧化硅结构增强的丝蛋白基支架的压缩模量为283.5 kPa[17]。因此,本研究中制备的纯丝蛋白3D 支架的压缩力学性能较为优异。引入羟基磷灰石会对支架的压缩性能有提升,羟基磷灰石本身也是天然骨组织重要成分[18-20]。而本研究中的nHAp/SF 支架其丝蛋白含量远低于15 wt%纯丝蛋白支架,在丝蛋白形成交联强化效果之前,低浓度的丝蛋白支架很难有优异的压缩性能,这个结果也表明高浓度的丝蛋白支架的确在力学性能上有很大的优势。
综上,本研究采用挤出式3D 打印和冷冻成型工艺制备了纯丝蛋白和nHAp/SF 3D 支架,并对墨水的流变性能、打印工艺参数、3D支架的微观形貌、分子结构和力学性能进行了分析发现:(1)混合纳米羟基磷灰石的丝蛋白墨水在低剪切速率条件下粘度更高,不利于挤出但有利于成型,剪切变稀行为更显著;(2)nHAp/SF复合支架样条表面形貌相比于纯丝蛋白支架更加光滑平整;(3)纯丝蛋白支架和复合支架的构象结构以β-折叠为主;(4)纯丝蛋白3D 支架的压缩性能较为优异,复合支架的压缩力学性能需要通过调控墨水比例和打印工艺进一步优化。后续研究将聚焦nHAp/SF 支架的骨组织细胞相容性及体外促进成骨的效果。

