丝蛋白软骨支架力学特性及其对关节软骨原位再生的影响
毛智南 毕雪薇 舒雄 管娟
创伤、过度负荷、老化等原因造成的软骨缺损是目前常见的临床骨科疾病[1]。然而,软骨缺乏血管、神经和淋巴等组织,损伤后自我修复能力有限,会引起病患关节肿胀和不适,并导致骨关节炎和整个关节的退行性病变[2-3]。尽管微骨折手术、自体软骨细胞植入术及自体或异体软骨组织移植术也在临床上取得了一定的成效,但其长期预后仍然存在较大不确定性及潜在风险[4-5]。因此,有效治疗关节软骨损伤是急需解决的重要医学问题,也是关系社会、经济和民生的问题。利用生物材料的策略有望成为软骨组织再生和功能恢复的有效方法。理想的组织工程材料或支架应该为细胞生长提供稳定的微环境,维持活细胞或生物活性分子的结构和表型,促进特定组织的细胞再生[6]。这要求支架具有合适的形态/孔径、良好的生物相容性、降解性和降解过程的力学性能保持性[7-8]。对于支架的构建,如果采用生物仿生的策略,除模仿天然软骨的细胞外基质(extracellular matrix,ECM)结构外,还应当模仿其力学特点(软和弹),实现功能仿生,将会更好地促进软骨修复。软骨细胞或骨髓间充质干细胞植入丝蛋白加明胶/硫酸软骨素/透明质酸复合支架上,并且动态压缩负荷模拟天然软骨力学微环境,软骨基质产物即蛋白聚糖和二型胶原明显上调形成新的软骨组织[9]。因此,具有仿生力学性能的工程软骨支架有利于软骨基质的形成。丝蛋白(silk fibroin,SF)作为一种天然高分子材料具有绿色来源、生物降解速率可控、生物相容性好、力学性能可调等特点,在组织工程领域已经被广泛应用[10-11]。此外,SF 及其降解产物在体内不会引起炎症反应[12]。目前,软骨组织工程支架的加工技术包括冷冻干燥、静电纺丝、3D 打印和盐浸法等,但制备的SF支架很少具备仿生软骨的力学性能,且降解过程中过快丧失力学稳定性,无法为细胞增殖和组织再生提供稳定的微环境。利用低温冷冻凝胶技术制备了具有高弹性且均匀孔结构的SF 多孔材料[13-14]。有研究利用该技术制备了具有优异生物相容性的物理化学双交联SF 多孔支架[15-16]。但是,该SF 支架在降解过程中是否能维持力学稳定性还需要进一步观察。本研究利用低温冷冻凝胶法,即在凝胶体系中引入化学交联剂,制备了化学和物理双交联的SF 软骨支架。本研究旨在对支架的微观结构和力学性能(包括降解前和降解过程中)及支架的体内组织相容性和软骨缺损修复进行评价。
资料与方法
一、资料
1. 材料和器材:桑蚕茧购买于上海复向科技有限公司;碳酸氢钠(NaHCO3),溴化锂(LiBr),乙二醇二缩水甘油醚(EGDE),四甲基乙二胺(TEMED),聚乙二醇(PEG,分子量为100 000),透析袋(截留分子量分别为3 500、8 000-14 000),蛋白酶(XIV 型来自灰色链霉菌),磷酸盐缓冲溶液(PBS)购买于Sigma,美国。扫描电镜(SEM,S-4800,日本Hitachi 公司)、动态机械分析仪(DMA Q800,美国)。使用的动物购自积水潭动物管理中心,动物实验方案经积水潭医院动物护理和使用委员会批准,符合实验动物护理和使用指南(国家科学院出版社,美国国立卫生研究院) 85-23 号出版物,1996 年修订)。
2. 丝蛋白溶液的制备:SF 提取自桑蚕茧,实验流程按照前期研究进行[17]。将桑蚕茧在沸腾的0.02 M NaHCO3溶液中煮1 h,脱去蚕丝表面丝胶;然后在超纯水中洗涤5次并干燥。将所得的干态脱胶蚕丝溶解在9.3 M LiBr 溶液中,在40 ℃下溶解3 h;随后将丝蛋白溶液在去离子水中透析3 d(MWCO 8 000-14 000 Da);每天更换3 次去离子水以去除溶液中的离子;最后通过离心再次去除杂质。最终利用质量法确定丝蛋白溶液的浓度,即称量已知体积的溶液(n= 3);再称量干燥后溶质的质量,进而计算丝蛋白的质量体积浓度。
3. 丝蛋白冷冻凝胶支架的制备:将浓度为5.5%w/v 的SF 溶液与TEMED 催化剂(0.25 v/v%)和交联剂EGDE(1 mmol/g)混合,体积定容在3.2 ml。TEMED 加入的量以溶液总体积的比例加入。EGDE 加入的方式为相对于SF 溶液中溶质的质量比例引入,含量表示为mmol/g。将反应溶液搅拌30 min,使溶液充分混合。随后将反应溶液放入温度为-10 ℃的恒温反应器中进行24 h 凝胶反应,得到冷冻凝胶支架。将该冷冻凝胶解冻12 h。最后通过冷冻干燥得到SF 多孔支架。含交联剂和催化剂的SF 支架命名为SF-1E0.25T;纯SF 支架命名为SF-0E0T。
二、方法
1. 扫描电子显微镜检查:用刀片将试样切成2 ~ 3 mm 厚且平整的样品。利用导电胶将样品贴在样品台上,随后溅射喷金120 s。通过扫描电子显微镜观察材料的表面形貌和孔径尺寸。
2. 压缩力学性能检测:压缩试验在动态机械分析仪上选取准静态模式进行。试样大小为7.5 mm ×5 mm(直径 × 高度),测试前试样在PBS 中浸泡12 h以达到平衡。压缩应变速率为30%/min。压缩杨氏模量在试验初始应变阶段(3%~5%)计算。
3. 降解后力学保持性测试:使用酶降解法评估SF 支架的力学稳定性。先配制1 U/ml 的蛋白酶[XIV 型来自灰色链霉菌(3.5 U/mg)],将大小为7.5 mm × 3 mm(直径×厚度)的SF 支架置于1 ml 酶溶液中. 每3 天更换1 次酶溶液。在7、14、21、28 d后取出降解样品并用去离子水洗涤除去残留的降解液。随后进行压缩力学性能测试,压缩杨氏模量取试验初始应变阶段(3%~5%)计算。
4. 支架的大鼠皮下组织相容性评价:将体重为250~300 g 的Sprague-Dawley(SD)大鼠用于评估SF支架在皮下植入模型的体内生物相容性。所有动物程序均按照《北京航空航天大学实验动物护理和使用指南》进行,并经北京航空航天大学动物伦理委员会批准(BM20180041)。麻醉后,将SF-1E0.25T支架植入大鼠皮下。支架在植入前进行灭菌处理并浸泡在无菌PBS 溶液中。植入的SF 支架尺寸为7.5 mm × 1.5 mm(直径×厚度),用于观察异物反应(foreign body reaction, FBR)。在手术后第28 天处死动物。收集样品和邻近组织用于以下组织学研究。对于组织学检查,样品首先用10%中性缓冲福尔马林固定,然后经脱水、浸蜡处理后包埋在石蜡中。随后将4 μm 厚石蜡切片用苏木精和伊红(HE)和Masson三色染色以评估FBR。
5. 支架的兔子膝关节软骨缺损修复评价:将SF-1E0.25T 支架植入兔子膝关节软骨缺损部位,验证支架体内原位软骨缺损修复的能力。体重为2.7~3.2 kg的成年雄性新西兰白兔用于体内研究。兔子经过麻醉、常规准备和造模,制备标准微骨折,然后植入SF-1E0.25T 支架与缺损相匹配。其中部分微骨折组(MF)作为对照组,最后缝合关节。12 周后,处死兔子进行大体观察和组织学研究。组织学标本用4%多聚甲醛(pH 7.4)中固定48 h,然后在20% EDTA(pH 7.2)中脱钙2 个月。脱钙标本在分级乙醇中脱水,并包埋在石蜡中,连续切片(6 mm厚),最后进行HE、番红固绿染色进行组织学评价。
6. 统计学处理:所有实验数据均以±s表示。各组间采用单因素方差分析进行统计学差异分析。P< 0.05为差异有统计学意义。
结 果
1.SF 软骨支架的形貌和力学特性:纯丝蛋白支架和物理化学双交联丝蛋白支架的微观形貌显示,SF-1E0.25T支架的微孔更加均匀(图1)。

图1 微观形貌表征 A SF-0E0T 支架的微观形貌 B SF-1E0.25T支架的微观形貌
2.SF软骨支架在降解过程中的力学性能变化:对SF-0E0T 和SF-1E0.25T 进行了压缩性能测试显示,降解前SF-0E0T 支架的压缩模量要高于SF-1E0.25T。但湿态下的加载-卸载过程中SF-1E0.25T 支架表现出更好的弹性(图2)。在PBS(pH = 7.4, 37 ℃)条件下,使用浓度为1 U/ml 的蛋白酶XIV溶液对2种支架进行体外降解观察。第7、14、21、28 天对支架的压缩力学性能进行了测试显示,SF-1E0.25T 支架的压缩模量从开始的40 kPa 逐渐降到第28 天的8 kPa 左右。与此对应的是,SF-0E0T 在降解第7 天后已经无法进行力学性能测试(图2,3)。
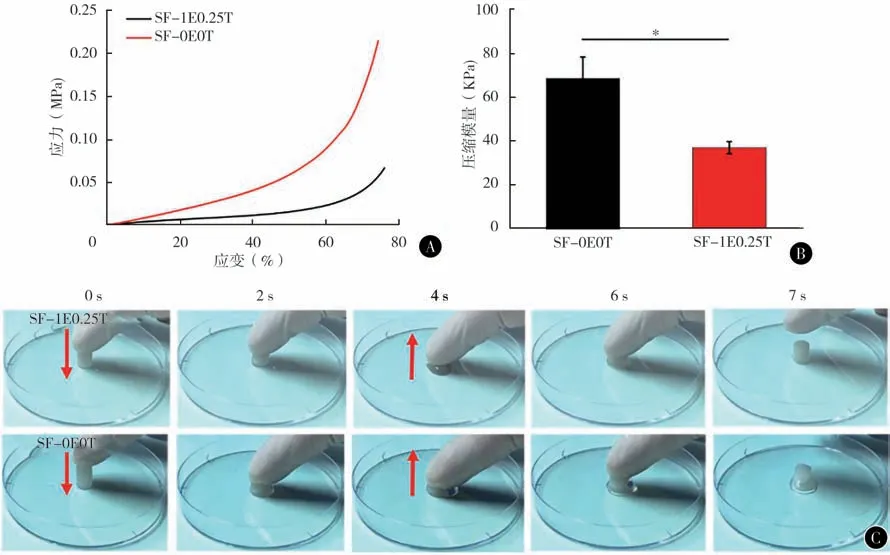
图2 支架的力学性能表征 A SF-0E0T和SF-1E0.25T支架的压缩应力-应变曲线 B SF-0E0T和SF-1E0.25T支架的压缩模量统计 C SF-0E0T和SF-1E0.25T湿态支架受压后自主恢复原始状态的示意图
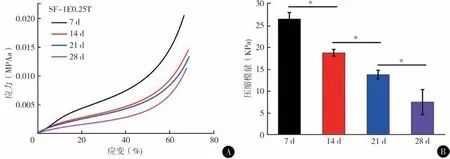
图3 SF软骨支架降解过程的力学性能表征 A SF-1E0.25T支架不同降解时间后(第7、14、21和28天)的压缩应力-应变曲线 B SF-1E0.25T支架不同时间后的压缩模量统计
3. SF 软骨支架的组织相容性:将SF-1E0.25T支架植入大鼠皮下,植入28 d 后组织学分析显示,周围组织中的细胞已经充分浸润到支架内部,支架内部也生成了新的再生组织,充分体现了支架与组织之间的融合。从Masson 组织染色结果可以看出,支架与周围组织界面处并未形成纤维囊,说明了支架在体内不会引起慢性炎症反应(图4)。
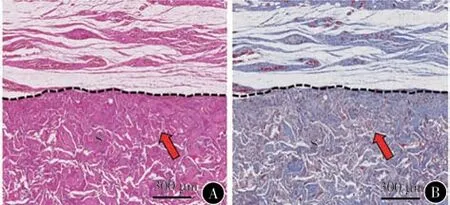
图4 SF-1E0.25T 支架大鼠皮下组织学分析 A 植入28 d 后H&E染色图像 B 植入28 d后Masson染色图像。“S”代表支架;虚线代表支架与周围组织的界面;箭头代表支架内的再生组织
4. SF 软骨支架的体内软骨再生能力:将SF-1E0.25T 支架植入兔子软骨缺损模型中经过12 周的饲养,对软骨修复效果显示,MF 组基本无新透明软骨生成;相反SF-1E0.25T组软骨缺损处(红线内)有再生透明软骨生成,相比于其他无添加生物活性因子材料原位软骨再生也体现出明显优势[18-19]。采用H&E 和番红固绿染色对SF-1E0.25T 组缺损部位和再生软骨组织进行检测显示,软骨缺损部位生成了新的软骨组织,并且与周围软骨组织整合很好,软骨基质成分含有糖胺聚糖(图5)。

图5 原位软骨修复的动物实验评价 A 植入12周后MF 组大体观照片 B 植入12 周后SF-1E0.25T 组大体观照片 C 植入12 周后SF-1E0.25T组的组织学评价(HE和番红固绿染色)。第一个箭头代表再生软骨与天然软骨的界面处;第二个箭头代表软骨基质
讨 论
关节软骨缺乏血管、神经和淋巴管等组织,导致其损伤后自愈能力有限[2-3]。因此,如何有效治疗关节软骨损伤一直是医学上的难题之一。关节软骨具有复杂的层级结构,大约1~2 mm 厚,覆盖在关节骨表面;其水分含量很高且表面光滑可以起到缓冲应力、降低摩擦、承受复杂载荷的作用;软骨组织在服役过程中须保持一定的力学稳定性。对于无负载生物活性因子的SF 软骨支架可以一定程度实现软骨的再生和修复[20],但该支架在服役过程中的力学稳定性及与软骨新基质形成之间的联系值得进一步探索。
相关研究表明均匀三维空间结构有利于细胞的增殖和分化,也有利于组织再生过程中ECM 的产生[21]。因此,本研究利用冷冻凝胶策略构建的SF多孔支架满足组织工程应用的基本性能要求,同时SF支架形变可以完全恢复到原始状态,基本实现了软骨力学仿生的目的。同时,该力学性能特点也优于现有部分的软骨组织支架[18,22-23]。SF 作为一种天然蛋白质材料,在蛋白酶的条件下可以发生降解。SF-1E0.25T 支架在降解过程压缩模量呈现出接近线性衰减的趋势。实验结果充分体现了双交联网络结构的SF软骨支架具有更高的力学稳定性,力学性能降低更可控。
生物材料植入宿主体内会引起异物反应,包括宿主细胞最初聚集,随后组织长入、生物材料降解或在植入后期生物材料周围形成纤维囊[24]。从材料与组织界面处是否形成胶原纤维囊,可以评价材料在体内是否可以稳定存在,即是否会导致慢性炎症反应。综合以上组织学评价,表明该SF-1E0.25T支架在体内呈现出优异的组织相容性。兔子软骨缺损模型的组织学结果表明,在无生物活性因子的辅助下,SF支架依然具有一定的软骨修复能力。故推测该效果与SF 软骨支架在降解过程可以保持稳定的力学性能有关,为新软骨基质不断的形成提供了良好的微环境。在未来的工作中有待更深入分析支架力学与软骨修复效果之间的关系,为无生物活性因子、无外源细胞的生物材料实现软骨修复提供理论基础。
本研究探索了双交联SF 软骨支架在体外降解过程的力学特性维持能力,并且采用大鼠皮下植入模型和兔膝关节软骨缺损模型,尝试建立仿生力学性能与软骨修复效果之间的联系。相比于纯SF 支架,SF-1E0.25T 支架在降解过程中,力学性能呈现出近线性衰减的趋势,为内源细胞生长和新软骨基质的形成提供稳定的微环境。同时该支架在大鼠皮下呈现出优异的组织相容性,无明显的异物反应。兔软骨缺损实验表明具有仿生力学性能的SF 软骨支架可以一定程度实现关节软骨的再生和修复。
志谢该研究工作得到了北京市属医学科研院所公益发展改革与试点项目(京医研2019-9)资助。所有动物实验均由北京航空航天大学动物护理与使用委员会(北京100083)和北京积水潭医院(北京100035)批准(202110-02)。
利益竞争声明作者声明,他们没有已知的可能影响本文所述工作的相互竞争的经济利益或个人关系。

