基于C肽的胰岛素抵抗指数可准确评估健康体检者的胰岛素抵抗与血尿酸水平的相关性
方福生,王 宁,刘星宇,王 薇,孙 菁,李 红,孙般若,谷昭艳,傅晓敏,闫双通
解放军总医院第二医学中心1保健一科,2健康医学科,3内分泌科,4第一医学中心内分泌科,北京100853
C肽来源于胰岛素原裂解过程中产生的生物活性肽,血清C肽比血清胰岛素更为精确地反映内源性胰岛素分泌[1]。目前研究发现C肽具有生物活性[2]。C肽对1型糖尿病动脉粥样硬化、周围神经病变有潜在治疗作用[3]。Jeon等[4]研究发现,C肽可抑制谷氨酰胺转移酶2介导的微血管渗漏、炎症和细胞凋亡,减轻糖尿病患者高血糖诱导的肺纤维化。临床上C肽主要用于评价胰岛β细胞功能、胰岛素抵抗。梁倩等[5]研究发现2型糖尿病患者空腹C肽与血尿酸水平存在关联,认为胰岛素抵抗与血尿酸水平升高密切相关。
胰岛素抵抗是高血糖及诸多代谢性疾病的共同土壤[6]。目前常用稳态模型(HOMA)胰岛素抵抗指数定量评估机体胰岛素抵抗[7]。基于血清胰岛素的胰岛素抵抗指数与血尿酸水平密切相关[8,9]。然而,由于血清C肽临床应用不如血清胰岛素广泛,C肽胰岛素抵抗指数作为另一个胰岛素抵抗评价方法,其实际应用相对较少。临床上可否使用基于C肽的胰岛素抵抗指数评估胰岛素抵抗与血尿酸的关联,其作用与基于血清胰岛素的胰岛素抵抗指数是否存在差异,目前尚不清楚。本研究通过对健康体检数据进行回顾性分析,探讨C肽胰岛素抵抗指数在评估健康体检者胰岛素抵抗与血尿酸水平关联中的作用。
1 资料和方法
1.1 研究对象
回顾性收集2017年1月~2021年12月在解放军总医院第二医学中心进行健康体检的人群资料,共纳入46 017例作为研究对象。健康体检对象以企事业单位职工为主,是城镇职工较好的代表性样本。纳入标准:年龄≥18岁,首次进行健康体检且资料完整,未应用胰岛素或胰岛素类似物。排除标准:1型糖尿病,其它特殊类型糖尿病,糖尿病酮症酸中毒、高渗性高血糖状态等急性并发症,急性心力衰竭,急性肾功能不全,服用利尿剂,服用降尿酸药物,服用糖皮质激素或其它可能影响胰岛素分泌的药物,近1个月有外伤、手术、严重感染等应激状态。本研究经解放军总医院伦理委员会批准(批文号:S2015-038-01)。
1.2 研究设计
制定统一调查表,健康体检时由专业人员收集年龄、性别、糖尿病病史、家族史等,测量身高、体质量、收缩压(SBP)、舒张压(DBP)。空腹(禁食8 h以上)抽血检测血尿酸(Ua)、空腹血糖(FPG)、空腹胰岛素(FINS)、空腹C肽(FCP)、总胆固醇(TC)、甘油三酯(TG)、低密度脂蛋白胆固醇(LDL-c)、高密度脂蛋白胆固醇(HDL-c)、糖化血红蛋白(HbA1c)、丙氨酸氨基转移酶(ALT)、天冬氨酸氨基转移酶(AST)、肌酐(Cr)等指标。应用HOMA2模型计算基于FINS的胰岛素抵抗指数(HOMA2-IR)、基于FCP的胰岛素抵抗指数(HOMA2 IR-CP)[10,11]。依据慢性肾脏病流行病学合作研究(CKD-EPI)公式计算肾小球滤过率(eGFR)[12]。采用比色法测定血尿酸、采用己糖激酶法测定血糖、采用酶比色法测定血脂(Cobas C501全自动生化分析仪,Roche)。采用电化学发光法测定血清胰岛素、血清C肽(Cobas e601电化学发光免疫分析仪,Roche)。
1.3 诊断标准
依据2020年版中国2型糖尿病防治指南,以2型糖尿病病史、和/或FPG≥7.0 mmol/L、和/或HbA1c≥6.5%判定2型糖尿病[13]。依据2019年中国高尿酸血症与痛风诊疗指南,将研究对象分为两组:Ua≤420 μmol/L和Ua>420 μmol/L[14]。
1.4 统计学分析
采用SPSS 26软件进行统计学分析。正态分布的计量资料以均数±标准差表示,组间比较采用独立样本t检验。非正态分布的计量资料以中位数(Q1,Q3)表示,组间比较采用非参数检验。计数资料以例数(%)表示,组间比较采用χ2检验。胰岛素抵抗指数与Ua的相关性分析采用单因素Pearson 相关分析(r<0.2,无相关;0.2≤r<0.4,弱相关;0.4≤r<0.6,中等强度相关)。矫正混淆因素后,采用多因素线性回归分析胰岛素抵抗指数与Ua水平的关联。采用分层交互分析不同亚组间胰岛素抵抗指数与血尿酸水平的关联是否存在差异。采用ROC曲线分析胰岛素抵抗指数与Ua的相关程度,通过最佳切点获得Ua 升高(>420 μmol/L)相关的HOMA2-IR、HOMA2 IR-CP值。以P<0.05为差异有统计学意义。
2 结果
2.1 一般资料
共纳入46 017例成年健康体检人群,研究对象的一般资料见表1。研究对象年龄50.0±9.9岁,Ua 342.8±89.3 μmol/L。Ua>420 μmol/L组女性比例、年龄、HDL-c、eGFR低于Ua≤420 μmol/L组(P<0.001),而体质量指数(BMI)、SBP、DBP、FPG、FINS、FCP、TC、TG、LDL-c、ALT、AST水平高于Ua≤420 μmol/L组(P<0.001),两组间HbA1c无统计学差异。
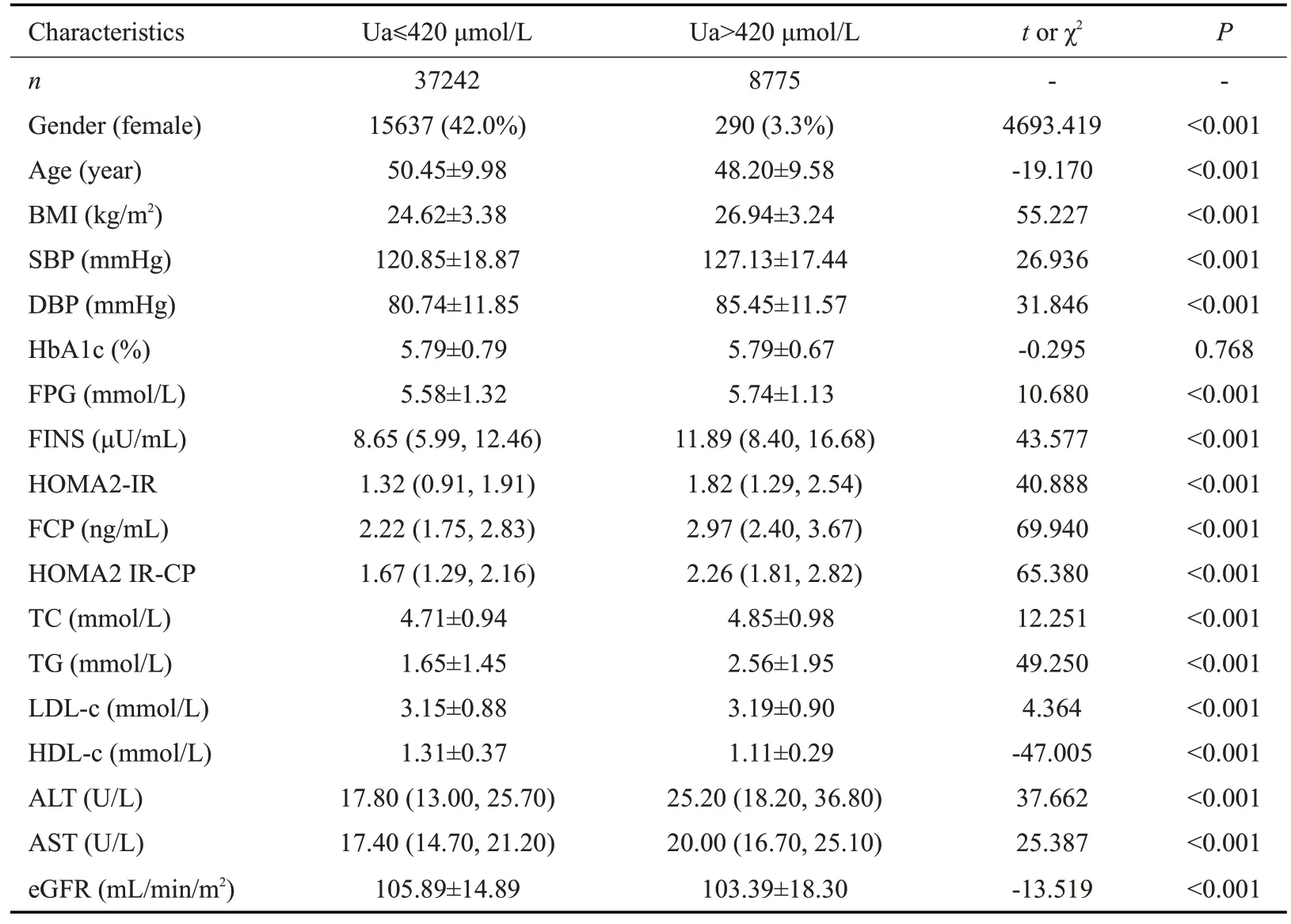
表1 研究对象的一般资料Tab.1 General information of study subjects
2.2 不同血尿酸组胰岛素抵抗指数的差异
比较两组胰岛素抵抗指数的差异(表1),Ua>420 μmol/L组HOMA2-IR、HOMA2 IR-CP水平均显著大于Ua≤420 μmol/L组(P<0.001)。
2.3 胰岛素抵抗指数与血尿酸的单因素Pearson相关分析
分析HOMA2-IR、HOMA2 IR-CP与Ua的相关性,单因素Pearson相关分析显示HOMA2-IR(r=0.262,P<0.001)与Ua弱相关,HOMA2 IR-CP(r=0.409,P<0.001)与Ua中等强度相关,FPG与Ua不相关(r=0.093)。
2.4 胰岛素抵抗指数与血尿酸的多因素线性回归分析
以Ua为因变量,以HOMA2-IR或HOMA2 IR-CP为自变量,多因素线性回归分析显示(表2),在调整相关混淆因素(年龄、性别、BMI、SBP、TG、FPG、ALT、eGFR)后,HOMA2-IR(β 4.934,95%CI4.230~5.637,P<0.001,R2=0.445)或HOMA2 IR-CP(β 21.316,95%CI20.199~22.433,P<0.001,R2=0.461)与Ua水平相关。
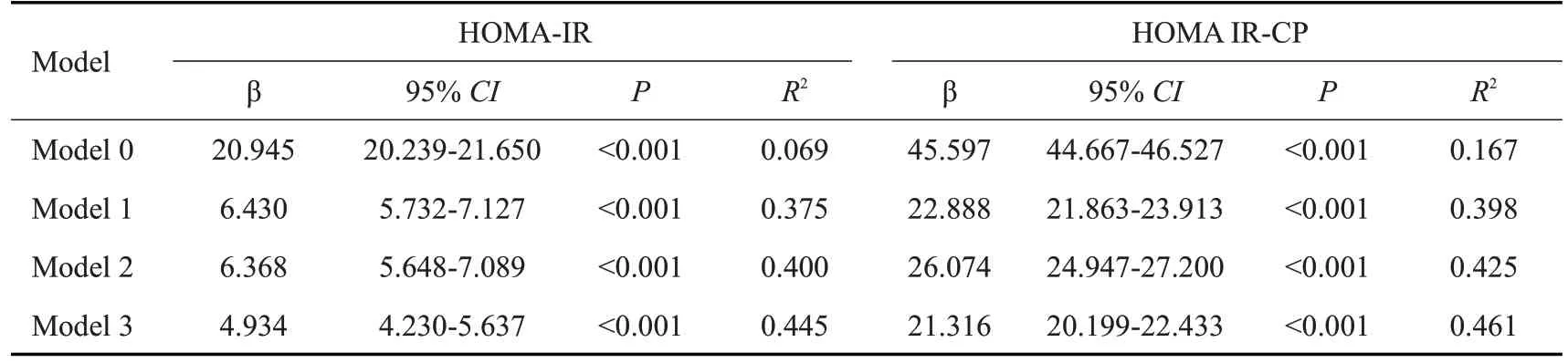
表2 胰岛素抵抗指数与血尿酸的多因素线性回归分析Tab.2 Multivariate linear regression analysis of insulin resistance index and serum uric acid level
2.5 分层交互分析不同亚组间胰岛素抵抗指数与血尿酸水平的关联
对不同性别、年龄、糖代谢状态亚组分别进行分析(表3),以Ua 为因变量,以HOMA2-IR(Q1~Q4)或HOMA2 IR-CP(Q1~Q4)、性别、年龄、糖代谢状态、BMI、SBP、TG、ALT、eGFR为自变量(分层变量除外),多因素Logistic回归分析显示,HOMA2-IR或HOMA2 IR-CP均与Ua水平相关(P<0.001)。交互检验作用发现不同性别、年龄、糖代谢亚组间关联均存在差异(Pinteraction<0.001)。
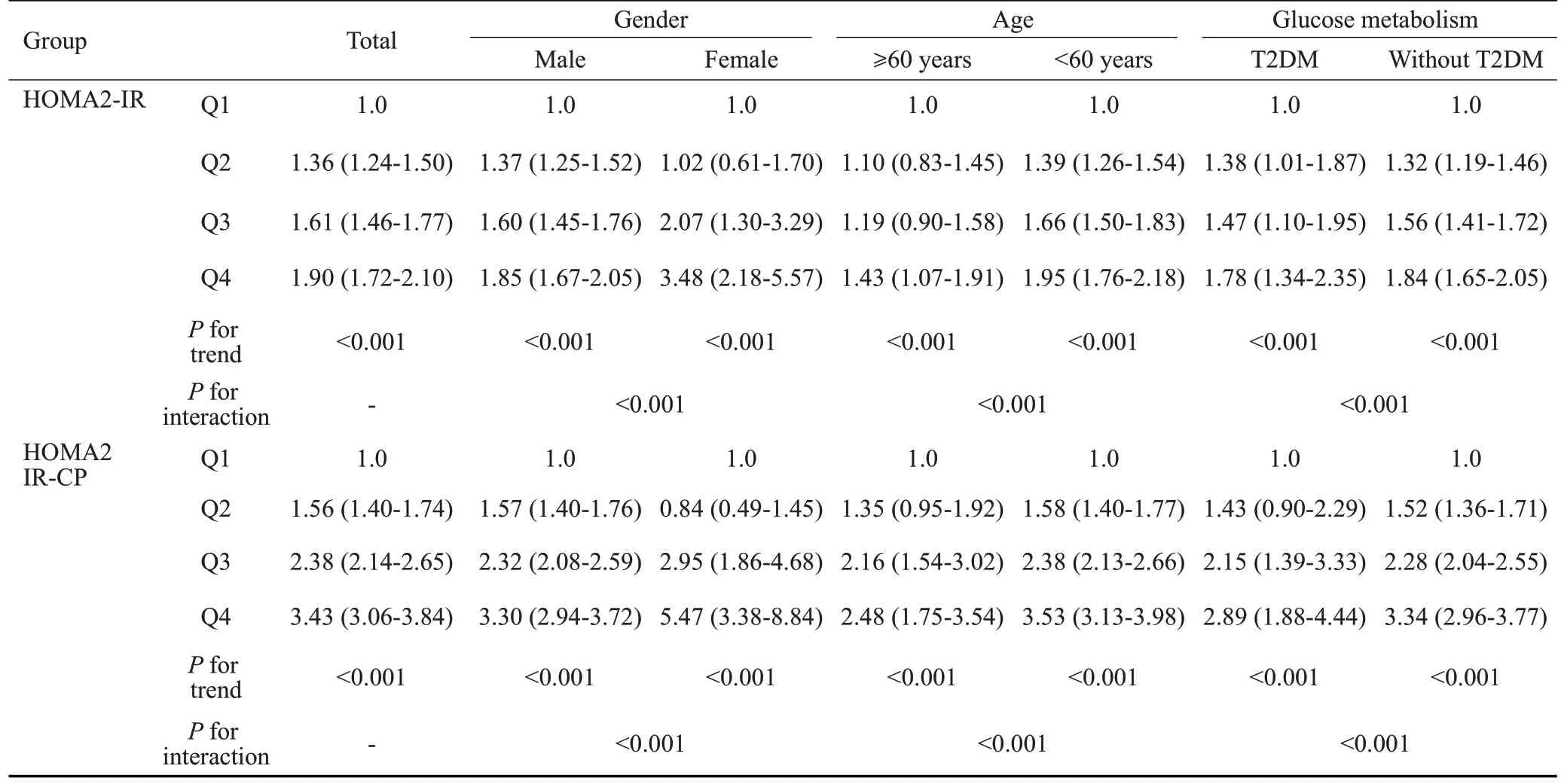
表3 分层交互分析不同亚组间胰岛素抵抗指数与血尿酸的关联Tab.3 Hierarchical interaction analysis of the associations between insulin resistance index and Ua in different subgroups
2.6 胰岛素抵抗指数与血尿酸升高的ROC曲线
应用ROC曲线分析HOMA2-IR与Ua的相关程度(图1),发现HOMA2-IR预测Ua升高(>420 μmol/L)的ROC 曲线下面积为0.662,切点为1.45,敏感性为67.1%,特异性为56.9%,约登指数为0.240。
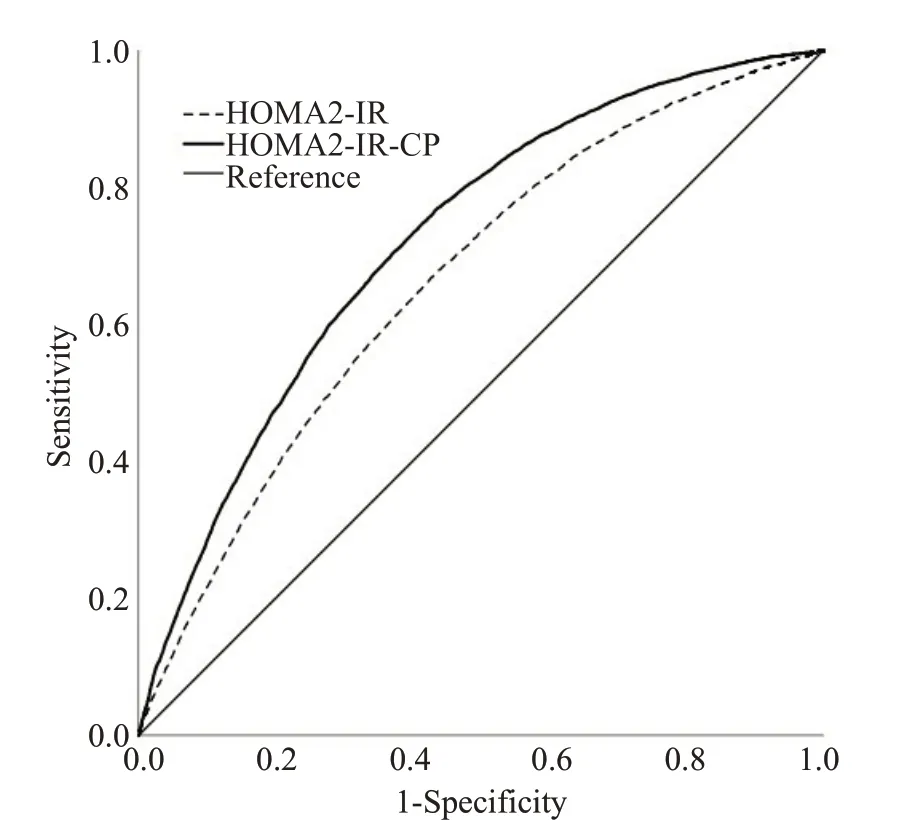
图1 HOMA2-IR、HOMA2 IR-CP与血尿酸升高的ROC曲线Fig.1 ROC curves of HOMA2-IR,HOMA2 IR-CP and elevated serum uric acid.
应用ROC曲线分析HOMA2 IR-CP与Ua的相关程度,发现HOMA2 IR-CP预测Ua升高(>420 μmol/L)的ROC 曲线下面积为0.722,切点1.78,敏感性为76.6%,特异性为56.7%,约登指数为0.333。
3 讨论
本研究发现,C肽胰岛素抵抗指数可更为准确地评估胰岛素抵抗与血尿酸水平关联,是个有用的评估方法。健康体检人群HOMA胰岛素抵抗指数与血尿酸水平相关,不同性别、年龄、糖代谢状态亚组间胰岛素抵抗指数与Ua的关联存在差异。与HOMA2-IR比较,C肽胰岛素抵抗指数与血尿酸的相关程度更高。HOMA2 IR-CP 预测血尿酸升高的ROC 曲线下面积也大于HOMA2-IR。因此,在评估胰岛素抵抗与血尿酸水平关联时,C肽胰岛素抵抗指数更具优势。
目前应用最广泛的胰岛素抵抗评估指标是HOMA胰岛素抵抗指数[14,15]。临床实践中通常使用血清胰岛素计算HOMA2-IR,C肽胰岛素抵抗指数应用相对较少[16]。然而,C肽在体内半衰期显著长于胰岛素[17],血清C肽比血清胰岛素更稳定,可代替胰岛素计算HOMA胰岛素抵抗指数,特别是使用外源性胰岛素的糖尿病患者[18]。Tekoh 等[19]分析小样本非糖尿病人群HOMA2-IR 与HOMA IR-CP 的相关性,发现两者之间没有关联。Ferrannini等[20]在欧洲心血管疾病和糖尿病调查中,计算了3 种不同的HOMA 指数,发现HOMA-IR、HOMA2-IR和HOMA2 IR-CP诊断血糖异常的敏感性、特异性均较低。吴晓明等[21]发现C肽胰岛素抵抗指数与致动脉粥样硬化指数(AIP)相关,而HOMA-IR 与AIP无关。本研究发现,HOMA2-IR、HOMA2 IR-CP均与血尿酸相关,但HOMA2 IR-CP相关程度更高,有一定临床应用价值。此外,HOMA指数诊断胰岛素抵抗的切点仍不清楚[22,23]。Demir 等[24]研究发现应用HOMA2-IR评估胰岛素抵抗的最佳切点为1.40。本研究结果相似,HOMA2-IR区分血尿酸水平升高的切点为1.45,而C肽胰岛素抵抗指数的切点为1.78。
胰岛素抵抗与血尿酸水平密切相关。有研究[25]发现非糖尿病人群胰岛素抵抗指数与血尿酸水平相关,而胰岛β细胞功能与血尿酸水平无关。有研究[26]发现新诊断2型糖尿病人群胰岛素抵抗指数与血尿酸水平升高有关。本研究发现,2型糖尿病患者胰岛素抵抗与血尿酸的关联不如非糖尿病成年人显著,与糖尿病患者比较注重膳食管理、不同个体间血尿酸水平差异较小可能有关。体内外研究发现高尿酸与心肌细胞、骨骼肌细胞胰岛素抵抗有关,二甲双胍可通过AMPK信号通路改善高尿酸诱导的胰岛素抵抗[27,28]。高尿酸血症是痛风的发病基础,可导致痛风性关节炎、肾脏损害,与心血管风险增加有关。胰岛素抵抗导致血尿酸水平升高的机制尚不清楚。胰岛素抵抗可促进糖酵解的中间产物转化为磷酸核糖焦磷酸、5-磷酸核糖,有助于嘌呤的生物合成和转化,尿酸生成增多[8]。胰岛素抵抗可引起高胰岛素血症,刺激近端小管尿酸盐阴离子转运蛋白,促进肾脏对尿酸的重吸收,导致尿酸水平升高[29]。
本研究的优点在于所有受试者均有血清胰岛素、血清C肽数据,分别应用胰岛素、C肽计算HOMA胰岛素抵抗指数,可以从多角度探讨胰岛素抵抗指数与血尿酸水平的关联。本研究也有一定的不足之处。首先,本研究为单中心回顾性横断面研究,无法根据本研究结果直接建立因果关系,有待多中心前瞻性研究加以证实。其次,2型糖尿病的诊断仅依据病史、空腹血糖及糖化血红蛋白,可能存在一定偏差。
总之,本研究通过对健康体检数据进行回顾性分析,探讨不同胰岛素抵抗指数与健康体检人群血尿酸水平的关联,发现C肽胰岛素抵抗指数可以用于评估胰岛素抵抗与血尿酸的关联,且比基于血清胰岛素的胰岛素抵抗指数更有优势。基于C肽的胰岛素抵抗指数可能是一个很好的评价胰岛素抵抗的指标,值得在临床上探索应用。