SLC12A8 通过JAK/STAT 途径促进膀胱癌细胞的增殖、侵袭与迁移并触发上皮间充质转化
张晓林,吴浩松,汪 盛
蚌埠医学院第一附属医院泌尿外科,安徽 蚌埠233004
膀胱癌是最常见的尿路恶性肿瘤,也是癌症相关死亡的常见原因之一,是女性常见的恶性肿瘤,是男性第四大常见恶性肿瘤[1]。在2020年,经统计,全球超过57万名患者被诊断出膀胱癌,其中男性患病人数大约是女性4倍[2]。大约70%的膀胱癌在诊断时被归类为非肌层浸润性膀胱癌(NMIBC),而其余约30%被归类为肌层浸润性膀胱癌(MIBC)[3,4]。经尿道膀胱肿瘤切除术是NMIBC患者的主要治疗方法,而根治性膀胱切除术则适用于MIBC 患者[5]。在生物学和临床水平上,NMIBCs是一种异质性癌症,具有广泛的复发和进展[6,7]。目前针对膀胱癌治疗手段仍以手术为主,化疗为辅方针,但由于易于复发和转移的特点,效果不理想。膀胱癌增殖、侵袭和转移分子机制是肿瘤发生、发展和治疗研究的热点之一[8]。揭示膀胱癌发生发展的分子机制,有助于发现新的治疗靶点,对膀胱癌治疗及预后意义重大。
电中性阳离子-氯化物偶联共转运蛋白基因家族(SLC12)最初是在鱼类和哺乳动物的分子水平上鉴定的[9]。其参与各种生物过程,包括离子和营养输送、细胞能量代谢和细胞体积调节以及药物输送[10]。大量的生理学、免疫组织化学和生物化学研究揭示了这个基因家族对人类健康和疾病的重要性的大量信息[11]。在多种癌症研究中可见到SLC12家族成员的身影,例如:结直肠癌[12]、膀胱癌[13]、卵巢癌[14]。我们利用生物信息学分析方法,发现在膀胱癌中,成员SLC12A8、SLC12A9表达差异最显著,而只有SLC12A2、SLC12A8预后有意义,因此,我们针对性研究SLC12A8在膀胱癌中的作用。虽然SLC12A8在膀胱癌研究中已有报道,但并未阐明其具体作用机制[15]。
本文研究SLC12A8在膀胱癌细胞中的表达以及与临床预后关系,并探讨SLC12A8在膀胱癌中的作用及其机制,明确是否通过激活JAK/STAT信号通路促进膀胱癌细胞增殖、侵袭与迁移,为该疾病在今后诊治过程中提供新思路。
1 材料和方法
1.1 细胞与试剂
人正常膀胱细胞SV-HUC-1及膀胱癌细胞系T24、5637、J82、UMUC3 来自本课题组前期研究库存。MEM及1640培养基(普诺赛),青霉素-链霉素及CCK-8细胞活性检测试剂(白鲨),胎牛血清(四季青),胰蛋白酶(Gbico),小干扰siRNA(吉满生物),nanotrans(佰欧晶),引物(通用),SDS、Tris、甘氨酸、TBS 及吐温(生工),脱脂奶粉及BSA(索莱宝),甲醇(麦克林),PVDF膜(密理博),ECL(三鹰),PAGE凝胶(雅酶),预染蛋白Marker(莫纳),蛋白酶磷酸酶抑制剂及BCA 试剂盒(碧云天),一抗:SLC12A8、N-cadherin、vimentin、p-STAT3、STAT3(Bioss、兔抗),一抗:E-cadherin、p-JAK2(Affinity、兔抗),二抗:(Affinity、抗兔)。
1.2 生物信息学分析
基于TCGA数据库转录组数据,利用“limma”R包对数据进行配对与非配对分析SLC12A8在膀胱癌中的表达,并制作OS和ROC曲线;另外,下载并提取TCGA数据库中膀胱癌患者临床信息完整的数据,分析SLC12A8与临床病理特征之间的关系。利用单因素与多因素COX回归分析,判断SLC12A8是否可作为膀胱癌独立预后影响因素。利用GSEA 软件对高表达SLC12A8基因集进行富集分析。利用仙桃学术(https://www.xiantao.love)分析SLC12A8与EMT标志物之间的相关性及基因SLC12A8在泛癌组织中表达。
1.3 细胞培养与转染
人正常膀胱细胞SV-HUC-1及膀胱癌细胞系(T24、5637、UMUC3、J82)分别保持在含有10%胎牛血清、100 U/mL青霉素及100 mg/L链霉素的1640和MEM培养基中;放在37 ℃、5%CO2细胞恒温培养箱中。待细胞融合度达90%时,可予胰蛋白酶将细胞消化,离心并重悬,用于后续实验。将T24、5637细胞按2×105/孔的密度接种在6孔板中,放置培养箱中,至融合度达60%~70%时,参照nanotrans说明书将siNC及siSLC12A8转入细胞,分为阴性对照组(NC)和敲低组(siSlc12a8),每组设3个重复。转染6 h后更换正常培养基,继续培养24 h~48 h,转染效率达标后用于后续实验。
1.4 提取RNA及实时定量PCR检测
使用Trizol 分别提取各组膀胱癌细胞中的总RNA,再使用反转录试剂盒进行相应的逆转录反应,即可获得可作为DNA模板的cDNA,进而使用实时定量PCR试剂盒进行上机检测各组细胞中目的基因的表达量,涉及的引物序列(5'-3')分别为:
SLC12A8:F:CTGGTGTCCTTCGTCATCCTG,
R:CACCTGCAACACACTGTCCA;
JAK2:F:TCTGGGGAGTATGTTGCAGAA,
R:AGACATGGTTGGGTGGATACC;
STAT3:F:GAAGGAGGCGTCACTTTCAC,
R:TTGTTCAGCTGCTGCTTTGT;
GAPDH:F:AGAAGTATGACAACAGCCTCAA,
R:GCCATCACGCCACAGTTT;qRT-PCR反应条件为:95 ℃30 s,95 ℃5 s,60 ℃30 s,进行40个循环,采用2-ΔΔCt法计算mRNA相对表达量,实验重复3次。
1.5 Western blotting检测
提取各组细胞置于冰上,使用RIPA进行蛋白裂解15 min,4 ℃12 000 r/min离心5 min,取上清,使用BCA试剂盒进行蛋白浓度检测,测定结束后放入金属水浴锅100 ℃恒温加热10 min。将等量配置好的蛋白质加载到凝胶上,在7.5%或10%凝胶上电泳分离,然后取出SDS-PAGE凝胶,进而将蛋白转至PVDF膜上,转膜结束后将PVDF膜放置5%脱脂奶粉中并于摇床上室温封闭2 h,封闭结束后用PBS清洗3次,分别取相应的稀释后一抗4 ℃孵育过夜,PBS清洗3次后加入稀释好的二抗室温孵育2 h,PBS再清洗3次,最后加入化学发光显影液ECL进行曝光检测。
1.6 CCK-8检测
将T24、5637 细胞分别铺至96 孔板中,设置好分组,每组5个复孔,2000/孔细胞、100 μL完全培养基,待细胞贴壁后,每孔分别加入10 μL CCK-8试剂,放入培养箱中孵育2 h,然后使用酶标仪检测各孔在450 nm波段处的A值,以此类推,连续记录0、24、48和72 h各孔的数值,最终计算出各组细胞的增值率。
1.7 Transwell实验
侵袭实验:先取24孔板及小室,将稀释好的基质胶按50 μL/孔均匀铺至小室底部,放入培养箱中烘干,使基质胶呈半凝固状,然后将不同组别的T24、5637各组细胞消化离心,用无血清1640培养基重悬细胞并计数,按5×104/孔铺至小室,同时每孔加入100 μL无血清培养基,小室外部每孔加入600 μL含20%血清的完全培养基,每组设置3个复孔,放入培养箱中培养48 h。取出小室,予以4%多聚甲醛固定2 h,再以1%结晶紫染色液室温染色30 min,最后取出小室,并用棉签及PBS清洗小室内部,然后将小室放在倒置显微镜下拍照(×160)并计数,最终算出各组细胞的侵袭率。
迁移实验:无铺基质胶步骤,余步骤和侵袭实验相同。
1.8 划痕实验
在12孔板中培养转染成功的各组T24、5637细胞,待细胞融合度达90%以上时,用10 μL枪头对各组细胞进行垂直划痕操作,然后吸取旧培养基,并更换为无血清培养基,放入培养箱中继续培养。在显微镜下拍照(64倍)并记录各组细胞划痕0、24、48 h后的划痕面积,计算出各组细胞的迁移率。
1.9 统计学分析
实验数据采用GraphPad prism 8.0软件及SPSS25.0统计软件进行统计分析,均以均数±标准差示,两组间比较采用非配对t检验,相关性分析采用Spearman检验,P<0.05认为差异具有统计学意义。
2 结果
2.1 SLC12A8在膀胱癌中的表达及预后
基于TCGA数据库中膀胱癌FPKM数据,配对与非配对分析结果表明,相较于正常组织,癌组织中SLC12A8表达量更高(P<0.05,图1A)。qRT-PCR检测发现T24和5637细胞系中SLC12A8基因表达水平较正常膀胱细胞高,差异具有统计学意义(P<0.05,图1B)。预后分析(OS)显示,高表达SLC12A8与较差的生存预后相关(P=0.012,图1C)。同时ROC 曲线(AUC=0.894)也验证了这一点(图1D)。泛癌分析结果显示,SLC12A8在泛癌中普遍高表达,其中膀胱癌组织中表达量明显高于正常组织(P<0.05,图1E)。
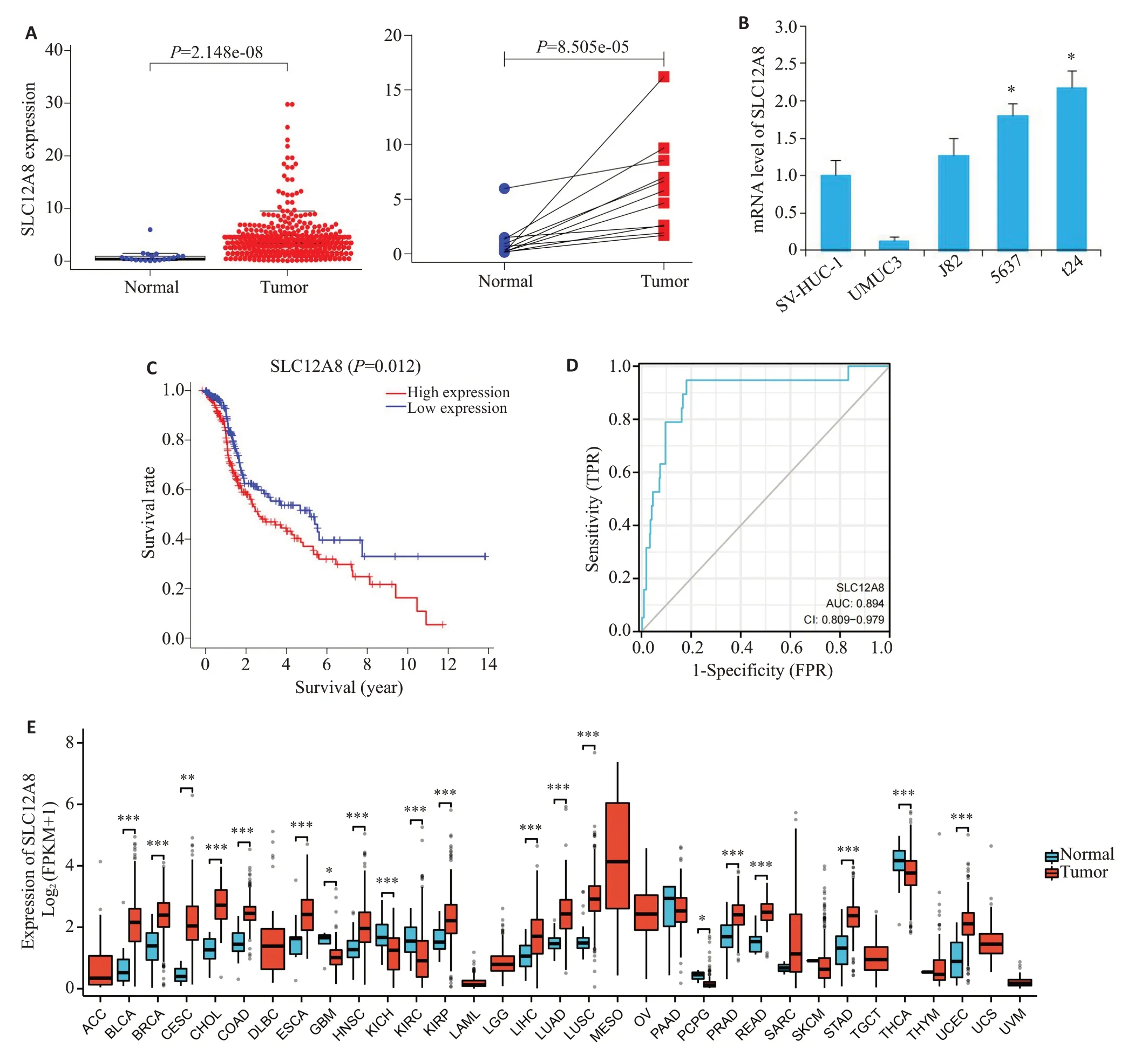
图1 生物信息学分析SLC12A8在膀胱癌中的表达及预后Fig.1 Bioinformatic analysis of SLC12A8 expression and prognosis in bladder cancer.A: TCGA database analysis of SLC12A8 expression in bladder cancer.B:SLC12A8 expression levels in different cell lines detected with qRT-PCR.*P<0.05 vs SV-HUC-1.C:Analysis of the correlation between SLC12A8 expression level and survival rates of the patients.D:ROC curve analysis of SLC12A8 expression and its diagnostic reliability.E:Pan-cancer analysis of SLC12A8 expression.*P<0.05,**P<0.01,***P<0.001 vs normal group.
2.2 SLC12A8表达与膀胱癌临床病理特征相关性分析
基于TCGA 数据库中临床病理特征信息完整的数据,分析结果显示,SLC12A8在膀胱癌患者中的表达与年龄、Grade分级、Stage分期、T分期和N分期等有关(P<0.05),而与性别和M 分期无关(P>0.05),其中SLC12A8 与高年龄、高级别和高分期等呈正相关(P<0.05,图2)。
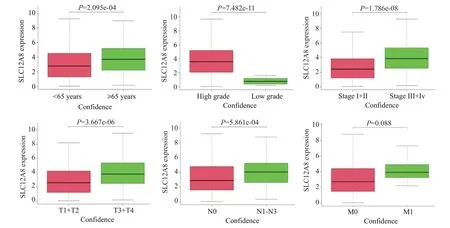
图2 基于TCGA数据库分析SLC12A8与膀胱癌临床病理特征关系Fig.2 Relationship between SLC12A8 expression level and clinicopathological features of bladder cancer patients analyzed based on the TCGAdatabase.
2.3 COX回归分析膀胱癌预后因素
单因素COX回归分析结果表明,年龄、分期、T分期、M分期、SLC12A8均可作为膀胱癌患者预后的潜在影响因素(P<0.05);多因素Cox回归分析结果提示,年龄与SLC12A8 可作为膀胱癌患者的独立预后变量(P<0.05,表1)。其中多因素Cox回归分析结果并以森林图进行展示(图3)。
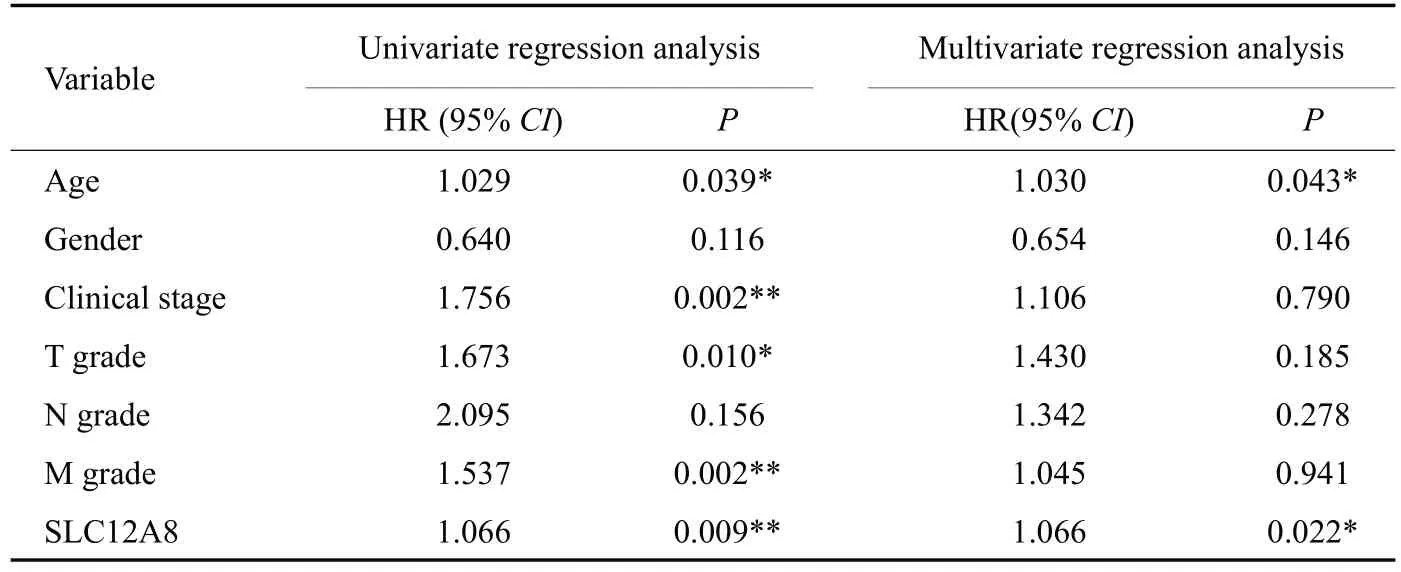
表1 单因素和多因素COX回归分析SLC12A8在膀胱癌中的作用Tab.1 Univariate and multivariate regression analysis of the role of SLC12A8 in bladder cancer
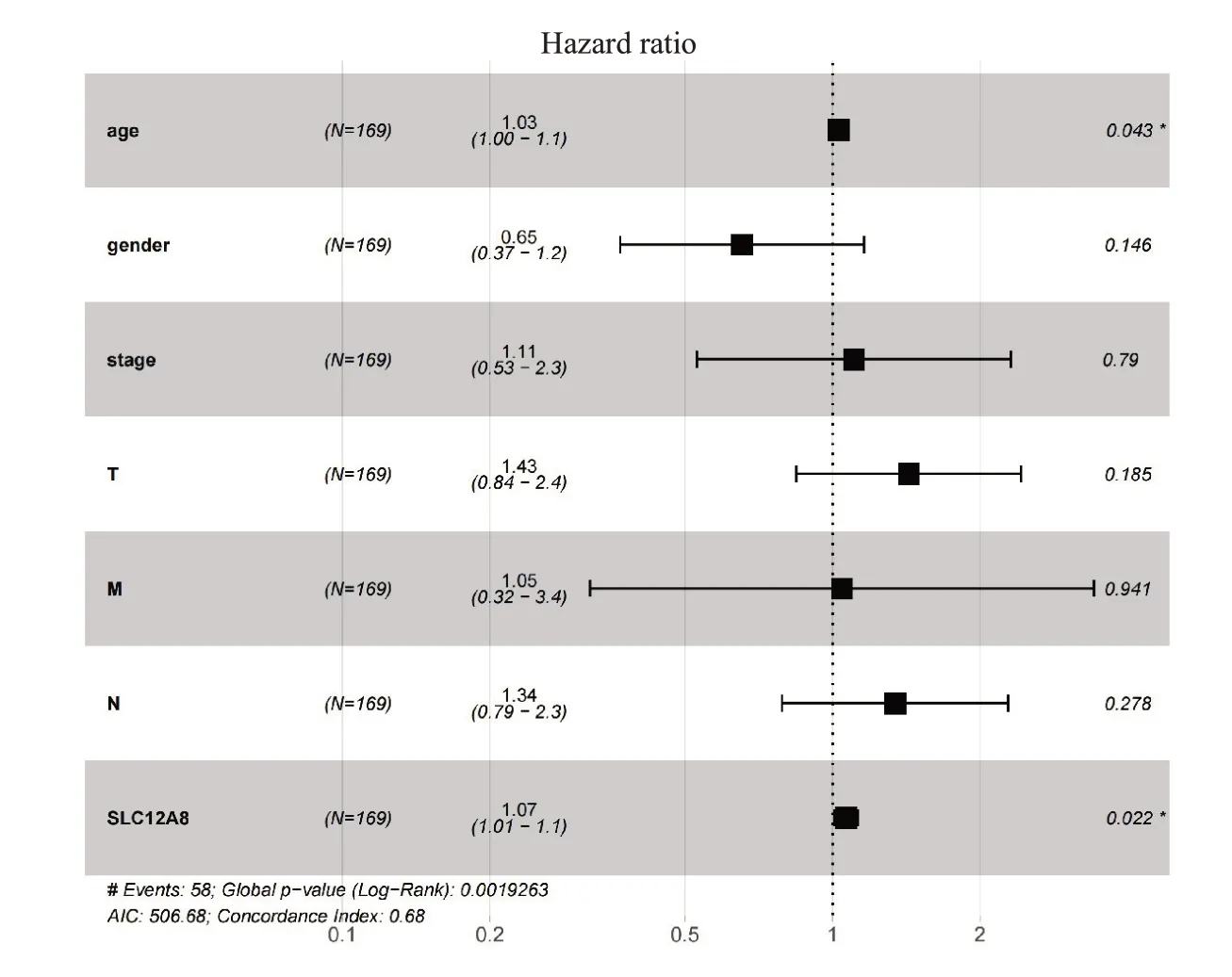
图3 多因素Cox回归分析预后因素Fig.3 Multivariate Cox regression analysis of the prognostic factors of bladder cancer.*P<0.05.
2.4 敲低SLC12A8抑制膀胱癌细胞增殖、侵袭与迁移
首先利用qRT-PCR 检测敲低效率,选取干扰效率最佳即siSLC12A8-3(简称si3)用于后续实验(P<0.05,图4A)。CCK8实验结果显示,相较于siNC组,siSLC12A8-3组细胞增殖能力明显降低(P<0.05,图4B)。Transwell实验结果显示,相较于siNC组,siSLC12A8-3组细胞侵袭与迁移能力明显降低(P<0.05,图4C~E)。划痕实验结果显示,相较于siNC组,siSLC12A8-3组细胞伤口愈合能力降低(P<0.05,图4F~H)。
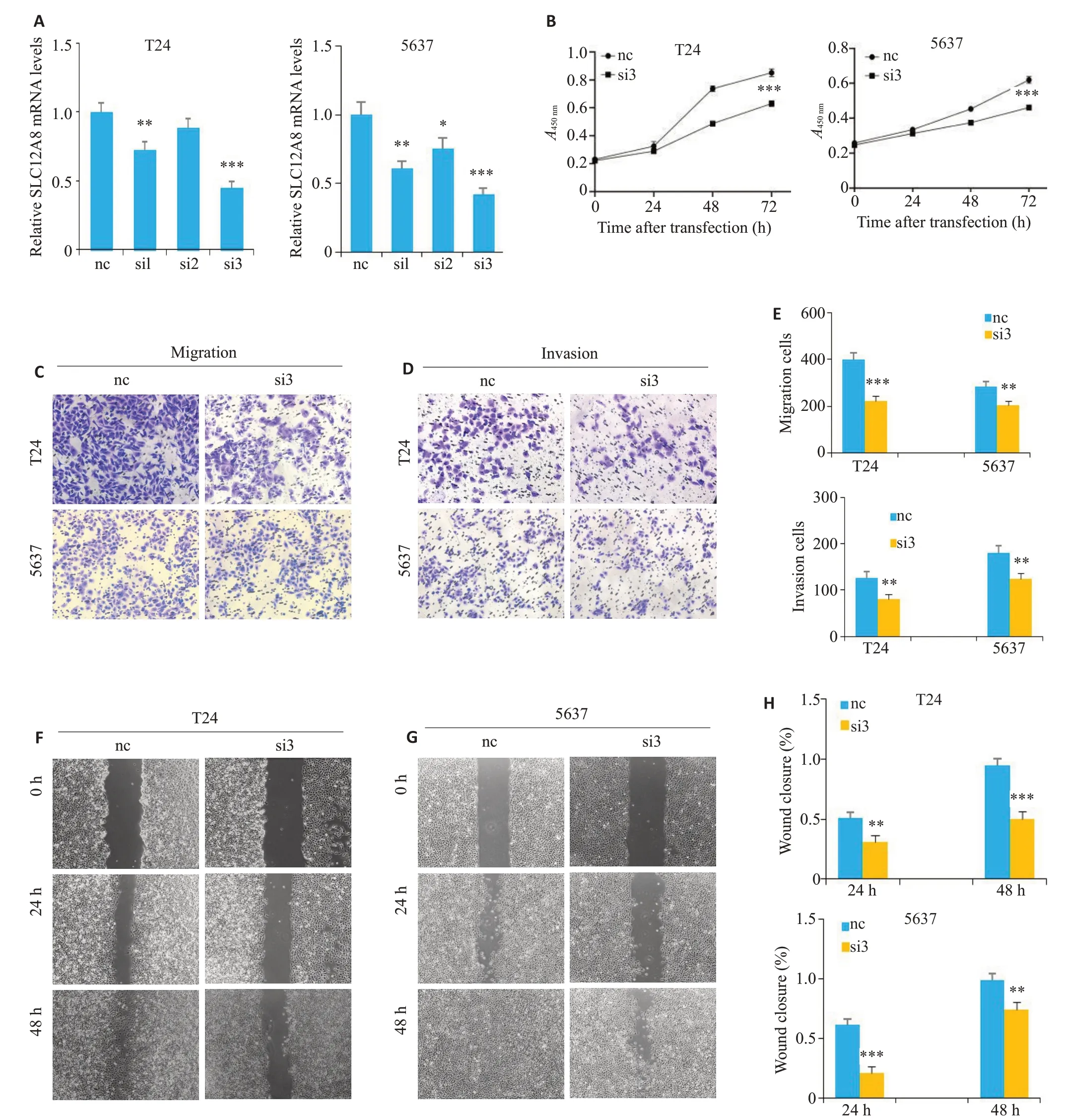
图4 敲低SLC12A8能够抑制细胞增殖、侵袭与迁移Fig.4 SLC12A8 knockdown inhibits proliferation,invasion and migration of bladder cancer cells.A: Verification of knockdown efficiency using qRT-PCR.B:CCK-8 assay for assessing proliferation of the cells.C-E:Transwell assay for assessing cell invasion and migration (Original magnification: ×160).F-H: Scratch assay for assessing cell migration ability (×64).**P<0.01,***P<0.001 vs NC group.
2.5 SLC12A8调控JAK/STAT信号通路
GSEA基因集通路富集分析,结果显示高表达的基因集显著富集在JAK/STAT 信号通路上(P=0.008,图5A);其中还意外发现SLC12A8可能与细胞周期有关(图5D)。qRT-PCR 技术预测该通路,结果显示,siSLC12A8 组的JAK2 及STAT3 表达水平显著低于siNC组(P<0.05,图5B、C)。Western blot检测发现,相较于siNC组,siSLC12A8组的p-JAK2及p-STAT3蛋白表达水平显著降低(P<0.05,图5E、F)。
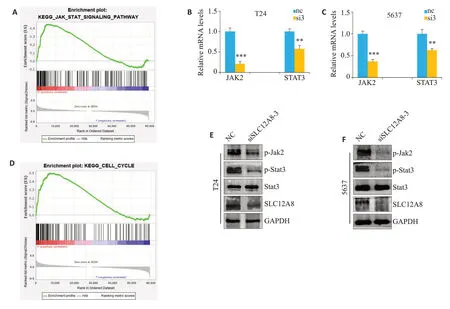
图5 SLC12A8调控JAK/STAT信号通路Fig.5 SLC12A8 regulates the JAK/STAT signaling pathway.A,D:GSEA enrichment analysis of potential mechanism of action of SLC12A8.B,C:Expression levels of the key genes in the JAK/STAT pathway detected with qRT-PCR.E,F: Western blotting for detecting JAK/STAT pathway protein expression levels in the cells.**P<0.01,***P<0.001 vs NC group.
2.6 SLC12A8通过JAK/STAT促进膀胱癌细胞进展
计划敲低SLC12A8同时给予colivelin(STAT3激活剂),将实验分为si3+nc和si3+colivelin组。CCK8检测结果显示,si3+colivelin组细胞活力较si3+nc组明显增强(P<0.05,图6A、B)。Transwell检测结果表明,相较于si3+nc组,si3+colivelin组细胞的侵袭与迁移能力显著提升(P<0.05,图6C~F)。
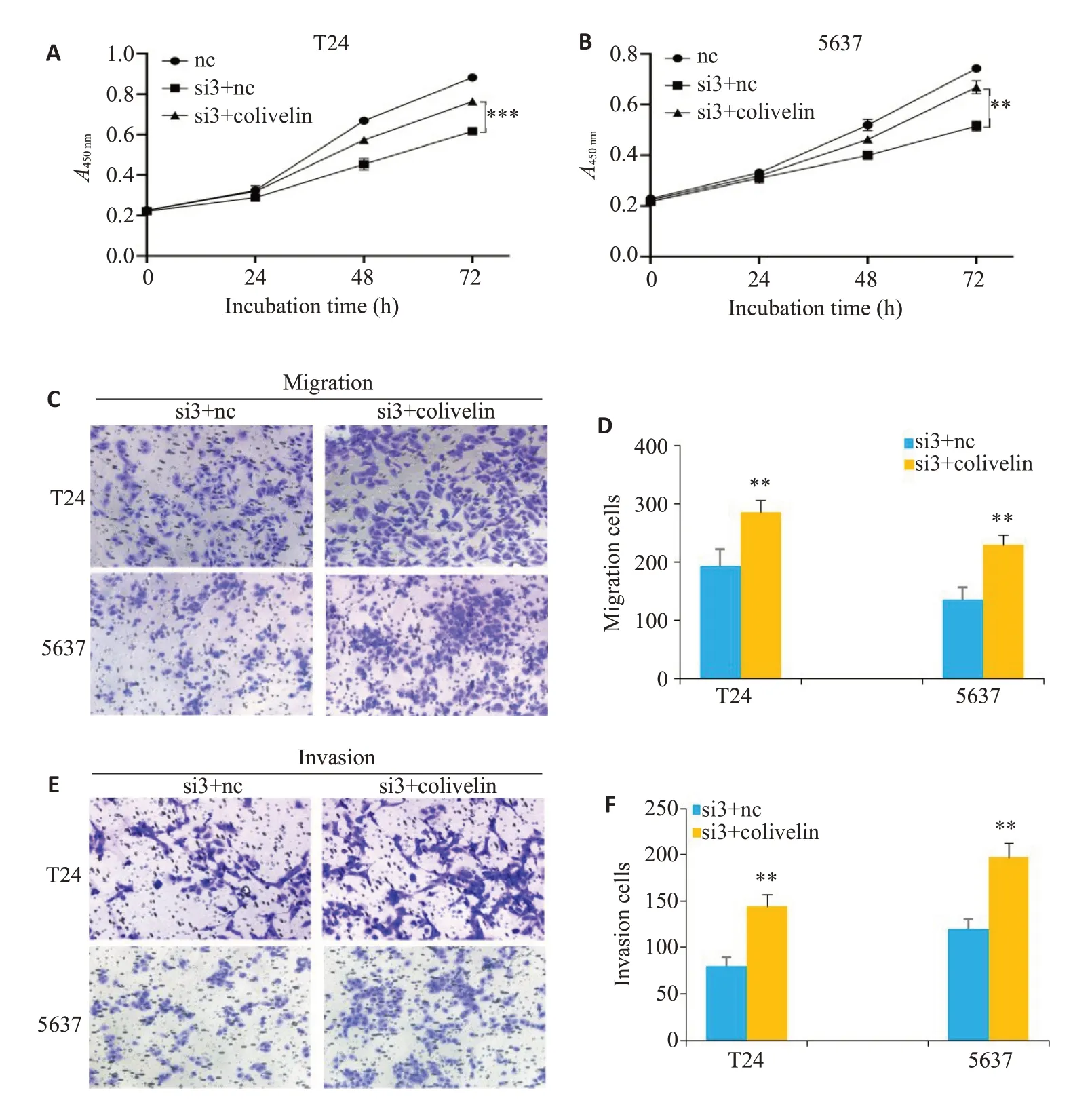
图6 SLC12A8通过JAK/STAT影响膀胱癌细胞生物学行为Fig.6 SLC12A8 affects biological behaviors of bladder cancer cells through the JAK/STAT pathway.A,B: CCK-8 assay for detecting cell viability.C,D: Transwell assay for detecting cell migration capacity (× 160).E/F:Transwell assay for detecting cell invasion (× 160).**P<0.05,***P<0.001 vs Si3+NC group.
2.7 SLC12A8 通过触发上皮间充质转化(EMT)促进膀胱癌细胞侵袭与迁移
TCGA 数据库相关性分析表明,SLC12A8 与Ecadherin 负相关(r=-0.183,P<0.001),而与N-cadherin正相关(r=0.302,P<0.001)、vimentin正相关(r=0.342,P<0.001,图7A)。GSEA富集分析,显示SLC12A8与膀胱癌细胞黏附、迁移相关(P<0.05,图7B)。Western blotting检测发现,相较于siNC组,siSLC12A8组中Ecadherin表达增加,而N-cadherin、vimentin等蛋白表达下降(图7C)。
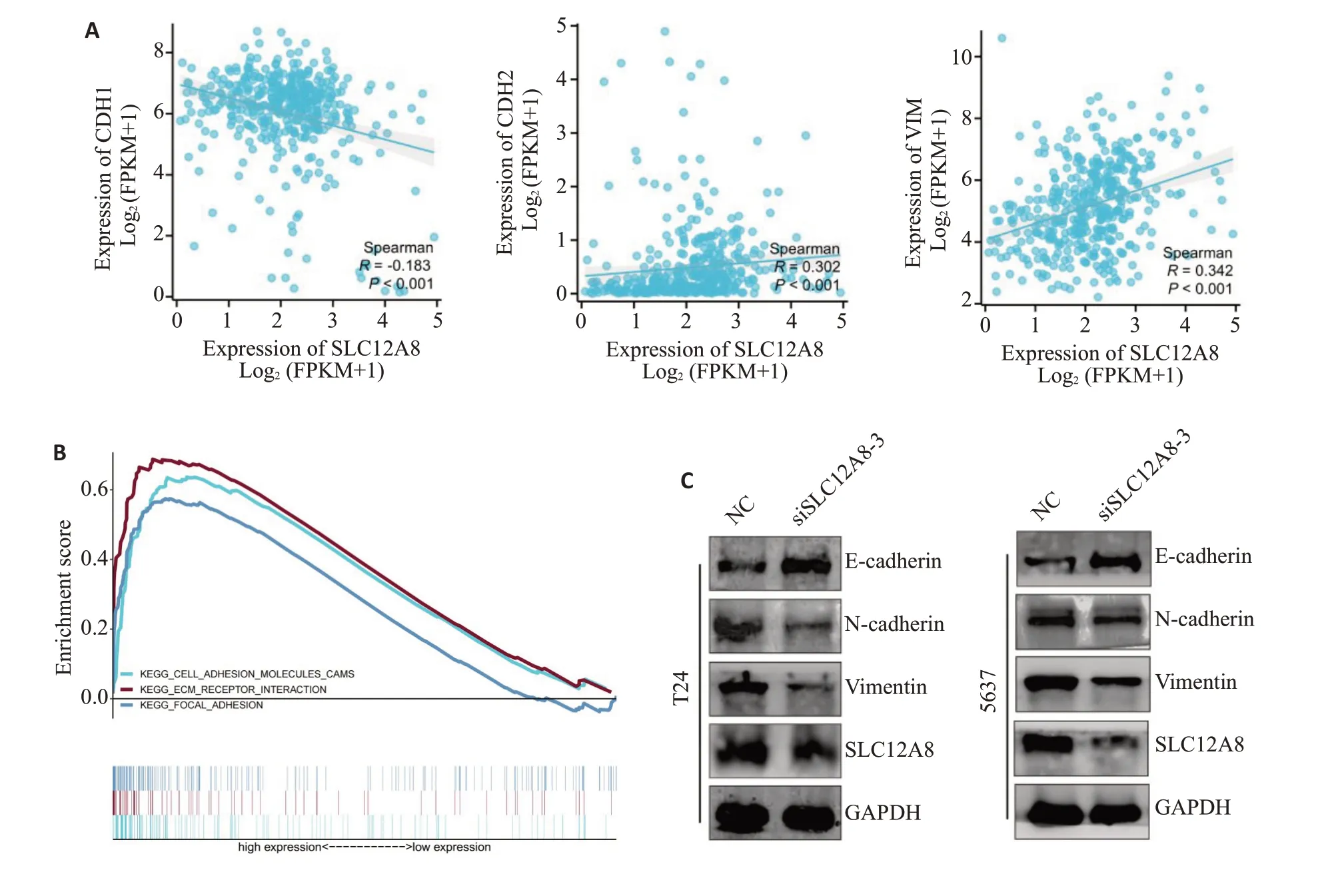
图7 SLC12A8促进膀胱癌细胞EMT发生Fig.7 SLC12A8 promotes epithelial-mesenchymal transition (EMT) in bladder cancer cells.A: Relationship between SLC12A8 and EMT marker expressions in TCGA database.B:GSEA enrichment analysis showing the possible involvement of SLC12A8 in EMT.C:Western blotting for detecting the effect of SLC12A8 knockdown on expressions of key EMT proteins.
3 讨论
本研究旨在探究SLC12A8在膀胱癌中的表达及作用机制,利用生物信息学分析结合细胞实验证实SLC12A8在膀胱癌中高表达,且与不良预后、病理分期相关,可作为独立预后因子。以人膀胱癌细胞T24、5637为研究对象,体外实验证实敲低SLC12A8可抑制膀胱癌细胞增殖、侵袭与迁移,并抑制上皮间充质转化。进一步研究发现,敲低SLC12A8 可能通过调控JAK/STAT信号通路抑制膀胱癌细胞生物学行为。
已有研究表明,在乳腺癌中,SLC12A8通过激活TLR/NLR信号通路促进乳腺癌细胞恶行进展,且高表达与乳腺癌预后呈负相关[16]。这无疑丰富了SLC12A8影响肿瘤进展的作用机制。另已有研究通过免疫组化学检测证实了SLC12A8在膀胱癌组织中表达高于癌旁组织,提示SLC12A8在肿瘤的进展及预后中起着重要作用[17]。这与本研究结果一致,证实了SLC12A8在膀胱癌中高表达、敲低SLC12A8具有抗肿瘤作用。另外,我们为了进一步分析敲低SLC12A8抑制膀胱癌细胞增殖的潜在机制,通过查阅相关文献报道,发现SLC12家族成员SLC12A1可以通过影响细胞周期进程进而抑制肿瘤增殖[18]。巧合的是,我们通过GSEA富集分析发现SLC12A8表达也可能与细胞周期相关,猜测SLC12A8可能通过参与细胞周期进程而影响细胞增殖,为证实这一推断,需进一步检测敲低SLC12A8后细胞周期变化及周期关键基因表达水平,但遗憾的是,在本研究中未能进一步深入研究。
在本研究中,运用膀胱癌T24和5637细胞系敲低SLC12A8基因。检测敲低SLC12A8基因表达后对T24和5637细胞功能学的影响。CCK8实验结果提示,与siNC 组相比,siSLCC12A8 组的细胞增殖明显降低(P<0.05)。Transwell侵袭实验结果提示,siSLCC12A8组的细胞平均侵袭及迁移细胞数明显减少(P<0.05)。划痕实验结果提示,siSLCC12A8组的细胞伤口愈合能力显著降低(P<0.05)。所以,SLC12A8可促进膀胱癌细胞的增殖、侵袭与迁移。本研究还深入探究了SLC12A8影响膀胱癌细胞生物学行为可能的作用途径。利用GSEA富集分析,提示SLC12A8可能参与调控JAK/STAT信号通路(P=0.008);并通过Western blot实验进一步验证,敲低膀胱癌细胞中SLC12A8基因表达后,对JAK/STAT信号通路中相关蛋白水平的影响。结果提示,对比siNC 组,siSLC12A8 组中p-JAK2 及p-STAT3蛋白表达量明显降低(P<0.05);当siSLC12A8组中加colivelin 进行回复实验,可部分逆转敲低SLC12A8 对膀胱癌细胞的抑制(P<0.05),因此,证实SLC12A8可通过JAK/STAT信号通路促进膀胱癌细胞的增殖、侵袭与迁移。一般情况下,活化的JAK导致结合受体的酪氨酸磷酸化,形成STAT的对接位点,在这个对接位点,JAK磷酸化STAT[19]。JAK/STAT信号在肿瘤研究中被经常报道,信号通路多被激活,起着调节细胞生长、凋亡和分化的作用[20,21]。例如在肺癌[22,23]、肝癌[24]及结直肠癌[25]中,抑制JAK/STAT信号传导能够抑制肿瘤进展。这与本研究结论相一致。
本研究还探究了敲低SLC12A8基因后是否影响膀胱癌细胞上皮间质转化。利用TCGA数据库相关性分析提示,在膀胱癌中,SLC12A8 与E-cadherin 负相关(r=-0.183,P<0.001),而与N-cadherin正相关(r=0.302,P<0.001)、vimentin 正相关(r=0.342,P<0.001);GSEA富集分析提示SLC12A8 可能参与上皮间质转化(P<0.05);Western blot 实验检测证实,对比siNC 组,siSLC12A8 组中E-cadherin 明显增加,N-cadherin 和vimentin蛋白表达量明显降低。实验证实了SLC12A8影响膀胱癌EMT过程,可能在膀胱癌侵袭迁移中扮演重要角色。
EMT是一种基本的细胞现象,在发育、组织修复和癌症进展中起着内在作用,其还受到多种细胞因子和生长因子的调节[26]。EMT的异常激活与肿瘤细胞在癌症进展和转移过程中的恶性特性有关,包括促进迁移和侵袭性,肿瘤干性以及对化疗和免疫治疗的耐药性增强[27]。SNAIL1/2、ZEB1/2和TWIST1/2被认为是驱动EMT的转录途径的主要调节因子[28]。另外,有关研究报道称STAT3是EMT的上游介质,EMT相关调节因子受到STAT3信号传导的影响,抑制STAT3从而抑制肿瘤转移[29,30]。这也在甲状腺癌[31]及肝癌[32]等相关研究中被广泛证实。结合我们的研究结果,敲低SLC12A8可以抑制STAT3 磷酸化及膀胱癌细胞EMT,提示SLC12A8可能通过调控STAT3进而影响膀胱癌细胞EMT过程。
总之,在本研究中,我们探索了SLC12A8影响膀胱癌进展的可能机制,证实了SLC12A8通过JAK/STAT信号通路调控膀胱癌进展及触发EMT发生进而导致膀胱癌侵袭与迁移。然而,本研究同样存在不足,例如,未能对SLC12A8影响膀胱癌细胞周期进一步展开研究,另外,未能纳入临床标本研究结果进一步佐证,这需要我们将来进一步研究而完善。