近红外光照射可显著改善大鼠抑郁所致的肠功能紊乱
郑轶珺,侯宇月,李 帆,史欣可,陶雅雯,赵欣宇,胡 浩,杨 林
西安交通大学1医学部,2基础医学实验教学中心,3第一附属医院泌尿外科,陕西 西安710061
肠功能紊乱为功能性肠病的一种表现,症状集中于下消化道,包括慢性反复发作的腹胀、便秘及腹泻等,无器质性改变,给个体和社会带来了巨大经济负担[1]。肠易激综合征(IBS)是肠功能紊乱最常见的类型,病因为多因素,内脏敏感性增加是其重要的病理生理机制[2,3]。精神因素在IBS治疗中的相关性目前得到广泛认可,各种生物和心理因素被认为通过脑-肠轴发挥作用[4-6]。调节慢性压力和心理社会因素或可成为治疗IBS的重要途径[7]。
近红外光是波长介于可见光和中红外光之间的一种电磁波,可通过刺激线粒体呼吸链复合物IV(细胞色素C氧化酶)并增加ATP的合成来调节脑部活动;可增强神经元的代谢能力,促进抗炎、抗凋亡及抗氧化应激反应[8];还可以通过调节脑源性神经生长因子(BDNF)水平促进神经元连接[9-11]。研究发现中红外光可改善APP/PS1小鼠的认知功能并重塑其肠道微生物群α与β的多样性[12],表明中红外光的照射可通过脑-肠轴对神经和消化系统发挥积极作用。以往文献显示近红外光照射可应用于创伤性脑损伤[13]、帕金森病、阿尔茨海默病及抑郁症的治疗,但其对于消化系统疾病的作用尚未见报道。目前多数研究集中在探讨肠道微生物对神经系统疾病的影响[14],有关精神情绪状态对消化系统影响的研究较匮乏。
本研究建立慢性束缚应激大鼠模型并使用近红外光照射,探究近红外光通过脑-肠轴对抑郁所致肠功能紊乱大鼠的作用及潜在机制,通过动物行为学、肠道功能、组织病理学、分子生物学等方法评价其抑郁程度及肠道功能,为近红外光的临床应用提供实验基础和科学依据。
1 材料和方法
1.1 实验动物与试剂
选用健康成年SPF级雄性大鼠32只,体质量160~180 g,由西安交通大学医学部实验动物中心提供,动物置于12 h光照/12 h黑暗的循环环境中,室温23~25 ℃。该方案得到了西安交通大学动物实验伦理委员会的批准(伦理编号:2021-1589)。Western blotting所使用的抗体BDNF、Nrf2、PGC-1α购自Proteintech公司。
1.2 大鼠慢性束缚应激模型的建立与分组
SD雄性大鼠32只随机分为对照组(Control)、模型组(Model)、近红外光低剂量组(Low NIR)、近红外光高剂量组(High NIR),8只/组。根据参考文献计算最适能量区间[15],低剂量频率10 Hz、占空比88%、照射5 s,高剂量组频率、占空比同前,照射20 s。将大鼠固定于自制的束缚筒,束缚筒长约20 cm,筒口直径5 cm,在筒身打洞8个,用特制的四根硬线穿过小洞,使线形成“米”字样,确保大鼠无法活动,筒壁上打数个小孔保证大鼠正常呼吸。每周一、三、五用光纤照射鼠头背侧中线、眼耳之间,照射完成后束缚大鼠。每日束缚6 h(上午9:00到下午3:00),持续28 d,每周称量大鼠体质量。
1.3 行为学测试
1.3.1 旷场实验 于末次束缚的第2天进行,将大鼠放入旷场实验箱(成都泰盟公司,型号OFT-100)的中心处,观察5 min内大鼠的运动情况。实验过程中确保周围环境安静,每只大鼠测试完成后清理其粪便及尿液,用75%酒精擦拭实验箱,防止其他气味干扰。
1.3.2 悬尾实验 在末次束缚后第2天进行,实验时距尾尖约2~3 cm处用胶带固定大鼠尾部,使大鼠头朝下悬挂,大鼠尾部的悬挂点距实验台面50 cm,记录5 min内大鼠的静止不动累计时间。
1.3.3 强迫游泳实验 在悬尾实验次日上午进行,将每只大鼠单独放入直径25 cm,深80 cm的水桶内,保持水温21~23 ℃,放入大鼠适应性游泳1 min,随后记录大鼠5 min内静止不动累计时间。
1.4 肠功能检测
1.4.1 粪便粒数及含水量 收集第0、14、28天的大鼠粪便,检测并记录每只大鼠12 h粪便粒数及含水量,含水量百分比=[(湿重-干重)/湿重]×100%。
1.4.2 结直肠扩张实验 实验前大鼠12 h禁食不禁水,用异氟烷麻醉大鼠,将8 F导尿管缓慢插入肛门,当其末端距离肛门约1 cm时固定,大鼠苏醒并适应10 min后,向球囊(直径2.7 mm;注水量3~5 mL;透明PVC材质)内注入生理盐水,根据AWR评分,记录大鼠出现3分表现时所注入的生理盐水毫升数,此数值为痛阈值。AWR评分评价内脏敏感性:给予结直肠扩张刺激时无反应,计0分;给予刺激时由不动变为短暂的头部活动,计1分;腹壁肌肉收缩,计2分;腹部抬起,计3分;身体呈弓形,骨盆结构抬高,计4分。
1.4.3 肠道推进实验 大鼠禁食不禁水12 h,首先用印度墨水以0.5 mL/kg的剂量灌胃,30 min后麻醉动物腹主动脉取血,之后取出自幽门至回盲部的肠管,铺直后测量其全长(小肠总长度)及幽门部位至墨水前沿的距离(推进长度),计算小肠推进百分率:小肠推进率(%)=墨水推进距离/小肠全长×100%。
1.5 组织病理学检测
1.5.1 大鼠海马及结肠组织HE染色 取大脑海马、结肠组织,多聚甲醛固定,脱水、石蜡包埋并切片,苏木精-伊红(HE)染色,用中性树脂封片,在光学显微镜下观察海马组织神经细胞排列情况,结肠组织表面层有无溃疡、炎性细胞浸润等。
1.5.2 海马CA1-1区神经元损伤率 光学显微镜高倍视野下(×40)观察大鼠海马CA1-1区,以细胞出现核碎裂、核固缩或核溶解为阳性细胞,每张切片选取5个不同视野,计算神经元损伤率。
1.5.3 结肠组织病理学损伤评分 使用光学显微镜(×10)观察大鼠结肠组织的炎症损伤情况,参考梁桂丽等[16]推荐的组织病理学评分表评估大鼠结肠病变,通过上皮损伤和溃疡形成、溃疡深度、水肿程度、炎细胞浸润程度及深度进行评测,分值越高代表病理损伤越严重。
1.6 Western blotting 检测大脑海马体BDNF、Nrf2、PGC-1α
以GAPDH 作为内参对照,20 mg 海马组织加入200 μL裂解液,随后用超声细胞破碎仪(南京先欧仪器制造有限公司,型号ATPIO-650D)连续破碎2~3 次,10 000 r/min离心15 min,取上清液备用。用BCA法测定蛋白浓度,取25 μL 5×SDS-PAGE loading buffer与蛋白样品以4∶1 混匀,沸水加热10 min,进行SDS-PAGE。电压90 V,电泳25 min,待蛋白条带跑至分离胶时,将电压调至120 V直至电泳结束。电泳后进行转膜,200 mA恒流转印80 min。将膜用TBST 清洗3 次,用脱脂牛奶封闭2 h 后加入抗BDNF 抗体(1∶1000)、Nrf2 抗体(1∶1000)、PGC-1α抗体(1∶1000),终浓度均为2 μg/mL,4 ℃冰箱内孵育过夜。TBST 漂洗4 次后加入抗兔二抗(1∶2000),室温摇床孵育1 h。TBST漂洗后进行化学发光,完成显影,拍照记录。条带使用Image J进行灰度分析。
1.7 统计学处理
实验数据用SPSS 18.0 进行处理,定量资料以均数±标准误表示,数据进行方差齐性检验,多组间比较采用单因素方差分析进行统计分析,P<0.05为差异有统计学意义。
2 结果
2.1 近红外光对肠功能紊乱大鼠行为学的影响
2.1.1 体质量变化 由图1可见,相较于对照组,模型组大鼠从第1周起体质量显著降低(P<0.01)。与模型组比较,近红外光低剂量组及近红外光高剂量组大鼠体质量变化差异无统计学意义(P>0.05)。
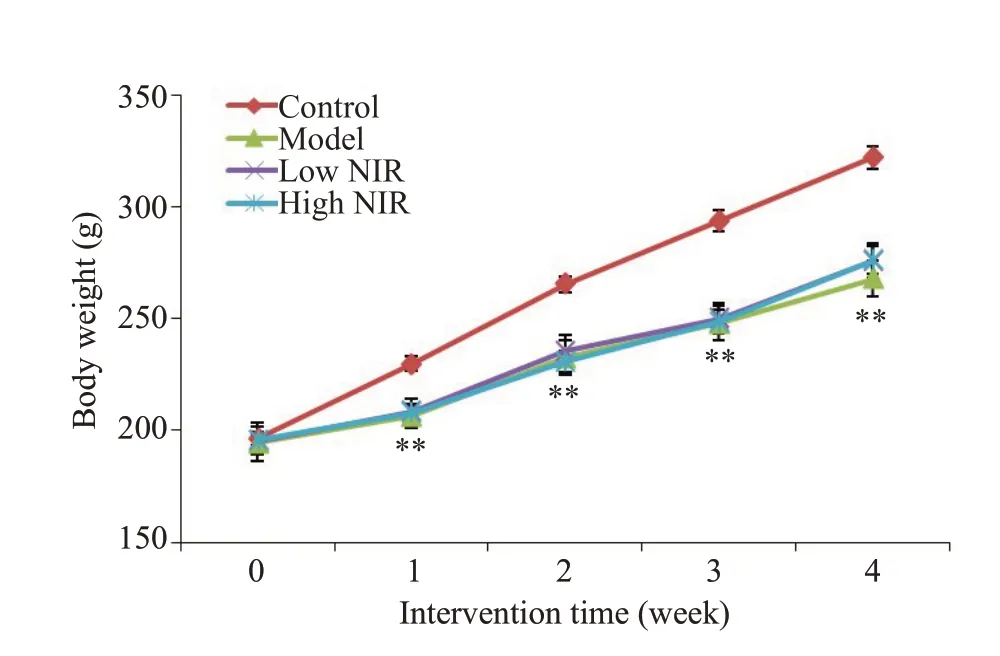
图1 大鼠体质量的变化Fig.1 Changes of body weight of the rats.**P<0.01 vs control group (model group,n=6;the other 3 groups,n=8).
2.1.2 旷场实验 在旷场实验中,各组大鼠之间总运动时间与总运动距离差异无统计学意义(P>0.05),提示各组大鼠自主活动差异没有统计学意义(图2)。
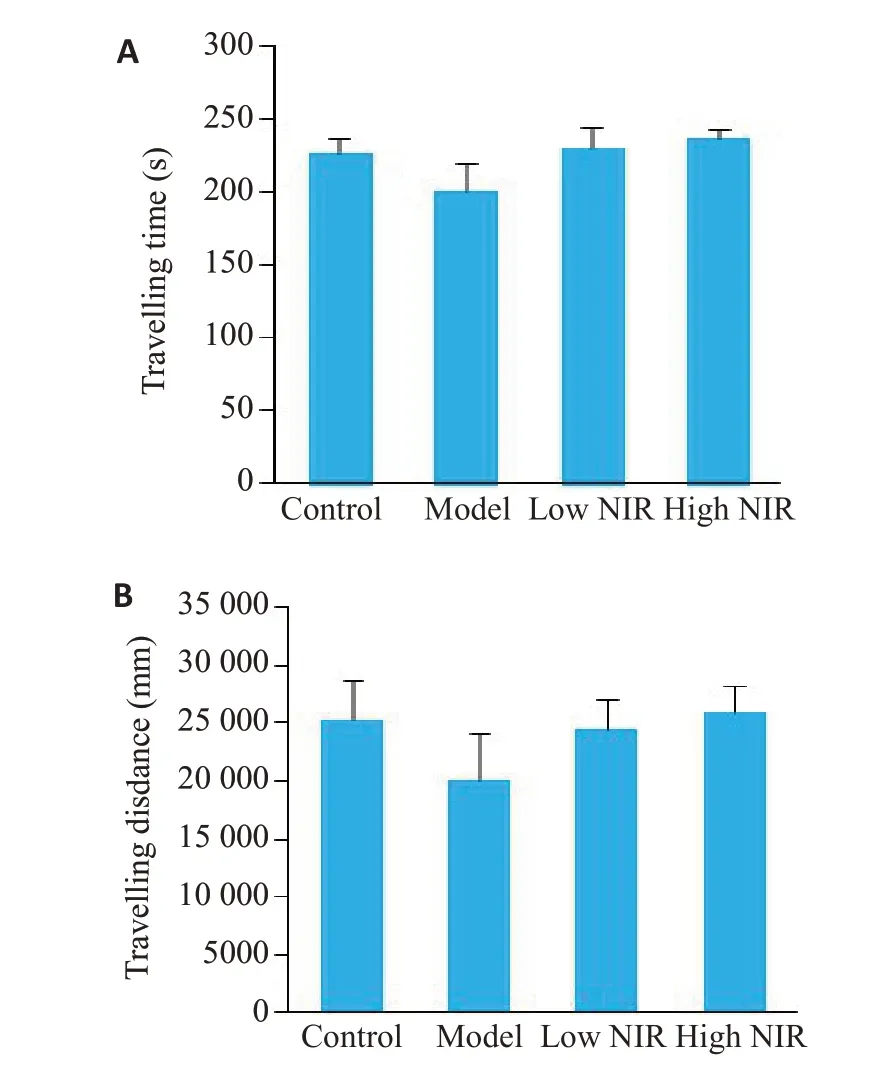
图2 旷场实验观察大鼠自主活动能力Fig.2 Autonomous activity of the rats in the 4 groups.A: Time spent in the open-field.B: Movement distance in the open-field (model group,n=6;the other 3 groups,n=8).
2.1.3 悬尾实验与强迫游泳实验 悬尾实验与强迫游泳实验中,相较于对照组,模型组大鼠静止时间明显延长(P<0.05,P<0.01,图3);近红外光高剂量组与模型组比较,静止时间明显缩短(P<0.05,P<0.01)。
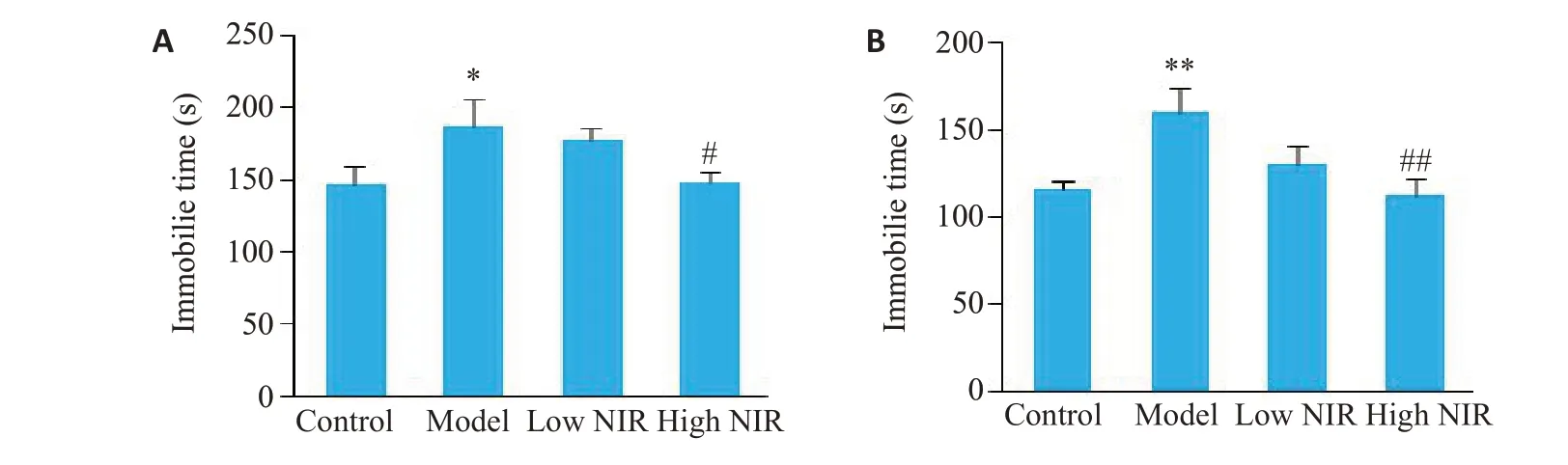
图3 悬尾与强迫游泳实验静止时间Fig.3 Immobile time in tail suspension test(A)and forced swim test(B)of the rats in the 4 groups.*P<0.05,**P<0.01 vs control group;#P<0.05,##P<0.01 vs model group(model group,n=6;the other 3 groups,n=8).
2.2 近红外光对肠功能紊乱大鼠肠道功能的影响
2.2.1 粪便粒数与含水量 由图4可见,在第4周末,相较于对照组,模型组大鼠粪便粒数及含水量显著降低(P<0.05,P<0.01);近红外光高剂量组与模型组比较,粪便粒数和含水量显著上升(P<0.01)。
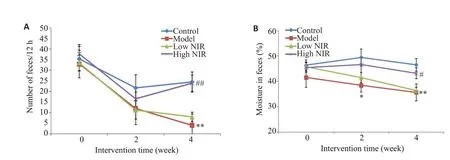
图4 大鼠粪便粒数及含水量变化Fig.4 Changes in fecal pellet count and water content of the rats.A: Change in rat fecal pellet count.B:Change in fecal water content.**P<0.01 vs control group;#P<0.05,##P<0.01 vs model group(model group,n=6;the other 3 groups,n=8).
2.2.2 结直肠扩张反射测试 由图5可见,相较于对照组,模型组大鼠痛阈值显著降低(P<0.01);近红外光低、高剂量组与模型组比较,痛阈值显著上升,差异有统计学意义(P<0.05,P<0.01)。
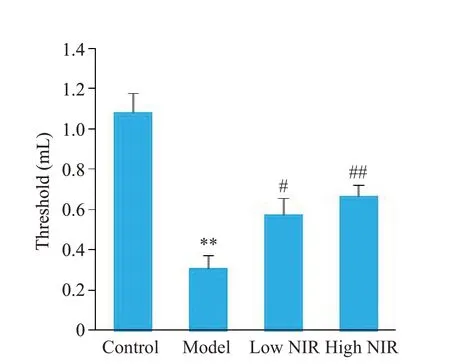
图5 大鼠结直肠反射痛阈值变化Fig.5 Change of colorectal reflex threshold in the rats.**P<0.01 vs control group;#P<0.05,##P<0.01 vs model group(model group,n=6;the other 3 groups,n=8).
2.2.3 肠道推进实验 由图6可见,模型组大鼠肠道推进率相较于对照组有所降低,低、高剂量近红外光组相较于模型组推进率肠道有升高趋势,但差异均无统计学意义(P>0.05)。
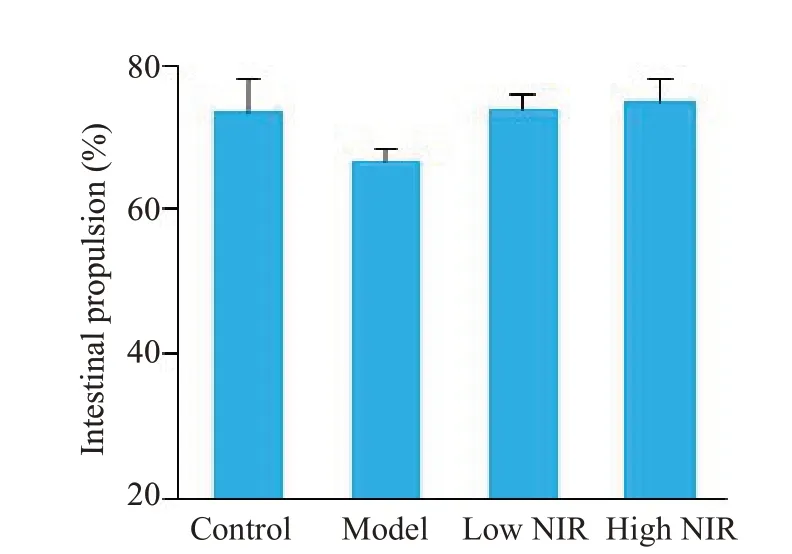
图6 大鼠肠道推进率变化Fig.6 Change of intestinal propulsion rate of the rats(model group,n=6;the other 3 groups,n=8).
2.3 组织病理学检测
2.3.1 大鼠海马CA1-1区染色结果 由图7可见,对照组大鼠海马锥体细胞排列规则、紧密。相较于对照组,模型组大鼠海马锥体细胞排列不规则、疏松,数量减少,部分细胞出现核固缩、核溶解现象。相较于模型组,低、高剂量组大鼠海马锥体细胞有明显改善,排列整齐。
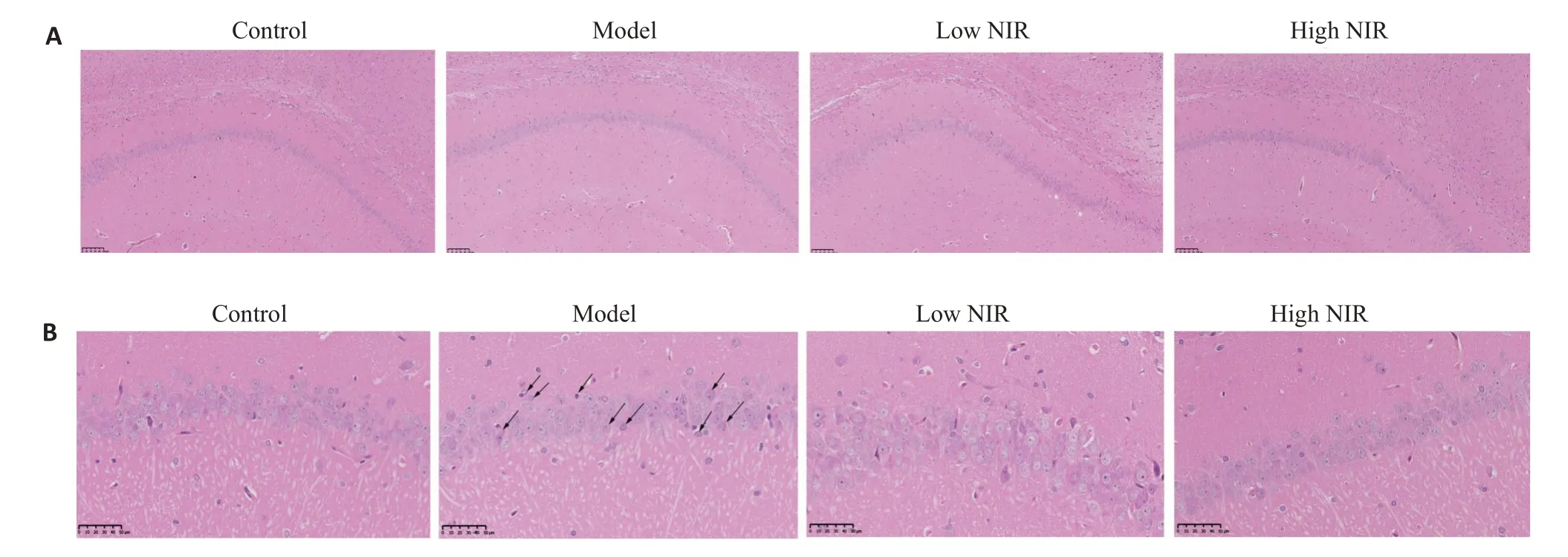
图7 近红外光对大鼠大脑海马体的作用Fig.7 Effects of near-infrared light therapy on rat hippocampus(HE staining,A:Original magnification:×10;B:×40).
2.3.2 大鼠海马CA1-1区神经元损伤率结果 由图8可见,模型组大鼠海马CA1-1区神经元损伤率相较于对照组有所升高,低、高剂量近红外光组相较于模型组神经元损伤率有下降趋势,但差异均无统计学意义(P>0.05)。
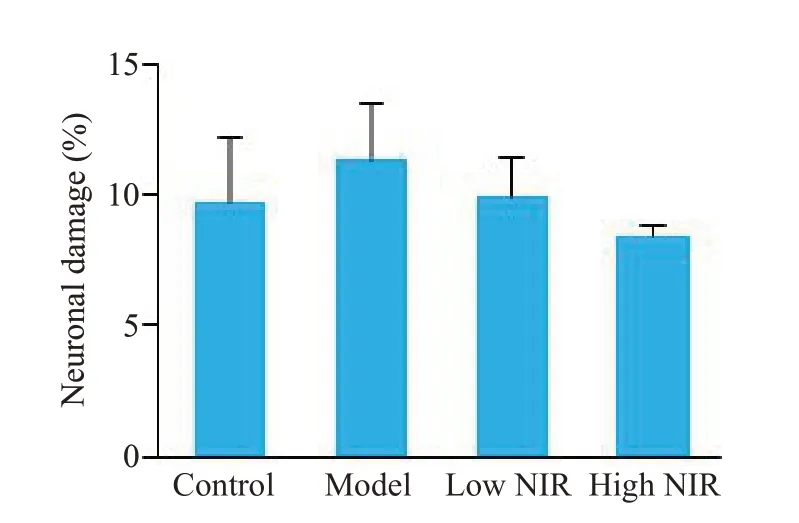
图8 大鼠海马CA1-1区神经元损伤率结果Fig.8 Neuronal damage rate in the CA1-1 region of the rat hippocampus(n=5).
2.3.3 大鼠结肠HE染色结果 由图9可见,对照组结肠黏膜腺体排列规则,组织结构完整,黏膜固有层内仅有少量炎性细胞浸润,黏膜下层血管未见充血水肿。与对照组相比,模型组黏膜腺体改变,上皮细胞排列不规则,组织结构破坏,黏膜层内出现大量炎性细胞浸润,黏膜下层增厚明显。与模型组相比,低、高剂量近红外光组大鼠结肠组织形态有明显改善,上皮细胞排列规则,炎性细胞浸润减少。
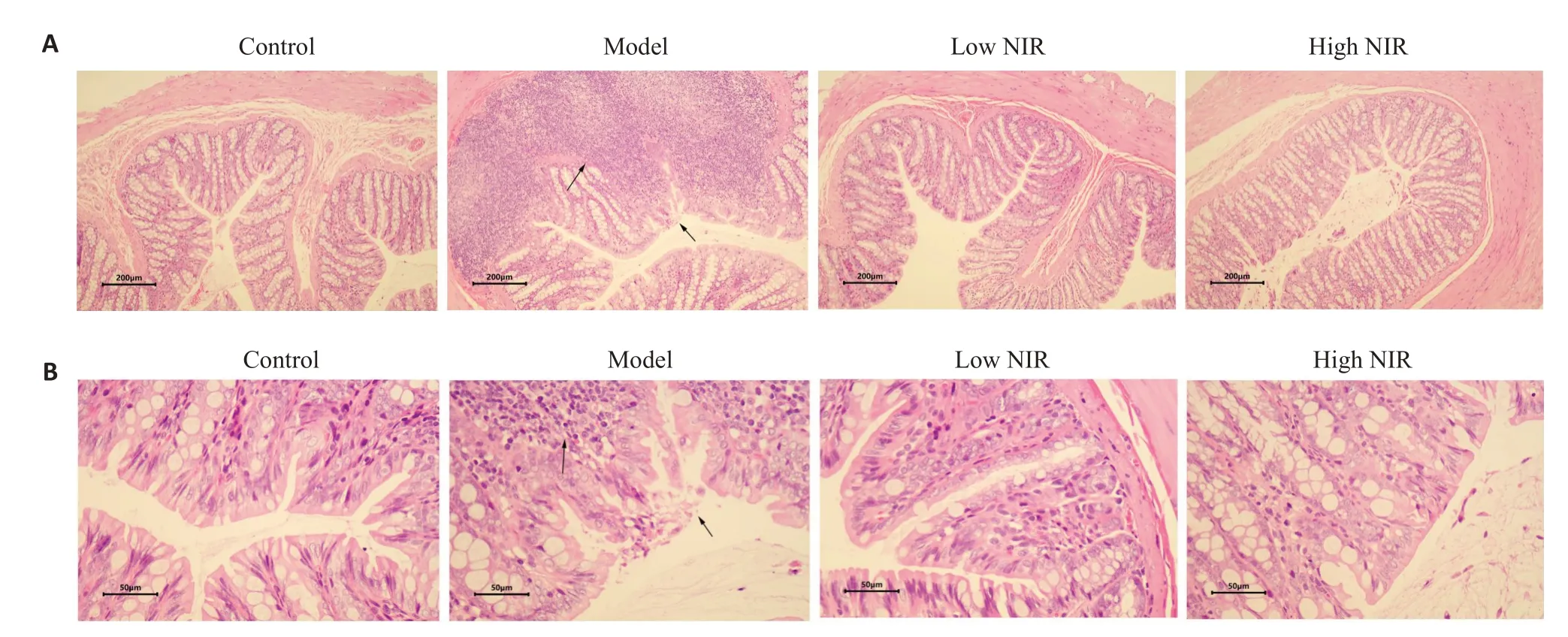
图9 近红外光对大鼠结肠的作用Fig.9 Effects of near-infrared light therapy on rat colon pathology(HE staining,A:×10;B:×40).
2.3.4 结肠组织病理学损伤评分结果 由图10可见,相比与对照组,模型组大鼠结肠病理损伤评分较高,损伤更为严重(P<0.01);相比于模型组,低、高剂量近红外光组损伤评分降低,损伤较轻,差异均有统计学意义(P<0.01)。
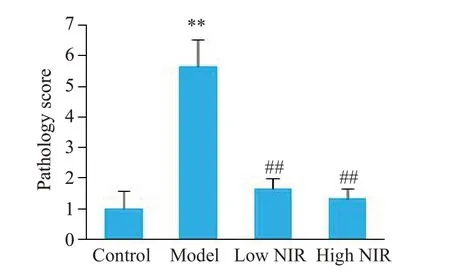
图10 大鼠结肠组织病理学评分Fig.10 Histopathology score of rat colon.**P<0.01 vs control group;##P<0.01 vs model group(n=3).
2.4 近红外光对肠功能紊乱大鼠海马体BDNF、Nrf2、PGC-1α蛋白表达的影响
由图11 可见,相较于对照组,模型组海马体内BDNF、Nrf2、PGC-1α蛋白表达降低(P<0.05,P<0.01),低、高剂量近红外光组相较于模型组BDNF、Nrf2、PGC-1α蛋白表达增强(P<0.05,P<0.01)。
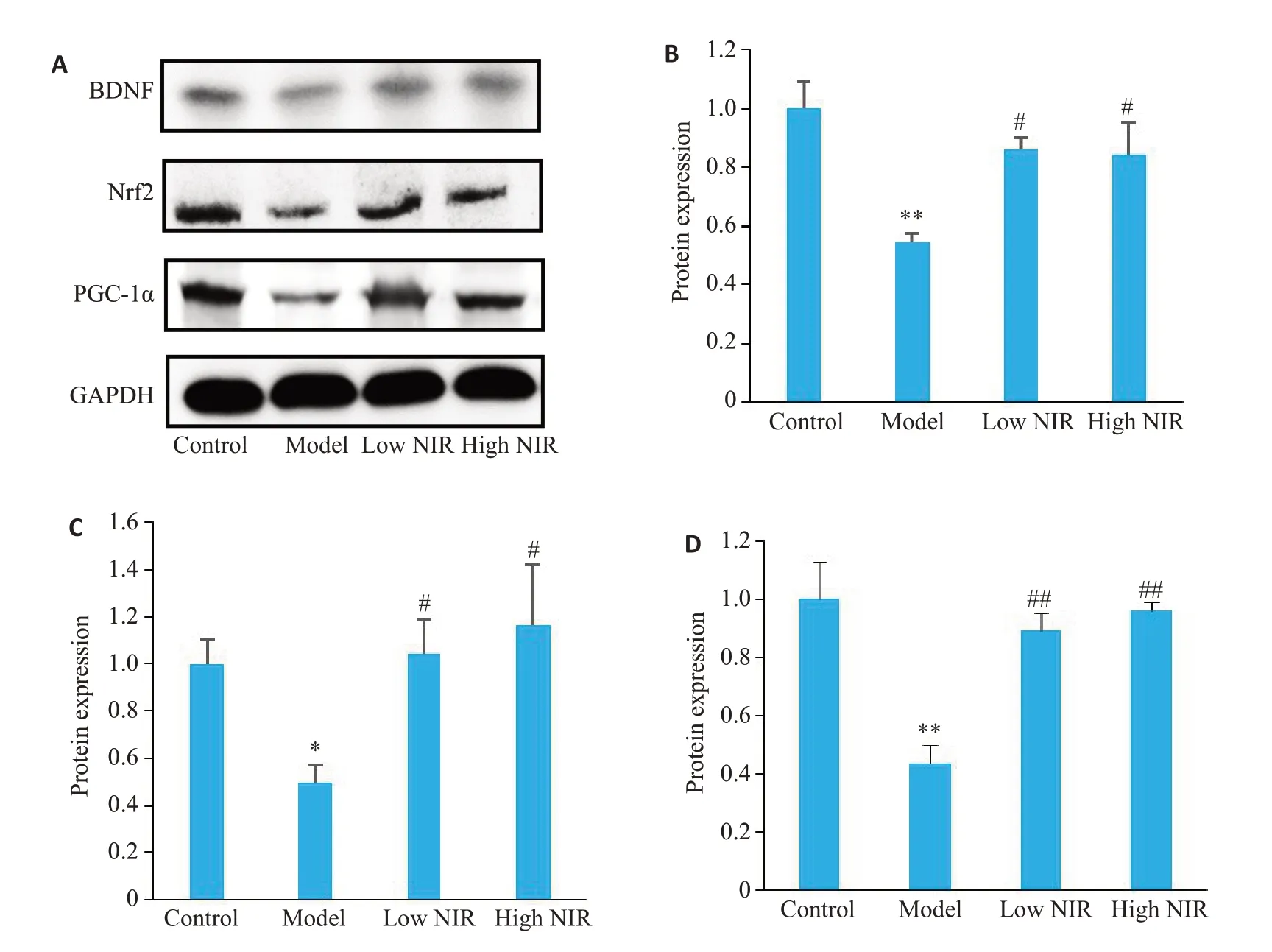
图11 大鼠海马体BDNF、Nrf2、PGC-1α蛋白表达的变化Fig.11 Changes of BDNF,Nrf2,and PGC-1α expression in rat hippocampus.A:Western blots of BDNF,Nrf2 and PGC-1α proteins.B:BDNF protein expression level.C:Nrf2 protein expression level.D:PGC-1α protein expression level.*P<0.05,**P<0.01 vs control group;#P<0.05,##P<0.01 vs model group(n=4).
3 讨论
目前近红外光的治疗作用受到广泛关注,大部分集中于阿尔兹海默症、帕金森症等神经系统病变,有关抑郁症、消化系统的研究较少。肠功能紊乱是反复发作、迁延不愈、严重影响患者生活质量的一类常见疾病,临床上部分通过选择性5-羟色胺再摄取抑制剂类药物进行治疗,但其副作用较多[17]。脑-肠轴是神经和胃肠之间通讯的双向信息调节系统,涉及下丘脑-垂体-肾上腺轴、自主神经系统、中枢神经系统以及胃肠微生物[18,19],形成双向传递的交通通路,调节胃肠运动功能、内脏敏感性及中枢认知功能,不良的情绪如抑郁会通过脑-肠轴影响胃肠道功能[20]。因此,通过改善大脑产生情绪从而影响肠道健康变得切实可行。以往研究发现用波长为810 nm的近红外光治疗10名抑郁症患者,两周后该组的平均Hamilton抑郁评分量表(HDRS)评分下降了约10分[21];更有文献显示,使用经颅近红外光照射治疗后患者的抑郁等级显著降低[22],表明使用近红外光照射是一种有潜力的新型非侵入性干预措施。
本研究将近红外光照射与脑-肠轴相联系,使用与人类身心疾病发病过程相似的慢性束缚应激方法建立抑郁动物模型,同时成功复制出慢性应激致大鼠便秘型肠易激综合征,近红外光照射干预可显著改善大鼠抑郁样行为、肠易激综合征症状及肠道功能。体质量增长的情况可以客观反映大鼠的精神状态,与对照组相比,束缚应激大鼠的体质量显著下降,而低、高剂量近红外光组大鼠体质量与模型组相比无明显变化,提示近红外光的治疗作用并不会影响大鼠体质量。旷场实验用于评估动物处于陌生环境时的自发探究和自主运动能力[23],与以往所报道的文献一致,本研究应用近红外光照射慢性束缚应激模型的动物不能改变其自主活动水平[24]。悬尾及强迫游泳实验测试大鼠在绝望环境中的挣扎时间,以衡量大鼠抑郁程度。与模型组比较,慢性束缚应激大鼠静止时间延长表现出抑郁样行为,而高剂量近红外光照射可以明显改善其抑郁情况。
针对粪便的检测发现,与对照组相比,模型组大鼠粪便粒数、粪便含水量明显下降,肠道推进率有下降趋势,说明模型组大鼠有较严重的便秘情况出现,且其肠道动力不足,粪便推进程度降低。结直肠扩张测试发现模型组大鼠出现痛阈值下降,表示大鼠内脏敏感性升高,提示大鼠发生肠道功能紊乱。关于便秘型肠易激综合征的内脏敏感性有不同报道,以往有研究表示肠道敏感性下降[25],但更多研究发现其敏感性升高[26],与本研究相符。组织病理学检测显示,模型组大鼠的脑、肠组织都有不同程度的改变,例如出现神经细胞排列更为疏松,肠道有明显炎症等情况,而不同剂量的近红外光对海马细胞及肠道起到了保护作用,防止神经细胞的破坏并减轻炎症损伤。
BDNF参与CNS内的大量功能,包括神经元存活和分化,其水平的变化造成突触传递障碍,从而导致认知缺乏[27,28]。文献表明小鼠应用光生物照射可以通过上调BDNF表达和增加ERK/CREB信号通路的磷酸化来减少神经元损伤[29]。已经证明,经颅632.8 nm激光照射不仅上调了BDNF/ERK/CREB通路,而且还增加了海马体中的神经元存活率[11]。此外,经颅810 nm激光照射促进了创伤性脑损伤小鼠模型中BDNF水平升高和突触发生[30]。以往研究发现,近红外光可通过增强细胞色素C氧化酶的活性和增加三磷酸腺苷合成来保护线粒体功能,还可通过下调氧化应激相关基因而发挥抗氧化作用[31]。PGC-1α可以通过诱导几种关键的活性氧解毒酶来抑制ROS的产生,并保护神经细胞。在生理条件下,Nrf2位于细胞质中,而在氧化应激时,Nrf2易位到细胞核,与启动子区域中的抗氧化反应元件(ARE)相互作用,发挥抗氧化作用。近年来有研究表明PGC-1α为Nrf2的上游调节因子,PGC-1α/Nrf2信号转导影响细胞抗氧化应激,改善大脑缺血性中风后的氧化应激[32]。因此,我们猜想近红外光可以通过PGC-1α/Nrf2信号转导通路发挥抗氧化应激作用,产生神经保护作用,调节BDNF表达,从而改善抑郁情况,并经由脑-肠轴的双向通路影响肠道疾病。本研究结果显示,模型组大鼠海马体BDNF、PGC-1α、Nrf2蛋白表达降低,与国内外文献研究一致,且近红外光干预后BDNF、PGC-1α、Nrf2蛋白表达增强。
综上,本研究结果显示长期束缚应激可导致大鼠产生抑郁样行为和便秘型肠易激综合征,近红外光照射可显著改善大鼠抑郁样行为、肠功能紊乱症状,其机制可能与近红外光照射升高大鼠大脑海马体BDNF水平有关,但具体机制仍需要更进一步的探索。