复合水凝胶SA/AAm-Lgs的制备及其对Fe3+的静/动态吸附
马培林, 宋亚婷, 李 旭, 刘志明
(东北林业大学 材料科学与工程学院,黑龙江 哈尔滨 150040)
重金属Fe3+污染一直是危害生态环境和人类公共卫生的全球性问题,Fe3+可通过在人体内积累而引起人呕吐、腹泻和肠道损伤。有效地去除水介质中的Fe3+对环境保护和人体安全至关重要[1]。吸附法是目前最有效的重金属污水处理方法之一[2]。研究制备出有效的吸附材料是去除污水中重金属离子的关键[3-4]。水凝胶是由单一或多种均聚物(或共聚物)化学交联或物理交联形成的三维网络结构的聚合物材料[5]。因其良好的生物相容性、环境友好性以及良好的重复利用性,水凝胶已成为去除废水中重金属、除草剂、有机染料等多种污染物的重要材料[6]。海藻酸钠(SA)是一种可从褐藻类的海带中提取的天然高分子物质,其具有来源广、价格低等优点,在处理重金属水污染领域有广泛的应用[7-9]。 因此,本研究将木质素磺酸钠(Lgs)引入到以SA和丙烯酰胺(AAm)为基体的溶液中,通过自由基聚合法制备复合水凝胶SA/AAm-Lgs。采用静态吸附法研究水凝胶对Fe3+的吸附动力学规律,并通过固定床工艺对Fe3+进行动态吸附实验,以期为开发优异的Fe3+吸附剂提供参考。
1 实 验
1.1 原料、试剂与仪器
六水合三氯化铁(FeCl3·6H2O),天津市致远化学试剂有限公司;丙烯酰胺(AAm)、海藻酸钠(SA)、木质素磺酸钠(Lgs)、过硫酸钾(KPS)、N,N′-亚甲基双丙烯酰胺(MBA),均为市售分析纯。
TU-1901紫外可见分光光度计,上海沪粤明科学仪器有限公司;JSM-7500F扫描电子显微镜,日本Hitachi Limited公司;傅里叶变换红外光谱(FT-IR)仪,Perkinelmer公司;JB/T5669力学性能测试仪,北京吉品时代科技有限公司。
1.2 复合水凝胶SA/AAm-Lgs的制备
将20 mL质量分数2%的海藻酸钠(SA)溶液、 6 g丙烯酰胺(AAm)和适量(0~9 mg)木质素磺酸钠(Lgs)溶解在含有25 mg N,N′-亚甲基双丙烯酰胺(MBA)和75 mg过硫酸钾(KPS)的烧杯中。经超声波振荡处理去除溶液中的气泡后,在50 ℃ 烘箱中加热2 h分别得到不同Lgs用量(0、 3、 5、 7和9 mg)的复合水凝胶(SA/AAm-Lgs)。具体合成路线见图1。

图1 SA/AAm-Lgs的合成
1.3 SA/AAm-Lgs对Fe3+吸附
1.3.1静态吸附 SA/AAm-Lgs对Fe3+的静态吸附实验操作如下:将0.5 g含有不同Lgs用量的水凝胶分别放入到50 mL Fe3+溶液(2 g/L)中,在25 ℃下振荡11 h,然后测定其吸光度,探究Lgs用量对Fe3+吸附性能的影响。同时,探究Fe3+溶液质量浓度(1、 2、 3、 4、 5 g/L)、吸附时间(0~11 h)和温度(5、 15、 25、 35、 45 ℃)对水凝胶吸附Fe3+性能的影响。同时,参考文献方法[10],采用准一级动力学、准二级动力学、Langmuir和Freundlich 4种模型研究SA/AAm-Lgs对Fe3+的吸附机理。
1.3.2动态吸附 SA/AAm-Lgs对Fe3+的动态吸附实验装置参考文献[11]。通过蠕动泵控制待测液恒流通过层析柱(内径1.6 cm,长19.5 cm),每隔一段时间于出水口取5 mL溶液,同时记录此刻吸附时间,测定取出液的吸光度,通过t时刻出水中Fe3+质量浓度(Ct)与Fe3+进水质量浓度(C0)比值Ct/C0对t作图,绘制不同柱高(5、 10和15 cm)、流速(0.5、 1和2 mL/min)和Fe3+进水质量浓度(1、 2和3 g/L)的突破曲线。同时参考文献[12],运用BDST模型对SA/AAm-Lgs吸附Fe3+的数据进行拟合和预测。
1.4 测试与表征
1.4.1Fe3+吸附量的测定 根据文献中Fe3+的标准曲线[10],采用紫外可见分光光度计测定经水凝胶吸附后的上清液的吸光度,进而计算出Fe3+的吸附量。
1.4.2微观形貌分析 首先将SA/AAm-Lgs(含Lgs 7 mg)放入冷冻干燥机中彻底脱水,然后放入溅射涂布机中喷金,喷金后使用SEM观察水凝胶截面的微观形貌。
1.4.3红外光谱分析 采用FT-IR对SA/AAm-Lgs(含Lgs 7 mg)及其制备原料进行结构和官能团测定,波数范围设置为500~4 000 cm-1。
1.4.4力学性能测试 将不同Lgs用量的水凝胶切成7 cm×0.5 cm×2 mm的长条,使用力学性能测试仪测量水凝胶的力学性能,拉伸速度设定为10 mm/min。为减小实验误差,每个样品测试3次,取平均值进行计算。
1.4.5溶胀性能测试 将不同Lgs用量的水凝胶切成1.5 cm×1.5 cm×5 mm,质量0.5 g的长方体,浸泡在50 g蒸馏水中,每隔一段时间记录水凝胶的质量,计算溶胀率。溶胀率通过式(1)计算。
η=(m′-m0)/m0
(1)
式中:η—溶胀率,%;m0—水凝胶原始质量,g;m′—水凝胶饱和质量,g。
1.4.6循环稳定性测试 将0.5 g SA/AAm-Lgs(Lgs用量为7 mg)放入2 g/L的Fe3+水溶液中,在25 ℃下吸附11 h。达到吸附平衡后,将吸附饱和的水凝胶浸入100 mL盐酸溶液(0.1 mol/L)中再生24 h,然后用100 mL去离子水反复洗涤3次去除盐酸,循环5次。
1.4.7吸附柱参数测试 SA/AAm-Lgs对Fe3+的动态吸附过程中,吸附柱的吸附总量(q)、平均吸附量(qe)及Fe3+去除率(R)根据式(2)~(6)计算。
(2)
Ca=C0-Ct
(3)
qe=q/m
(4)
W=C0vt0/1 000
(5)
R=q/W×100%
(6)
式中:v—溶液通过吸附柱的流速,mL/min;t0—总吸附时间,min;Ca—被吸附的Fe3+质量浓度,mg/L;C0—Fe3+初始(进水)质量浓度,mg/L;Ct—t时刻水中Fe3+质量浓度,mg/L;qe—平均吸附量,mg/g;q—吸附Fe3+的总吸附量,mg;m—吸附剂总质量,mg;W—通过吸附柱的Fe3+总量,mg。
2 结果与讨论
2.1 SA/AAm-Lgs的结构分析
2.1.1SEM分析 复合水凝胶SA/AAm-Lgs的微观形貌见图2。由图可见,水凝胶具有多孔三维网状结构,孔径范围在1~3 μm,表明其具有较高的比表面积。同时,高密度交联网络和高结合水含量为凝胶材料提供较高的机械强度和水溶性小分子自由扩散的通道,这种疏松孔状网络结构增大了水凝胶对Fe3+的吸附性能。

a.×5 000; b.×10 000

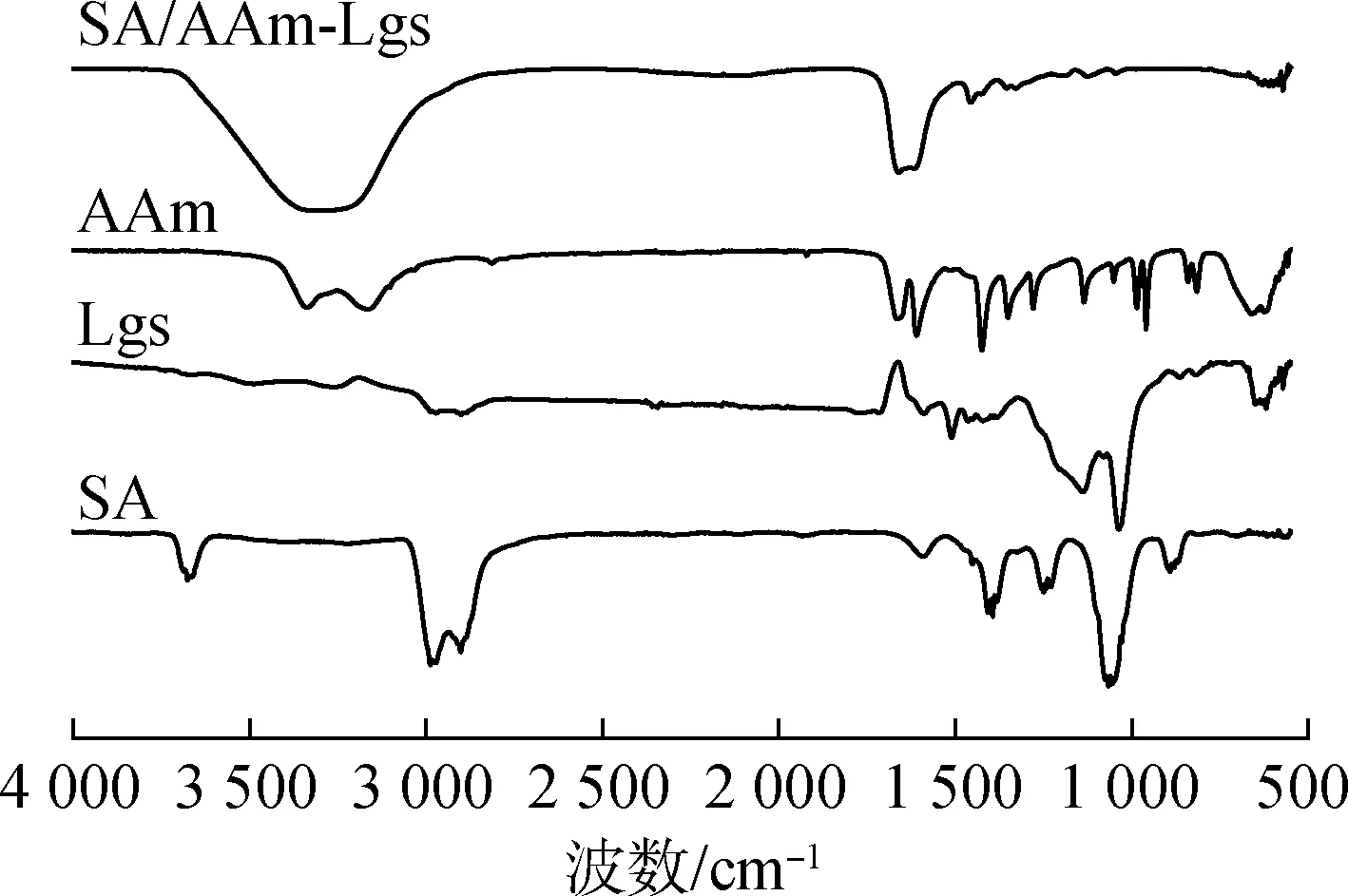
图3 样品的红外光谱Fig.3 FT-IR spectra of samples
2.2 SA/AAm-Lgs的性能分析
2.2.1力学性能分析 不同Lgs用量的复合水凝胶SA/AAm-Lgs力学性能如图4所示。由图可知,未添加Lgs时,水凝胶的断裂伸长率为94%,抗拉强度为0.045 MPa;随着Lgs的用量增加,SA/AAm-Lgs的断裂伸长率增大,抗拉强度略微增强,当Lgs用量为9 mg时,SA/AAm-Lgs的断裂伸长率最大,达到137%,抗拉强度0.059 MPa。这是因为Lgs中的磺酸基团与水凝胶网络中的羟基等官能团形成分子间氢键,水凝胶内部交联程度随之增强,力学性能随之增强,因此添加适量的Lgs能增强水凝胶力学强度。
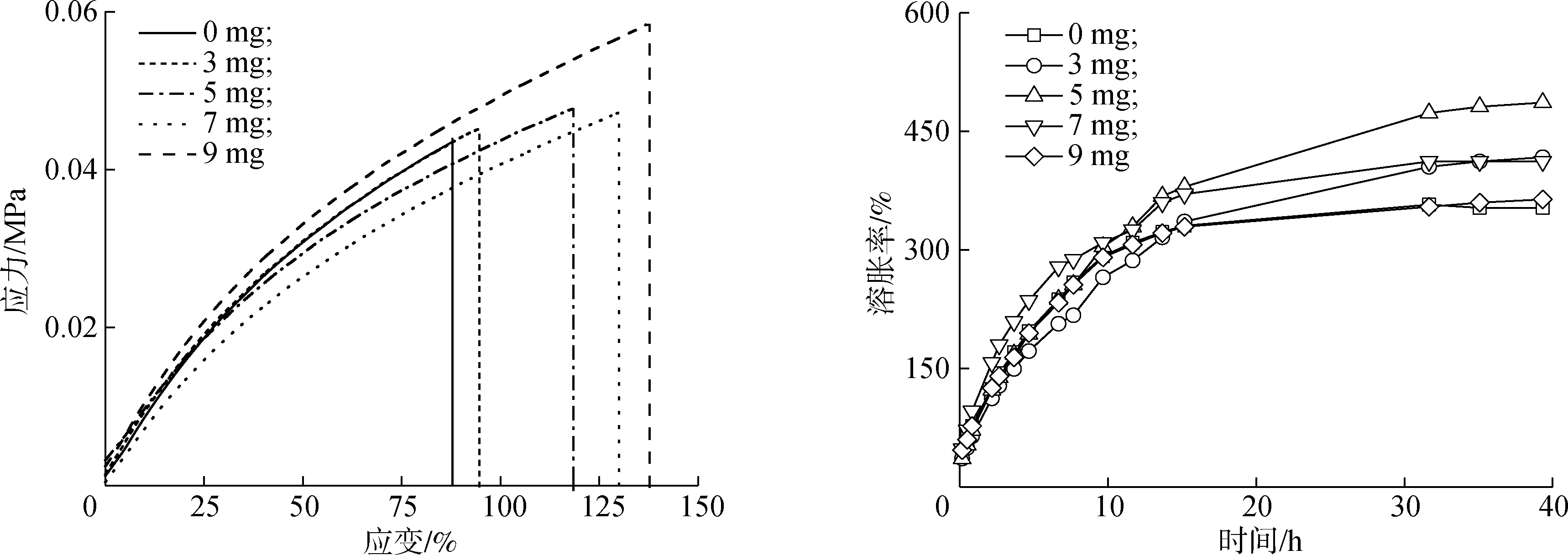
图4 不同Lgs用量SA/AAm-Lgs的应力-应变曲线 图5 不同Lgs用量SA/AAm-Lgs的溶胀曲线
2.2.2溶胀性能分析 不同Lgs用量水凝胶溶胀曲线如图5所示。由图可知,不同Lgs用量的水凝胶在0~15 h内的溶胀率急剧增加,之后缓慢增加,在30 h之后达到溶胀平衡状态。随着Lgs用量的增加,水凝胶的平衡溶胀率先升高后降低,5 mg Lgs时制备的SA/AAm-Lgs的溶胀率最大(487%)。这是因为Lgs中含有大量的亲水官能团(—SO3和—OH),当SA/AAm-Lgs中Lgs的含量开始增加时,水凝胶中的聚合分子链也会随之增大,使水凝胶的亲水性能逐渐增强,其饱和溶胀度也逐渐达到最大值。Lgs用量为7和9 mg的水凝胶溶胀率分别为412%和364%,这是因为Lgs含量太大导致水凝胶的交联密度增大,SA/AAm-Lgs中吸水空间变小,使得吸水性能变差[14]。因此,添加适量的Lgs能在一定程度上提高水凝胶的溶胀性能。
2.2.3循环稳定性能分析 实验中SA/AAm-Lgs(含Lgs 7 mg)对Fe3+经过5次吸附-解吸循环后,其对Fe3+的吸附能力稍有下降(由137 mg/g变为104 mg/g)。可能是由水凝胶在吸附-解吸过程中质量损失,以及水凝胶在盐酸溶液中对Fe3+不完全解吸造成的,这说明SA/AAm-Lgs具有优异的再生性能,回收后的SA/AAm-Lgs水凝胶仍可用于吸附Fe3+。
2.3 SA/AAm-Lgs对Fe3+的静态吸附
2.3.1不同Lgs用量的影响 在吸附温度25 ℃、吸附时间11 h、Fe3+初始质量浓度2 g/L下,不同Lgs用量制备的复合水凝胶SA/AAm-Lgs(0.5 g)对Fe3+的吸附能力如图6(a)所示。由图可知,随着Lgs用量的增加,水凝胶对Fe3+的吸附量先增加后减少,Lgs的用量为7 mg制备的SA/AAm-Lgs对Fe3+的吸附量最大,为130 mg/g。由此可知添加适量的Lgs可使SA/AAm-Lgs中—SO3和—OH基团含量提高,提供更多的Fe3+结合位点,从而提高SA/AAm-Lgs对Fe3+的吸附能力。因此,以7 mg Lgs制备得到的复合水凝胶作为后续吸附实验材料。
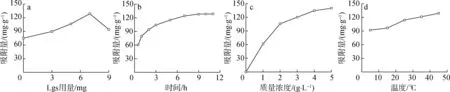
a.Lgs用量Lgs dosage; b.时间time; c. Fe3+初始质量浓度Fe3+ initial mass concentration; d.温度temperature
2.3.2吸附时间的影响 在用量0.5 g、吸附温度25 ℃、Fe3+初始质量浓度2 g/L下,考察吸附时间对SA/AAm-Lgs(含Lgs 7 mg)吸附性能的影响,如图6(b)所示。由图可知,在反应初始阶段(0~9 h),SA/AAm-Lgs对Fe3+的吸附量快速增加,在>9~11 h阶段,对Fe3+的吸附过程趋于平缓,基本达到吸附平衡。这主要是因为SA/AAm-Lgs上带负电荷的—OH、—COOH以及—SO3,易与Fe3+相结合,从而去除溶液中Fe3+。在吸附初始阶段时,水凝胶网络中有较充足的活性位点可与Fe3+充分结合,随着接触时间的延长,吸附位点逐渐饱和,有效活性位点大量减少,因此在吸附后期,SA/AAm-Lgs对Fe3+的吸附也逐渐饱和,吸附量不再变化。因此,选择9 h为最佳吸附时间。
2.3.3Fe3+初始质量浓度的影响 在吸附时间11 h,吸附温度25 ℃下,研究不同初始浓度的Fe3+溶液对SA/AAm-Lgs(含Lgs 7 mg)吸附Fe3+的影响,如图6(c)所示。由图可知,保持SA/AAm-Lgs的质量(0.5 g)不变,随着Fe3+溶液的初始浓度不断增加,SA/AAm-Lgs对Fe3+吸附量不断增大。初始质量浓度在0~2 g/L 之间,水凝胶对Fe3+吸附量呈线性增加,随着初始浓度继续增加,水凝胶吸附变缓,在2 g/L后趋于平缓。该结果可能是因为Fe3+初始浓度较低时,SA/AAm-Lgs表面的结合位点不饱和,其次,较高的Fe3+浓度增加了水凝胶和水溶液之间传质阻力的动力,使得Fe3+与SA/AAm-Lgs发生碰撞的可能性更高。但随着Fe3+初始质量浓度进一步提高,SA/AAm-Lgs上活性吸附位点逐渐饱和,对Fe3+吸附量趋于平缓。因此,Fe3+初始质量浓度较佳值选取2 g/L。
2.3.4吸附温度的影响 温度对于吸附过程也存在较强的影响,在吸附时间11 h,Fe3+初始质量浓度2 g/L下,研究不同温度下SA/AAm-Lgs(含Lgs 7 mg)对Fe3+的吸附情况,如图6(d)所示。由图可知,随着温度逐渐升高,SA/AAm-Lgs对Fe3+吸附量逐渐增加(从92 mg/g增加到了134 mg/g),这是因为温度升高,加速了Fe3+在SA/AAm-Lgs中的扩散过程,从而提高了Fe3+被SA/AAm-Lgs吸附的机会。考虑实际应用是在常温下操作以及成本等因素,选取25 ℃为较佳吸附温度。
2.3.5SA/AAm-Lgs对Fe3+的吸附动力学研究 采用准一级、准二级动力学模型对SA/AAm-Lgs静态吸附Fe3+结果拟合,经计算,准二级动力学模型拟合相关系数(R2)为0.996,拟合的平衡吸附量为140.64 mg/g;准一级动力学模型拟合相关系数(R2)为0.992,拟合的平衡吸附量为75.5 mg/g。由数据可知,准二级动力学模型拟合度较好,并且其拟合的平衡吸附量(140.64 mg/g)与实际平衡吸附量(130.3 mg/g)更相近,说明吸附过程主要是化学吸附。
2.3.6SA/AAm-Lgs对Fe3+的吸附等温线研究 采用Langmuir和Freundlich吸附等温模型对SA/AAm-Lgs静态吸附Fe3+结果进行拟合,经过计算,Langmuir模型拟合的相关系数(R2)为0.960,最大理论吸附量(qm)为166.67 mg/g,与实验计算值143.15 mg/g相近。Freundlich模型拟合的相关系数(R2)为0.771 8。因此,Langmuir模型拟合效果更好,SA/AAm-Lgs对Fe3+的吸附更适合Langmuir模型,说明SA/AAm-Lgs对Fe3+的吸附过程为单分子层吸附。
2.4 SA/AAm-Lgs的动态吸附性能分析
2.4.1柱高的影响 在含Fe3+溶液进水质量浓度2 g/L,系统流速1 mL/min下,吸附柱高度在5、 10和15 cm时分别进行动态吸附,绘制的突破曲线和相应吸附柱参数如图7(a)和表1所示。由图可知,随着固定床高度的增加,突破曲线向右偏移,达到吸附突破点的时间分别为150、 210和330 min。由表1可知,吸附柱柱高增加的同时,吸附总量和Fe3+去除率(R)也提高,这是因为柱高较低时,吸附剂中的活性吸附位点也相应变少[15],通入的Fe3+会快速通过吸附柱导致出水中的含Fe3+量很快达到突破点。随着吸附柱高的增加,吸附剂含量增加,吸附活性位点也增多,Fe3+与吸附剂有更多的接触机会,因此出水中的Fe3+到达突破点的时间变长,吸附能力也提高[16]。根据15 cm柱高吸附的吸附时间是5 cm的2.2倍,是10 cm的1.6倍,选择10 cm为较佳柱高。

表1 不同操作条件下吸附柱的参数1)
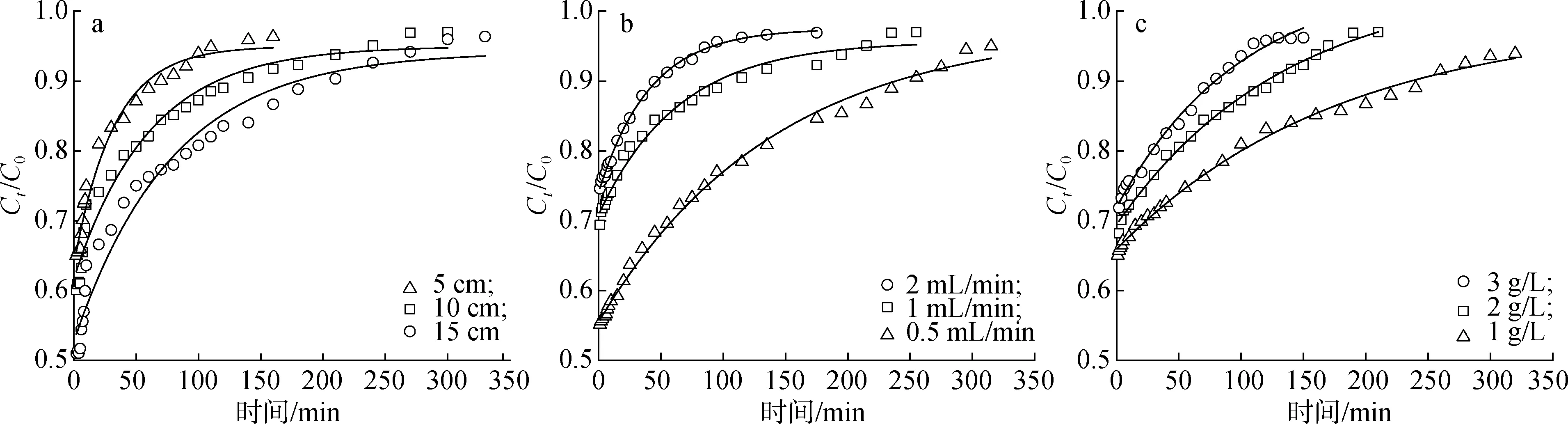
a.柱高height of column; b.流速velocity of flow; c.Fe3+进水质量浓度Fe3+ influent mass concentration
2.4.2流速的影响 在Fe3+进水质量浓度为2 g/L,吸附柱高度为10 cm下,探究系统流速为0.5、 1和2 mL/min时SA/AAm-Lgs对Fe3+动态吸附的影响,根据实验结果绘制突破曲线和相应吸附柱参数,如图7(b)和表1所示。由图可知,随着流速的增加,突破曲线的形状逐渐变陡,吸附的突破时间减少,流速为0.5、 1和2 mL/min达到吸附突破点的时间分别为320、 210和140 min。吸附质在吸附柱中停留时间较长,更有利于吸附,主要原因是在流速较慢的情况下,通入吸附柱的Fe3+可以与水凝胶有充分的接触[17]。吸附剂上的—OH、—COOH等官能团与Fe3+发生螯合作用被固定在吸附剂上,随着Fe3+溶液的不断通入吸附柱,吸附位点逐渐被占用,出水中的Fe3+溶液浓度逐渐升高。然而随着流速的增加,Fe3+在吸附柱中停留时间较短,导致吸附质与吸附剂的接触时间缩短,减少了SA/AAm-Lgs与Fe3+之间的接触时间,导致Fe3+进行内扩散的时间不足,进而更快到达突破时间[18]。随着流速的减少,对Fe3+平均吸附量呈上升趋势,但流速为0.5 mL/min时到达突破点的吸附时间是1 mL/min的1.5倍,是2 mL/min的2.3倍。因此,选择1 mL/min为较佳流速。
2.4.3Fe3+进水质量浓度的影响 在吸附柱高度为10 cm,系统流速为1 mL/min下,考察Fe3+进水质量浓度为1、 2和3 g/L时SA/AAm-Lgs对Fe3+的动态吸附的影响,绘制突破曲线和相应的吸附柱参数,如图7(c)和表1所示。如图所示,随着Fe3+进水质量浓度的减少,突破曲线向左偏移,达到吸附突破点的时间分别为 150、 210和300 min。由表1可知,随着Fe3+进水质量浓度的增加,Fe3+去除率也略微增加,吸附总量和平均吸附量相近。这是因为含Fe3+溶液进水质量浓度较低时,由于浓度梯度较低导致吸附质与吸附剂之间的传质缓慢。而在较高的进水质量浓度下,SA/AAm-Lgs两侧的浓度差增大会出现更大的驱动力,传质速率也进一步加快,且水凝胶与Fe3+没有充分的接触,吸附柱利用率降低,从而更快达到饱和[19]。随着进水质量浓度的增加,Fe3+去除率增加,吸附总量和平均吸附量相近。因此,选择Fe3+质量浓度3 g/L为最佳进水质量浓度。
综合分析不同条件下的吸附量、吸附时间及Fe3+去除率,选择柱高10 cm、流速1 mL/min、Fe3+进水质量浓度3 g/L为该动态吸附装置的最佳运行条件。
2.4.4BDST模型拟合及预测 BDST模型可以描述不同柱高下SA/AAm-Lgs吸附Fe3+的性能。在Fe3+进水质量浓度2 mg/L、流速1 mL/min条件下,将柱高作为横坐标,将随机选取Ct/C0为0.8和0.85为突破点时所对应的时间t为纵坐标,绘制拟合曲线,如图8所示。由拟合数据可知,Ct/C0为0.8的拟合的相关系数为0.992,Ct/C0为0.85的拟合的相关系数为0.989,拟合程度均较好,说明柱高对突破曲线的影响较小,可以用BDST模型描述不同柱高下SA/AAm-Lgs吸附Fe3+与突破时间的关系。当突破点由0.8提高至0.85时,斜率由7.713 min/cm增加至10.669 min/cm,截距由18.82 min减小至3.41 min,吸附量由15.4 g/L增加至21.3 g/L,说明吸附量随突破点的提高而增加。吸附速率常数(K)从-0.036 8 mL/(mg·min)减至-0.254 6 mL/(mg·min),由于吸附过程的推进,大量Fe3+被吸附在SA/AAm-Lgs表面,使SA/AAm-Lgs两侧的浓度梯度下降,吸附的能力减弱,因此吸附速率常数下降。

图8 SA/AAm-Lgs吸附Fe3+的BDST模型拟合结果Fig.8 BDST model fitting results of SA/AAM-Lgs hydrogel adsorbing Fe3+
此外,在Fe3+初始质量浓度2 g/L、流速1 mL/min条件下,选用突破点Ct/C0=0.8的拟合方程计算不同柱高下的理论突破时间,与通过实验所得的实际时间进行对比。选取3个不同突破点(Ct/C0为0.78、 0.75和0.70)所对应不同柱高(5、 10和15 cm,突破点与柱高一一对应)下理论突破时间与实际突破时间,两者误差分别为4.76%、 0.95%和1.67%。这表明SA/AAm-Lgs对Fe3+的吸附过程可以通过BDST模型描述,进而预测不同浓度和流速的突破时间。
当柱高为10 cm,Fe3+初始质量浓度2 g/L条件下,流速由1 mL/min改为2 mL/min,突破点Ct/C0为0.8时,理论时间与实际突破时间分别为19.75和19.06 min;突破点Ct/C0为0.85时,理论时间与实际突破时间分别为49.94和47.97 min,理论突破时间与实际突破时间的误差分别为3.49%和3.94%。当柱高10 cm,流速1 min/L条件下,Fe3+初始质量浓度由2 g/L改为1 g/L,突破点Ct/C0为0.8时,理论时间与实际突破时间分别为120.05和109.81 min;突破点Ct/C0为0.85时,理论时间与实际突破时间分别为207.18和186.94 min,理论与实际的突破时间误差分别为8.91%和9.77%。以上误差均在15%以内,这表明在实际应用中,通过改变Fe3+进水质量浓度或流速,就可以预测出水溶液达到突破点时所需的时间,进而提高了操作效率。
3 结 论
3.1以海藻酸钠(SA)和丙烯酰胺(AAm)为基体,引入木质素磺酸钠(Lgs),采用自由基聚合法制成了复合水凝胶吸附剂SA/AAm-Lgs。SEM和FT-IR分析表明:成功制备了多孔三维网状结构的SA/AAm-Lgs;性能分析表明:添加适量的Lgs能增强水凝胶的力学强度和溶胀性能,制备的水凝胶具有良好的循环稳定性。
3.2复合水凝胶SA/AAm-Lgs(含Lgs 7 mg)静态吸附Fe3+的工艺为:水凝胶用量0.5 g,温度25 ℃、Fe3+初始质量浓度2 g/L。此条件下,SA/AAm-Lgs对Fe3+的吸附量高达143 mg/g。吸附等温线和动力学模型拟合表明SA/AAm-Lgs对Fe3+的吸附更适合Langmuir等温线和准二级动力学模型,这说明吸附过程为以化学吸附为主的单分子层吸附过程。
3.3复合水凝胶SA/AAm-Lgs动态吸附Fe3+实验中,随吸附柱高度增加,吸附突破时间也延长;随着进水Fe3+初始质量浓度和流速的增加,吸附突破时间急剧缩短。BDST模型拟合得到的理论和实际的突破时间误差均在15%以内,其可以较好地描述Fe3+在吸附柱中的动力学特征。

