尖孢镰刀菌cox1基因的生物信息学鉴定及克隆
□文/田雨纯 赵丹*
关键字:尖孢镰刀菌;cox1基因;生物信息学
尖孢镰刀菌为白色气生菌丝,是植物枯萎病菌的病原菌,是一种土传病原性真菌并广泛分布于世界各地,具有致病力强、致病范围广等特点[1]。从初发到大面积泛滥只需2~3 年,其发病率通常为10%~30%,病情严重的年份发病率可达50%,甚至还会绝收,严重影响植株果实产量[2],研究其内部主要成分并有针对性地研制相关药物抑制病菌生长成了刻不容缓的任务。
cox1(细胞色素c氧化酶第I亚基)是呼吸复合物IV的3 个线粒体DNA 编码的亚基(MTCO1,MTCO2,MTCO3)中的1 个。它从还原的细胞色素c 中收集电子,并将其转移到氧气中以产生水。释放的能量用于跨线粒体内膜传输质。
本研究对尖孢镰刀菌cox1 基因及蛋白进行了理化性质、信号肽、亲/疏水性、跨膜结构、蛋白质二级结构、蛋白质三级结构等进行预测和分析。运用生物信息学相关知识为植物保护病菌抑制领域提供一定运用价值。
一、材料与方法
(一)序列检索
在NCBI 中进行BLAST 分析,检索尖孢镰刀菌cox1基因序列及其编码蛋白序列。茄病镰刀菌、禾谷镰刀菌、黄色镰刀菌、轮枝镰刀菌、稻瘟病菌、立枯丝核菌、古巴假霜霉菌及稻平脐蠕孢cox1 基因及蛋白序列从NCBI蛋白数据库中获得。
(二)生物信息分析方法
蛋白质理化性质分析、蛋白质结构域分析、蛋白质疏水性预测、蛋白质跨膜预测(蛋白质信号肽预测)蛋白质二级结构预测以及蛋白质三级结构预测。
预测蛋白跨膜结构利用TMHMM 软件,信号肽预测工具利用Signal P 软件,蛋白同源性比对利用NCBI 中的BLAST X 程序,蛋白序列比对分析利用DNA MAN 软件,蛋白进化树绘制利用MEGA7 软件,蛋白理化性质分析利用Protparam工具。
(三)总RNA提取及反转录
尖孢镰刀菌总RNA 经传统Trizol 法提取,照Takara Reverse Transcription System 说明书进行反转录。将反转录后的产物用ddH2O稀释10倍,-20℃保存备用。
(四)尖孢镰刀菌cox1基因CDS区克隆
采用PCR 的方法克隆尖孢镰刀菌cox1 基因CDS 区,引物序列见表1。PCR 反应体系共20 微升:PCR MasterMix 10 微 升,Forward/ReversePrimer (10pmol/微 升)各0.5 微升,Template cDNA 1 微升,ddH2O 8 微升;PCR扩增条件:94℃3 分钟,94℃30 秒,51.9℃30 秒,72℃1分钟,35个循环;72℃延伸1.5分钟,4℃保存[3]。

表1 引物序列
二、结果与分析
(一)尖孢镰刀菌cox1基因克隆
BLSAT 检索出尖孢镰刀菌cox1 基因长1593bp,共编码530 个氨基酸,序列如图1 所示。尖孢镰刀菌cox1 基因CDS区克隆结果如图2所示,符合预期。

图1 尖孢镰刀菌cox1基因及蛋白质序列
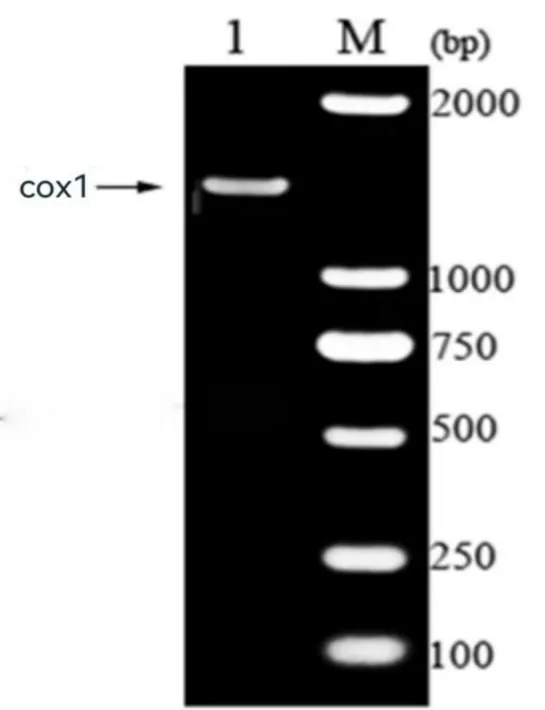
图2 尖孢镰刀菌cox1基因电泳图
(二)尖孢镰刀菌cox1蛋白质的理化分析
利用生物信息分析软件Protparam 对尖孢镰刀菌cox1 蛋白进行理化分析,结果显示如表2 所示。亮氨酸含量最高,含有70 个,占总氨基酸数的9.2%,甘氨酸含有50 个,占总氨基酸数的9.4%,异亮氨酸含有46个,占总氨基酸数的8.7%,半胱氨酸(Cys)含量最低,仅含有1 个,占总氨基酸数的0.2%,cox1 蛋白的氨基酸数量为530 个,其分子量为58390.82D、分子式为C2767H4174N648O698S22,cox1蛋白的理论等电点PI为8.46。

表2 蛋白质的理化性质分析
(三)尖孢镰刀菌cox1蛋白信号肽分析
信号肽主要由三部分组成:n 区(n-region)为正电荷的氨基酸;疏水区(h-region)由9个或更多的以中性氨基酸为主组成;加工区(c-region)是信号肽酶切割信号肽的部位[4]。使用在线网站SignalP4.1 Server 预测cox1 蛋白信号肽情况,具体结果如图3 所示,综合评估推测cox1 蛋白不存在信号肽,也不跨膜,在细胞质中合成后,不进行蛋白转运,直接在细胞质基质中与代谢底物相互作用,属于非分泌型蛋白质[5]。
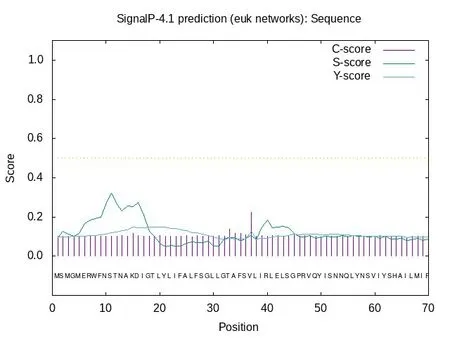
图3 尖孢镰刀菌cox1蛋白质信号肽
(四)尖孢镰刀菌cox1蛋白的亲疏水性分析
不同的氨基酸侧链基团极性不同,导致其组成的蛋白质有一定的亲/疏水性。通过在线分析网站对cox1蛋白的疏水性进行研究,如图4 所示。横轴表示的是氨基酸的位置,纵轴代表的是氨基酸平均疏水指标,并且图中的正值和负值分别表示的是疏水性和亲水性,正值越大,表明疏水性越强,负值越大,表明亲水性越强[6]。结果表明,cox1 蛋白的最大疏水值(即最小亲水值)出现在第195 位氨基酸,最小疏水值(即最大亲水值)出现在第443 位氨基酸,在图7 中呈现了亲水性氨基酸和疏水性氨基酸的分布,肽链中疏水性氨基酸残基数量明显多于亲水性氨基酸残基,因此可以推测cox1 蛋白为疏水性蛋白。
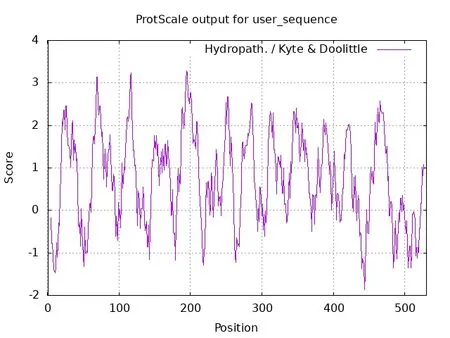
图4 尖孢镰刀菌cox1蛋白的疏水性分析
(五)尖孢镰刀菌cox1蛋白的跨膜结构分析和预测
通过在线网站预测蛋白跨膜结构,尖孢镰刀菌cox1蛋白进行蛋白跨膜结构预测(图5)。横轴表示的是氨基酸的位置,纵轴代表的是跨膜结构的可能性[7],图5 结果显示,尖孢镰刀菌cox1蛋白存在12个跨膜区域,因此可推测cox1蛋白为十二层跨膜结构蛋白。
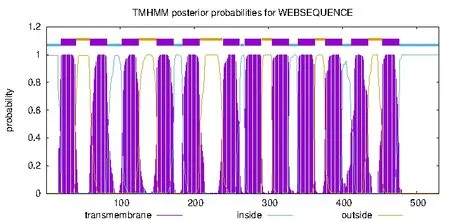
图5 尖孢镰刀菌cox1蛋白的跨膜分析图
(六)尖孢镰刀菌cox1蛋白序列比对与进化分析
通过NCBI查找发现,尖孢镰刀菌cox1蛋白有530个氨基酸,用DNA MAN软件把其氨基酸的序列与茄病镰刀菌、禾谷镰刀菌、黄色镰刀菌、轮枝镰刀菌、稻瘟病菌、立枯丝核菌、稻平脐蠕孢cox1 蛋白序列进行对比,结果显示(图6),不同生物物种cox1蛋白序列存在一定的序列一致性,图7所示是9个物种的系统进化树。

图6 9个物种cox1氨基酸序列比对图
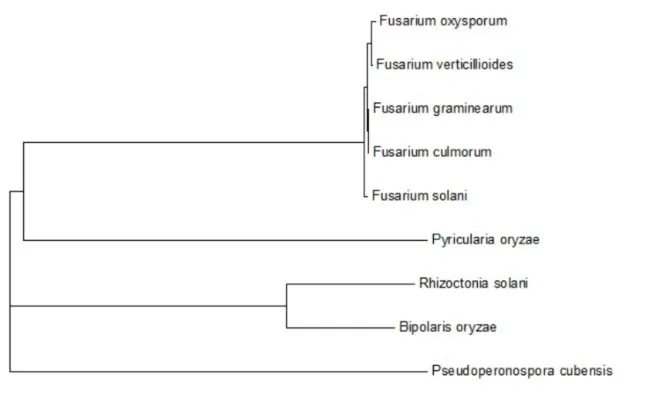
图7 9个物种cox1氨基酸序列系统进化树
(七)尖孢镰刀菌cox1蛋白的二级、三级结构预测
蛋白质二级结构作为一级结构和三级结构的纽带,对其的预测可以为三级结构和功能提供大量信息,如设计蛋白质突变体或确定蛋白质空间结构及功能[8]。
利用二级结构预测网站的α-螺旋占比较多为55.66%,片状结构(β-折叠和β-转角)为5.28%,无规则卷曲为39.06%(图8),由此推断,cox1蛋白二级结构中最主要的结构元件是α-螺旋,此外无规则卷曲和片状结构分散于整个蛋白质中,且N-末端存在无规则卷曲形式,C-末端也存在无规则卷曲。
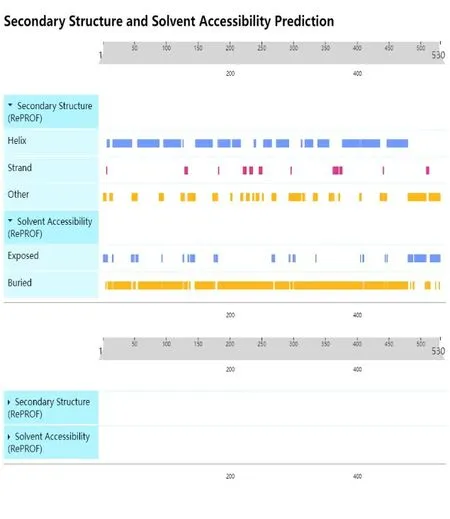
图8 尖孢镰刀菌cox1蛋白的二级结构预测
蛋白质的三级结构是由多肽链在二级结构的基础上经过进一步盘绕、折叠形成的复杂三维构象,这些二级结构主要包括α-螺旋、β-折叠、β-转角和无规则卷曲,它们之间通过侧链基团的相互作用借助次级键形成三级结构。Cox1蛋白三级结构预测通过网站建模得图(图9),如图可看出α-螺旋占主要结构部分,无规则卷曲和片状结构分散于整个蛋白质中。
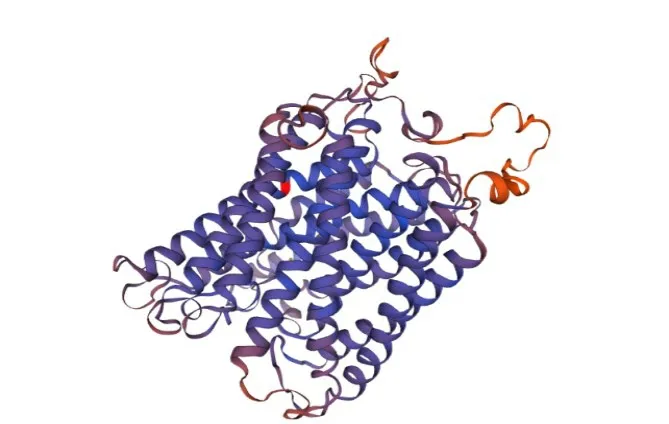
图9 尖孢镰刀菌cox1蛋白质三级结构预测图
三、结论与讨论
本研究结果获得克隆尖孢镰刀菌cox1 基因CDS 序列1593bp,同时为探究cox1 蛋白的未知生物学功能提供了新思路,也为当下植物保护领域,植物真菌病害的防治打下了一定理论基础,结合生物信息学可研制更高效、低成本、对环境友好的绿色杀菌剂。
生物信息学(bioinformatics)是一门新兴的交叉学科,综合运用了生物学、数学、计算机科学和工程学。它可以应用各种数据库解释生命科学研究中发现的海量数据,所以被广泛应用于生命科学中的各个领域[9],以互联网为媒介、数据库为载体、利用数学和计算机科学对生物学数据进行存储、检索和处理分析,并进一步挖掘和解读生物学数据,它是一门理论概念与实践应用并重的学科[10]。
本研究运用生物信息学软件对尖孢镰刀菌cox1 基因进行克隆,并对cox1蛋白从理化性质、信号肽、亲/疏水性、跨膜结构、蛋白质二级结构、蛋白质三级结构等方面进行预测和分析。结果表明尖孢镰刀菌cox1 基因CDS序列1593bp,编码530 个氨基酸,Cox1 蛋白为碱性氨基酸,不存在信号肽,合成后就在核糖体处发挥作用,不存在运输,属于非分泌型蛋白质,分泌蛋白,疏水性较强,较稳定,有明显的跨膜现象。cox1 蛋白二级结构中α-螺旋占主要结构部分,此外无规则卷曲和片状结构分散于整个蛋白质中,cox1 蛋白三级结构预测结果同样证实了二级结构成分含量的准确性,与二级结构结论相一致。cox1 蛋白在不同物种之间同源性较高,序列比对一致性较高,证明了该蛋白在同系同物种进化过程中发挥着至关重要的作用。

