果糖-1,6-二磷酸酶在肿瘤中的作用:一项泛癌分析
占云梅,蓝红阳,徐佳明,孟 凡
(1. 赣南医学院第一临床医学院;2. 赣南医学院第一附属医院消化内科,江西 赣州 341000)
癌症一直以来都是影响全球卫生健康的主要原因,其致死率在过去的20世纪中一直处于上升状态[1]。在与癌症抗争的同时人们对于它的理解和认识也越来越深入,著名的“沃伯格效应”就曾提出,肿瘤组织内存在大量的有氧糖酵解代谢,与周围正常组织构成明显差别[2]。现已明确这是由肿瘤组织的营养和生存需求决定的,糖酵解反应产生的中间物质能参与脂质、特定氨基酸和核酸的生物合成,并调节氧化还原的磷酸戊糖途径[3]。比如产物之一的乳酸,既能作为底物参与线粒体呼吸,又是糖异生途径的主要前体物质,产生能量的同时也为生物大分子的合成提供了原料,高效促进了癌细胞增殖[4]。越来越多的研究表明,高频率的糖酵解代谢是癌症的重要标志[5]。
果糖-1,6-二磷酸酶(Fructose-1,6-bisphosphatase, FBP1)是糖异生途径的关键限速酶,参与糖酵解的逆向反应。其编码基因FBP1位于9 号染色体22.2-22.3 位置,包含7 段长度大于31 Kb 的外显子和6 个内含子[6]。在已报道的文献中,RNA 结合蛋白CUG-BP6(CUGBP elav-like family member 6,CELF6)与FBP1结合可稳定FBP1转录,抑制乳腺癌细胞增殖和侵袭[7];BET 家族蛋白(Bromodomaincontaining Protein 4,BRD4)与FBP1结合可抑制胰腺癌细胞生长[8];LI F M 等[9]通过在肝脏中特异性敲除FBP1发现肝星状细胞可被诱导活化以促进肝癌进展;LI B 等[10]证实FBP1 在肾脏中的普遍缺失,与透明细胞肾癌直接相关;值得注意的是,这些肿瘤细胞或组织内出现了糖原水平不同程度的升高,这可能与FBP1编码蛋白的功能有关,即FBP1可通过抑制糖酵解代谢调控肿瘤进程。类似的表现在胶质母细胞瘤、卵巢癌等组织细胞中同样存在[7-14]。如此强大的癌症背景,让我们对它在泛癌层面的调控表现尤为关注。然而我们搜索各主要数据库,并未发现相关资料。对其进行基因、蛋白组学、调控网络等方面的深入分析(图1)或可利于我们更好地理解FBP1的生物功能。

图1 FBP1相关分析总览
1 方法
1.1 mRNA 和蛋白差异性表达分析通过肿瘤免疫浸润网站TIMER2.0(http://timer.comp-genomics.org)[15],设置基因FBP1,得到基于癌症基因图谱(The Cancer Genome Atlas,TCGA)的不同癌症类型中肿瘤组织和正常组织的基因表达差异。某些缺乏对比性数据的肿瘤类型,我们进一步通过交互式基因表达分析网站[16],从TCGA、基因型与组织表达(GTE)数据库中选择正常组织进行匹配。此外,还通过GEPIA 的“病理分期”模块分析了FBP1与不同肿瘤的临床病理分期的关系。对于蛋白表达层面,使用UALCAN(http://ualcan. path. uab. edu/)[17],基于样本类型(原发性肿瘤与正常组织),分析FBP1基因在不同TCGA 数据集中的蛋白表达,并在对每组样本内和样本间进行归一化后,以代表样本中位数标准偏差的Z值可视化为箱式图。
1.2 生存分析通过GEPIA 的“生存率”版块,分别从总生存率(Overall survival,OS)和无病生存率(Recurrence free survival,RFS)两种临床结果,建立Cox 比例风险回归模型,以中位数作为截断值,月为生存单位,分析不同癌症类型中FBP1基因与生存率的关系。
1.3 免疫浸润分析通过肿瘤免疫浸润分析网站TIMER 2.0 的“免疫相关”版块,用TIMER、EPIC、MCP-COUNTER、 CIBERSORT-ABS、 XCELL、QUANTISEQ、TIDE 等算法,经斯皮尔曼检验后可视化为热图以预测不同肿瘤样本中CD8+T 细胞、Treg细胞等免疫相关细胞及癌症相关成纤维细胞的浸润差异。
1.4 基因改变分析通过cBioPortal(https://www.cbioportal.org)[18]网站对FBP1 的基因组学进行变异分析,将发生突变、结构变异、扩增、深度缺失等改变的频率对应TCGA 中不同肿瘤类型,并对FBP1基因的突变位点进行分析。此外,通过GSCA(http://bioinfo.life.hust.edu.cn/GSCA)[19]分析FBP1基因的拷贝数改变(Copy number variation, CNV)和生存率之间的关系,并以无病间隔(Disease free interval,DFI)、疾病相关存活(Disease specific survival,DSS)、OS、无进展生存(Progression free survival,PFS)这4个主要临床结果为终点将结果可视化为热图。
1.5 功能富集和交互式作用分析在GEPIA 网站的“相似基因”版块,在所有基于TCGA的肿瘤类型中筛选与FBP1基因功能相似的前200个基因,同时在蛋白相互作用网站STRING(https://cn. string-db.org)[20]中筛选前50个与FBP1相互作用的基因,再将所有筛选出来的基因导入DAVID(https://david.ncifcrf. gov/tools. jsp)[21]网站后进行标准基因标识转换,最终按基因本体(Gene ontology, GO)下的生物过程(Biological process,BP)、细胞成分(Cellular component, CC)、分子功能(Molecular function, MF)和“路径”下的KEEG进行功能富集分析。
此外,使用ENCORI(https://starbase. sysu. edu.cn/)[22]网站进行功能相关基因间的RNA-RNA 共表达分析,并在“miRNA-目标基因”版块导出FBP1基因的预测miRNA。后者与在TargetScanHuman 7.2(https://www. targetscan. org/vert_72)网站得到的FBP13'UTR靶miRNA进行对比,得出重复值后返回ENCORI网站进行miRNA-目标基因的共表达验证。
1.6 药物敏感性分析使用GSCA 网站的药物版块,分别进行FBP1基因表达与癌症治疗反应(The cancer therapeutics response portal, CTRP)、基因组学药物敏感性(Genomics of drug sensitivity in cancer, GDSC)的相关性分析,并将前30 个结果可视化为热图。
2 结果
2.1 FBP1的差异性表达分析在TIMER 2.0中导出的差异性表达结果如图2a所示:FBP1在肿瘤组织中表达升高的有乳腺浸润癌(Breast invasive carcinoma,BRCA)、胶质母细胞瘤(Glioblastoma multiforme,GBM)、子宫内膜癌(Uterine corpus endometrial carcinoma,UCEC)、前列腺癌(Prostate adenocarcinoma,PRAD);表达降低的有胆管癌(Cholangiocarcinoma,CHOL)、肾嫌色细胞癌(Kidney chromophobe,KICH)、肾透明细胞癌(Kidney renal clear cell carcinoma,KIRC)、肾乳头状癌(Kidney renal papillary cell carcinoma,KIRP)、肝细胞癌(Liver hepatocellular carcinoma,LIHC)、肺腺癌(Lung adenocarcinoma,LUAD)、肺鳞状细胞癌(Lung squamous cell carcinoma,LUSC)、嗜铬细胞瘤和副神经节瘤(Pheochromocytoma and Paraganglioma,PCPG)及皮肤黑色素瘤(Skin cutaneous melanoma,SKCM);膀胱尿路上皮癌(Bladder urothelial carcinoma,BLCA)、宫颈鳞状细胞癌(Cervical squamous cell carcinoma,CESC)和宫颈内腺癌、胃腺癌(Stomach adenocarcinoma,STAD)、甲 状 腺 癌(Thyroid carcinoma,THCA)、结肠癌(Colon adenocarcinoma,COAD)、食管癌(Esophageal carcinoma,ESCA)和头颈部鳞状细胞癌(Head and Neck squamous cell carcinoma,HNSC)中的FBP1在肿瘤组织的表达和正常组织中无差异(P>0.05)。缺乏对比性数据的肿瘤类型,在GEPIA网站中选择TCGA和GTE数据库中的正常组织进行匹配,结果如图2b所示:FBP1在弥漫性大B 细胞淋巴瘤(Diffuse large B-cell lymphoma,DLBC) 、卵 巢 浆 液 性 囊 腺 瘤(Ovarian cystadenocarcinoma,OV)、脑低级胶质瘤(Lower grade glioma,LGG)、急性髓细胞样白血病(Acute myeloid leukemia,AML)、腱鞘巨细胞瘤(Tenosynovial giant cell tumor,TGCT)中高表达;在肉瘤(Sarcoma,SARC)、肾上腺皮质癌(Adrenocortical carcinoma,ACC)和胸腺癌(Thymoma,THYM)中低表达。
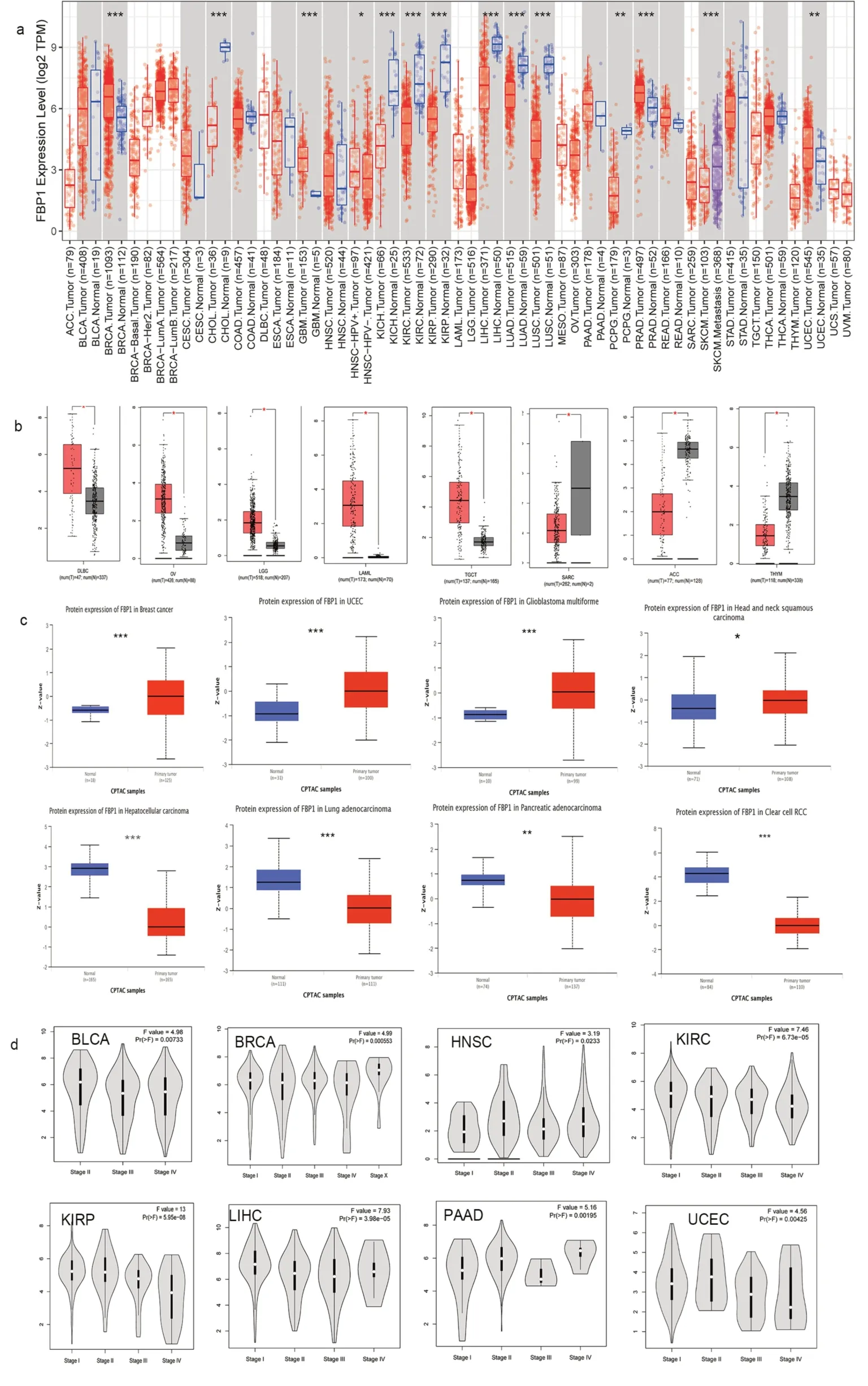
图2 FBP1在肿瘤组织中的差异性表达
蛋白组学的差异性表达如图2c 所示:FBP1在肿瘤组织中高表达的有BRCA、UCEC、GBM、HNSC;低表达的有LIHC、LUAD、PAAD、KIRC。通过比较可以看出,蛋白组学的差异性表达结果与基因表达基本一致。此外,在GEPIA 网站分析的FBP1基因与肿瘤的临床病理分期之间的关系如图2d 所示:FBP1与BLCA、BRCA、HNSC、KIRC、KIRP、LIHC、PAAD、UCEC的临床病理分期显著相关。
2.2 FBP1 表达与生存预后分析以FBP1基因的中位数表达作为截断值,将所有肿瘤患者分为高表达组和低表达组,分析不同癌症类型中FBP1基因与OS 和DFS 这两种临床预后的关系。结果如图3所示,OS 与FBP1在BLCA、KIRC、LUAD、SARC、SKCM 中的低表达及READ、LGG、UVM 中的高表达有关;DFS 则与FBP1在LIHC、PRAD、KIRC 中的低表达及LGG 中的高表达有关。结果发现KIRC 和LGG 中的FBP1表达水平在OS 和DFS 两种临床预后中保持一致,即FBP1在KIRC 肿瘤组织中的低表达、LGG肿瘤组织中的高表达均与预后不良相关。

图3 FBP1表达与不同肿瘤类型患者生存预后的相关性
2.3 FBP1 与免疫浸润分析基于IMER、EPIC、MCP-COUNTER、 CIBERSORT-ABS、 XCELL、QUANTISEQ、TIDE 等算法,本文分析了不同肿瘤样本中FBP1基因表达与CD8+T 细胞、Treg 细胞及癌症相关成纤维细胞等免疫相关细胞的浸润差异的关系,如图4 所示。在大部分算法中,BRCA-Basal、CESC、HNSC、SARC、SKCM,UCEC中的FBP1表达与CD8+T 细胞的免疫浸润存在明显正相关,而在BRCA、BRCA-LumA/LumB、THYM 中表现为负相关;Treg 免疫浸润方面,BRCA-Basal、ESCA、HNSC、LUAS、LUSC、SKCM、TGCT、UCEC 中的FBP1表达与之呈正相关,而KIRC 中表现为负相关;CAF 细胞浸润方面,HNSC-HPV-、LGG、PCPG、THYM 中的FBP1表达与CAF 浸润正相关,而在KIRC、OV、PRAD 中负相关。
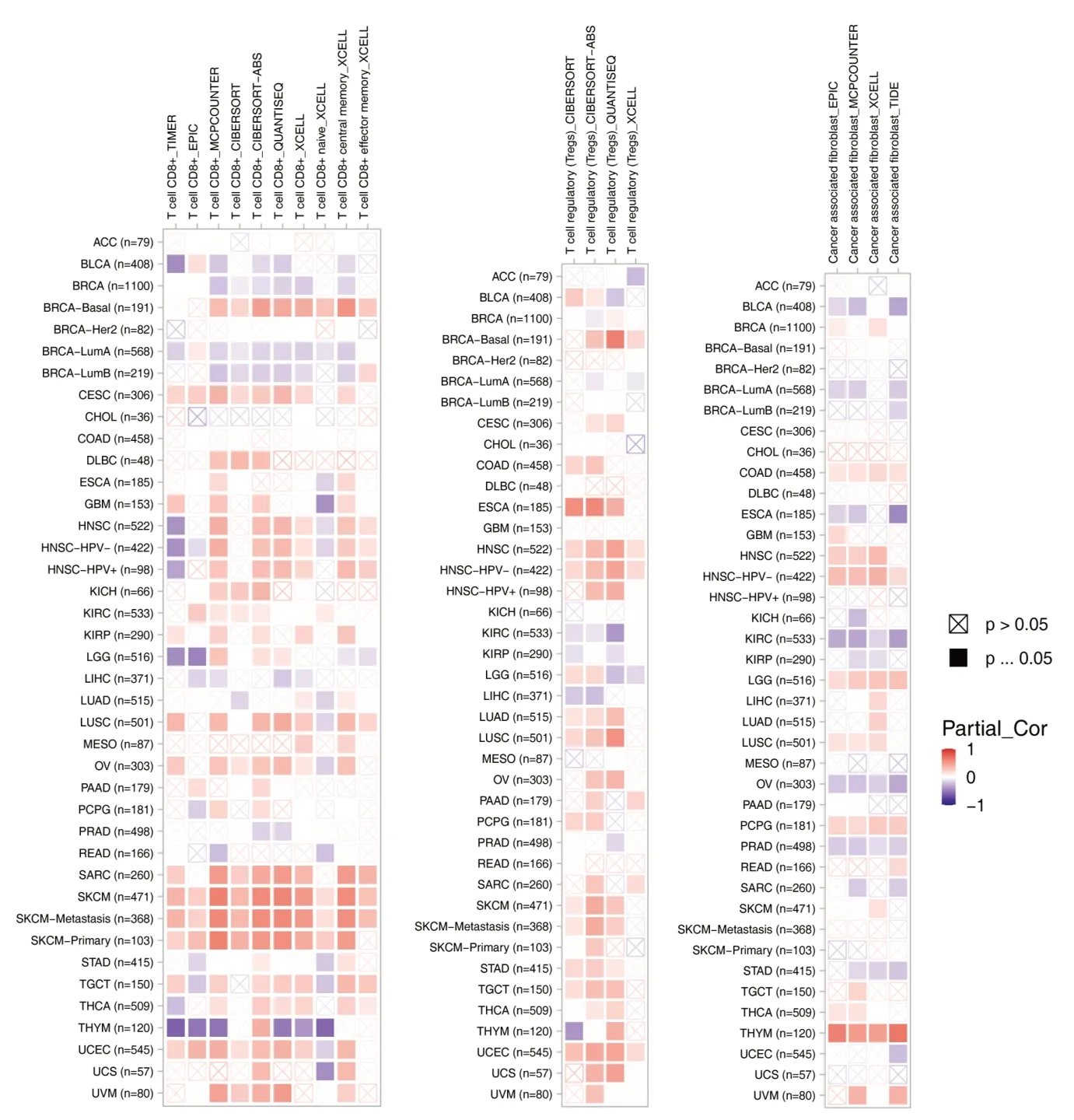
图4 FBP1表达与免疫浸润的相关性
2.4 FBP1基因变异通过cBioPortal网站对FBP1基因变异分析结果如图5a 所示。图5a 显示FBP1基因变异和CNA 变化在绝大部分肿瘤组织中都存在:在CHOL、CESC 中为突变,在ACC、SARC、HNSC、KIRC 中为扩增,而在LAML、THCA、KIRP 中为深度缺失。CNV 和预后之间的关系如图5b所示:KIRC、KIRP、SARC、UCEC、UVM 中FBP1的CNV 与DSS 正相关;KIRC、KIRP、LAML、SARC、THYM、UCEC、UVM 中与OS 正相关;ACC、KIRC、KIRP、SARC、THYM、UCEC 中与PFS正相关。图5c展示了FBP1的突变类型和位点,即错义突变是FBP1的主要突变类型,在205号位点发生了赖氨酸(Lysine)突变。

图5 FBP1在不同肿瘤组织中的基因变异特征
2.5 FBP1 相关基因功能富集和交互式作用分析将所有FBP1相关基因进行GO和KEEG富集分析如图6a 所示。GO 分析表明这些基因位于胞外,主要参与糖酵解过程;KEEG 分析表明“碳代谢”“代谢途径”可能参与了FBP1的作用机制。如图6b所示:在KIRC 中FBP1的表达始终与细胞周期蛋白依赖性激酶4(Cyclin dependent kinases 4,CDK4)、转化生长因子-β(Transforming growth facter β1,TGF-β1)、基质金属肽酶2(Matrix metalloproteinase 2,MMP2)、缺氧诱导因子1α(Hypoxia-inducible factors 1α,HIF1A)、DNA 损伤诱导转录物3(DNA damageinducible transcript 3,DDIT3/CHOP)等负相关,而在LGG 中与之正相关。如图7a 所示,在KIRC 中,miR-214-3p与FBP1的表达水平呈负相关,miR-139-5p和miR-1251-5p 与FBP1 的表达水平呈正相关;而在LGG 中,miR-214-3p 和miR-1251-5p 与FBP1 的表达水平呈正相关,miR-139-5p与FBP1的表达水平呈负相关。将这3 种miRNA 在KIRC 和LGG 的生存预后K-M 图如图7b 所示:KIRC 中miR-214-3p 的高表达、miR-139-5p 和miR-1251-5p 的低表达与更差的OS相关。

图6 FBP1的基因功能分析
2.6 FBP1与药物敏感性分析通过GSCA 网站进行的CTRP、GDSC 与FBP1基因表达相关性分析如图8 所示。CIL70、STF-31、氟伐他汀、洛伐他汀、氯硝柳胺在FBP1高表达的癌症组织中具有较高的敏感性,其他药物如拉帕替尼片、卡奈替尼、austocystinD 等则在FBP1低表达的肿瘤组织中敏感性更好。此外,现行的绝大部分基因组学药物,特别是博来霉素(50 uM)、TW 37、多西他赛、ZG-10等也在FBP1高表达的肿瘤组织中表现出良好的敏感性。

图8 CTRP、GDSC与FBP1表达的相关性
3 讨论
自有氧糖酵解的概念提出以来,越来越多的研究证实,肿瘤微环境(Tumor microenvironment ,TME)参与了癌症的发生和进展[23],代谢重编程已成为恶性肿瘤的一大标志[24]。肿瘤细胞会在癌症进展的任意阶段依据TME 变化选择有利于自身存活的代谢方式,糖酵解便是其主要手段之一。FBP1编码蛋白作为限速酶参与糖异生反应,抑制糖酵解[25],在多种肿瘤组织中发挥调控作用。基于TCGA和CPTAC数据库,我们发现FBP1在KIRC 肿瘤组织中的低表达及LGG 肿瘤组织中的高表达均与较差的OS 和DFS 相关。这与文献报道FBP1 在KIRC 中普遍缺失[10]、防治因放疗导致的FBP1 水平下降有助胶质母细胞瘤的治疗[11]等相符。
除肿瘤细胞外,TME 中的多种免疫和非免疫细胞参与了癌症的发生和进展,免疫治疗已是当前癌症诊疗的一大方向[26]。FBP1 表达在相当一部分的肿瘤组织中与靶向肿瘤的CD8+T 细胞[27]、介导免疫逃避的Treg 细胞[28]及肿瘤组织中主要的基质细胞(如:CAF)[29]等存在显著相关性。尤其是CAF,它是一种高度动态化的异质性细胞,持续活化,还能根据肿瘤细胞表观遗传的改变分泌相应的产物以促进癌症的进展,常被认为是抗癌治疗的靶点之一[30]。本文分析显示LGG 中的FBP1 表达与CAF 浸润正相关,而在KIRC 中负相关,这与FBP1 在KIRC和LGG 中的差异化表达及预后相一致,说明FBP1与KIRC和LGG中的免疫浸润相关。
基因结构或功能的改变与癌症的发生密切相关。此前有报道FBP1的基因突变导致代谢紊乱[31-33],本文研究发现FBP1基因和CNA变化在绝大部分肿瘤组织中也都存在,且与多种肿瘤的DSS、OS、PFS 等临床预后相关,尤其是在KIRP、KIRC、UCEC等肿瘤类型中,预后始终与FBP1的CNV呈正相关。这可能提示FBP1的CNV 对某些特定肿瘤,比如KIRC的预后具有较好的预测价值。
在我们前面的分析中,FBP1的基因和蛋白组学始终表现为在KIRC 的肿瘤组织中低表达、LGG 的肿瘤组织中高表达,且在KIRC 肿瘤组织中的低表达与LGG 肿瘤组织中的高表达均与不良预后、免疫浸润等直接相关。本文进一步探讨了FBP1 在这2种癌症中的相关基因网络,发现KIRC 中FBP1 的表达始终与CDK4、TGFB1、MMP2、HIF1A、DDIT3/CHOP等负相关,而在LGG 中正相关。在已报道的文献中,这些基因参与调控癌细胞增殖[34-35]、分化[36-37]、转移[38-40]、氧化应激[41-42]及凋亡[43-45],这可能提示FBP1的调控机制涉及这些生物学行为。此外,本文还预测了FBP1 的靶miRNA,发现3 个在KIRC 和LGG 中均与FBP1表达具有统计学相关的miRNA,分别是miR-214-3p、miR-139-5p 和miR-1251-5p,他们在其他疾病或癌症中发挥了关键作用[46-49],但在KIRC 和LGG 中的具体作用未见报道。基于此,本文首次从生物信息学角度论证了miR-214-3p/FBP1负向调控轴及miR-139-5p/FBP1、miR-1251-5p/FBP1 正向调控轴促进了KIRC 的进展并影响其预后,但在LGG 中并未发现这3 种miRNA 与临床预后的统计学关联,不排除存在样本量缺乏的因素。寻找敏感性药物一直是癌症治疗的重要策略方向,本文最后还针对肿瘤组织中的FBP1 表达特征,进行了敏感性药物预测,为临床化疗提供参考。
4 结论
本文对FBP1 进行了较全面的综合分析,探讨了FBP1 参与癌症进展的多个方面。从差异性表达、免疫浸润、基因变异到生存预后、生物学功能,我们发现了FBP1 表现高度一致的2 个癌症类型:KIRC 和LGG,FBP1 有望成为二者的特异性预后标志和治疗靶点。此外,我们还发现在KIRC 中存在miR-214-3p/FBP1 负向调控轴及miR-139-5p/FBP1、miR-1251-5p/FBP1 正向调控轴促进癌症的进展,靶向miR-214-3p、miR-139-5p 和miR-1251-5p 有望成为KIRC治疗的另一种选择。

