生物原料蛋白胨中重要成分的超高效液相色谱-串联质谱定量分析方法
田梦园 张进 国果 李博岩
1(贵州医科大学公共卫生与健康学院, 环境污染与疾病监控教育部重点实验室, 贵阳 550025)
2(贵州医科大学基础医学院, 贵阳 550025)
蛋白水解物(Protein hydrolysate)又称蛋白胨,是蛋白质经酸、碱和酶不完全水解而得到的水溶性混合物。蛋白胨按来源可分为植物源、动物源和微生物源。蛋白胨富含多种营养补充因子,因此被广泛用于食品、微生物培养和医药等领域[1]。尤其是以哺乳动物细胞表达的治疗性抗体和功能性蛋白为主的现代生物制药,越来越多地使用动物源蛋白胨,用于改善细胞生长特性和提高容积效率。蛋白胨的化学组成复杂,含有细胞生长所需要的多种氨基酸、肽、碳水化合物、维生素、微量元素和生长因子等物质[2],具有促进细胞增殖、抗凋亡、抗氧化和抗菌等生物活性[3],能够显著提高细胞的增长速度和降低细胞培养成本。其中,氨基酸、鸟嘌呤和腺嘌呤是供给细胞营养的核心成分,参与细胞呼吸、合成三磷酸腺苷,促进蛋白质、DNA 和RNA 合成[4],可作为蛋白胨质量评价的重要指标。然而,这些物质的稳定性以及含量易受温度、湿度、浓度和光照条件等因素影响[5],致使蛋白胨的生物性能与使用价值降低。因此,准确分析和表征蛋白胨样本中的化学成分是一个具有挑战性的难题。目前,蛋白胨的研究主要集中在制备方法[6]、含量测定[7-11]和细胞培养应用[1]等方面,有关贮存条件等影响其成分变化以及质量稳定性的关键因素的研究却鲜有报道。
荧光、拉曼和近红外光谱技术与化学计量学方法结合适用于大规模原材料的筛选与质量鉴定,可以实现样品的快速无损分析,是表征样品质量与批次变化的最常用方法[12],但难以满足蛋白胨溶液成分变化的解析要求。传统的高效液相色谱法测定氨基酸,通常需要衍生化处理,存在操作繁琐、破坏样本、成本昂贵、衍生产物易污染仪器以及重现性差等缺点。超高效液相色谱-串联质谱技术(UHPLCMS/MS)具有超高效液相色谱的快速分离与质谱的高分辨检测能力,对复杂基质样品进行分析具有显著优势[13]。
本研究利用UHPLC-MS/MS 技术,无需衍生化处理,直接测定蛋白胨样品溶液中16 种重要化合物的含量,建立了一种准确、高效分析蛋白胨的方法。通过考察不同贮存温度条件下多组分含量的变化,确定蛋白胨样品的适宜贮存和使用条件,为蛋白胨的质量评估和控制提供了参考。
1 实验部分
1.1 仪器与试剂
Qsight LX50 超高效液相色谱仪、Qsight 210 三重四极杆质谱仪(美国珀金埃尔默公司);120D 分析天平(日本岛津公司);ST8R 台式高速冷冻离心机(美国赛默飞公司);PHS-25 雷磁pH 计(上海仪电公司);Syncronis HILIC 色谱柱(100 mm×2.1 mm,1.7 μm,美国赛默飞公司);Accucore C18色谱柱(100 mm×2.1 mm,2.6 μm,美国赛默飞公司);Raptor Polar X 色谱柱(100 mm×2.1 mm,2.7 μm,美国RESTEK公司)。
蛋白胨(美国Merck 公司)。标准品:鸟嘌呤(Guanine)、腺嘌呤(Adenine) (HPLC 级,≥98%,南京草本源生物科技有限公司);脯氨酸(Pro) (HPLC 级,≥99%,美国Merck 公司);天冬氨酸(Asp)、丝氨酸(Ser)、谷氨酸(Glu)、精氨酸(Arg)、苏氨酸(Thr)、酪氨酸(Tyr)、缬氨酸(Val)、赖氨酸(Lys)、亮氨酸(Leu)、异亮氨酸(Ile)、苯丙氨酸(Phe)、色氨酸(Trp)和丙氨酸(Ala) (HPLC 级,≥98%),上海生工生物工程公司。甲酸(LC-MS 级,美国CNW 公司);乙酸铵(LC-MS 级,美国Merck 公司);乙腈(HPLC级,≥99.9%,美国Merck 公司)。蒸馏水(香港屈臣氏有限公司)。
1.2 实验方法
1.2.1 标准溶液制备
分别称取16 种标准物质各25.0 mg, 用0.10 mol/L HCl 溶解并定容至25 mL, 制备1.00 g/L 的标准储备液,于-20 ℃避光保存。
移取适量的各标准品溶液,混合后用1%甲酸-乙腈溶液稀释,制备一系列混合标准溶液,各物质的浓度分别为Trp:0.01、0.05、0.10、0.20、0.40、0.80、1.60、2.00 mg/L;Phe、Leu、Ile:0.01、0.05、0.10、0.50、1.00、5.00、10.00、15.00 mg/L;Tyr、Val: 0.10、0.50、1.00、2.00、5.00、8.00、10.00、15.00 mg/L;Pro: 0.05、0.10、0.50、1.00、1.50、2.00、2.50、5.00 mg/L;Ala: 0.50、1.00、2.00、3.00、4.00、6.00、8.00、10.00 mg/L;Thr、Ser、Arg、Lys、Glu、Asp: 0.20、0.50、1.00、2.00、4.00、6.00、8.00、10.00 mg/L;Adenine:0.005、0.01、0.05、0.10、0.20、0.30、0.40、0.50 mg/L;Guanine:0.01、0.05、0.10、0.20、0.40、0.60、0.80、1.00 mg/L。溶液现用现配。
1.2.2 样品溶液制备
称取1.60 g 样品,以超纯水溶解并定容至100 mL。取100 μL 溶液至2 mL 离心管中,加入900 μL 1%甲酸-乙腈溶液,4 ℃下以14000 r/min 离心5 min, 取上清液100 μL,与900 μL 90%乙腈混匀,过0.22 μm 滤膜后,待测。所有操作均在避光条件下完成。
1.2.3 不同贮存温度条件下的样品分析
取5 个不同贮存温度(-80、-40、-20、4 和25 ℃)下的贮存样品溶液,用UHPLC-MS/MS 方法分别于第0、2、4、6、8、15 和30 天分析样品溶液中的14 种氨基酸和腺嘌呤、鸟嘌呤的含量,并测量溶液的pH 值。各实验重复3 次。
1.2.4 液相色谱条件
RESTEK Raptor Polar X 色谱柱(100 mm × 2.1 mm, 2.7 μm);保护柱过滤器:Thermo Scientific™UHPLC filters(2.1 mm×0.2 μm,美国赛默飞公司);流动相A 为0.5%甲酸溶液,流动相B 为90%乙腈溶液(含有20.0 mmol/L 乙酸铵)。梯度洗脱:0~2.0 min,2% A;2.0~15.0 min,2%~15% A;15.0~20.0 min,15%~30% A;20.0~21.0 min,30%~12% A;21.0~23.0 min,12% A;23.0~25.0 min,12%~2% A;25.0~30.0 min,2% A。柱温:20 ℃;样品室温度:4 ℃;流速:0.30 mL/min;进样量:10 μL。
1.2.5 质谱条件
电喷雾离子源(ESI),正离子多反应监测模式(MRM);ESI 喷雾电压:5850 V;反吹干燥气流速:120 L/h;雾化器流速:220 L/h;热表面诱导去溶剂质谱接口温度:320 ℃;离子源温度:350 ℃。各目标物的质谱检测参数见表1。

表1 16种化合物的质谱检测参数与色谱保留时间信息Table 1 Mass spectrometric (MS) parameters and chromatographic retention time of 16 kinds of compounds
1.3 数据分析
使用MATLAB R2021b 软件(MATHWORKS)进行数据方差分析(ANOVA)、Tukey′s HSD 检验和主成分分析(PCA),以p<0.05 表示有显著性差异,具有统计学意义。数据一般以平均值±标准偏差表示。
2 结果与讨论
2.1 分析条件优化
2.1.1 色谱柱的选择
氨基酸多属于极性较强的化合物,通常采用亲水性色谱柱进行分离。本研究考察了Thermo Syncronis HILIC (100 mm × 2.1 mm,1.7 μm)、Accucore C18(100 mm × 2.1 mm,2.6 μm)和RESTEK Raptor Polar X(100 mm×2.1 mm,2.7 μm)3 种色谱柱对氨基酸的分离性能(见电子版文后支持信息图S1)。在相同的色谱洗脱条件下分离16 种混合标准溶液,RESTEK Raptor Polar X 柱的分离效果最好(图1A);HILIC 柱的粒径较小、平衡时间长、柱压高,并且分离度不及Raptor 柱;C18柱分离效果最差。上述结果说明,传统的反相色谱柱不适合分离未衍生的氨基酸物质,因此,本研究选择Raptor 色谱柱。

图1 (A)16 种标准品混合物与(B)样品溶液中16 种化合物的定量离子流图Fig.1 Quantitative production ion chromatograms of (A) 16 kinds of standards mixture and (B) 16 kinds of compounds in hydrolysate solution
2.1.2 流动相的优化
以乙腈和水为基础流动相,系统研究了甲酸和乙酸铵作为调节剂对目标化合物的色谱峰形和分离效果的影响。当水相中加入0.1%甲酸时,多数化合物的色谱峰响应低、分离度差;随着甲酸浓度增加,目标化合物的峰形与强度都有所改善;当甲酸浓度为0.5%、pH=2.25 时,色谱峰形与响应都较好(见电子版文后支持信息图S2)。在乙腈流动相中添加20.0 mmol/L 乙酸铵且pH=5.20 时,各化合物能得到很好分离与准确定量(图1A,电子版文后支持信息图S3)。
2.1.3 质谱条件的优化
通常,氨基酸为两性化合物,在正离子模式下的响应更强。采用质谱多反应监测(MRM)模式,优化驻留时间等参数有效分离和检测氨基酸、鸟嘌呤和腺嘌呤等(表1)。在优化的色谱质谱条件下所得的蛋白胨样品溶液中16 种目标化合物的定量离子流图见图1B,16 种化合物的色谱峰形较好、分离度高。
2.2 方法学验证
2.2.1 方法的线性关系、检出限和定量限
测定标准物质混合溶液,计算各物质浓度(x)与其在特定离子峰下的色谱峰面积(y),拟合数据得到16 种物质的线性回归方程和线性相关系数(R2),结果见表2,16 种化合物在各自质量浓度范围内线性关系良好,R2均大于0.99。

表2 16种化合物的线性范围、回归方程、线性相关系数(R2)、检出限(LOD)和定量限(LOQ)Table 2 Linear ranges, regression equations, determination coefficients, limits of detection (LODs) and limits of quantification(LOQs) of 16 kinds of compounds
采用逐步稀释低浓度标准溶液的方式,选取各物质色谱峰附近基线为参照,计算信噪比(S/N),以S/N≥3 且符合定性要求的物质的最低浓度为检出限(LOD),以S/N≥10 且满足精密度和准确度要求的物质的最低浓度为定量限(LOQ),计算各化合物的检出限与定量限(表2)。与文献[13]的分析方法相比,本研究提出的UHPLC-MS/MS 方法定量分析蛋白胨溶液中16 种化合物具有更低的检出限和定量限。
2.2.2 精密度、重复性和稳定性
取适量混合标准品溶液,连续测定6 次,计算各物质色谱峰面积的相对标准偏差(RSD),RSD 在1.08%~2.16%之间(电子版文后支持信息表S1),表明仪器精密度较好。与文献[13]的分析方法相比,本研究提出的UHPLC-MS/MS 方法定量分析蛋白胨溶液中16 种化合物更准确,精密度更优。
准确称取蛋白胨粉末样本1.60 g,共6 份,分别制备溶液并测定其中的16 种目标物质对应的色谱峰面积。16 种物质含量的RSD 在1.40%~4.94%范围内(电子版文后支持信息表S1),表明本方法的重复性较好。
取同一批次蛋白胨样本,制备成溶液后,分别在0、6、12、18 和24 h 进行UHPLC-MS/MS 检测分析。结果表明,16 种目标物质的色谱峰面积的RSD 在0.75%~4.68%之间(电子版文后支持信息表S1),样品溶液在24 h 内具有较好的稳定性。
2.2.3 加标回收率
称取蛋白胨粉末1.60 g,共9 份,每3 份为1 组,分别加入3 个水平的混合标准品溶液适量,测定样品溶液各目标物质对应的色谱峰面积,计算含量和加标回收率(电子版文后支持信息表S2)。结果表明,16 种物质的平均加标回收率在91.7%~106.7%之间,相对标准偏差≤5.63%(n= 3)。
2.3 贮存温度对样品组成的影响
考察了不同贮存温度(-80、-40、-20、4 和25 ℃)下的蛋白胨样品溶液pH 值随贮存时间的变化关系。如图2 所示,当贮存温度为-80、-40 和-20 ℃时,贮存30 d 后,样品溶液的pH 值稳定,对应的均值与标准偏差分别为(7.024±0.024)、(7.022±0.020)和(7.022±0.018)。当贮存温度为25 ℃时,样品溶液的pH 值从最初(0 d)的(7.003±0.006)迅速降至第2 天的(6.413±0.035),然后逐渐上升,直至第30 天达到(8.350±0.010),与冷冻温度条件下相比,pH 值增加了1.35。这主要因为样品溶液中含量较高的葡萄糖在较高温度下易被微生物消耗,由糖酵解反应生成的酸性物质导致溶液pH 值下降[14],随着贮存时间延长,微生物在内源酶的作用下分解蛋白质而产生氨及胺类等碱性含氮物质,如氨、甲胺、二甲胺和三甲胺等其它类似化合物,使pH 值逐渐增大[15]。当贮存温度为4 ℃时,第8 天时样品溶液的pH 值达到最小(6.73±0.015),之后逐渐增加,第30 天的pH 值达到7.800±0.020。这说明较低温度(如4 ℃)在一定程度上抑制了样本溶液的生物活性,但在较长贮存时间内,样本组分仍然发生本质性改变。

图2 蛋白胨样品溶液在不同贮存温度下pH 值随贮存时间的变化图Fig.2 pH value changes of hydrolysate solution over storage time at different temperatures
-80、-40 和-20 ℃冷冻温度条件下贮存30 d 后的蛋白胨样品溶液依然澄清,还保持有蛋白胨新鲜溶液固有的淡黄色,感官性状未见明显变化。4 和25 ℃条件下,随着贮存时间延长,溶液颜色变深,浑浊度增加,并产生少量沉淀,带有明显的蛋白质变质气味。铁介导的色氨酸氧化可能是样本溶液颜色变深的一个重要原因[16]。另外,溶液中存在的铜绿假单胞菌(Pseudomonas aeruginosa)适宜在25 ℃生长,产生的水溶性色素而使样本溶液颜色变深、偏红。含硫氨基酸在变质过程中产生硫化物,通过自由基反应形成硫化氢,使其具有异味[17]。产生沉淀的原因可能是受到氨基酸电荷和溶解度的综合影响,与溶液的pH 值、贮存温度及样本浓度相关[18]。
上述结果表明,不同贮藏温度下的样品溶液的pH 值、感官性状(电子版文后支持信息图S4)以及各物质的含量明显变化的时间点基本一致。
2.4 样品成分含量变化
2.4.1 方差分析
对不同温度条件下各贮存时间点的样本溶液进行UHPLC-MS/MS 检测,分析关键成分的含量变化(电子版文后支持信息表S3~S5,表3 和表4)。单因素方差分析结果显示,贮存温度为-80、-40 和-20 ℃时,不同时间点的各物质含量无统计学意义上的差异(p>0.05),表明蛋白胨样品在冷冻条件下贮存,30 d 内化学成分与样本质量均相对稳定,基本不会影响样本的生物性能和使用情况。

表3 4 ℃条件贮存的蛋白胨中各物质含量(mg/L)的方差分析结果Table 3 Analysis of variance (ANOVA) result of the compositional content (mg/L) in hydrolysate solution stored at 4 ℃

表4 25 ℃条件下贮存的蛋白胨中各物质含量(mg/L)的方差分析结果Table 4 ANOVA result of the compositional content (mg/L) in hydrolysate solution stored at 25 ℃
贮存温度为4 和25 ℃时,缬氨酸和赖氨酸的含量呈现轻微上升趋势(p<0.05),脯氨酸含量基本不变,不受贮存时间影响(p>0.05)。其它物质得含量随着贮存时间延长而显著降低(p<0.05)。单因素方差分析结果表明,4 和25 ℃条件下样品中物质含量与不同贮存时间之间存在显著性差异(p<0.05)。采用图基检验(Tukey′s post hoc test)分析样品溶液在7 个贮存时间点(0~30 d)检测所得各物质的含量,结果见表3 和表4,表中相同行内不相同的小写字母标记表示各化合物在不同贮存时间点之间的差异显著(p<0.05)。
贮存温度为4 ℃时,与初始含量(第0 天)相比,除脯氨酸之外的15 种物质含量发生显著性变化(p<0.05)的时间均为第8 天。含量呈下降趋势的13 种物质在第8 天的相对含量降低了3.75%~52.00%,在第30 天降低了11.14%~71.56%。其中,天冬氨酸含量(2.25 mg/L, 第0 天)的降低幅度最大,分别为52.00%(第8 天)和71.56%(第30 天)。可能的原因是天冬氨酸是一种酸性α-氨基酸,在转氨酶作用下易分解为其它物质或转化成赖氨酸等。其它物质含量的降低幅度为:谷氨酸(33.33%~58.56%)>腺嘌呤(20.00%~60.00%)>苏氨酸(19.49%~48.01%)>丝氨酸(18.26%~35.68%)>鸟嘌呤(18.18%~40.91%)>酪氨酸(14.97%~29.94%) >异亮氨酸(11.92%~36.27%) >苯丙氨酸(10.34%~24.14%) >丙氨酸(9.46%~37.16%)>精氨酸(7.91%~18.24%)>色氨酸(7.69%~15.38%)。样本中谷氨酸的含量较高(3.33 mg/L@day 0)。游离的谷氨酸是一种微酸性氨基酸,参与溶液中微生物的许多代谢或化学反应而易被消耗,因此其含量随贮存时间增长(>8 d)迅速降低。腺嘌呤,即维生素B4,为辅酶和核酸的组成成分,是样品释放能量的关键,可能因为参与糖、蛋白质等的代谢,其含量在贮存8 d 后显著减少。溶液中的苏氨酸可在生物酶(如脱水酶、苏氨酸脱酶、醛缩酶)的作用下转变为其它的氨基酸物质,致使含量降低。丝氨酸是中性脂肪族含羟基氨基酸,可以异生为糖类物质,参与代谢或供能,或在脱水酶催化下脱水脱氨生成丙酮酸而被消耗,导致含量降低。亮氨酸含量随贮存时间延长而下降的幅度最小,分别减少了3.75%(第8 天)和11.14%(第30 天)。亮氨酸与异亮氨酸都是支链氨基酸,能够分解转化为葡萄糖而被消耗,其含量在贮存8 d 后也明显降低。
蛋白胨样本中富含赖氨酸(5.68 mg/L,第0 天),其含量在贮存第8 天时增加到6.21 mg/L,增加幅度为9.33%;在第30 天达到7.02 mg/L,增加幅度为23.59%。赖氨酸为碱性生酮氨基酸,在样品溶液中一般不参与转氨基作用。赖氨酸的增加可能源于天冬氨酸经过反应在还原酶和脱氢酶作用下生成α-氨基乙二酸。蛋白胨富含蛋白质,发酵水解后也产生赖氨酸。蛋白胨是水解产物,4 ℃时为微生物杆菌(如谷氨酸棒状杆菌和乳糖发酵短杆菌)发酵提供了可行条件。缬氨酸含量在第8 天和第30 天分别提高了5.99%和32.97%。微生物发酵法是一种常见且经济的L-型缬氨酸生产方法,4 ℃长期贮存条件致使样本溶液易发酵,缬氨酸含量增加。
与4 ℃的贮存温度相比,25 ℃更温和、更适合蛋白胨样本中微生物发酵与化学反应,因此溶液组分份变质更快、时间更短。异亮氨酸和丙氨酸的含量在第4 天发生显著性变化(p<0.05),分别降低了11.46%和17.43%。缬氨酸的含量在第6 天增加了32.41%(p<0.05)。11 种化合物的含量在第2 天发生了显著性减少(p<0.05):腺嘌呤(40.00%)、谷氨酸(25.83%)、天冬氨酸(23.29%)、鸟嘌呤(18.60%)、丝氨酸(16.67%)、酪氨酸(16.05%)、苯丙氨酸(15.69%)、苏氨酸(7.91%)、精氨酸(7.80%)、色氨酸(5.13%)、亮氨酸(2.11%)。赖氨酸含量在第2 天显著性增加了6.11%(p<0.05)。贮存30 d 时,这些物质含量降低的最小幅度达15.02%(亮氨酸),最大幅度为82.19%(天冬氨酸),腺嘌呤的降解率高达80.00%。缬氨酸和赖氨酸含量在30 d 内分别上升了44.32%和26.70%。总之,4 和25 ℃两种温度条件下天冬氨酸和腺嘌呤的降解率最高。这些结果表明贮存温度是影响蛋白胨化学组成与质量稳定性的重要因素。其中,-80 ℃适合蛋白胨样本长期保存,-20 ℃条件下至少可以贮存1 个月,2~4 ℃冷藏7 d 后样本会变质,25 ℃的室温下样本存放1~2 d 就会变质。
图3 为5 个温度条件下,不同贮存时间点蛋白胨中各目标化合物含量变化热图,显示了15 种物质含量的显著性差异动态变化(n=3)。在非冷冻贮存过程中,蛋白胨的物质含量变化是一个复杂过程。微生物在适宜的温度条件下迅速繁殖,同时消耗其中的营养成分导致样品变质,这是造成样品组成物质含量随贮存时间变化的主要原因。25 ℃更利于多数微生物的生长,分解消耗营养物质的速率更快。多数氨基酸以及腺嘌呤和鸟嘌呤在微生物的脱氨基作用下发生降解,如氨基酸脱氨生成α-酮酸和氨[19],丝氨酸和苏氨酸可在脱水酶催化下脱水脱氨,生成酮酸和氨。脱氨基作用产生的氨不断积累,对细胞培养有抑制和毒性作用,因而影响蛋白胨的生物性能。脱羧基作用也是氨基酸分解的途径之一。在氨基酸脱羧酶的作用下脱羧生成二氧化碳和胺类化合物,如酪氨酸和色氨酸(以及组氨酸)分别转化为酪胺和色胺(及组胺)[20]。乳酸菌、微球菌和葡萄球菌等微生物含有蛋白酶、脂肪酶和氨基酸脱羧酶,可促进蛋白质分解为氨基酸[21],这可能是导致一些氨基酸含量增加的原因之一。
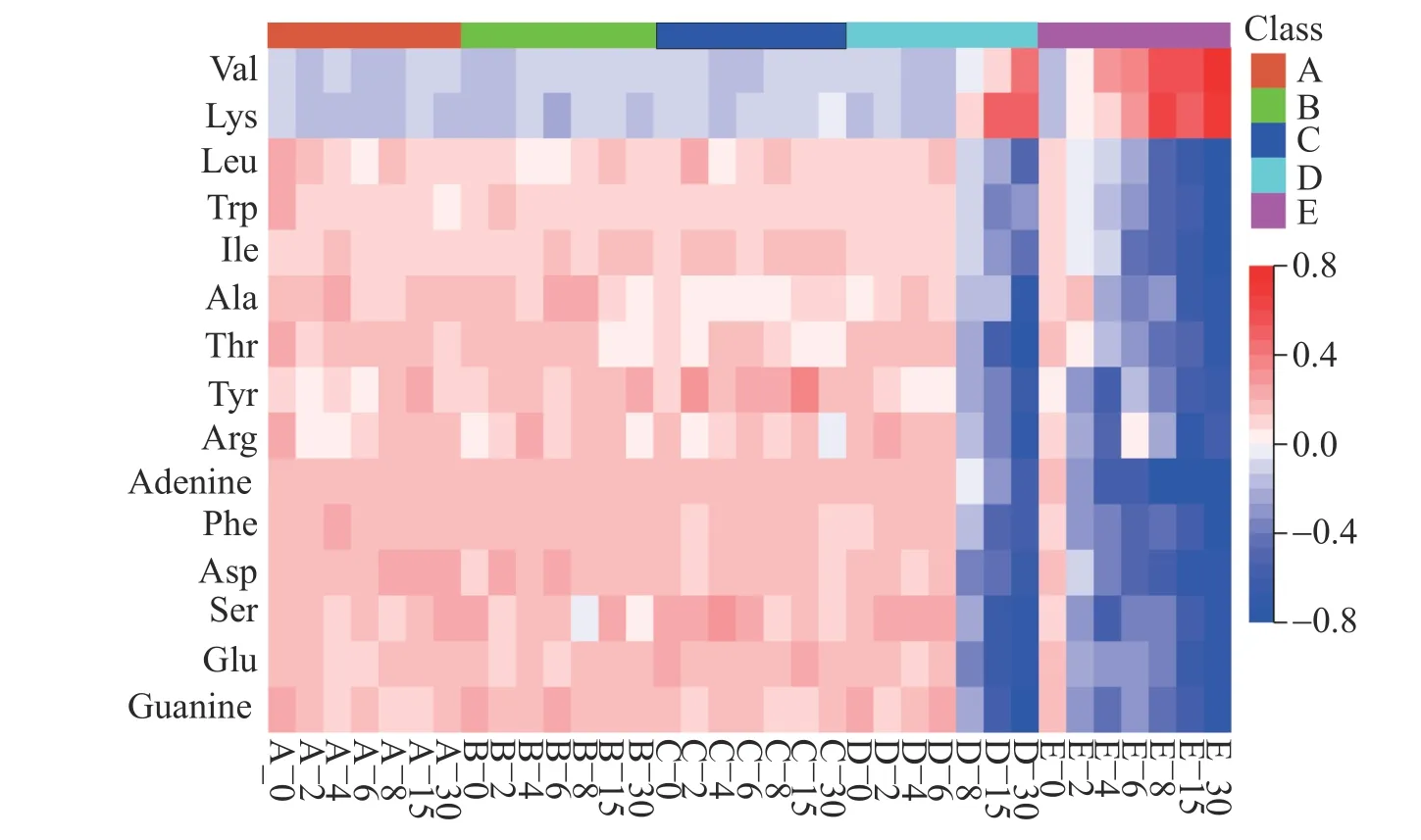
图3 5 个不同贮存温度条件下不同时间点的蛋白胨溶液中各物质含量动态变化图: (A) -80 ℃;(B)-40 ℃;(C)-20 ℃;(D)4 ℃;(E)25 ℃Fig.3 Heatmap of temporal changes of content of 15 kinds of compositions in hydrolysate solution over storage time at five temperatures: (A) -80 ℃; (B) -40 ℃; (C) -20 ℃; (D) 4 ℃; (E) 25 ℃
此外,样品中的氨基酸与其含有的金属离子、糖类和维生素等发生反应,如氨基酸与还原糖的非酶促Maillard 反应也可能导致氨基酸含量显著下降。25 ℃条件下,随pH 值升高,可能发生的Maillard 反应强度增大[22]。多数水溶性维生素也是辅酶或辅基的主要成分,在细胞培养过程中发挥重要作用,如维生素B6 参与氨基酸代谢,提供重要的转氨酶及脱羧酶的辅酶,促进氨基酸的降解[23]。
2.4.2 主成分分析
主成分分析(Principal component analysis,PCA)是一种常用的多元统计方法,用于无监督模式下提取数据特征。针对4 和25 ℃贮存条件下样品在不同贮存时间所测得的16 种物质含量,经过归一化和中心化方法处理3 次重复实验数据后,进行PCA。3 个主成分解释了4 ℃条件下的样本物质含量数据的99.06%的方差。图4 给出了第1 个主成分(PC1)对第2 个主成分(PC2)的主成分得分图。显然,从第0 天至第6 天,16 种物质的含量变化不显著,对应的主成分得分值相近,分布在95%的置信区域内(即椭圆形区域);然而在第8 天、第15 天和第30 天时含量发生明显变化,对应的得分值差异较大。3 次实验的重复性较好。
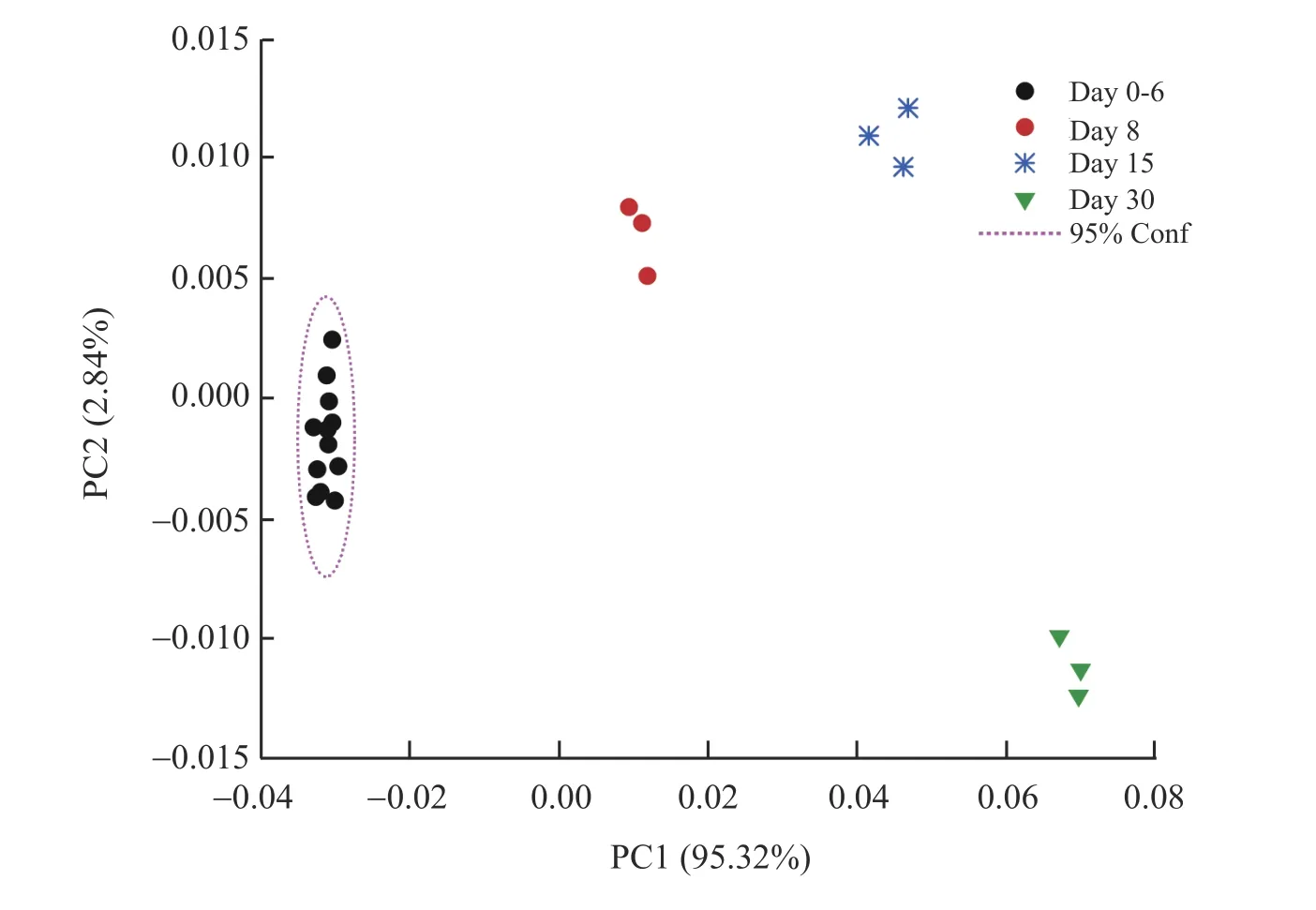
图4 4 ℃条件下贮存30 d 后样品溶液中16 种物质含量的主成分分析得分图Fig.4 Principal component analysis(PCA)score plot of the content of 16 kinds of compositions in hydrolysate solution during a period of 30 days stored at 4 ℃
25 ℃条件下样品溶液的物质浓度变化迅速。为更细致监测样品变化的时间节点,实验增加了6、12、18 和24 h 这4 个时间点的物质含量数据。PCA 模型的3 个主成分解释了98.26%的数据方差。得分图(图5)显示在1 d 内的贮存时间点样品含量变化不显著(p<0.05),从第2 天至第30 天的每个贮存时段的样品组成含量均发生明显改变,并且彼此显著不同。PCA 结果进一步说明样本在25 ℃条件下存放1~2 d,其生物性能就发生改变,不可再使用。
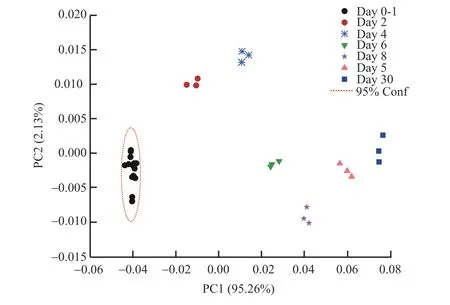
图5 25 ℃条件下贮存30 d 后样品溶液中16 种物质含量的主成分分析得分图Fig.5 PCA score plot of the content of 16 kinds of compositions in hydrolysate solution during a period of 30 d stored at 25 ℃
3 结论
通过优化UHPLC-MS/MS 实验参数,建立了蛋白胨溶液中氨基酸、鸟嘌呤和腺嘌呤等16 个重要成分的定量分析方法,本方法具有良好的准确性与精确性。贮存温度是引起蛋白胨成分含量变化的重要因素。结果表明,样品在-20 ℃以下冷冻温度保存30 d 质量稳定;样品不宜在4 和25 ℃条件下储藏,多数化合物易发生降解反应。不同贮藏温度下的样品溶液的pH 值、感官性状以及各物质的含量明显变化的时间点基本一致。因此,可以通过测定样本溶液的pH 值与感官性状变化,大致判断蛋白胨的质量状态,为合理使用蛋白胨提供了参考。

