液体培养甘薯组培苗对培养基分装量和接种茎段的优化
赵元增,王永刚,窦莹霞,孙海燕
(河南科技学院生命科技学院,河南 新乡 453003)
利用组培技术培育甘薯脱毒苗并进行规模化扩繁,仍是国内外防治甘薯病毒病、提高甘薯产量与品质的最有效方法[1-3].目前,虽然甘薯脱毒苗繁育技术体系已经趋于成熟,但生产成本高、快繁效率低仍然是制约组培苗工厂化生产的瓶颈,这不仅影响甘薯脱毒苗原种的生产与供应,也直接影响了种苗的价格、用户的经济承受能力、脱毒苗的普及程度和生产单位的经济效益[4].因此,以降本增效为目的,不断优化培养条件,持续改进培养方法,提高组培苗快繁效率,仍是建立成熟高效的甘薯脱毒苗繁育技术体系的重要任务[5-7].
脱毒苗组培一般采用琼脂固化的培养基,琼脂通常占培养基成本的50%以上,且配制时需要熬煮,接种时需要扦插,移栽时需要洗净培养基,费电、费工、费时[8].为规避应用琼脂粉带来的高成本,许多研究运用相对廉价的替代物,如用卡拉胶[9-10]、魔芋粉[11]来代替琼脂,或采用一些疏松多孔的材料,如蛭石[12]、珍珠岩[13]、滤纸桥[14]、脱脂棉[15]、沙土[16]等作为支撑物用于组培.以上方法不仅操作繁琐、降本幅度有限,且培养效果不一,难以在组培苗的工厂化生产中广泛应用.去除培养基中的琼脂,直接采用液体培养,可最大限度地降低培养基的固化成本[17].有研究表明,采用液体培养快繁甘薯、马铃薯、甘蔗等的脱毒苗的效果优于固体培养及以脱脂棉等作为支撑物的两相培养[4,18,19].但是,采用液体培养时,由于外植体长期浸泡于培养液,会因通气不良而导致成苗率降低,这在甘薯、马铃薯等植物的组培快繁中均有报道[20,21].另外,也有研究认为,液体培养虽有利于组培苗根的形成与生长,但组培苗一般低矮、整齐度差、繁殖系数低,且容易污染[15].为解决组培苗液体培养中存在的问题,本文从培养基分装量、接种茎段长度与形态等方面,对甘薯脱毒苗液体培养快繁技术进行了优化,以期为完善甘薯脱毒苗快繁技术体系、降低生产成本提供参考.
1 材料与方法
1.1 供试材料
甘薯品种龙薯9 号、洛薯13 号的脱毒组培苗.
1.2 试验设计
1.2.1 接种茎段长度与形态试验采用液体培养,扩繁培养基的组成为MS+IBA(0.1 mg/L)+蔗糖(30 g/L),使用容积为300 mL 的玻璃广口瓶盛装,分装量为30 mL/瓶.
选取生长茁壮、叶片与叶柄无黄枯、节间长度尽可能一致的甘薯组培苗,依据截取茎段的长短、保留叶柄(叶片)与否的不同,将组培苗茎节截成不同长度与形态的茎段,设置a~f 六个处理,不同处理的接种茎段长度与茎段形态如表1 所示.将截好的茎段极性向上或平放,分散接种于液体浅层.拿取培养瓶时要轻拿轻放,尽量避免接种的茎段聚集到一起.每一处理接种15 瓶,每瓶6 个茎段.

表1 不同处理的接种茎段长度与茎段形态Tab.1 The length and shape of stem segments used in different treatments
1.2.2 培养方式与培养基分装量试验采用固体培养、液体培养、玻璃棉(硅酸铝棉)作支撑物的三种液体培养方式,扩繁培养基的组成均为MS+IBA(0.1 mg/L)+蔗糖(30 g/L).根据培养方式与培养基分装量的不同,设置A~E 五个处理,不同处理的培养方式与培养基分装量如表2 所示.固体培养是在培养基中加入6 g/L 的琼脂粉加以固化,玻璃棉作支撑物的液体培养是将厚度为1.0 cm 的玻璃棉铺到培养瓶底,再加入液体培养基,使培养基液面刚好触及玻璃棉上表面.培养瓶均采用容积为300 mL 的玻璃广口瓶.

表2 不同处理的培养方式与培养基分装量Tab.2 The culture methods and medium volume of different treatments
选用长势良好、培养周期一致的甘薯试管苗,将茎节截成1.5~2.0 cm 长且带有半截叶柄的茎段(同上处理b).接种固体培养基时,将茎段斜插于培养基,保持茎段的节处外露;液体培养的茎段接种方法同上;玻璃棉支撑培养的接种是将茎段平放或斜插到玻璃棉表面.每一处理接种15 瓶,每瓶6 个茎段.
1.3 培养条件
培养温度25±1 ℃,光照强度2 000~3 000 lx,光照时间12 h/d.
1.4 数据统计
离体培养结束时,调查各处理的成苗率、单瓶成苗数、大多数组培苗的株高、较高植株的株高、单瓶黄枯叶片数、根系生长状况等结果.之后,将组培苗截成1.5~2.0 cm 长的茎段,统计每一处理所截取的茎段总数,据此计算增殖系数,增殖系数=每一处理培养结束后截取的茎段总数(段)/接种的茎段总数(段).最后,采用SPSS20.0 进行数据处理与单因素方差分析.
2 结果与分析
2.1 接种茎段长度与形态对甘薯组培苗生长的影响
经过30 d 的培养,龙薯9 号不同类型的接种茎段对甘薯组培苗生长的影响见表3,各处理的组培苗培养30 d 的生长差异如图1 所示.

图1 龙薯9 号a-f 处理的组培苗培养30 d 时的生长差异Fig.1 Growth difference of tissue culture plantlets of sweet potato cultivar Longshu 9 among different treatments cultured for 30 days
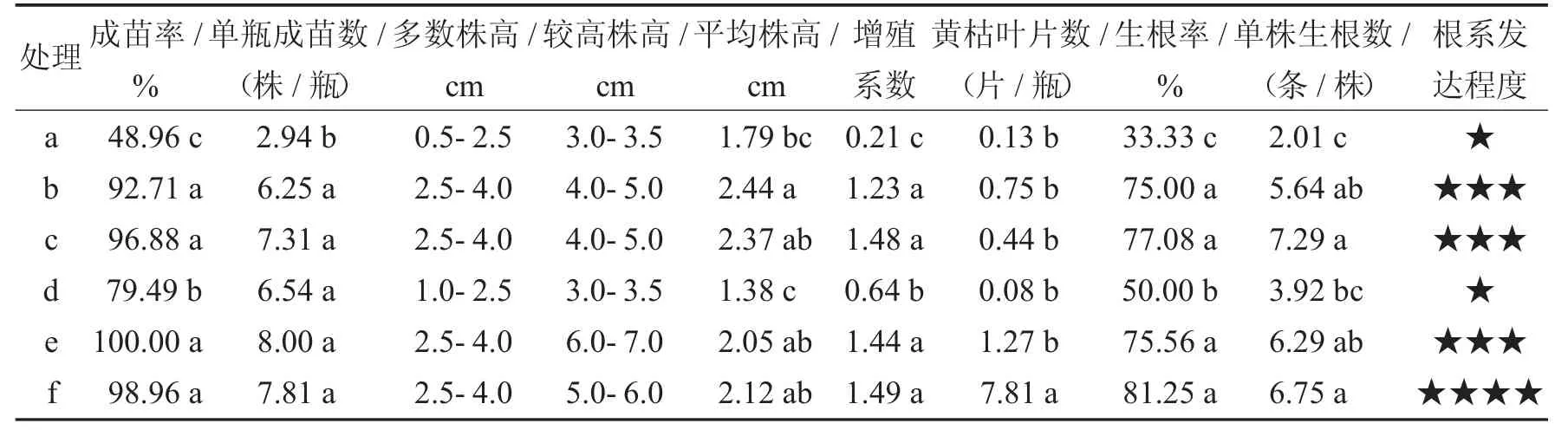
表3 不同类型的接种茎段对甘薯组培苗生长的影响Tab.3 Effects of different inoculated stem segments on the growth of tissue culture plantlets of sweet potato
由表3、图1 可以看出,当接种茎段仅保留半截叶柄时,茎段的长短对组培苗的成苗与生长有显著影响.茎段长度最短的a 处理,多数接种的茎段膨胀未萌发,成苗率仅有48.96%,生根率和单瓶成苗数也在所有处理中最低.随着接种茎段长度的增加,组培苗整体生长状况趋优:植株生长茁壮,株高明显增高,茎段的成苗率、单瓶成苗数、增殖系数、生根率和单株生根数均呈增加趋势.不过,处理b 和处理c 的成苗数、组培苗株高、增殖系数及根系生长状况等性状指标表现,在两种处理间并无显著差异.这表明,在仅保留半截叶柄的情况下,接种茎段长度为1.5~2.0 cm 或2.5~3.5 cm 都是适宜的,但从提高繁殖效率而言,接种的茎段长度保持在1.5~2.0 cm 更适宜.
由表3 和图1 可以看出,当茎段长度保持1.5~2.0 cm 不变,叶柄、叶片的保留与否对茎段的成苗和组培苗的生长也有显著影响.将叶柄与叶片全部去除的d 处理,形成的组培苗低矮,多数株高在1.0~2.5 cm之间,最高株高也仅有3.0~3.5 cm,其成苗率、平均株高、增殖系数、生根率均显著低于保留半截叶柄的b处理和保留全长叶柄的e 处理,也显著低于保留全部叶柄与叶片的f 处理.对于b、e 与f 处理,茎段的成苗率、生根率及组培苗的长势并无显著差异,不同之处仅表现在:f 处理产生的黄枯叶片数显著增多,根系较其他处理更发达.
综上可知,接种茎段的长度与形态对茎段的成苗、组培苗的生长都有显著影响,接种茎段的长度过短或切除茎段上的全部叶柄和叶片,都导致接种茎段成苗率、生根率显著降低,组培苗的生长变差.在保持接种茎段长度1.5~2.0 cm 的条件下,保留半截叶柄、全长叶柄和保留完整叶柄叶片的处理方法,均有利于茎段的成苗和组培苗的茁壮生长,且三种处理方式对茎段成苗和组培苗生长的影响并无显著差异.从提高接种效率考虑,刻意保留全长叶柄或完整叶柄、叶片的茎段截取方法,需要小心仔细的操作,费工费时,使茎段的截取与接种效率降低,不宜采用;而随意截断叶柄仅保留半截叶柄的茎段截取方法,简便快捷,可大幅提高茎段截取与接种的效率.综合考虑,当以液体培养方式扩繁甘薯组培苗时,接种茎段的长度保持在1.5~2.0 cm 且保留半截叶柄是最适宜的.
2.2 培养方式与培养基分装量对甘薯组培苗生长的影响
2.2.1 培养方式与培养基分装量对龙薯9 号组培苗生长的影响经过50 d 的培养,绝大多数接种茎段均已萌发成苗,组培苗形成的根呈青绿色,相互缠绕分布于培养瓶底,形成发达的根系网络,各处理之间无明显差异.龙薯9 号A~E 处理的组培苗培养50 d 的生长情况见表4,A~E 处理间的组培苗生长差异如图2 所示.
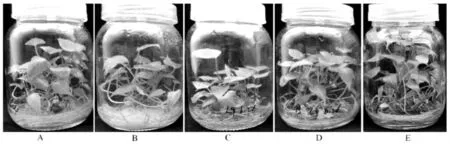
图2 龙薯9 号A~E 处理的组培苗培养50 d 时的生长差异Fig.2 Growth difference of tissue culture plantlets of sweet potato cultivar Longshu 9 among different treatments cultured for 50 days
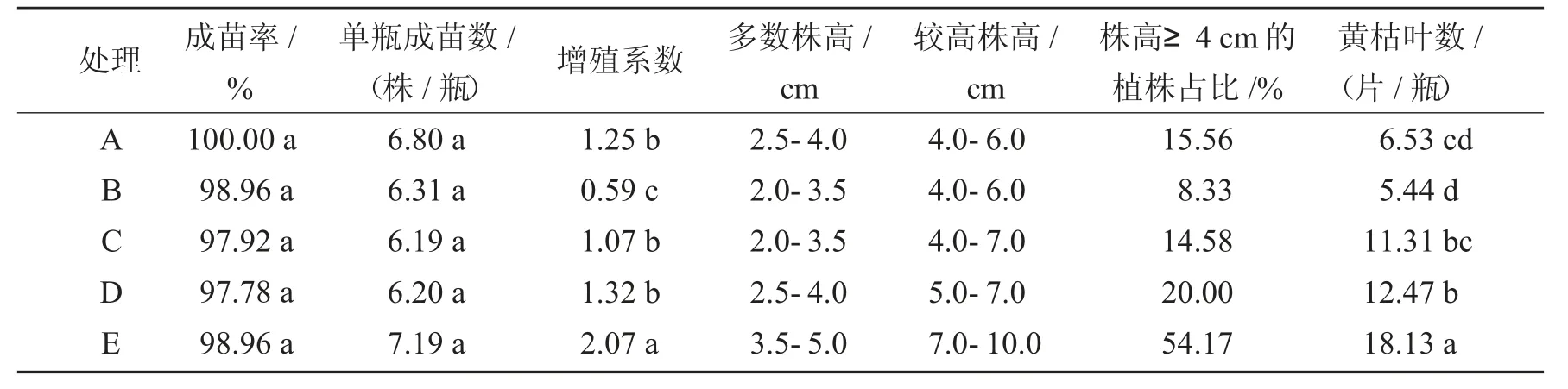
表4 龙薯9 号A~E 处理的组培苗培养50 d 时的生长情况Tab.4 Growth of tissue culture plantlets of sweet potato cultivar Longshu 9 of different treatments after 50 days of culture
由表4、图2 可以看出,各处理97%以上的接种茎段都能萌发成苗,成苗率和单瓶成苗数在处理之间无显著差异,但不同处理之间的组培苗长势却存在显著差异.在所有处理中,E 处理的组培苗长势最佳,多数植株的株高在3.5~5.0 cm,较高株可达7.0~10 cm,株高4.0 cm 以上的植株占比达到54.17%,远高于其他处理.当培养基分装量同为30 mL 时,与E 处理相比,固体培养的A 处理和以玻璃棉作支撑物的B 处理,大多数植株相对低矮,多数株高在2.0~4.0 cm,最高株也仅有4.0~6.0 cm,株高4.0 cm 以上的植株占比很低.A 处理的增殖系数显著高于B 处理,两者都显著低于E 处理.由此可知,相较于固体培养和玻璃棉支撑培养,液体培养更适合甘薯组培苗的生长与快繁.
由表4、图2 还可以看出,同为液体培养,不同培养基分装量对组培苗的长势也有显著影响.与E 处理相比,C、D 处理的组培苗长势明显变差,D 处理的多数植株株高在2.5~4.0 cm,C 处理的组培苗更低矮,多数株高仅有2.0~3.5 cm.D 处理的增殖系数大于C 处理,但差异不显著,两者的增殖系数均显著低于E处理.因此,当采用液体培养扩繁甘薯组培苗时,液体培养基的分装量以30 mL/瓶为宜.
综上可知,不同培养方式与培养基分装量显著影响龙薯9 号组培苗的生长,采用液体培养基且分装量为30 mL/瓶的培养方式,最有利于甘薯组培苗的生长与扩繁.
2.2.2 培养方式与培养基分装量对洛薯13 号组培苗生长的影响洛薯13 号A~E 处理的组培苗培养50 d时的生长情况见表5,各处理间的组培苗生长差异如图3 所示.
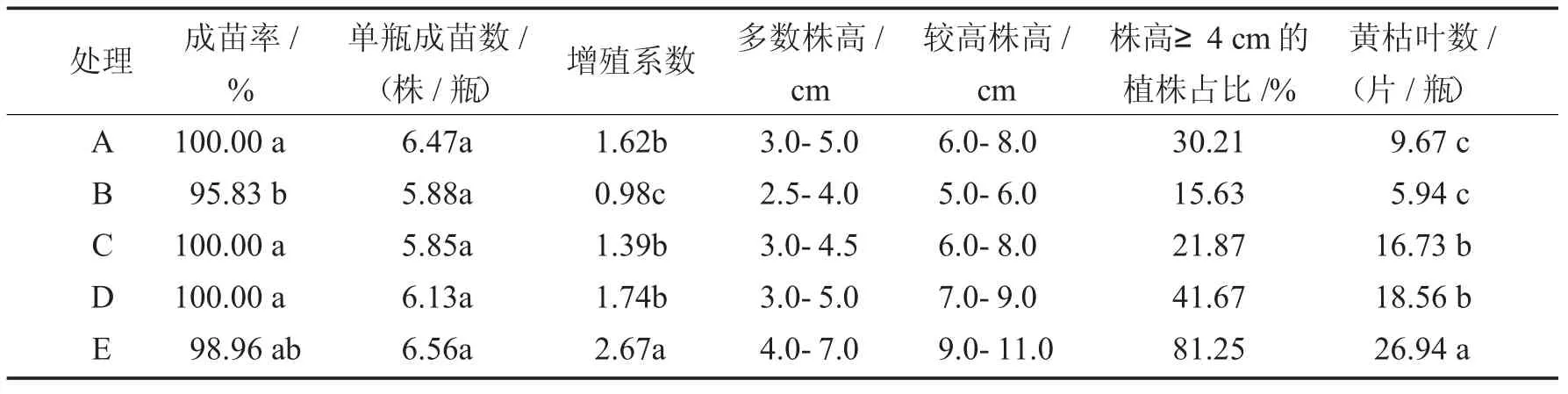
表5 洛薯13 号A~E 处理的组培苗培养50 d 时的生长情况Tab.5 Growth of tissue culture plantlets of sweet potato cultivar Luoshu 13 among different treatments after 50 days of culture
由表5、图3 可以看出,除单瓶成苗数在处理之间不存在显著差异外,龙薯13 号组培苗的成苗率、增殖系数等性状在处理之间差异显著.对于培养基分装量相同而培养方式不同的A、B、E 处理,组培苗整体长势由优到差依次表现为E 处理>A 处理>B 处理.液体培养的E 处理的组培苗生长状况表现最优,大多数植株生长茁壮,株高达到4.0~7.0 cm,株高超过4 cm 的植株占比高达81.25%,远高于其他处理.以玻璃棉作为支撑物培养的B 处理,组培苗生长状况表现最差,不仅成苗率、增殖系数显著低于其他处理,且植株低矮,多数植株的株高在2.5~4.0 cm,较高的植株株高也仅有5.0~6.0 cm,株高超过4.0 cm 的植株占比远低于A、E 处理.因此,相较于固体培养和玻璃棉支撑培养,液体培养更适合洛薯13 号组培苗的快繁培养.由表5、图3 还可以看出,同为液体培养的C、D、E 处理,随着培养基分装量的增加,组培苗增殖系数升高,株高增加,较高植株的占比增大,植株整体长势趋优.当培养基分装量为30 mL 时,组培苗的生长状况达到最优,增殖系数也达到最大,并显著高于C、D 处理.
综上可知,不同培养方式与培养基分装量显著影响洛薯13 组培苗的生长和快繁,并且洛薯13 号组培苗在各处理中的性状差异特征及其表现规律与龙薯9 号在各处理中的表现呈现一致性.总之,洛薯13 号组培苗最适宜的扩繁方式,同龙薯9 号一样,采用液体培养基且培养基分装量为30mL/瓶是最佳选择.
3 讨论与结论
培养基的形态(固体还是液体)影响组培苗的生长与增殖,在保证组培苗质量与快繁效率的前提下,扩繁组培苗优选液体培养方式.本研究表明:在甘薯脱毒苗的快繁培养中,液体培养的组培苗生长更茁壮,其株高、增殖系数等均优于同等条件下的固体培养和玻璃棉支撑培养,这与闫明明等的研究结果一致[4].植物组培一般采用固体培养,这主要得益于固体培养便于操作和保存,且培养材料位置固定,便于跟踪观察.但从有利于培养物的生长发育出发,固体培养由于培养材料与培养基接触面有限,养分的吸收受限,同等条件下的固体培养效果一般低于液体培养[18-19].与固体培养相比,液体培养的营养成分流动性强,更易被植物吸收利用;由于省去了琼脂粉,培养成本得到了有效降低;培养基制作和接种过程方便快捷,移栽时更容易清除根部培养基[14].在本研究中,培养结束时,液体培养的甘薯组培苗出现的黄枯叶数显著高于固体培养及玻璃棉支撑培养.这是因为,在液体培养中,茎段腋芽一旦萌发其生长速度明显快于固体培养,营养消耗迅速[22],待到培养后期,液体培养的植株茎叶更繁茂,相互遮蔽,从而影响培养瓶内的气体流通,导致液体培养的组培苗提早出现黄枯叶[23].由于黄枯叶出现于培养的后期,对组培苗的生长和增殖影响很小,可忽略不计.玻璃棉支撑培养的组培苗生长较差,应该是因为棉纤维束缚了培养基中营养元素的自由流动,且茎段与玻璃棉的接触面较小所致[4].相较于液体培养,固体培养成苗慢、生长慢,但不易早衰,因此可用于组培苗的保存[21].
采用液体培养快繁甘薯脱毒苗,培养基的分装量是影响组培苗成苗与生长的重要因素,过多或过少均不利于组培苗的培养.本研究表明:培养基分装量为30 mL 的处理,组培苗的整体生长状况表现最佳,其株高、增殖系数均显著高于分装量为15 mL 和20 mL 的处理.培养基分装量的确定,既要保证接种茎段能够正常萌发成苗,成苗率高,又要满足培养周期内组培苗生长的需要,并且不会造成额外的浪费.培养基分装量过多,外植体长期浸没于培养液,会因通气不良而造成成苗率和成苗数降低[19,21],这一问题在甘薯、马铃薯等组培苗的液体培养中均出现[23-24].在保证成苗率的前提下,培养基的分装量还应满足一个生长周期内组培苗生长的需要:分装过多,培养结束还剩余大量营养,造成额外的浪费;分装过少,造成营养和激素供应不足,从而抑制组培苗的正常生长[19,21].此外,过多的培养基,还会造成组培苗含水量过高,影响移栽后的成活[25].本研究采用容积300 mL 的培养瓶,当培养基分装量为30 mL 时,成苗率、成苗数不受影响,且组培苗的生长表现最佳。这说明30 mL 的培养基已经满足培养周期内组培苗生长对营养的需要.当将培养基分装量降低到20 mL 或15 mL 时,虽然对成苗率与成苗数没有显著影响,但组培苗的生长已显著变差,说明培养基分装量过少,已无法满足组培苗正常生长的需要.
采用液体培养快繁甘薯组培苗,接种茎段的长短和形态也是影响其成苗与生长的重要因素.本研究表明:若接种茎段太短或去除茎段上全部的叶柄与叶片,不仅成苗率、生根率显著降低,且形成的植株也生长缓慢,植株低矮,增殖系数显著降低;适当保留茎段节处的叶柄或全叶,对茎段腋芽萌发成苗和组培苗的生长都有利.究其原因,过短或光秃的茎段,接种后完全浸泡于培养液,致使腋芽不能正常萌发或延缓萌发;而对于保留半截叶柄、全长叶柄或全叶的茎段,接种后受叶柄或叶片的支撑,茎段并未淹没于培养液,从而腋芽的萌发与生长不受影响或影响较小.从接种操作的实际出发,刻意保留茎段的全长叶柄或整个叶片,必然使茎段截取的效率降低,迟滞接种的速度.接种过程中也发现,保留整叶的茎段,不仅操作中叶柄容易折断,且由于叶片大而重,接种于培养液后茎段容易发生倾翻或悬于培养基之外,需要再次调整,将茎段摆正,使接种效率大大降低.本研究发现,保留半截叶柄的茎段,其培养效果与保留全长叶柄或完整叶片的处理并无显著差异.综合考虑,当采用液体培养方式扩繁甘薯脱毒苗时,保留半截叶柄且长度为1.5~2.0 cm 的茎段是最适宜的接种材料,不仅便于切割与接种,还能提高接种效率,且成苗率高,组培苗生长茁壮迅速.
采用液体培养方式扩繁组培苗,需要综合考虑培养瓶大小、接种外植体数量等影响因素,协调好培养基分装量与接种外植体大小的关系.培养基分装量的确定,应以满足组培苗成苗、生长的营养需要又不造成额外浪费为准则,以此为据,必须综合考虑组培苗培养周期的长短、单瓶接种外植体的数量、培养瓶的大小、外植体的大小和形态等.以培养瓶大小为例,同样体积的培养基,分装到容积越大的培养瓶,形成的液层深度越浅,对外植体萌发成苗的不利影响就越小;同一的液层深度,容积越大的培养瓶,可分装更多的培养基,接种的培养材料就可以越多.从外植体大小与形态来讲,在培养基液层深度既定的条件下,外植体越小,浸没于培养基中就越深,对成苗与生长的不利影响就越大;反之,外植体越大(长),虽然可以规避培养液腌渍的不利影响,但造成组培苗的快繁效率降低.本研究采用的是容积为300 mL 的广口瓶,加注30 mL 培养基后,液层的厚度约0.6 cm.当将长度为0.7~1.0 cm 的短茎段或1.5~2.0 cm 长且全部去除叶柄叶片的茎段接种于培养基后,茎段完全沉没培养液内;而将1.5~2.0 cm 甚至更长,且带部分或全长叶柄以及带有完整叶片的茎段放于培养基后,茎段仍有部分外露于培养液之外.两大类茎段接种后在培养液中的淹没如否,恰恰是两大类茎段经离体培养后,组培苗成苗和长势出现显著差异的原因.
综上可知,在保证甘薯组培苗质量与繁殖效率的前提下,为了降低培养基成本,提高接种效率,甘薯脱毒苗的快繁优选液体培养,即在容积为300 mL 的培养瓶中盛装30 mL 培养基,接种1.5~2.0 cm 长并保留半截叶柄的茎段,经过一个培养周期的离体培养,不但茎段腋芽萌发不受影响,成苗率与成苗数高,而且组培苗生长迅速,增殖系数高.

