TdT 阳性大B 细胞淋巴瘤1 例*
代洁,谭燕勤,马越,周成敏,黄宗瑶,李吉满
610041 成都,四川省肿瘤临床医学研究中心,四川省肿瘤医院·研究所,四川省癌症防治中心,电子科技大学附属肿瘤医院 病理科
根据WHO 第五版造血与淋巴系统肿瘤的分类,B 细胞肿瘤分为B 细胞前体细胞肿瘤和成熟B 细胞肿瘤[1]。淋巴瘤的“未成熟特征”是指肿瘤细胞中存在一些在正常淋巴样前体中观察到的典型形态学、免疫组织化学和分子特征,比如TdT 的表达和缺乏V(D)J 序列的高突变。未成熟特征是B 淋巴母细胞淋巴瘤(B-lymphoblastic lymphoma,B-LBL)的诊断线索,且未成熟特征在弥漫大B 细胞淋巴瘤(diffuse large B-cell lymphoma,DLBCL)中的表达极为罕见[2]。在它们的鉴别中,TdT 是一个重要的标记,因此,表达TdT 但没有其他不成熟特征的B 细胞肿瘤可能会给诊断带来困难。本文分享了1 例骨原发性DLBCL 伴TdT 阳性表达的罕见病例以提高对此类少见疑难病例的认识和鉴别。
1 病例资料
患者,女,44 岁,4 年多前无明显诱因出现左髋部疼痛,疼痛能忍受,于当地医院诊断为“腰椎间盘突出”,对症治疗后疼痛无明显好转,上述疼痛反复存在。3 年前患者左髋部疼痛较前明显加重,伴行走困难,遂就诊于我院。患者既往史和家族史无特殊发现。核磁共振检查提示(图1):腰5椎体、左侧髂骨及髋臼、右侧耻骨联合多发骨质异常,以左侧髋臼病变显著,伴周围软组织稍肿胀,怀疑肿瘤性病变。同时患者接受了全身骨骼显像检查,发现左侧髂骨及髋臼放射性异常浓聚,其余骨骼未见明显异常。遂在全麻下行左侧髋臼骨肿瘤刮除活检、骨水泥填充成形术。
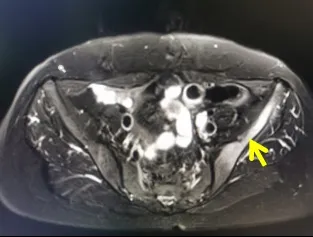
图1 患者腰部MRIFigure 1.Magnetic Resonance Image of the Lumbar Region
术后病理检查发现,左侧髋臼骨肿瘤刮除组织呈灰红灰白碎组织,总计3 cm×3 cm×3 cm。HE 染色镜下见骨小梁周围有小至中等大的细胞弥漫分布,灶性区坏死,肿瘤细胞有少-中等胞浆,核深染,染色质细腻,核仁不明显,可见星空现象(图2)。免疫组织化学染色结果显示,肿瘤细胞TdT(部分+,图3)、CD79a(+)、PAX-5(+)、CD138(+)、CD38(部分弱+)、LCA(+)、Bcl-2(+,90%)、Bcl-6(弱+,40%)、C-MYC(+,40%),Ki-67 增殖指数为60%。CD20(图4)、Kappa、Lambda、CD34、CD99、CD3、CD5、MUM1、CD30、CD10、CD23、ALK、CD1a、SATB2 和HMB45 均呈阴性。原位杂交发现EBER(-)。荧光原位杂交显示BCL-2、BCL-6(图5)和MYC 分离均为阴性。基因检测发现:EP300(NM001429)53.1%胚系突变;KMT2D(NM003482.3)48.9%胚系突变;MGA(NM001164273.1) 51.5%胚系突变。骨髓检查发现:粒细胞系统增生明显活跃,占ANC 54.5%,红细胞系统增生明显活跃,占ANC 31.5%,粒红两系增生明显活跃伴缺铁。淋巴瘤及慢性淋巴瘤免疫分型见15.63%成熟淋巴细胞,以成熟T 淋巴细胞为主,免疫表型未见异常。成熟B淋巴细胞,为多克隆,免疫表型未见明显异常;另见0.14%浆细胞、1.39%B 淋系原始幼稚细胞。病理诊断为侵袭性B 细胞淋巴瘤,鉴别诊断有:(1)B 淋巴母细胞白血病/淋巴瘤;(2)DLBCL 伴TdT 阳性表达。综合临床及上述检查结果,该患者最终诊断为:DLBCL 伴TdT 阳性表达,侵袭性,系生发中心来源(Hans 分型)。

图2 肿瘤细胞HE 染色(A,×100,B,×400)Figure 2.HE Staining of Tumor Cells(A,×100,B,×400)
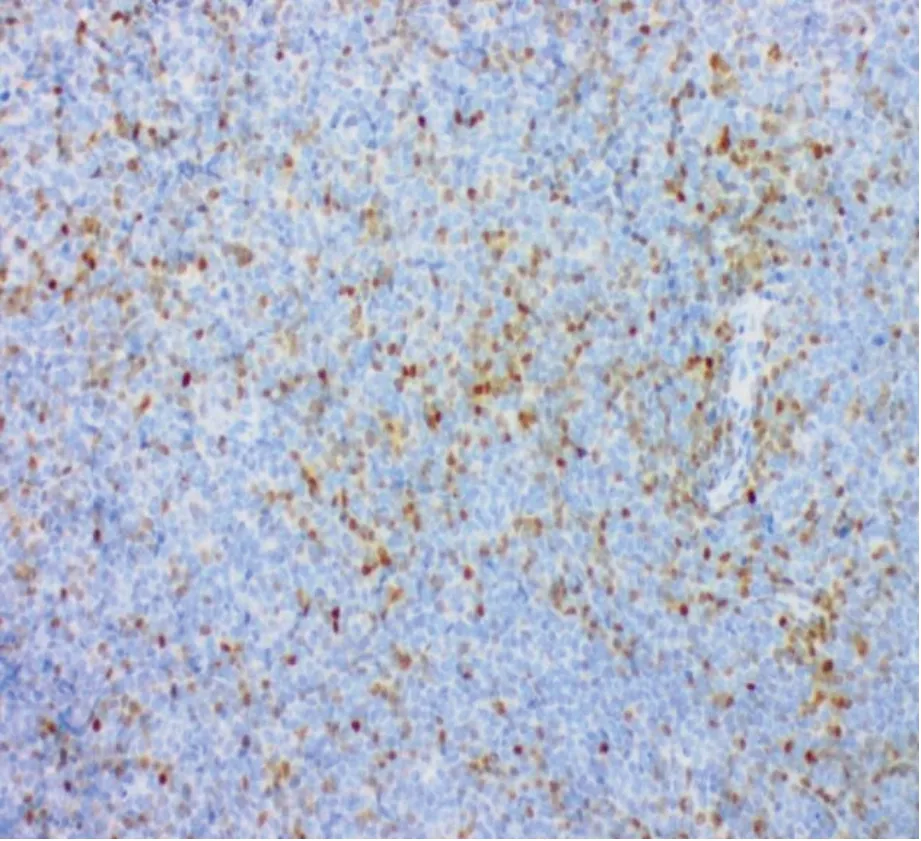
图3 肿瘤细胞TdT 部分阳性Figure 3.Partially Positive TDT Expression in Tumor Cells
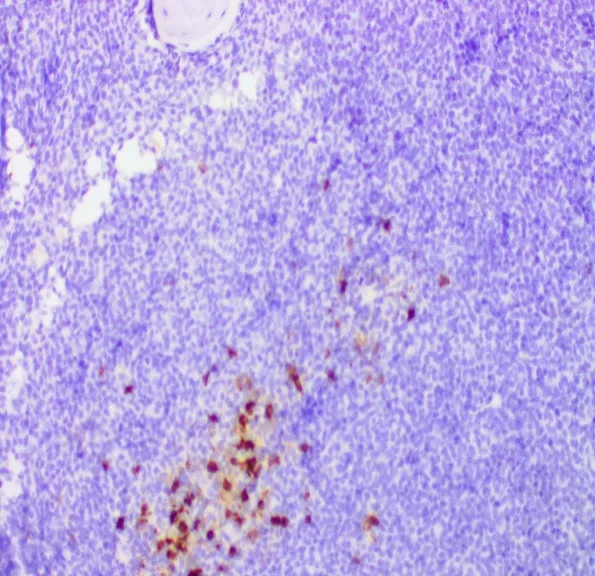
图4 肿瘤细胞CD20 阴性Figure 4.CD20-Negative Expression in Tumor Cells

图5 bcl-6 分离探针FISH 杂交结果阴性Figure 5.The FISH Image of bcl-6 Break-Apart Probe
患者分别于第1、3 周期行Hyper-CVAD A 化疗方案,第2、4 周期行Hyper-CVAD B 化疗方案,4 周期化疗后复查PET-CT 提示:左侧髋臼髂骨体及左侧坐骨结节处氟代脱氧葡萄糖代谢显著异常活跃,左侧髂骨翼前份髓腔内见局限性高密度影,考虑淋巴瘤。遂改变化疗方案,第5 周期化疗行阿扎胞苷+Bcl-2 抑制剂后开始奥布替尼靶向治疗4 周期,同时予CHOP 方案4 周期化疗。由于躯干骨继发恶性肿瘤,9 周期化疗+4 周期靶向治疗后开始行骨盆部图像引导、IMRT 放疗,并建议患者在外院进行骨髓移植。移植后采用替雷利珠单抗治疗2 周期后改用信迪利单抗治疗至今,目前已随访近4 年,患者一般身体状况良好。
2 讨 论
TdT 是从动物(通常是牛)胸腺和骨髓中分离提取的。TdT 催化脱氧核苷酸添加到DNA 分子的3’-OH 末端,催化作用不需要模板[3]。在免疫球蛋白和T 细胞受体基因的 V(D)J 重组过程中,TdT 通过催化脱氧嘧啶核苷酸随机添加到单链 DNA 中,在增加抗原受体多样性方面发挥着至关重要的作用[4]。在正常组织中,TdT 的表达大多局限于胸腺和骨髓中的B 细胞或T 细胞前体,而不是成熟淋巴细胞。在B 细胞发育过程中,TdT 通常在前B 细胞阶段表达,但当IGH 重排完成,IGK 或 IGL 重排开始时(前B 细胞阶段),其表达逐渐下降并消失。在淋巴肿瘤中,TdT 在大多数急性B 或T 淋巴母细胞白血病/淋巴瘤病例中表达[5]。
B 淋巴母细胞白血病/淋巴瘤和弥漫性大B 细胞淋巴瘤这两类患者通常需要不同的治疗方法,大多数DLBCL 患者以类似的方式治疗,最常见的是R-CHOP(利妥昔单抗、环磷酰胺、阿霉素、长春新碱和泼尼松)化疗方案,而患有B 淋巴母细胞白血病/淋巴瘤的患者接受更强的化疗。肿瘤细胞中缺乏免疫球蛋白轻链、CD20 表达减弱或缺乏以及TdT、CD34 或CD99 的表达已被用作支持B 细胞不成熟的特征[6-8]。本病例TdT 部分阳性表达,CD20、免疫球蛋白轻链Kappa和Lambda表达均呈阴性是B-LBL的诊断线索,但CD34 和CD99 却表达阴性,又不支持B-LBL 的诊断,那么本例是诊断为B-LBL 还是DLBCL 呢?
淋巴母细胞淋巴瘤(lymphoblastic lymphoma,LBL)是一类罕见的、恶性度极高的非霍奇金淋巴瘤,其发病率约占非霍奇金淋巴瘤的2%。B-LBL 较T-LBL 更为罕见,其发病率约为LBL 20%左右,多见于青少年与儿童,易侵袭皮肤、乳腺、肝脏和骨髓等结外器官[9],常伴随白血病症状。B-LBL 起病时多伴有贫血[10]。本例患者年龄较大44 岁,且没有白血病及贫血症状,淋巴瘤及慢性淋巴瘤免疫分型见0.14%浆细胞、1.39%B 淋系原始幼稚细胞,骨髓原始细胞数<5%,不支持考虑B-LBL。
伴有TdT 表达的成熟B 细胞淋巴瘤的报道较少,文献或世卫组织方案中关于这些肿瘤的指南也很少。据少量文献报道,TdT 可表达于MYC 易位伴BCL2 和BCL6 同时易位的弥漫性大b 细胞淋巴瘤,称为双打击或三打击淋巴瘤,在现行的WHO 分类中被归类为高级别B 细胞淋巴瘤[6],本病例BCL2、BCL6 和MYC 荧光原位杂交检测均为阴性。文献中也指出成熟B 细胞淋巴瘤会表达TdT,尤其是滤泡性淋巴瘤进展的时候[11-13]。在组织学转化为高级别肿瘤,滤泡性淋巴细胞瘤病例的一小部分可以发展为表达TdT 的肿瘤[6]。WHO 方案中目前的建议是将这些肿瘤归类为滤泡性淋巴瘤转化而来的B-LBL/白血病[14]。然而本例患者并无滤泡性淋巴瘤的相关病史,肿瘤组织病理学也无滤泡相关结构,故相关诊断并不适宜。
Endo 等[15]报道了1 例原发性皮肤腿型DLBCL(primary cutaneous diffues large B-Cell lymphoma,legtype, PCDLBCL-LT),而最初因为TdT 表达、肿瘤细胞免疫球蛋白轻链缺失、CD20 弱表达而诊断为B-LBL。但B-LBL 更倾向于影响18 岁以下的青少年,报道患者为97 岁,肿瘤发生在腿部、BCL2, BCL6 和MUM1 免疫组化阳性,荧光原位杂交检测有MYC 易位最终诊断为PCDLBCL-LT。
本病例为原发性骨的淋巴瘤,临床上没有贫血及白血病征像。肿瘤细胞表现为成熟的形态,包括体积大,细胞质分布均匀,细胞核大,染色质细腻,核仁不明显,没有表达其它原始细胞的标记如CD99、CD34、CD1a 等。综上所述,本案例诊断为DLBCL伴TdT 阳性表达,侵袭性,系生发中心来源(Hans 分型)。所以我们在诊断B 淋巴母细胞白血病/淋巴瘤的时候不能仅仅依靠TdT 的阳性表达,还需要结合临床及其它免疫组化标记综合判断,否则容易导致误诊。
作者声明:本文全部作者对于研究和撰写的论文出现的不端行为承担相应责任;并承诺论文中涉及的原始图片、数据资料等已按照有关规定保存,可接受核查。
学术不端:本文在初审、返修及出版前均通过中国知网(CNKI)科技期刊学术不端文献检测系统的学术不端检测。
同行评议:经同行专家双盲外审,达到刊发要求。
利益冲突:所有作者均声明不存在利益冲突。
文章版权:本文出版前已与全体作者签署了论文授权书等协议。

