基于生物信息学探讨M2型巨噬细胞相关基因对肝癌患者预后及药物治疗效果的影响
白媛媛 侯恩存
(1 广西中医药大学研究生院,广西南宁市 530001;2 广西中医药大学附属瑞康医院肿瘤二区,广西南宁市 530011)
肝癌是临床上常见的癌症,在过去20年里,发展中国家的肝癌发生率及病死率逐渐超过发达国家[1]。由于临床表现出现较晚、对常规化疗和靶向治疗的高耐药、频繁复发等因素,肝癌的病死率居高不下[2]。肝癌发生的危险因素包括HBV感染、丙型肝炎病毒感染、脂肪肝、过量酗酒等。手术治疗仅适用于早期肝癌患者,而这部分患者仅占15%左右,且随着肝脏再生能力的下降,可选择的治疗方式越少,这导致肝癌患者的预后较差[3]。因此,需要构建能够预测肝癌患者预后的模型,从而个性化地制订更为合理的治疗方案来提高肝癌患者生存率。
巨噬细胞作为人体先天免疫系统中一种极为重要的免疫细胞,它不仅可以通过自身的吞噬功能有效清除外来病原体,还可以通过释放多种免疫激活因子刺激其他免疫细胞的功能,使人体免受外来病原体的侵害。研究表明,巨噬细胞具有高度异质性和可塑性,可在不同组织分泌的信号因子刺激下被活化,并出现表型转化及功能变化[4-6]。随着对免疫细胞与癌症之间关系研究的深入,有学者发现肿瘤微环境中存在大量的巨噬细胞浸润,即肿瘤相关巨噬细胞(tumor-associated macrophage,TAM),并且发现肿瘤细胞释放的多种细胞因子如巨噬细胞集落刺激因子、白细胞介素4等,可诱导TAM向M2型极化,而M2型TAM的主要功能为促肿瘤血管生成,促进肿瘤细胞侵袭、迁移和浸润,以及抑制抗肿瘤免疫反应[7-9]。目前已有研究显示,肝癌细胞内的Wnt配体通过经典Wnt信号通路刺激TAM向M2型极化,从而导致肝癌细胞增殖、迁移和免疫耐受[10]。另有学者发现,在肝癌发展的早期阶段,肝星状细胞和巨噬细胞在肝癌衍生生长因子的刺激下会分别转变为癌症相关成纤维细胞和M2型TAM,在细胞转换期间肝星状细胞与巨噬细胞存在相互作用,可相互刺激对方进行转换[11]。此外,有研究表明,通过上调受体相互作用蛋白激酶与抑制脂肪酸氧化可阻断M2型TAM的免疫抑制作用,这对肝癌发生与发展有抑制作用[12]。由此可见,M2型TAM与肝癌的发生和发展息息相关,并且通过药物实现阻断M2型TAM的相关功能可能是治疗肝癌的一种新方向。因此,本研究通过生物信息学方法筛选与M2型巨噬细胞相关的肝癌基因,分析该类基因对肝癌患者预后的影响,并基于与该类基因相关的药物进行药物敏感性分析,为肝癌的临床诊疗提供参考。
1 材料与方法
1.1 肝癌患者的基因表达、临床数据及肝癌基因突变数据的获取 在癌症基因组图谱(the Cancer Genome Atlas,TCGA)数据库(https://portal.gdc.cancer.gov/repository)界面下,在“Cases”的“Project”中选择“LIHC”,在“File”的“Data Category”“Data Type”中分别选择“transcriptome profiling”“Gene Expression Quantification”,下载基因表达数据,对下载后的数据进行标准化处理,共获得374例肝癌患者肝癌组织样本和50个正常组织样本的基因表达数据;在“Cases”选择不变的情况下,在“File”的“Data Category”中选择“Clinical”,下载肝癌患者相关的临床数据,在对数据进行标准化处理后获取肝癌患者的年龄、性别、生存时间、肿瘤分级与分期等临床数据,用于后续的生存分析;在“Cases”选择不变的情况下,在“File”的“Data Category”“Data Type”中分别选择“simple nucleotide variation”“Masked Somatic Mutation”,下载肝癌基因突变数据。在基因表达汇编(Gene Expression Omnibus,GEO)数据库(https://www.ncbi.nlm.nih.gov/geo)中下载肝癌基因表达谱芯片GSE20140,芯片内包含37例肝癌患者的肝癌组织样本基因表达数据和临床数据,利用GPL5474平台获取每个探针结果所代表的基因名称。
1.2 与M2型巨噬细胞相关的肝癌基因的筛选 基于R语言(4.1.2版本),利用CIBERSORT算法分析从TCGA数据库获得的正常组织样本和肝癌组织样本中22种免疫细胞的占比,将分析结果作为每个组织样本中22种免疫细胞的相对含量。利用CIBERSORT算法分析结果提供的参数信息,当所有免疫细胞子集上反褶积结果具有统计学意义(P<0.05),则可判定每个组织样本中免疫细胞相对含量分析结果具有准确性,剔除不准确的组织样本;利用CIBERSORT算法分析结果提供的相关系数,设定相关系数为0.3再次进行筛选,并剔除正常组织样本,最终获得与M2型巨噬细胞具有相关性的肝癌组织样本。利用R语言的Pearson检验,分析最终筛选得到的肝癌组织样本中基因表达与M2型巨噬细胞相对含量的相关性,设定过滤条件为P=0.01,最终获得与M2型巨噬细胞相关的肝癌基因,并输出相关性结果,绘制关系网络图。
1.3 与M2型巨噬细胞相关的肝癌基因的富集分析 使用R语言的Bioconductor包对与M2型巨噬细胞相关的肝癌基因进行基因本体论(Gene Ontology,GO)功能富集分析与京都基因和基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)通路富集分析,其中GO功能富集分析包含生物过程、细胞组分和分子功能。最后通过ggplot2包对GO功能富集分析结果和KEGG通路富集分析结果进行可视化处理,绘制GO功能富集分析的柱状图与KEGG通路富集分析的网络关系图。
1.4 与M2型巨噬细胞相关的肝癌预后基因筛选及生存分析 (1)使用R语言对从TCGA数据库与GEO数据库下载得到的肝癌组织样本基因表达数据进行批次整理,将两者合并取交集。根据已获得的与M2型巨噬细胞相关的肝癌基因进行筛选,获得两个数据库都包含的与M2型巨噬细胞相关的肝癌基因,用于后续的生存分析。(2)基于从TCGA数据库获得的肝癌患者肝癌组织样本基因表达数据和生存数据,运用R软件中的survival包,采用单因素COX回归模型分析方法进行生存分析,设定筛选标准为P<0.05,得到与M2型巨噬细胞相关的肝癌预后基因,其中危险比(hazard ratio,HR)<1的基因为低风险基因,HR>1的基因为高风险基因,最后以森林树图呈现结果。(3)针对获得的与M2型巨噬细胞相关的肝癌预后基因,运用R语言进行LASSO回归算法筛选特征性基因,最终获得4个特征性基因。将上述4个特征性基因的表达量乘以各自的LASSO回归系数并相加,以建立风险评分公式。根据公式并基于TCGA数据库肝癌患者的相关数据,可计算每例肝癌患者的风险评分。根据风险评分的中位值,将肝癌患者分为高风险组和低风险组,利用R语言中的survival包比较两组患者的生存情况,并运用ggsurvplot包绘制生存曲线。
1.5 肿瘤突变负荷分析、抗癌药物筛选及药物敏感性分析 根据从TCGA数据库下载得到的肝癌基因突变数据,筛选出高风险组和低风险组中具有肝癌基因突变的肝癌患者,利用R语言的limma包对两组的肿瘤基因突变数据进行差异表达分析,得到两组的肿瘤突变负荷,通过绘制小提琴图将数据可视化。利用R语言的oncoPredict包对从TCGA数据库获得的肝癌患者基因表达数据进行药物敏感性分析,提取高风险组和低风险组中的差异表达基因,与抗癌药物敏感性基因组学数据库(www.cancerrxgene.org)下载的基因进行取交集,获取两组中基因的药物敏感性分析数据,利用R语言limma包对两组的药物敏感性结果进行差异分析。
2 结 果
2.1 与M2型巨噬细胞相关的肝癌基因的筛选结果 最终共获得110个与M2型巨噬细胞相关的肝癌基因,其中正相关基因有32个,负相关基因有78个,见图1。
2.2 与M2型巨噬细胞相关的肝癌基因的富集分析结果 GO功能富集分析结果显示,与M2型巨噬细胞相关的肝癌基因涉及445个生物过程、48个细胞成分和39个分子功能,其中生物过程主要有内皮细胞发育、信号受体活性的负调控、骨形态发生蛋白(bone morphogenetic protein,BMP)信号通路等,见图2。KEGG通路富集分析共得到30条信号通路,在信号通路上的富集数量最多的8个基因分别为衣被蛋白复合体(coatomer protein complex,COP)Z1、COPZ2、大麻素受体相互作用蛋白1(cannabinoid receptor interacting protein 1,CNRIP1)、促肾上腺皮质激素释放激素结合蛋白(corticotropin releasing hormone binding protein,CRHBP)、含LY6/PLAUR结构域蛋白1(LY6/PLAUR domain containing 1,LYPD1)、环形交叉轴突导向受体同源物4(roundabout guidance receptor,homolog 4,ROBO4)、磷酸二酯酶2A(phosphodiesterase 2A,PDE2A)、同源盒蛋白 A13(homeobox A13,HOXA13),其涉及的信号通路主要为内皮细胞发育、信号受体活性的负调控等,见图3。
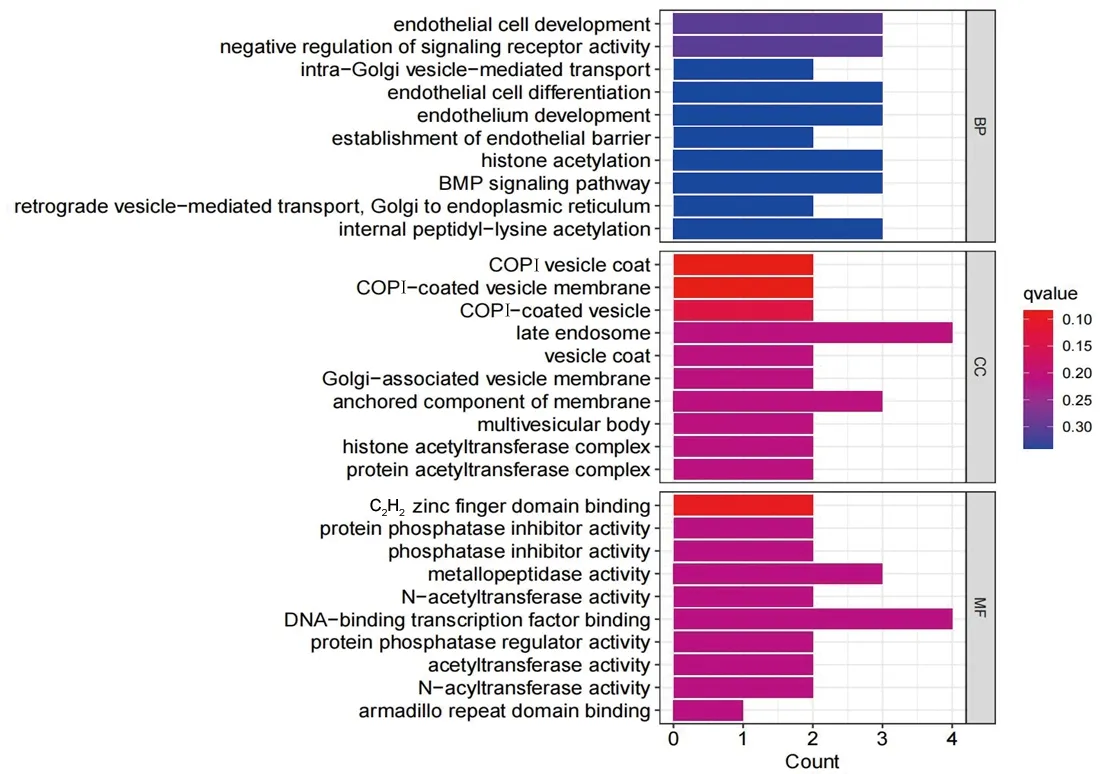
图2 GO功能富集分析柱状图(仅展示前10个条目)

图3 KEGG通路富集分析网络关系图
2.3 与M2型巨噬细胞相关的肝癌预后基因筛选及生存分析结果 (1)单因素COX回归分析共筛选12个与M2型巨噬细胞相关的肝癌预后基因,分别是PDE2A、信号识别颗粒19(signal recognition particle 19,SRP19)、C型凝集素域家族3成员B(C-type lectin domain family 3 member B,CLEC3B)、核纤层蛋白B1(lamin B1,LMNB1)、安眠蛋白A亚基α(meprin A subunit alpha,MEP1A)、TATA盒结合蛋白相关因子9(TATA-box binding protein associated factor 9,TAF9)、CRHBP、脱氧核糖核酸酶 Ⅰ 样蛋白3(deoxyribonuclease Ⅰ like 3,DNASE1L3)、电压依赖性阴离子通道 1(voltage dependent anion channel 1,VDAC1)、突触回蛋白4 (synaptogyrin 4,SYNGR4)、具有序列相似性的家族107成员A(family with sequence similarity 107 member A,FAM107A)、含溴结构域蛋白8(bromodomain containing 8,BRD8),其中高风险基因有7个,低风险基因有5个,见图4。再通过LASSO回归的10倍交叉验证,最后确定4个特征性基因,分别是CLEC3B、LMNB1、TAF9、SYNGR4,其中CLEC3B为低风险基因,LMNB1、TAF9、SYNGR4为高风险基因,见图5。建立风险评分公式,风险评分=-0.248×CLEC3B+0.008×LMNB1+0.230×TAF9+0.006×SYNGR4。(2)高风险组和低风险组肝癌患者的生存时间差异有统计学意义(P<0.001),高风险组肝癌患者的生存时间更短,见图6。

图4 与M2型巨噬细胞相关的肝癌预后基因森林树图
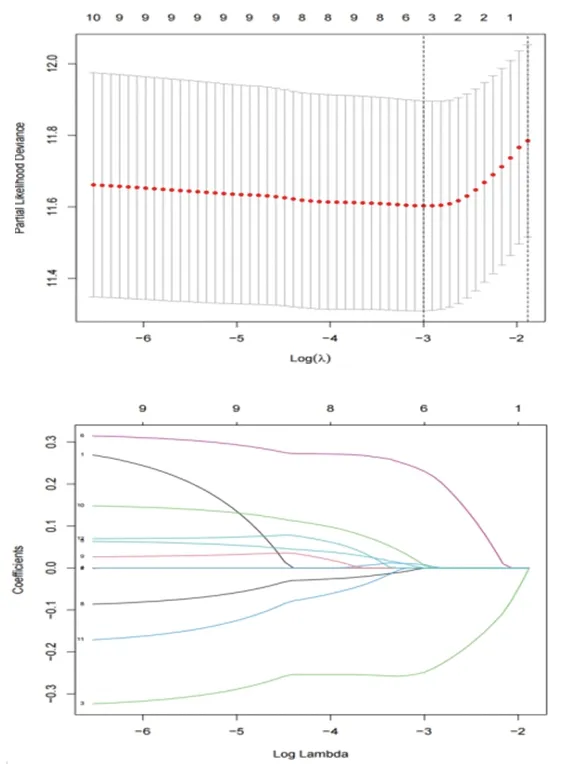
图5 LASSO回归模型图
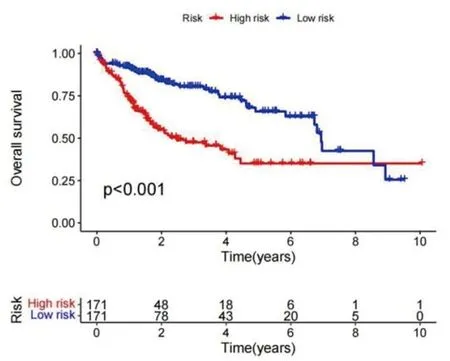
图6 高风险组与低风险组的生存曲线图
2.4 肿瘤突变负荷分析、抗癌药物筛选及药物敏感性分析结果 高风险组和低风险组的肿瘤突变负荷差异有统计学意义(P=0.004),见图7。通过对高风险组和低风险组中基因对应的药物敏感性数据进行差异分析,选取差异较大的药物(P<0.01),并结合目前临床治疗肝癌的主要药物进行筛选,确定5-氟尿嘧啶、阿法替尼、阿培利司、AT13148抑制剂这4种抗癌药物,其中5-氟尿嘧啶、阿法替尼、阿培利司在低风险组中较敏感(P<0.001),而AT13148抑制剂在高风险组中较敏感(P<0.001),见图8。

图7 高风险组和低风险组的肿瘤突变负荷差异分析小提琴图
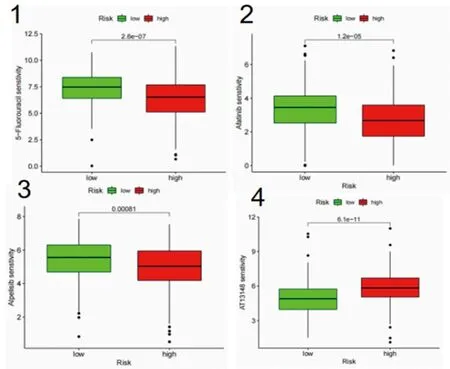
图8 高风险组和低风险组的药物敏感性差异分析
3 讨 论
目前认为巨噬细胞与癌症的发生和发展密切相关。有学者发现,炎症的发生会招募多种免疫细胞,包括巨噬细胞,巨噬细胞会通过释放促炎性细胞因子引起微环境的改变,这容易导致炎症周围组织出现基因突变,从而引发癌变[13-14]。发生癌变后,巨噬细胞在肿瘤细胞释放的多种细胞因子的刺激下转变为TAM。在肿瘤微环境中存在大量的TAM,而TAM具有多种形态与功能,其中M2型TAM具有抑制免疫、促进肿瘤进展的功能[15-16]。目前已知M2型TAM在肝癌的进展中发挥了重要作用[17-18],因此本研究主要从M2型巨噬细胞入手,探讨M2型巨噬细胞对肝癌患者预后和相关药物治疗效果的影响。
本研究共获得110个与M2型巨噬细胞相关的肝癌基因,KEGG通路富集分析结果提示在信号通路上的富集数量最多的8个基因前3位为COPZ1、COPZ2、CNRIP1。COPZ1是共原子蛋白复合物1的组成部分,参与核内体的成熟、自噬和高尔基膜上包被囊泡的构建。一项细胞实验研究显示,在大多数肝癌细胞系中COPZ1的蛋白表达量高于正常人肝细胞,敲除COPZ1后肝癌细胞的增殖和迁移能力受到抑制,且COPZ1与TAM的浸润水平有较强的相关性[19]。 CNRIP1是肿瘤发展过程中重要的转录调节因子,其可通过抑制γ-丁酰基羟化酶1介导的肉碱代谢来抑制肝癌细胞的增殖[20]。此外,CNRIP1还可以通过Ras/蛋白激酶B信号通路来促进肝癌细胞的增殖、侵袭;敲除CNRIP1后,肝癌细胞中的Ras信号通路受到抑制,且肝癌细胞的增殖、侵袭能力增强[21]。有研究显示,CNRIP1蛋白广泛分布于腹膜组织、肠道组织、肝脏组织的巨噬细胞和外周血单核细胞[22]。CNRIP1可以促进C-C基序趋化因子配体5的表达,而C-C基序趋化因子配体5可募集M2型TAM[23]。上述研究提示COPZ1、CNRIP1在肝癌进展中发挥重要作用,这可能与其增加TAM的浸润水平或具有募集TAM的作用有关。目前尚无COPZ2与肝癌之间相关性的研究,COPZ2在肝癌发展中的作用及机制仍待进一步探索。
本研究GO功能富集分析结果显示,与M2型巨噬细胞相关的肝癌基因涉及多种生物过程,其中包括内皮细胞发育;而KEGG通路富集分析结果也显示内皮细胞发育信号通路是与M2型巨噬细胞相关的肝癌基因涉及的主要通路。肿瘤的发生和发展与血管新生密切相关,血管新生是肿瘤组织生长和转移所必需的,而血管新生主要依赖内皮细胞的分化和发育[24]。有研究表明,当肿瘤微环境处于缺氧状态,巨噬细胞会极化为M2型TAM,通过分泌促血管生成因子,包括血管内皮生长因子A、表皮细胞生长因子、胎盘生长因子、转化生长因子β、肿瘤坏死因子α、白细胞介素1β、白细胞介素8、C-C基序趋化因子配体2、C-X-C基序趋化因子配体8和C-X-C基序趋化因子配体12,促进肿瘤组织血管内皮细胞的分化与增殖,通过修复血管及刺激血管新生,给癌细胞提供氧气和营养,促进癌细胞的增殖[25]。而下调血管内皮生长因子受体的表达可以显著抑制内皮细胞的增殖、迁移和侵袭,从而抑制肝癌的血管新生,因此靶向内皮生长因子受体的治疗对肿瘤治疗意义重大[26]。
本研究通过单因素COX回归和LASSO回归分析,最终确定了4个具有特征性的与M2型巨噬细胞相关的肝癌预后基因,分别是CLEC3B、LMNB1、TAF9、SYNGR4。根据这4个基因建立风险评分公式,然后进行分组及生存分析,结果显示风险评分较高的肝癌患者(高风险组)的生存时间短于风险评分较低的肝癌患者(低风险组)(P<0.05),提示上述4个基因在肝癌进展中具有重要作用,可影响肝癌患者的预后。研究表明,CLEC3B在肝癌中的表达降低,其表达水平与肝癌患者的生存率呈正相关,表明CLEC3B可能可以作为肝癌的潜在预后生物标志物[27];LMNB1表达上调与肝癌的增殖、迁移和入侵有关[28];TAF9可以促进肝癌细胞增殖、迁移和侵袭,其表达上调与肝癌进展及患者总生存期的降低有关[29]。但目前SYNGR4与肿瘤之间相关性的研究极少,其在肿瘤尤其是肝癌发展中的作用机制有待研究。
肿瘤突变负荷在肿瘤免疫治疗中多被用于预测免疫检查点抑制剂的疗效,目前已成为诸多恶性肿瘤的重要标志物[30]。因此,本研究进一步分析高风险组与低风险组肝癌患者的肿瘤突变负荷,发现高风险组肝癌患者的肿瘤突变负荷高于低风险组(P<0.05),说明基于CLEC3B、LMNB1、TAF9、SYNGR4的风险评分较高的肝癌患者一般较少从免疫治疗中获益。此外,药物敏感性分析结果显示,5-氟尿嘧啶、阿法替尼、阿培利司在低风险组中较敏感(P<0.05),而AT13148抑制剂在高风险组中较敏感(P<0.05),表明5-氟尿嘧啶、阿法替尼、阿培利司更适合低风险评分的肝癌患者,而AT13148抑制剂更适合高风险评分的肝癌患者。目前上述抗癌药已经在临床抗癌治疗中得到广泛应用,但它们在不同肝癌人群中的作用机制还需进一步研究证实。总之,基于与M2型巨噬细胞相关的肝癌预后基因(CLEC3B、LMNB1、TAF9、SYNGR4)建立的风险评分,有助于临床医师评估免疫治疗及常用抗癌药物对肝癌患者的疗效,从而制订更适宜的治疗方案以改善患者的预后。
综上所述,多个与M2型巨噬细胞相关的基因在肝癌的发生和发展中具有重要作用,其中CLEC3B、LMNB1、TAF9、SYNGR4与肝癌患者的预后密切相关,且有助于评估免疫治疗及抗癌药物的疗效。但是今后仍需开展相关基础实验进一步探讨相关基因的作用机制,并开展多中心、大样本的前瞻性研究去验证该风险评分的预测准确性。

