基于OpenFDA数据库的4种紫杉醇类抗肿瘤药物的不良反应分析▲
李彦儒 张生潭 宝 志 肖 莉 路向星
(河北省沧州中西医结合医院西药学部,河北省沧州市 061001)
紫杉醇是一种三环二萜类化合物,其分子式为C47H51NO14,最初是从太平洋红豆杉树的树皮中提取分离而来,由于具有独特的抗癌机制,其已成为目前临床上广泛使用的天然抗癌药物之一[1]。与其他防止微管蛋白结合的抗癌药物不同,紫杉醇可促进微管蛋白组装成微管,使微管稳定并防止微管解离,阻断癌细胞周期进展,阻止癌细胞有丝分裂,从而抑制其生长[2-5]。美国食品和药物管理局于1992年批准将紫杉醇用于治疗晚期卵巢癌。此后,紫杉醇逐渐被应用于乳腺癌、结直肠癌、膀胱鳞状细胞癌、肺癌、头颈部癌及艾滋病等疾病的治疗[6]。
目前紫杉醇类抗肿瘤药物主要包括传统紫杉醇制剂、紫杉醇脂质体制剂、白蛋白结合型紫杉醇、多西他赛。紫杉醇水溶性差,传统的紫杉醇制剂须添加辅料聚氧乙烯蓖麻油和乙醇,而聚氧乙烯蓖麻油常引起过敏反应[7]。有学者将紫杉醇包封于类脂质双分子层中形成微型囊泡,制成紫杉醇脂质体制剂,从而明显地降低了传统的紫杉醇制剂过敏反应的发生率[8]。此外,紫杉醇脂质体制剂具有被动靶向特性,其治疗效果优于传统的紫杉醇制剂[9]。白蛋白结合型紫杉醇是利用白蛋白的自然特性将其与紫杉醇相结合,可提高肿瘤组织对紫杉醇的摄取和蓄积[10]。与传统的紫杉醇制剂相比,白蛋白结合型紫杉醇的输注时间明显缩短,避免了由聚氧乙烯蓖麻油引起的过敏反应,同时也解决了紫杉醇水溶性差的问题[11-12]。多西他赛的作用机制与紫杉醇类似,但多西他赛与微管蛋白的结合力更强,因此其抗肿瘤活性更强[13]。近年来,抗肿瘤药物的安全性受到广泛关注。因此,本研究基于美国食品药品监督管理局公共数据公开项目(the US Food and Drug Administration Public Data Open Project,OpenFDA)的数据[14],分析上述4种紫杉醇类抗肿瘤药物不良反应的发生情况,为临床合理、安全用药提供参考。
1 资料与方法
1.1 数据来源 本研究数据来源于OpenFDA数据库中的 API模块(API 端点及介绍),其中包含药物不良事件、药品说明书、国家药品编码及召回报告4个部分。进入API模块的药物不良事件部分后,采用数据库交互式图表板块检索相关数据,如不良反应报告数、上报人员的职业、上报国家、患者性别、用药适应证、不良反应类型及严重程度等。
1.2 数据检索 本研究以“紫杉醇类抗肿瘤药物”为目标药品,以“paclitaxel”“liposome-paclitaxel”“albumin-bound paclitaxel”“docetaxel”为检索词,检索时间为 2004年1月1日至2022年3月31日。根据不同检索需求,在View选择框中选择不同的筛选字段来获取相应的数据及图表,大致操作如下:为获取药品不良反应报告数,在View选择框中输入“receivedate”;为获取不良反应上报人员的职业分布情况并进行相应的计数查询,在View 选择框中输入“primarysource.qualification”;为获取不良反应上报国家的分布情况,在View选择框中输入“primarysource.reportercountry”;为获取患者的性别分布情况,在View选择框中输入“patient.patientsex”;为获取用药适用证,在View选择框中输入“patient.drug.drugindication”;为获取不良反应的类型,在View选择框中输入“patient.reaction.reactionmeddraversionpt”;为获取不良反应的严重程度,在View选择框中输入“serious”。
1.3 统计学分析 采用SPSS 19.0软件进行统计学分析,计量资料以例数(百分比)表示。
2 结 果
2.1 紫杉醇类抗肿瘤药物不良反应报告年度分布 从2004年1月1日至2022年3月31日,OpenFDA记录传统紫杉醇制剂的不良反应共71 926条,紫杉醇脂质体制剂的不良反应共81 921条,白蛋白结合型紫杉醇的不良反应共56 811条,多西他赛的不良反应共70 513 条。4种紫杉醇类抗肿瘤药物年度不良反应报告数增长趋势基本一致,即2004—2010年增长幅度不大,2011—2017年增长速度较快,2018年增长迅猛。2019—2021年传统紫杉醇制剂、紫杉醇脂质体制剂、白蛋白结合型紫杉醇的不良反应报告数较稳定,而多西他赛的不良反应报告数则逐年下降。2022年仅有3个月数据,故不做分析。见图1。
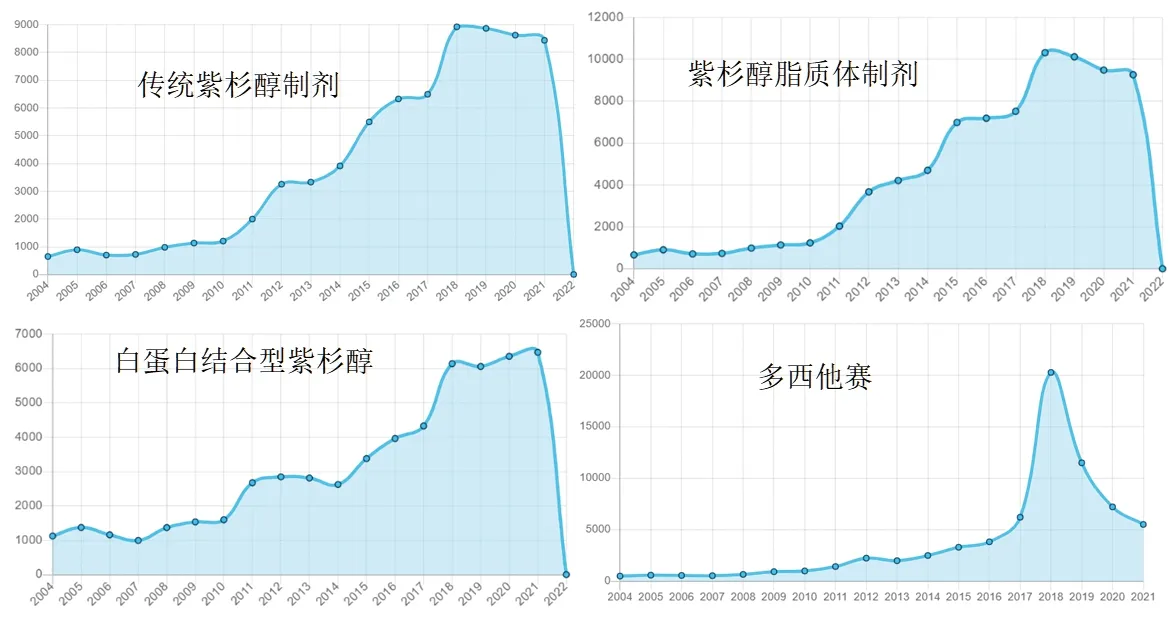
图1 4种紫杉醇类抗肿瘤药物不良反应报告年度分布
2.2 紫杉醇类抗肿瘤药物不良反应上报人员的职业分布情况 传统紫杉醇制剂、紫杉醇脂质体制剂、白蛋白结合型紫杉醇的不良反应多由医生上报,其次是其他医务人员;而多西他赛不良反应的上报人员中,医生、患者或非医务人员、其他医务人员及药师的所占比例相差不大。见表1。

表1 4种紫杉醇类抗肿瘤药物不良反应上报人员的职业分布情况[n(%)]
2.3 紫杉醇类抗肿瘤药物不良反应上报国家的分布情况 4种紫杉醇类抗肿瘤药物不良反应上报的国家均以日本居首位。见表2。

表2 4种紫杉醇类抗肿瘤药物不良反应上报国家的分布情况(n)
2.4 紫杉醇类抗肿瘤药物不良反应报告中患者性别分布情况 4种紫杉醇类抗肿瘤药物的不良反应报告中均以女性患者偏多,占比均为70%左右。见表3。

表3 4种紫杉醇类抗肿瘤药物不良反应报告中患者性别分布情况[n(%)]
2.5 紫杉醇类抗肿瘤药物不良反应报告中用药适应证分布情况 除去不明确的适应证,传统紫杉醇制剂、紫杉醇脂质体制剂、白蛋白结合型紫杉醇的主要用药适应证为乳腺癌、卵巢癌、非小细胞肺癌转移性乳腺癌,多西他赛的主要用药适应证为乳腺癌、转移性乳腺癌、前列腺癌。见表4。
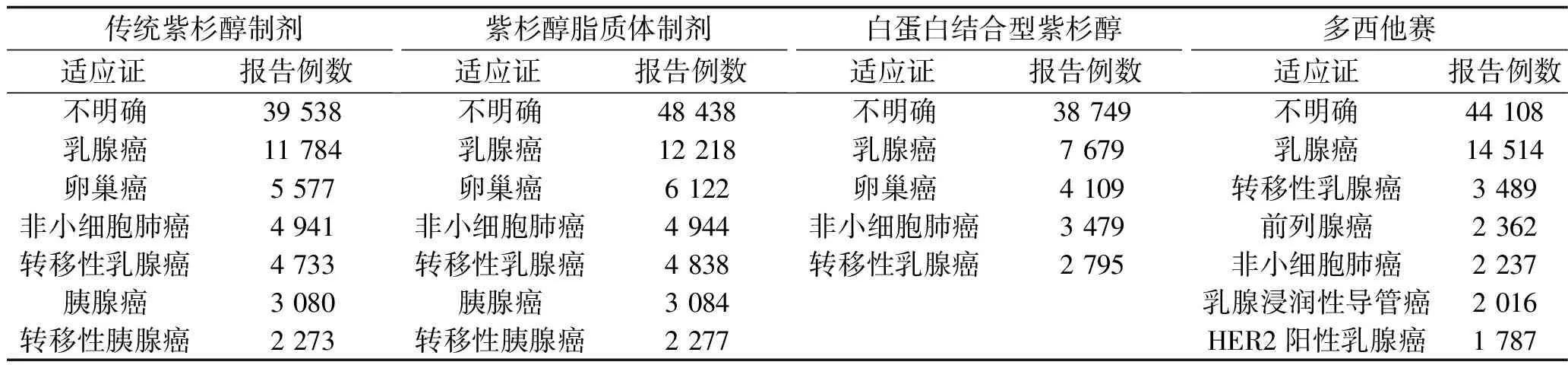
表4 4种紫杉醇类抗肿瘤药物不良反应报告中用药适应证分布情况(n)
2.6 紫杉醇类抗肿瘤药物不良反应类型及严重程度 在上报的不良反应报告中,严重不良反应包括住院、死亡、致残、致畸、危及生命,其中传统紫杉醇制剂上报的严重不良反应共68 179例,占比94.79%,紫杉醇脂质体制剂共77 427例,占比94.51%,白蛋白结合型紫杉醇共53 402例,占比94.00%,多西他赛共55 542例,占比78.77%,见表5。前9种其他常见不良反应。见表6。

表5 4种紫杉醇类抗肿瘤药物严重不良反应的分布情况[n(%)]
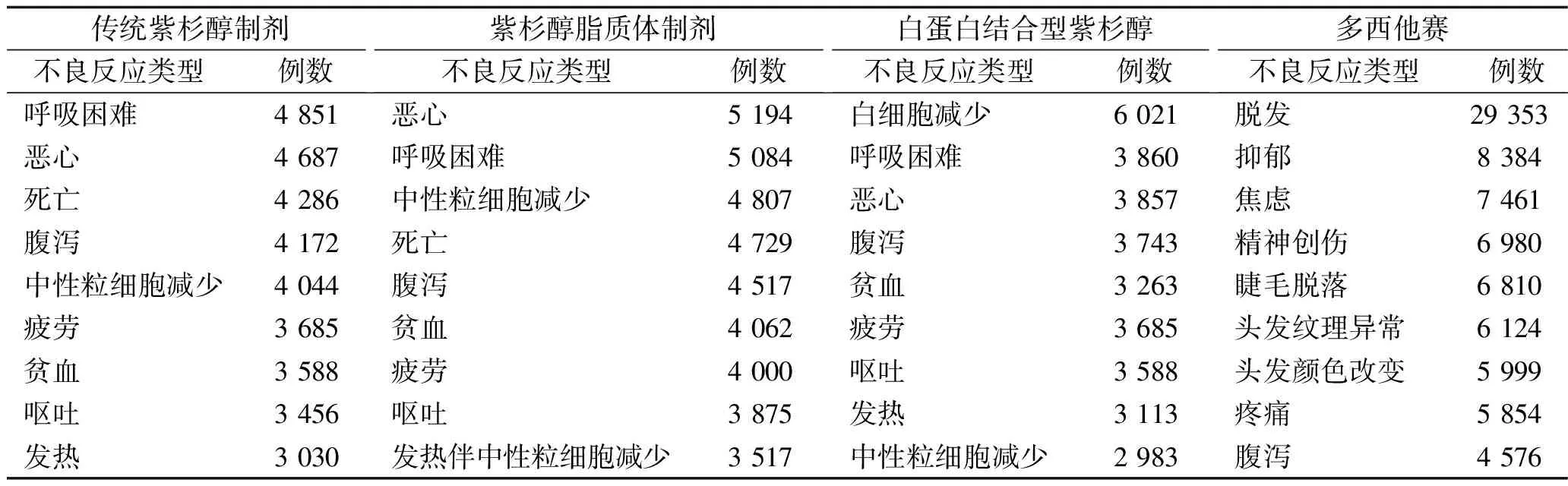
表6 4种紫杉醇类抗肿瘤药物常见不良反应的分布情况(n)
3 讨 论
3.1 4种紫杉醇类抗肿瘤药物不良反应报告年度分布情况 2010—2017年,传统紫杉醇制剂、紫杉醇脂质体制剂、白蛋白结合型紫杉醇、多西他赛的不良反应报告数均整体呈上升趋势,在2018年增长迅猛,可能与这几年乳腺癌和卵巢癌的发病率升高密切相关[15]。2019—2021年传统紫杉醇制剂、紫杉醇脂质体制剂、白蛋白结合型紫杉醇的不良反应报告数较稳定,而多西他赛的不良反应报告数则逐年下降,这可能是因为随着多西他赛使用量的增加,文献报告不良反应的应对措施随之增加,因此不良反应报告数逐渐下降[16-18]。
3.2 4种紫杉醇类抗肿瘤药物不良反应上报人员的职业分布情况 传统紫杉醇制剂、紫杉醇脂质体制剂、白蛋白结合性紫杉醇的不良反应多由医生上报,其次为其他医务人员,多西他赛不良反应的上报人员中,医生、其他医务人员、患者或非医务人员的占比相差不大,可能与这4种药物均为注射制剂,需在医院完成治疗有关。值得注意的是,患者可能不了解药物不良反应上报机制,因此医疗机构应加强宣传,不仅使患者在关注疾病进展的同时,也要关注药物的不良反应。
3.3 4种紫杉醇类抗肿瘤药物不良反应上报国家的分布情况 传统紫杉醇制剂、紫杉醇脂质体制剂、白蛋白结合型紫杉醇、多西他赛的不良反应上报国家中前5位均无中国,可能与药物不良反应数据来源有关,OpenFDA数据库的报告来源主要为欧美国家,亚洲地区(除日本外)报告数相对较少,存在地域信息不对称性[19]。
3.4 4种紫杉醇类抗肿瘤药物不良反应报告中患者的性别与用药适应证分布情况 传统紫杉醇制剂、紫杉醇脂质体制剂、白蛋白结合型紫杉醇、多西他赛的不良反应患者均以女性多见,均占70%左右,这可能与药物的适应证有关。这4种紫杉醇类抗肿瘤药物主要用于治疗乳腺癌、卵巢癌等疾病,这也与我国的紫杉醇类抗肿瘤药物药品说明书中的适应证相一致。我国传统紫杉醇制剂说明书提到其可用于进展期卵巢癌的一线和后续治疗、淋巴结阳性的乳腺癌患者在含阿霉素标准方案联合化疗后的辅助治疗、转移性乳腺癌联合化疗失败或者辅助化疗6个月内复发的乳腺癌患者,以及非小细胞肺癌的一线治疗。紫杉醇脂质体制剂可用于卵巢癌的一线化疗及卵巢癌转移性癌的一线化疗,可以与顺铂联合应用,也可用于曾接受过含阿霉素标准化疗方案的乳腺癌患者的后续治疗或复发患者的治疗,并可与顺铂联合用于不能手术或放疗的非小细胞肺癌患者的一线化疗。白蛋白结合型紫杉醇可用于治疗联合化疗失败的转移性乳腺癌或辅助化疗后6个月内复发的乳腺癌患者。多西他赛的抗癌谱较广,可用于治疗乳腺癌、非小细胞肺癌、前列腺癌和胃癌,以及局部晚期或转移性乳腺癌;其可以联合曲妥珠单抗用于治疗人表皮生长因子受体2基因过度表达的转移性乳腺癌患者;其还可以联合阿霉素及环磷酰胺用于淋巴结阳性的乳腺癌患者的术后辅助化疗。此外,美国国立综合癌症网络指南推荐紫杉醇类药物单药或与其他药物联合使用作为晚期胃癌的一线治疗选择[20]。
3.5 4种紫杉醇类抗肿瘤药物不良反应的类型及严重程度 传统紫杉醇制剂、紫杉醇脂质体制剂、白蛋白结合型紫杉醇、多西他赛的不良反应多为严重不良反应,其中传统紫杉醇制剂、紫杉醇脂质体制剂和白蛋白结合型紫杉醇的严重不良反应发生率达到94%以上,而多西他赛的严重不良反应发生率相对较低。发生率位于前三的紫杉醇类抗肿瘤药物的严重不良反应依次为危及生命、死亡、住院、致残、致畸。多西他赛严重不良反应中发生率较高的是危及生命,死亡、住院、致残的发生率相当,致畸发生率较低。
OpenFDA数据库所提供的传统紫杉醇制剂、紫杉醇脂质体制剂、白蛋白结合型紫杉醇、多西他赛的前9种其他常见不良反应,与我国药品说明书提及的不良反应基本一致。我国传统紫杉醇制剂说明书提到其主要不良反应为骨髓抑制,包括中性粒细胞减少、白细胞减少、血小板减少、贫血,其次是胃肠道反应,包括恶心、呕吐、腹泻、黏膜炎等,其他不良反应还包括肌肉痛、关节痛、周围神经病变、胆红素升高、碱性磷酸酶升高、感染、出血、心动过缓、低血压等。此外,传统紫杉醇制剂说明书的黑框警告提到基线中性粒细胞计数<1 500个/mm3的实体瘤患者或基线中性粒细胞计数<1 000个/mm3的艾滋病相关性卡波氏肉瘤患者、怀孕和哺乳妇女、聚氧乙烯蓖麻油过敏者禁用该药。我国紫杉醇脂质体制剂说明书中不良反应包括过敏反应(皮疹、面部潮红、呼吸困难、低血压及心动过速)、骨髓抑制(中性粒细胞减少、血小板减少)、神经毒性(轻度麻木和感觉异常)、心血管毒性(低血压、无症状的短时间心动过缓、肌肉关节疼痛)、胃肠道反应(恶心、呕吐、腹泻、黏膜炎)、肝脏毒性和脱发,对紫杉醇类药物过敏和中性粒细胞计数<1 500个/mm3的患者禁用该药。我国白蛋白结合型紫杉醇说明书中提到的主要不良反应与前二者基本一致,包括骨髓抑制、胃肠道反应、呼吸困难、肌肉痛、关节痛、乏力、中性粒细胞减少伴发热、脱发、皮疹、肝功能异常等,若患者外周血中性粒细胞计数<1 500个/mm3则禁用该药。我国多西他赛说明书中常见不良反应为免疫系统疾病(面部潮红、伴或不伴有瘙痒的皮疹、胸闷、背痛)、各类神经系统疾病(感觉异常、烧灼痛、无力)、皮肤及皮下组织疾病(手、足部的局部皮疹、瘙痒)、肝毒性及体液潴留,对于胆红素>正常值上限的患者,或者AST和/或ALT>正常值上限1.5倍合并碱性磷酸酶>正常值上限2.5倍的患者,以及中性粒细胞计数<1 500个/mm3的患者,应避免使用多西他赛。
3.6 小结 本研究基于OpenFDA数据库对4种紫杉醇类抗肿瘤药物的不良反应进行了较全面的比较与分析,其适应证、不良反应与我国相应药物说明书基本一致,临床治疗时应密切关注药物的不良反应,必要时开展药学监护,促进临床合理用药。由于OpenFDA数据库是一种自发呈报系统,不良反应上报数据可能不全面,而且无法获取患者详细的用药记录,导致无法分析药物剂量和用药疗程与不良反应发生的关系。但是总体而言,OpenFDA数据库作为药品不良反应的大数据库,对于挖掘药品不良反应及分析具有重要意义。

