科技伦理审查制度建设中的主体、程序与方法优化

摘 要:充分发挥伦理审查在科技伦理治理中的作用,必须重视伦理审查相关机制构建与完善。目前我国伦理委员会建设、伦理审查程序运行、伦理审查方式方法应用等方面的机制还存在一些欠缺和不足,影响科技伦理审查质量和效率,亟需寻求对策加以优化。通过案例探讨、数据分析、域外经验借鉴等方法与途径进行研究,得到如下结果:一是在伦理委员会建设上,构建相关认证机制,提高准入门槛,以全面均衡地提升伦理委员会综合实力,通过人员聘用、单独建制、财务支持等路径增强伦理委员会独立性,通过制度约束、业务培训、指导监督,不断提高伦理委员会审查能力;二是在伦理审查程序运行上,完善利益冲突回避机制,合理确定回避主体范围等,根据研究风险等级启用相应审查程序,实行分级分类管理;三是在伦理审查方式方法上,优化审查结果互认机制,通过结果互认提高审查效率和质量,并加强伦理审查信息化建设,推进伦理数據标准化,健全信息系统权限管理制度。
关键词:科技伦理审查;伦理委员会;审查程序;审查方法
DOI:10.6049/kjjbydc.2022090612
中图分类号:G311
文献标识码:A
文章编号:1001-7348(2023)06-0121-09
0 引言
科技发展能够推动社会进步、造福人类,同时,也会引发一定的社会风险和伦理挑战。在当下知识极易扩散的互联网时代,科技给人类带来了很多便利和福祉,但科技伦理失灵导致的科技危机也成为人类面临的重大挑战[1]。最近一二十年来,全球范围内出现一些触及伦理边界的科技事件,如法国进行世界首例换脸手术,美国机构在中国湖南衡阳利用儿童测试“黄金大米”,中国深圳市科研人员贺建奎实施以生殖为目的的人类胚胎基因编辑和生殖医疗活动等,对社会伦理形成强烈冲击,引发公众普遍关注和热议,导致人们产生科技伦理恐慌。
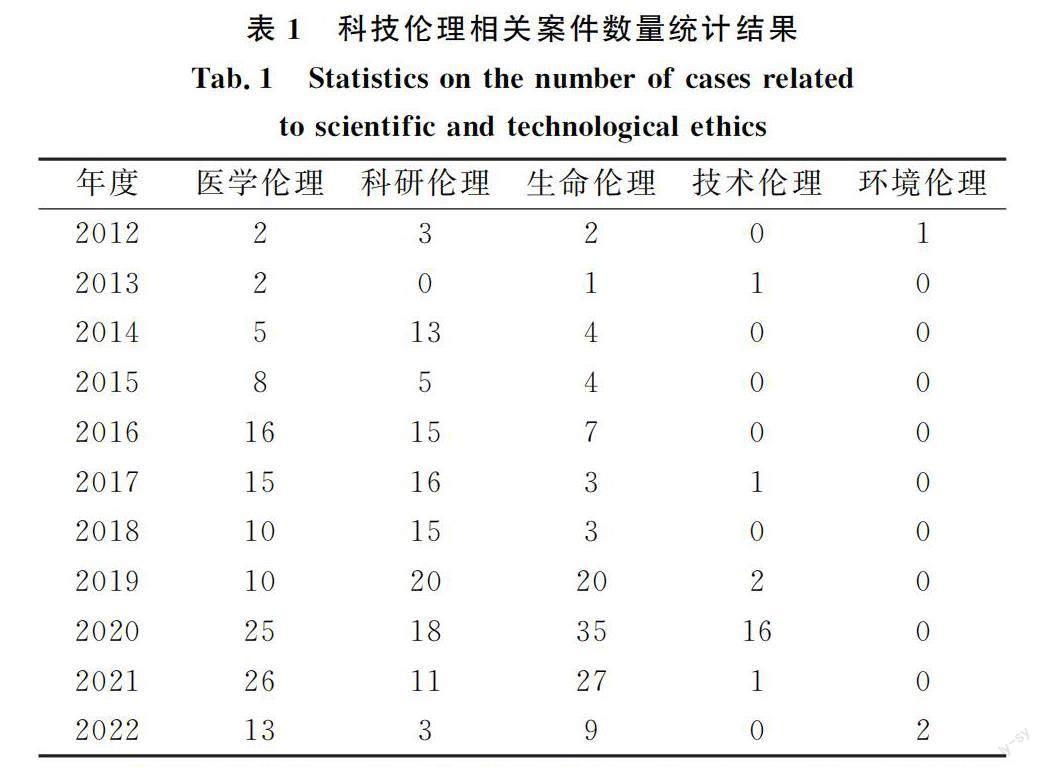
在我国司法实践中,关涉科技伦理的案件不断增加,具体涉及医学伦理、科研伦理、生命科学伦理、技术伦理等方面。通过中国裁判文书网、北大法宝、北大法意等数据库,检索2012年1月至2022年6月法院审结的案件发现,每年都有科技伦理相关案件出现,如表1所示。这些案件中,除医学伦理案件外,关涉科研伦理的案件亦不在少数,共119例,较多涉及科研活动中违背诚信、客观、公正、负责等伦理原则的不端行为,如抄袭剽窃他人研究成果,伪造、篡改研究数据,以及科研成果不当署名等。
通过数据库检索还发现,涉及生命科学伦理的案件多为民事诉讼,其中案由涉及“冷冻胚胎”与“伦理”的案件有78起,诉讼请求集中于冷冻胚胎返还和继续胚胎移植手术。较为典型的案例有“郭某诉淮安市某医院要求继续履行胚胎移植医疗服务合同纠纷案”,其原告婚后长期未孕,遂在淮安市某医院进行人类辅助生殖技术治疗,但胚胎培养成功后丈夫去世,原告要求医院继续履行合同,实施胚胎移植手术。
我国越来越重视科技伦理治理,出台了一系列政策法规。2019年7月中央全面深化改革委员会第九次会议审议通过《国家科技伦理委员会组建方案》,其意义不仅在于组建一个新机构,还在于加强统筹规范和指导协调,推动构建规范有序的科技伦理治理体系。2021年12月,新修订的《中华人民共和国科学技术进步法》增加了有关科技伦理治理的规定,其中,第98条要求“健全科技伦理治理体制”,第103条涉及科技伦理委员会建立、科技伦理制度规范完善等内容。2022年3月中共中央办公厅、国务院办公厅印发《关于加强科技伦理治理的意见》(以下简称“两办《意见》”),对科技伦理治理工作作出顶层设计和系统部署,旨在提升科技伦理治理能力,有效防范科技伦理风险,促进我国科技事业健康发展。
加强科技伦理治理,须强化科技伦理审查工作。传统科技一般在应用阶段才会产生伦理问题,而现代新兴科技(如基因科技)常在研究和应用之初就产生系列伦理问题,存在伦理始涉性。因此,对科技活动实施伦理审查,在开展相关研究之前由伦理委员会审查其方案计划,有利于尽早发现违背伦理道德的研究项目,及时阻止或纠正,同时,可增强科研人员的科技伦理意识,使其在研究中遵循科技伦理原则,从而避免前沿科技创新可能带来的伦理风险。因此,科技伦理审查是科研人员从事负责任研究和创新的重要防线,是取得高质量研究成果的安全锁和防火墙[2],有利于避免科技的工具理性价值与人类社会伦理道德向善之间的冲突[3]。科技伦理审查是科技伦理治理体系的重要组成部分,也是科技伦理治理的重要手段,科技伦理审查机制应成为科技伦理治理的基础性制度。目前我国科技伦理审查制度尚处于发展阶段,有待进一步探索和完善,正如习近平总书记强调“要前瞻研判科技发展带来的规则冲突、社会风险、伦理挑战,完善相关法律法规、伦理审查规则及监管框架”[4]。
科技伦理审查制度构建和完善,是一项浩大、繁难的系统工程,本文选取有关科技伦理审查工作机制的3个重要问题进行探讨,以期推进科技伦理审查制度建设。
1 伦理审查主体建设路径优化
对科研单位伦理审查工作落实与开展而言,伦理(审查)委员会是主要承担主体。《中华人民共和国科学技术进步法》第103条明确提出建立科技伦理委员会,并强调高校、企事业单位等应履行科技伦理管理主体责任,开展科技伦理审查;《涉及人的生物医学研究伦理审查办法》规定,相关机构应设立伦理委员会,并保障其独立开展伦理审查工作;两办《意见》指出“涉及人、实验动物的科技活动,应当按规定由本单位科技伦理(审查)委员会审查批准”。
伦理(审查)委员会作为伦理审查的执行主体,在科技伦理审查中扮演十分重要的角色,关乎科研机构伦理审查质量和效率,是保障审查效果的关键性因素,其工作有助于理性确定科技自由与法律道德禁区之间的界限[5]。因此,加强伦理(审查)委员会组织建设和能力建设十分重要。
1.1 建立伦理委员会及其成员认证机制
从20世纪90年代中期开始,我国各类机构伦理(审查)委员会建设进入快速发展时期,在人员组成、审查标准、审查流程等方面逐步规范,对科技伦理治理、科技发展起到积极作用。但伦理(审查)委员会建设仍存在一些问题,比较突出的是发展不均衡、机制不统一。有些伦理委员会存在规章制度不完善、人员组成与审查不规范等问题[6];有些伦理委员会虽已成立,但缺少有资质的成员,缺乏岗前培训与继续教育[7],且区域内各机构伦理审查委员会之间缺乏行业共识,伦理审查的同质化水平不高[8];动物伦理委员会可参照的审查规范不多,加之大多数研究者的动物实验伦理意识薄弱,导致动物实验伦理审查的严格程度和实施水平尚不理想[9]。
实现伦理委员会建设的规范化、标准化、同质化,全面均衡地提升伦理委员会及其成员的综合实力,充分保障各机构伦理审查质量和效率,则有必要建立伦理委员会及其成员认证制度,通过准入考核、注册监督、系统培训等,确保伦理审查人员的综合素质和专业水准。
伦理审查制度较为成熟的国家,一般设置了伦理委员会认证机制,以提高伦理委员会准入门槛。如美国的人体研究保护项目认证协会(AAHRPP)是国际上著名的非营利伦理委员会认证机构,由美国医学院协会、美国大学联合会等第三方团体组成。AAHRPP根据相关书面材料、实地考察材料、申请者答辩情况等,作出完全认可、合格认可、待认可和保留认可的结论(见图1)。其还有后续的监督、培训等职能,比如,在首次认证后3年、首次复审合格后每5年对申请者进行复查,并将认证续期申请的决定分为完全认可、试用、撤销认可和待审再认可,对不再符合要求的伦理委员会撤销认证。
可以借鉴国际社会伦理审查认证经验,立足我国基本国情和伦理价值理念,建立和完善伦理委员会及其成员认证机制。
(1)建立权威、统一的伦理审查委员会专业资质认证体系。两办《意见》指出:“建立健全科技伦理(审查)委员会的设立标准、运行机制、登记制度、监管制度等,探索科技伦理(审查)委员会认证机制。”应积极探索针对不同类型的机构伦理委员会,制定准入、注册、培训、监管等工作指南和规范,其中,准入工作要具体划定研究机构设置伦理委员会的门槛,明确伦理委员会准入条件、准入标准、准入程序,推动伦理委员会专业化与规范化建设。
(2)成立专门的伦理审查认证机构。伦理审查认证机构应被赋予准入考核、培训教育、监督复查等职能,并依据专业资质认证指南和规范,对特定范围内机构伦理委员会及其成员进行考察和认证。如果伦理审查认证机构定位为相关行政部门主导的社会团体性质的民间组织,则更具合理性和实效性。以相关行政部门为主导,则伦理审查认证机构可以得到行政部门的指导和监管,在国家法律法规的框架内规范运作,并遵循社会主流伦理价值观,同时,便于相关行政部门发挥统筹协调优势,调动和整合各方資源建设伦理审查认证机构。将伦理审查认证机构定位为非政府民间组织,可与国际通行做法接轨,有利于与国际相关机构交流合作。
1.2 增强伦理审查主体独立性
伦理审查主体保持独立性,是排除伦理审查干扰因素、保障审查结果客观公正的重要前提。Benz[10]强调相关治理角色应保持高度独立性;樊春良等(2022)提出要保持科技管理机构的独立性。在实践层面,国家政策法规一再强调机构伦理(审查)委员会独立开展工作,如《涉及人的生物医学研究伦理审查办法》指出“采取有效措施保障伦理委员会独立开展伦理审查工作”,两办《意见》指出“科技伦理(审查)委员会要坚持科学、独立、公正、透明原则”。
就目前伦理审查实践来看,伦理审查委员会在工作独立性上还有所欠缺。比如,一些机构伦理委员会的负责人由机构领导担任,领导可能放宽伦理审查要求,给予一些重大研究项目“特殊照顾”[11];伦理委员会的运行经费主要来源于所属机构(高尚荣,2016),经费上的依赖性容易对伦理委员会独立开展工作形成掣肘。
鉴于上述情形,应采取有效机制和对策保证伦理审查独立性,提升审查结果公正性和公信力。
(1)通过聘用、回避等方式尽力规避科研机构内部因素可能对伦理委员会工作产生的不利影响。目前,伦理委员会大都由科研机构设立,其成员一般是机构内部人员,这给独立开展审查工作带来一定难度。为尽量减少同事关系、利益关系带来的不利影响,可以采取如下措施:①尽量聘请外单位人员担任伦理委员会委员,特别是聘请外单位专家担任伦理委员会顾问;②当伦理委员会成员与研究项目存在利益关系时,严格执行回避制度;③主任、副主任委员不由单位行政领导(如院长、所长)兼任,最好由具有相应资质的权威专家担任。
(2)为伦理委员会提供独立的场所、设备、人员编制等。机构伦理委员会应设立独立建制的办公室,拥有专门的办公场所、会议室、资料室,以及办公所需基础设施等。此外,还应为伦理委员会办公室配备专职秘书及相关工作人员。
(3)通过财务支持等途径促进伦理委员会独立开展工作。科研机构应为伦理委员会设立专项经费预算,使之拥有相对独立的财务管理办法。此外,伦理委员会应经常组织全体成员进行交流学习,提升成员职业道德素质。
1.3 加强制度约束、业务培训、指导监督
(1)制度约束。伦理委员会应在国家相关法律法规框架内制定切实可行的管理制度和严谨明晰的伦理审查操作规程,并不断优化完善,以保证伦理委员会审查工作在制度规范的约束和引导下有序开展,促进审查能力提升。
(2)业务培训。对伦理委员会委员进行持续、系统化培训,如采取专题讲座、沙龙座谈、案例研讨、考察访问等方式,加强科技伦理知识和相关法律法规知识学习,提升委员的履职能力、业务水平。
(3)指导监督。各级行政主管部门及其伦理专家委员会要加强对伦理委员会工作的指导和监管,通过颁布政策规则、提供咨询建议、实施检查评估等方式,促使伦理委员会守正纠偏、补短强弱,不断提升审查能力。另外,可引入独立的第三方机构进行监督,通过考核评估加强伦理委员会审查能力建设。
2 伦理审查程序优化
科技伦理治理必须注重相关程序建构和完善,包括伦理审查程序。伦理审查程序的科学化、规范化和实质化,是保障伦理审查效率和质量的关键所在,有助于准确预判和有效规避科技活动中可能出现的伦理风险,体现程序正义的价值诉求(杨博文,2022)。我国出台了《涉及人的生物医学研究伦理审查办法》等法规文件,对伦理审查程序作了规定,这对于填补新兴科技带来的伦理缺口,保障科技活动健康发展具有重要作用。但是,我国科技伦理审查起步较晚,审查程序及运行机制尚不够完善,有必要加强程序机制建设。
2.1 完善利益冲突回避机制
在科技伦理审查实践中,伦理委员会及其成员与申办方、研究者、受试者等之间可能存在利益冲突,有必要采用回避等方式予以管理,确保审查结果客观公正。
伦理审查制度较为成熟和完善的国家,比较注重利益冲突管理,在利益冲突回避上形成了较为完备的法律法规。例如,美国联邦法规第45章第46条规定了机构伦理审查委员会(Institutional Review Board,IRB)的责任,确立了利益冲突回避原则:每个IRB至少应有一名成员不属于该机构,也不属于该机构成员的直系亲属;所有IRB成员不得参与任何与初始审查及后续审查存在利益冲突的项目。美国卫生与人类健康服务部设立了受试者保护办公室(Office for Human Research Protections,OHRP),主要负责对伦理审查工作进行监督,其发布了《涉及人体受试者研究中的利益关系:受试者保护指南》(以下简称《指南》)。《指南》指出,当相关利益影响到受试者权益时,就会发生利益冲突,包括经济利益冲突和非经济利益冲突;伦理委员会审查时必须考虑研究团队成员、伦理委员会、科研机构之间可能的利益冲突,各机构伦理委员会必须制定利益冲突管理政策,界定“伦理委员会成员的利益冲突”,明确其成员何时需要报告利益冲突并在伦理审查中予以回避。在《指南》的指引下,美国各机构伦理委员会制定了具体的利益冲突回避制度,并予以严格执行,取得了较好成效[12]。
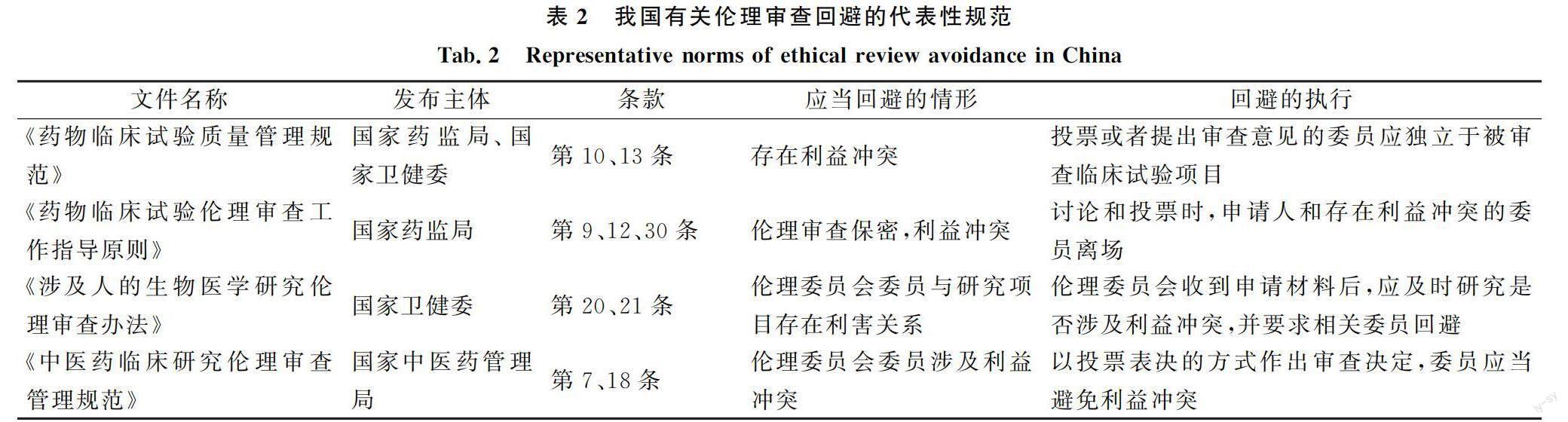
关于伦理审查中的利益冲突回避问题,我国已通过一些规范性文件作出规定,如表2所示。
我国规范性文件对利益冲突回避有一些规定,但较为粗略。比如,如何认定伦理委员会委员与研究项目存在利害关系?其利益冲突有哪些表现形式?回避程序究竟如何实行?这些都没有具体规定,可操作性不强,可能导致其执行流于形式。完善和优化利益冲突回避机制,需着重处理好如下几个问题:
(1)合理确定回避主体范围。从相关文件规定来看,伦理审查的回避主体仅仅是伦理委员会委员,未涵盖伦理委员会其他相关人员,回避主体范围显得狭窄,难以保证审查不受干扰。应立足我国现实国情,适当扩大回避主体范围,在发生利益冲突时,除伦理委员会委员需要回避外,其他相關人员如秘书、行政人员也应在回避之列。
(2)明确应当回避的具体情形。对于伦理审查出现利益冲突而应回避的情形,相关规范性文件往往以“存在利害关系”“存在利益冲突”之类的模糊语言进行陈述,不便于实际操作。借鉴美国明确界定伦理委员会利益冲突情形的做法,中国伦理审查制度可对相关内容作出具体规定。参考吕刚等[13]研究,可以将伦理审查中存在利益冲突而应回避的情形分为如下几种:①经济利益冲突,主要表现为伦理委员会成员与申办方、研究者之间存在经济往来,如获得后者给予的股票及期权、咨询费、演讲酬金、作为专家证人的报酬等;②精神利益冲突,指伦理委员会成员可能利用职权之便获得非物质利益,如学术地位、荣誉声望、著作人身权等;③社会关系利益冲突,指伦理委员会成员具有基于血缘、地缘、学缘、业缘等形成的社会关系网络,且在伦理审查中可能通过其社会关系人获利而取得间接利益;④负利益冲突,指研究参与者(申办方、研究者等)或研究项目本身可能对伦理委员会成员带来利益损害等。
(3)改进回避程序的执行规则。相关法规制度关注和强调伦理委员会委员自行回避,这是将伦理审查的客观公正建立在个体德性的基础上,仰赖个人自律性、主体性,可能导致伦理审查结果不公。应充分尊重申办方、研究者乃至受试者的合法权益,允许他们提出回避申请,并将当事人的申请回避作为重要的程序权利加以确认。依据《药物临床试验伦理审查工作指导原则》等文件规定,存在利益冲突的伦理委员会委员的回避只是在投票决定环节,而未涉及审查过程的其它环节,这忽视了多环节的回避,难以保证程序正义。为公正起见,利益相关委员的回避应贯穿伦理审查工作全过程。
2.2 完善分级分类审查程序
在科技伦理审查实践中,应基于风险等级分级和风险—受益评估,区别不同情形,采用不同审查程序和审查办法,根据研究风险等级进行分类管理,以减少或免除研究者和伦理委员会不必要的负担,提高审查效率,同时,使得伦理委员会有更多时间和精力审查并管理那些风险高、伦理挑战大的科研项目。有些国家依据研究风险级别确定伦理审查级别,启用相应审查程序。如2010年加拿大颁发第2版《三理事会政策宣言:涉及人类研究的伦理指导》,对研究涉及的伦理风险分级及其内涵作出具体说明和界定,并对不同风险等级研究项目应采用的审查程序作了详细规定[14]。关于分等级、分程序开展伦理审查,我国制定了一些规范,如表3所示。
从相关规范来看,总体上较为粗简。如《生物医学新技术临床应用管理条例(征求意见稿)》只明确了高风险生物医学新技术研究涉及的范围,如基因转移技术、基因编辑技术、基因调控技术等,至于中低风险研究情形则未提及。科技伦理分等级、分程序审查机制建设还存在不足,致使审查实践面临诸多困难。比如,对伦理风险缺乏清晰完整的界定,以致难以把握分级标准;伦理风险等级与伦理审查级别的对应关系尚不明确,以致难以依法依规区分审查类别;对分级后审查程序的适用缺乏明细规定,以致难以恰当地选择和使用相应审查程序。鉴于此,应做好如下两方面工作:
(1)制定伦理风险评估标准,对风险分级及其内涵作出明确界定。风险—受益评估是伦理审查的重要内容,应加强这方面的探讨,对科技伦理风险进行合理明晰的等级划分和界定。比如,对于科技活动所带来的环境健康风险评估与预防,应综合多方面因素对风险等级进行明确规定[15]。许多国家和地区比较注重科技伦理风险等级评估标准建构,如欧盟发布《人工智能法案》,秉持风险分级、凸显道德优势的治理理念[16],将人工智能应用场景分为4类风险等级:①极小风险(Low or Minimal Risk),如允许自由使用人工智能电子游戏或垃圾邮件过滤器等应用;②有限风险(Limited Risk),指包含公开透明义务的人工智能系统;③高风险(High Risk),指产品安全组件、关键性基础设施、公民教育、涉权型执法等领域的人工智能应用;④不可接受的风险(Unacceptable Risk),指对人类安全与基本权利构成威胁的人工智能应用[17]。又如,美国密歇根大学在临床医学试验中根据受试者受害程度将研究风险分为4个等级,并界定和阐述各级风险内涵:一是不超过最小风险(No More Than Minimal Risk),指研究中可能造成的伤害、不适具有可预测性,且不超过受试者在日常体检与心理测试中产生的不适;二是略微超过最小风险(Minor Increase Over Minimal Risk),指风险程度介于中度风险与不超过最小风险之间的一种风险等级;三是中度风险(Moderate Risk),指临时的、中度的身体伤害或者疼痛(持续超过一天),短暂的声誉受损或情绪沮丧,或因缺勤导致的中度经济损失;四是高风险和危及生命的风险(High Risk & Life-Threatening Risk),指死亡、器官永久损害、长期声誉受损、因残疾造成失业等。一些国家依据此类评估标准进行科技伦理风险评价和审查,在初始审查中筛除那些风险大且不合伦理原则的研究项目,或在持续性审查(后续跟踪审查)中暂停或终止研究过程中出现不可控风险的项目,体现了基于风险的规制思路[18]。其评估标准有时还用于相关司法实践,如美国威斯康星州诉卢米斯案,法院曾参考风险评估工具COMPAS得出的結论作出判决[19]。中国可借鉴国外风险—受益模型和相关实践经验,结合国内实际,探索适合中国的风险评估模式,在各科技领域形成统一的风险评估标准,为伦理审查实践中科学合理划分伦理风险等级奠定基础。
(2)依据风险等级对审查程序作出合理分类,通过程序安排实现审查资源优化配置,充分发挥程序在伦理风险防控中的作用。笔者认为,依据研究风险等级,审查程序可设定为3类:高风险等级伦理审查程序、较高风险等级伦理审查程序、低风险等级伦理审查程序。由此,可针对不同风险等级的审查程序作出具体要求,制定不同工作流程和操作规范,从而达到审查程序宽严繁简分流的目的,实现科技伦理分级管理,提升工作效率,并有效规避不符合相关政策要求的研究设计,以防范风险。我国现行政策法规对上述分级审查程序也有一些规定,但总体上较为粗疏。比如,对一些低风险的研究,相关部门规定了快速审查程序或简易审查程序,如2010年版《药物临床试验伦理审查工作指导原则》第25条对于快审规定了3种情形:对IRB已批准的临床试验方案进行较小修正者、尚未纳入受试者、预期的严重不良事件。但实践中遇到紧急情况,对于相关研究是否采取快审程序进行审查,颇难决断[20]。
3 伦理审查方式方法优化
3.1 优化审查结果互认机制
科研机构建立协同共治合作模式,实施伦理审查互认,是提高伦理审查效率和质量的一种有效方式。它有利于避免重复审查、节省审查成本,也有助于科研机构相互促进,加快新技术研发和推广应用。2017年中共中央办公厅、国务院办公厅印发《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》,指出“逐步推进伦理审查互认”。2022年中共中央办公厅、国务院办公厅印发《关于加强科技伦理治理的意见》,强调“逐步建立科技伦理审查结果互认机制”。在国家层面政策指引下,一些机构、地区积极探索,整合资源,构建伦理协作审查机制,推行伦理审查结果互认。例如,浙江省已有11家单位建立了临床试验伦理协作审查联盟,浙江互联网金融联合会发起成立了全国首个省级金融科技伦理委员会,积极推进伦理审查互认[8];长三角地区的沪苏浙皖在生物医药产业链联盟建设中,初步建立长三角药品医疗器械检查互认互信合作机制,推进长三角多中心临床研究伦理审查结果互认[21]。
就目前情况来看,伦理审查互认工作有必要建构和完善相关机制。
(1)构建具有同质性的审查标准,促使审查结果具备认可度。目前,审查互认接受率较低,现实案例也非常少,比如全国有近900家药物临床试验机构,但重大新药创制平台单位之间进行审查互认的只有38家。造成这种局面的一个重要原因是审查质量的可靠性缺乏保障,审查标准的一致性和同质性较差(盛艾娟,2020)。各机构伦理审查执行标准不一,影响审查结果质量,导致互认困难。因此,建立伦理协作审查关系的科研单位需根据国家相关法规和指南的要求,建立同质性审查标准,确定伦理审查操作流程及工作细则。审查标准应对伦理审查范围、基本要求与基本流程以及规范性引用文件、文档管理和评估等作出详细规定,特别是对伦理审查工作中使用的各种表格(如伦理审查申请表、伦理审查受理通知)、模版(如会议议程模版、会议记录模版、伦理审查批准函模版、评审表模版等)、文件清单作出具体明晰的规定。通过审查标准构建和完善,推进各机构伦理委员会工作的规范、统一,提升伦理审查质量和同质化水平,为促进审查结果互认奠定基础。
(2)发挥联盟主管部门或依托单位的作用。目前,一些地方的伦理审查互认联盟是在平等自愿、互利共赢的基础上形成的共享联合体。其所开展的伦理审查互认工作在共同规则的约束下进行,约束缺乏刚性,因此应设立一个各单位均认可的机构进行管理或依托,由此获得有效开展工作的组织保障。管理或依托的机构可以是政府相关主管部门,也可以是相关科研单位,负责伦理审查互认的组织实施、管理监督。从实践来看,上述做法能取得较好效果,如北京市医学伦理审查互认联盟顺利成立并正常运行,这与北京市卫健委的指导和监管有着密切关系。该联盟实行秘书单位工作制和轮值制,并以秘书单位为依托单位,负责制定联盟相关制度、管理成员单位进入和退出事宜,指导开展伦理审查互认等工作。
(3)加强多个单位承担不同研究任务的合作项目的伦理审查互认机制建设。针对多中心科学研究(如多中心临床医学研究)伦理审查协作互认方式和机制,官方规范性文件也作出了一些规定。但在科研实践中,多家单位(如科研院所、高校、企业)、多个学科(如生物学、物理学、工程学)合作项目涉及的伦理审查和审查互认问题较少得到关注,导致多单位共同承担的项目在伦理审查互认上遇到梗阻。目前,多单位承担不同研究任务的合作项目愈来愈多,且时常涉及伦理问题,故应关注和探寻此类研究项目伦理审查、结果互认的有效方式与路径。笔者认为,参与此类合作项目的各方首先应签署伦理协作审查互认协议,然后由牵头单位负责受试者招募和筛选、试验干预、指标评估、数据统计分析等事宜,并接受伦理委员会审查,其它合作单位则认可牵头单位审查结果,不再重复审查或者通过快审程序进行审查。当然,伦理委员会无论是审查合作项目牵头单位的研究,还是审查合作单位的研究,都应将合作项目视为一个系统而有机的整体,审核其整个研究方案并作出是否符合伦理要求的评判。
3.2 加强伦理审查信息化建设
随着信息技术的高速发展以及科技伦理审查工作要求的提高,传统的纸质化工作模式已难以满足伦理审查工作的需要,必须加快推进信息化系统在伦理审查工作中的应用,提高信息化管理水平。
加强伦理审查信息化建设,有利于取得多方面良好效应。首先,可以提高伦理审查工作效率。以人工记录、纸质存档等传统手段开展审查工作,需耗费大量物力人力,而采用信息化手段,不仅便于伦理申请人提交文件,而且可以为伦理委员会保存、传递、调阅相关文件以及沟通衔接提供极大便利,在节省物力人力的同时保证信息传递时效性、交互性,有助于缩短审查周期。其次,可以提高伦理审查工作规范性、精准性。在信息化系统程序的控制下,可促使上传的审查资料符合规范要求;系统的自动跟踪提醒功能,可使每一个审查环节、步骤在必要时间节点上得到关注和落实,避免人工操作出现的疏忽遗漏,从而提高审查规范性、准确性。最后,可以促进伦理审查流程标准化建设。一些科研单位的伦理委员会下设多个领域伦理委员会,或者有协作关系的不同单位都设立伦理委员会,它们拥有各自不同的审查流程。如果建立伦理审查信息平台,则可以统一各伦理委员会审查流程,实现流程标准化。
伦理审查信息化已经成为发展趋势。2000年WHO发布《审查生物医学研究的伦理委员会工作指南》,倡导“国家、单位和社区应该努力建立伦理委员会和伦理审查系统,以保证能为未来的研究参与者提供尽可能广泛的保护”。近年来我国不断有伦理委员会启用电子信息系统,实现项目审查在线操作。例如,华东师范大学伦理委员会于2020年开通网上伦理审查系统,对教师和学生的研究项目进行科研伦理审查,实现从线上申请、审查、意见反馈、修稿提交到线上投票、批准函发放的全过程管理[22];北京市医学伦理审查互认联盟的48家联盟单位中,有29家已使用伦理电子信息系统(李晓玲,2021)。
我国伦理审查信息化建设已取得一定成绩,但还存在一些不足,需采取一定措施加以强化和推进。
(1)政府及有关部门应采取有效措施,加快伦理审查信息化建设步伐。我国科技伦理审查信息化程度不高,政府及相关机构主动公开相关信息的意愿不足[23]。据调查,我国药物临床试验机构只有7.8%的伦理委员会建立了伦理审查系统,77.68%的伦理委员会仅有日常办公软件[24]。即便是经济、科技较为发达的深圳市,情况亦不容乐观,该市48家医疗机构设立了伦理委员会,只有8家(占16.67%)伦理委员会拥有电子伦理审查系统,而且大多只是医院科研管理或药物临床试验管理系统的一个模块(许卫卫,2019)。由上可见,伦理审查信息化覆盖面尚不广泛,且信息化程度普遍偏低,故有必要加快伦理审查信息化建设步伐,整体提升伦理审查信息化水平。为此,政府及有关部门应进一步出台相关法规和政策,予以引导和强化;构建和完善持续、稳定、有效的经费投入机制,为伦理审查信息化建设提供物质保障;组织信息技术培训与交流,提高相关人员信息化技术使用能力[25],为伦理审查信息化推广和普及奠定基础。
(2)加强数据标准化建设,实现伦理信息互通共享。做好纸质数据电子化、电子数据标准化工作,建立规范的电子数据应用标准,消除电子数据的不一致性,实现数据资源科学管理和共享应用。开展伦理审查互认、区域伦理审查等,要求基于数据标准化实现相关伦理数据信息的互联互通、共建共享。此外,为加强科研伦理审查,惩戒剽窃抄袭、篡改或捏造数据等学术不端行为,推动科研诚信建设,有不少单位和地区积极推进科研诚信信息的跨时空共享应用。因此,只有实现数据信息标准化,建立数据共享机制,才能促进更多单位参与到科研诚信信息共享平台建设中来,并利用平台信息对学术不端行为进行审查、监督和惩处。但就目前情况来看,用于伦理审查的数据平台大多由相关单位与数据供应商合作建设,而供應商的管理系统(ECMS)在技术标准上存在差异,致使不同单位的平台数据难以互联互通和共享,制约伦理审查信息化发展。因此,推进伦理审查电子数据标准化建设,实现跨机构或跨地区的数据资源互通共享已成为当务之急。可由相关科研主管部门或科研单位牵头,对数据平台建设进行整体统筹,确立伦理资源数据采集方式、基本内容、存储格式、信号编码、传输方式等应遵循的基本原则,建构统一、科学、规范的资源数据标准体系,切实解决平台数据标准范围过窄、通用性差、适用性不强等问题,从而实现伦理数据信息跨机构或跨地区交换共享。
(3)健全信息系统权限管理制度,为维护数据安全、确保审查过程真实性提供保障。在科技伦理审查信息化建设过程中,现代信息技术手段一方面能助力伦理委员会提高审查效率和质量,另一方面使得个人隐私、试验记录等信息存在被窥探或滥用的危险。因此,有必要关注和强化信息安全管理工作,特别是加强信息系统权限管理。数据系统主要通过权限管理和轨迹追踪技术实现数据信息保真性、可溯源性,以使各种信息内容(电子印章、签名等)和信息处理过程真实可靠和便于验证。但现阶段,信息系统权限管理还不完善,存在职能权限不清晰、权限分配不严谨等问题,最终可能导致信息泄露或被篡改,特别是ECMS多采取用户名加密码的形式进行权限管理,而其安全性往往不足,容易引发不能有效追溯和验证伦理审查过程的风险。鉴于上述情况,应重点关注系统用户权限管理,使级别权限设置安全可靠,防止非法操作编辑[26]。在系统权限管理功能上,应根据具体需要分配各级各类用户(研究者、申办者、伦理委员会成员等)的访问权限,并坚持权限功能设计的两个基本原则:每个用户只能浏览、操作权限之内的菜单和功能界面;权限系统对所有访问请求进行审查过滤,自动拒绝非法访问。另外,应遵照《中华人民共和国电子签名法》等法律法规要求,推广和应用电子签名、电子印章、电子校验等技术,使伦理审查信息系统能够对接国家级CA认证中心、存证机构,解决身份认证、授权管理等方面的问题,以保证数据信息安全,同时,有利于快捷高效地开展伦理审查。
4 结语
科学技术的高速发展,特别是一些新兴技术的突飞猛进,令全社会共享其利,但其带来的伦理风险也日益凸显。推动科技伦理治理,防范科技伦理风险,已成为时代赋予的新课题、新使命。伦理审查是行之有效的科技伦理治理手段,完善的伦理审查机制对规范前沿科技领域研究和创新具有重要作用。应从国家科技自强自立、国家科技治理体系和能力现代化的高度,重视和加强伦理审查机制建设。我国伦理审查机制建设和制度安排已取得很大成效,但仍有待进一步推进和完善。伦理委员会建设、伦理审查程序运行、伦理审查方式方法应用直接影响伦理审查质量和效率,应积极探索和寻求对策,完善和优化相关机制,形成科学、健全的科技伦理审查制度体系,为高质量、高效率地开展伦理审查活动提供保障,进而有效规避科技伦理风险。
参考文献:
[1] 刘益东.致毁知识增长与科技伦理失灵:高科技面临的巨大挑战与机遇[J].中国科技论坛,2019,35(2):1-3.
[2] 李建军.如何强化科技伦理治理的制度支撑[J].国家治理,2021,42(2):33-37.
[3] 陈书全,王开元.国家治理视域下科技伦理审查的制度路径[J].科技进步与对策,2022,39(18):110-120.
[4] 习近平.在中国科学院第二十次院士大会、中国工程院第十五次院士大会、中国科协第十次全国代表大会上的讲话[N].人民日报,2021-05-29(2).
[5] 徐明.论生命科技的挑战与立法应对[J].科技进步与对策,2013,30(5):106-110.
[6] 樊景辉,张文洁,苏健芬,等.基层医院伦理委员会建设存在问题及对策[J].医学与哲学,2020,41(6):29-31.
[7] 李建军,王添.科研机构伦理审查机制设置的历史动因及现实运行中的问题[J].自然辩证法研究,2022,38(3):51-57.
[8] 姜慧,张皓,朱旭迪,等.共同富裕示范区科创高地建设科技伦理反思性高阶“元治理”路径[J].科技管理研究,2022,42(10):211-219.
[9] 张维,熊鸿燕,邓强庭,等.医学论文中涉及动物实验和临床试验的伦理规范调查及案例分析[J].中国科技期刊研究,2017,28(4):300-305.
[10] ARTHUR BENZ. Governance: a political science perspective[M]//JANSEN D. New forms of governance in research organizations:from disciplinary theories towards interfaces and integration. New York: Springer,2007.
[11] 吴爵,孙云,蒋辉.影响伦理审查工作独立性的因素及对策分析[J].中国医学伦理学,2019,32(11):1383-1387.
[12] MARKMAN MAURIE."Conflict-of-Interest" and participation in IRB deliberations: an alternative perspective[J]. Cancer Investigation,2008,26(2):115-117.
[13] 吕刚.浅析临床研究伦理审查的个人利益冲突对策[J].知识经济,2016,18(16):54-55.
[14] MARTIN TOLICH,BARRY SMITH. Evolving ethics envy-New Zealand sociologists reading the Canadian tri-council policy statement: ethical conduct for research involving humans[J]. New Zealand Journal of Social Sciences,2014,9(1):1-10.
[15] 朱炳成.環境健康风险预防原则的理论建构与制度展开[J].暨南学报(哲学社会科学版),2019,41(11):51-62.
[16] 金玲.全球首部人工智能立法:创新和规范之间的艰难平衡[J].人民论坛,2022,15(4):44-47.
[17] JESSICA MORLEY, LUCIANO FLORIDI,LIBBY KINSEY. From what to how: an initial review of publicly available AI ethics tools, methods and research to translate principles into practices[J].Science and Engineering Ethics,2020,26(4):2141-2168.
[18] 曾雄,梁正,张辉.欧盟人工智能的规制路径及其对我国的启示——以《人工智能法案》为分析对象[J].电子政务,2022,19(9):63-72.
[19] 曹奕阳.人工智能时代司法裁判的机遇、挑战及应对[J].法治论坛,2019,14(3):278-290.
[20] 何金玉,陈洁纯,李婷,等.新型冠状病毒肺炎疫情期间定点收治患者的医院应急科研管理实践与思考[J].中国医学工程,2020,28(8):15-19.
[21] 于量.优化“两链”,强固补紧密协同[N].解放日报,2022-08-17(3).
[22] 王群,饶昇苹.高校科研伦理审查工作回顾与思考——以华东师范大学为例[J].中国高校科技,2021,35(S1):70-72.
[23] 田亦尧,李欣冉.科技伦理治理机制的法治因应与逻辑转换——由生物技术科技伦理规制问题展开[J].科技进步与对策,2021,38(2):121-127.
[24] 佘志华,陈舟,梁松岳.基于云架构的药物临床试验伦理审查信息化体系建设[J].中国临床药理学与治疗学,2021,26(9):1023-1030.
[25] SAND MARTIN,DURAN JUAN MANUEL. Responsibility beyond design: physicians′ requirements for ethical medical AI[J].Bioethics,2022,36(2):162-169.
[26] 曹奕陽.手机取证与隐私权保护的平衡——以现代公法比例原则为视点[J].科技与法律,2019,31(6):68-76.
(责任编辑:万贤贤)
Subjects, Procedures and Method Optimization in the Construction of
Science and Technology Ethical Review System
Cao Yiyang
(School of Law, Central China Normal University,Wuhan 430079,China)
Abstract:The rapid development of science and technology, especially the emergence of new technologies, has brought benefits to the whole society. However, the ethical risks it brings have become increasingly prominent. The ethical and moral issues are mainly related to nuclear technology, biotechnology and information technology. How to promote scientific and technological ethical governance and prevent scientific and technological ethical risks have become the new mission. For this reason, it is of great significance to strengthen the ethical review of science and technology. Ethical review is an effective means of scientific and technological ethics governance, and ethical review of science and technology follows the concept of “science and technology for good”. Ethical review is served as gatekeeper and has a very important normative effect on research and innovation in cutting-edge scientific and technological fields. In order to give full play to the role of ethical review in the governance of scientific and technological ethics, attention should be paid to the construction and improvement of relevant mechanisms for ethical review.
There are still some deficiencies in China's construction mechanisms of the ethics committee, the operation of the ethical review procedures and the application of the ethical review methods. For example, the standardization and homogeneity of the ethics committee construction are still insufficient, which affects the overall level of the ethics committee construction. The procedures and mechanisms for avoiding conflicts of interest are far from satisfactory, and this may lead to unfair ethical review results. Due to the lack of homogeneous review standards, mutual recognition of the ethical review results is highly affected. The mechanism for the construction of information technology for ethical review is not good enough, leading to a generally low level of information management. These problems will influence the quality and efficiency of the ethical review of science and technology. Therefore, it is necessary to find the countermeasures and optimize relevant mechanisms.
By using the research methodology of case study, data analysis, overseas experience, and other methods and approaches, this study concludes the following countermeasures for further improvement and optimization. (1) Regarding the construction of the ethics committee, the relevant certification mechanism should be built, and the entry threshold should be raised to comprehensively improve the strength of the committee. The independence of the ethics committee should be enhanced from three aspects of personnel recruitment, independent establishment and financial support. The review capacity of the ethics committee should be continuously strengthened through system constraints, business training, guidance and supervision. (2) As to the operation of ethical review procedures, the conflict of interest avoidance mechanism should be improved, and the scope of the avoidance subject should be reasonably determined. Scientific and technological ethical risk assessment standards should be set to define the risk classification and its connotation, and corresponding review procedures should be used according to the risk levels of research projects in the hierarchical and classified management. (3)With regarding to the ethical review methods, the mutual recognition mechanism of review results should be optimized to improve review efficiency and quality through mutual recognition. It is necessary to strengthen the construction of ethical review information, promote the standardization of electronic data, and improve the authority management system of the information system.
In conclusion, the above research can solve the specific problems existing in the practice of the ethical review of science and technology in China. By multi-party exploration, especially by drawing on the successful experience abroad, the corresponding countermeasures with strong feasibility and certain novelty are proposed. Ethical review of science and technology can effectively avoid scientific and technological ethics and safety risk. By optimizing the related mechanism of ethical review of science and technology, the good governance of science and technology can be realized.
Key Words:Ethical Review of Science and Technology; Ethics Committee; Review Process; Review Methods

