治疗前SII在结外NK/T细胞淋巴瘤中的预后价值
党倩倩,王颖熠,邓小玉,杨道科,郑颖娟
治疗前SII在结外NK/T细胞淋巴瘤中的预后价值
党倩倩,王颖熠,邓小玉,杨道科,郑颖娟
郑州大学第一附属医院放疗科,河南郑州 450052
探讨治疗前全身免疫炎症指数(systemic immune-inflammation index,SII)在结外NK/T细胞淋巴瘤(extranodal NK/T-cell lymphoma,ENKTCL)中的预后价值。回顾性分析2012年1月至2019年12月郑州大学第一附属医院确诊为ENKTCL的176例患者的临床资料,采用受试者操作特征曲线(receiver operating characteristic curve,ROC曲线)计算SII的最佳截断值,Cox比例风险回归模型进行多因素分析,Kaplan–Meier法进行生存分析。ROC曲线得到SII最佳截断值为796.74,曲线下面积为0.752。Kaplan–Meier生存分析发现SII<796.74组患者的总生存率显著高于SII≥796.74组(2=28.662,<0.001),两组患者的无进展生存率比较差异无统计学意义(2=0.756,=0.384)。单因素分析发现,国际预后指数(international prognostic index,IPI)评分、B症状、淋巴结侵犯、EBV-DNA均与患者的无进展生存相关(<0.05),IPI评分、B症状、淋巴结侵犯、EBV-DNA、SII均与患者的总生存相关(<0.05);Cox多因素分析发现,有B症状(=2.636)、有淋巴结侵犯(=2.381)、EBV-DNA≥500copies/ml(=2.212)均是影响患者无进展生存的独立危险因素;有B症状(=2.378)、SII≥796.74(=2.501)均是影响患者总生存的独立危险因素。SII是影响ENKTCL患者预后的独立危险因素,且SII值较高的患者整体生存预后较差。
结外NK/T细胞淋巴瘤;全身免疫炎症指数;危险因素;生存预后
结外NK/T细胞淋巴瘤(extranodal NK/T-cell lymphoma,ENKTCL)是一种EB病毒(Epstein-Barr virus,EBV)感染相关的非霍奇金淋巴瘤,在亚洲和拉丁美洲发病率较高,占非霍奇金淋巴瘤的2%~15%,约80%的患者最初累及鼻腔、鼻咽、上呼吸道,即结外鼻型NK/T细胞淋巴瘤,20%发生在皮肤、胃肠道等部位,称为非鼻型NK/T细胞淋巴瘤[1-2]。ENKTCL组织学特点主要为瘤细胞浸润引起的血管损伤与坏死,进展性和侵袭性极高[3]。近年来,国际预后指数(international prognostic index,IPI)、韩国预后指数(Korean prognostic index,KPI)、自然杀伤细胞淋巴瘤预后指数(prognostic index of natural killer cell lymphoma,PINK)、包含EBV-DNA的自然杀伤细胞淋巴瘤预后指数(prognostic index of natural killer cell lymphoma with Epstein-Barr virus DNA,PINK-E)和列线图修正风险指数等几种预后相关的评分模型被提出,但它们在预测患者生存结局方面仍存在分歧[4-6]。鉴于此,寻找新的指标来预测ENKTCL患者的生存预后至关重要。全身炎症及免疫反应与多种疾病的发生发展密切相关。2014年,Hu等[7]提出全身免疫炎症指数(systemic immune- inflammation index,SII),将中性粒细胞、淋巴细胞及血小板的动力学参数整合为一个标志物,并证实其与多种实体瘤的预后相关[8-11]。本研究拟探究SII对ENKTCL的预后预测价值,现报道如下。
1 资料与方法
1.1 一般资料
回顾性分析2012年1月至2019年12月郑州大学第一附属医院确诊为ENKTCL的176例患者的临床资料。纳入标准:①根据世界卫生组织分类指南,经病理组织学确诊为ENKTCL;②既往无恶性肿瘤或继发肿瘤病史,无肿瘤治疗史;③临床资料和随访资料完整。排除标准:①合并自身免疫性疾病或其他血液病的患者;②具有严重心、肺、肝、肾功能不全的患者;③合并第二原发肿瘤或继发性肿瘤患者;④在外院进行初诊治疗的患者。本研究经郑州大学第一附属医院伦理委员会批准(伦理审批号:2022-KY-1183-001),所有研究对象均免除签署知情同意书。
1.2 资料收集
收集患者的临床资料,包括性别、确诊年龄、Ann Arbor分期、B症状、淋巴结侵犯、肿瘤分期、预后指数、SII(血小板计数×中性粒细胞计数/淋巴细胞计数)、EBV-DNA、随访时间、生存状况等。
1.3 治疗及生存评估
患者接受以下初始治疗策略:单纯化疗、单纯放疗、化疗联合放疗。化疗方案包括:①DDGP方案(顺铂、地塞米松、吉西他滨、培门冬酶);②GELOX方案(吉西他滨、奥沙利铂、天冬酰胺酶);③SMILE方案(甲氨蝶呤、异环磷酰胺、左旋门冬酰胺酶、依托泊苷);④改良SMILE方案(甲泼尼龙、异环磷酰胺、美司钠、依托泊苷、培门冬酶、甲氨蝶呤)。生存评估包括无进展生存和总生存,无进展生存以疾病发生进展或死亡为随访终点,总生存以死亡或随访截止时间为终点。
1.4 统计学方法
采用SPSS 21.0软件对数据进行统计学分析。采用受试者操作特征曲线(receiver operating characteristic curve,ROC曲线)计算SII最佳截断值,采用Cox比例风险回归模型进行多因素分析,Kaplan-Meier法进行生存分析。<0.05为差异有统计学意义。
2 结果
2.1 SII的最佳截断值
利用ROC曲线得到SII最佳截断值为796.74,曲线下面积为0.752(95%:0.660~0.845,<0.001)。
2.2 患者的生存曲线
根据ROC曲线中获得的最佳截断值,将患者分为SII≥796.74组和SII<796.74组。SII≥796.74组患者的中位总生存为49.9个月,SII<796.74组患者的中位总生存为53.4个月;SII<796.74组患者的总生存率显著高于SII≥796.74组(2=28.662,<0.001),两组患者的无进展生存率比较差异无统计学意义(2=0.756,=0.384),见图1。
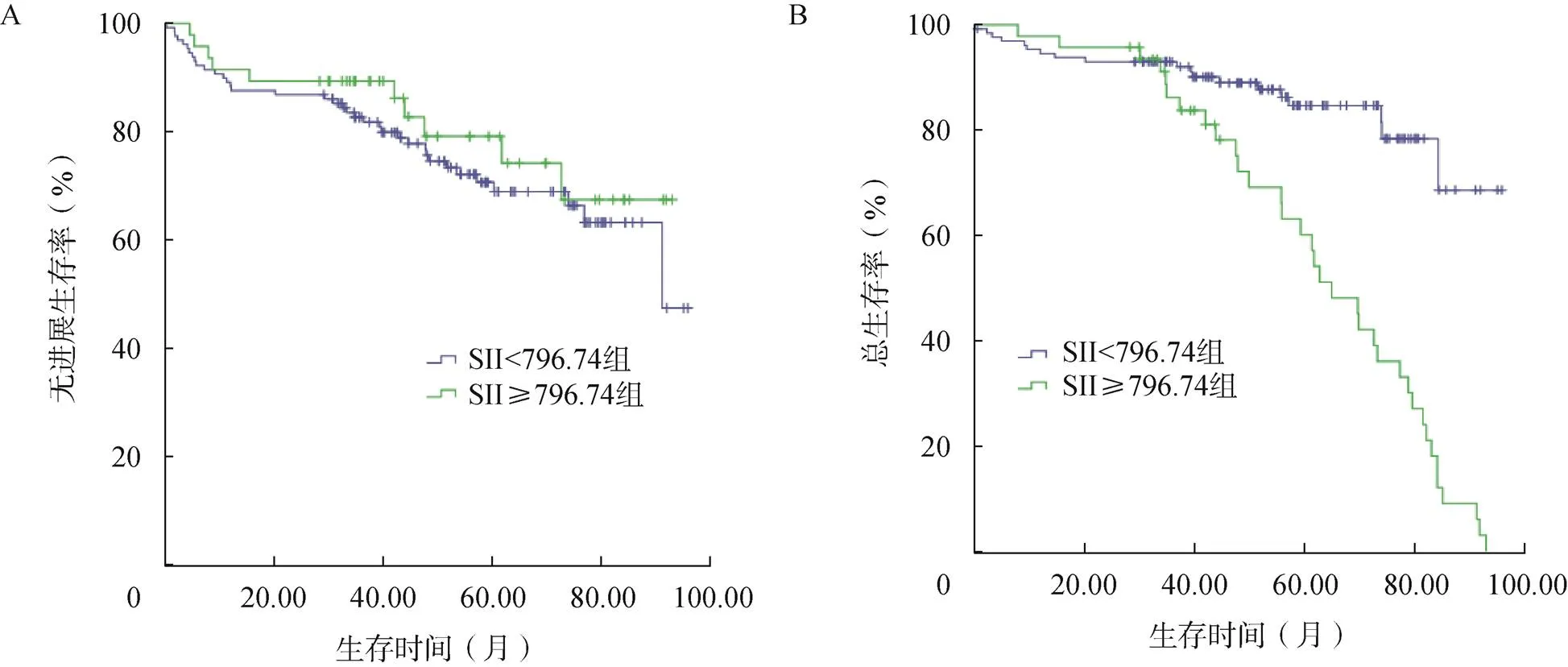
图1 不同SII水平患者的Kaplan-Meier生存分析
A.无进展生存率;B.总生存率
2.3 患者的临床特征分析
两组患者的年龄、PINK-E评分、B症状比较差异均有统计学意义(<0.05),见表1。
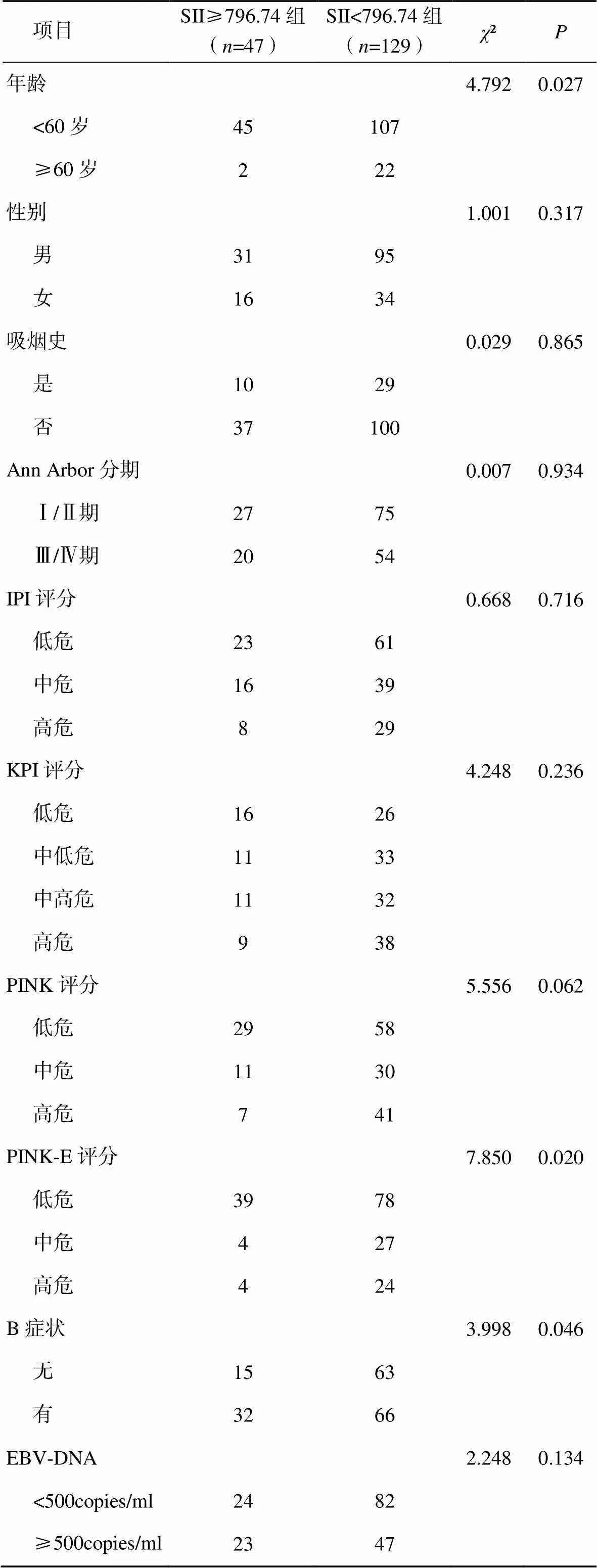
表1 患者的临床特征分析(例)
2.4 影响患者预后的单因素和多因素分析
单因素分析发现,Ann Arbor分期、IPI评分、B症状、淋巴结侵犯、EBV-DNA均与患者的无进展生存相关(<0.05),IPI评分、B症状、淋巴结侵犯、EBV-DNA、SII均与患者的总生存相关(<0.05),见表2;Cox多因素分析发现,有B症状(=2.636)、有淋巴结侵犯(=2.381)、EBV-DNA≥500copies/ml(=2.212)均是影响患者无进展生存的独立危险因素;有B症状(=2.378)、SII≥796.74(=2.501)均是影响患者总生存的独立危险因素,见表3、表4。
3 讨论
ENKTCL是多发于亚洲人群的一种非霍奇金淋巴瘤亚型,其侵袭性强、进展快、预后差,局部早期患者首选放疗,5年生存率约为70%[12]。晚期和复发性ENKTCL通常选择放疗联合化疗,其5年生存率仅为40%左右[13]。近年来,学者们致力于寻找一些指标或模型来筛选出高风险患者,以指导临床的个体化精准治疗。IPI评分、KPI评分、PINK、PINK-E等早已应用于ENKTCL的风险评估中,然而,它们对不同分期患者的预测结果呈现出相反的趋势,因此,需要找到新的、适用于预测全部分期ENKTCL患者预后的指标。
炎症已被证实在肿瘤发展过程中起关键作用,并引起机体内各种造血细胞的变化:中性粒细胞首先到达机体炎症部位,淋巴细胞也开始行使自己的免疫功能,并与循环肿瘤细胞发生相互作用[14]。在肿瘤微环境中,中性粒细胞刺激机体产生血管生成趋化因子和各种细胞因子,促进肿瘤的发生发展[15];而淋巴细胞可抑制肿瘤细胞的增殖和转移,当淋巴细胞减少时,这一功能被削弱[16]。此外,血小板可保护循环肿瘤细胞免受自然杀伤细胞的杀伤,促进循环肿瘤细胞的转移和增殖[17]。Tan等[18]研究发现,高中性粒细胞/淋巴细胞比值可作为结外鼻型NK/T细胞淋巴瘤的一个独立预后指标。SII能综合反映炎症和免疫状态,在实体瘤中的预后价值已得到证实。一项28例睾丸弥漫大B细胞淋巴瘤的研究发现,SII是无进展生存的一个不良预后因素[19];Wang等[11]研究也得出相似结论。但SII是否影响ENKTCL患者的生存尚无法明确。
本研究结果表明,SII<796.74组患者的总生存率显著高于SII≥796.74组。多因素分析发现,B症状和SII均是影响ENKTCL患者预后的独立危险因素。这一结果表明,SII作为机体免疫炎症标志物的同时,还可用于预测ENKTCL患者的预后。但本研究为回顾性分析,样本量较少可影响结果的精确性;此外,在不同的研究方案中,得到的SII临界值不同,且本研究并未比较治疗前中后SII值的动态变化对患者生存预后的影响。
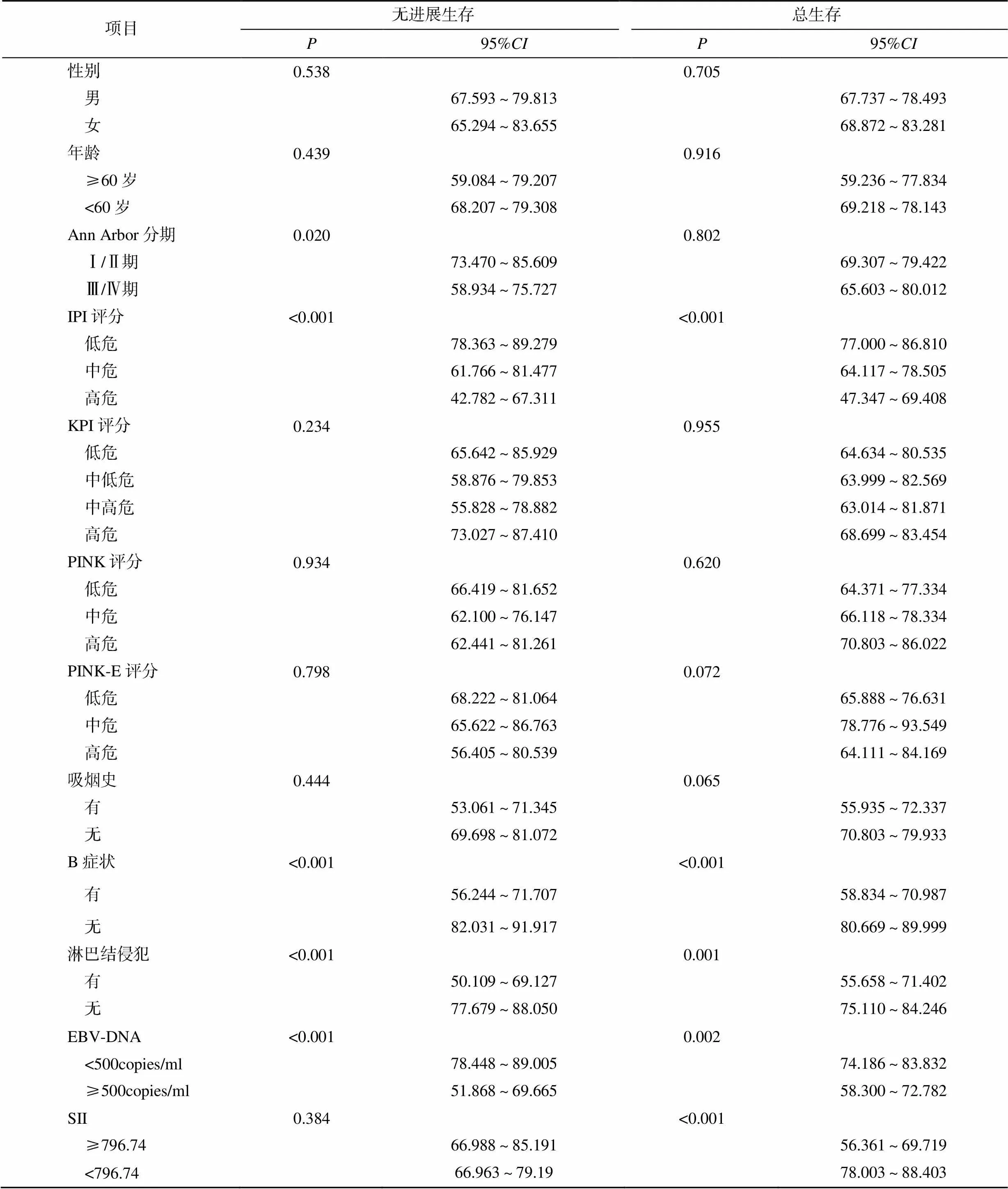
表2 影响患者预后的单因素分析
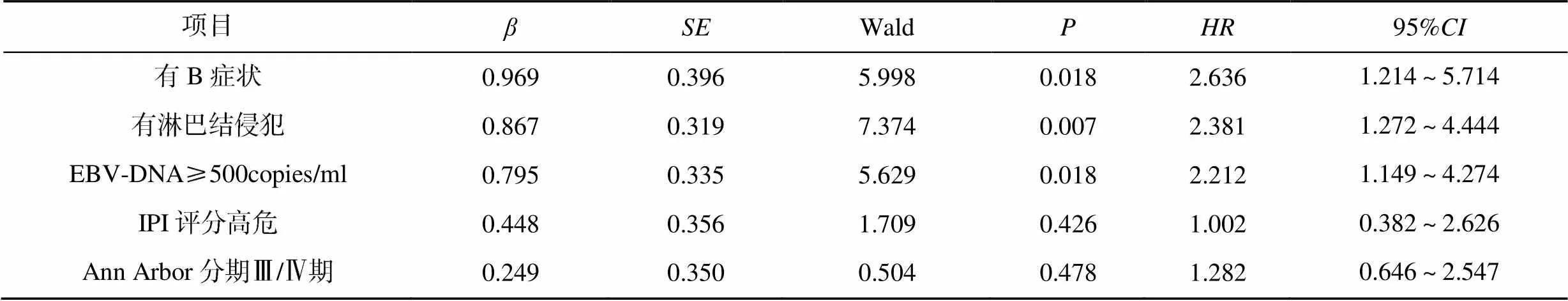
表3 影响患者无进展生存的Cox多因素分析
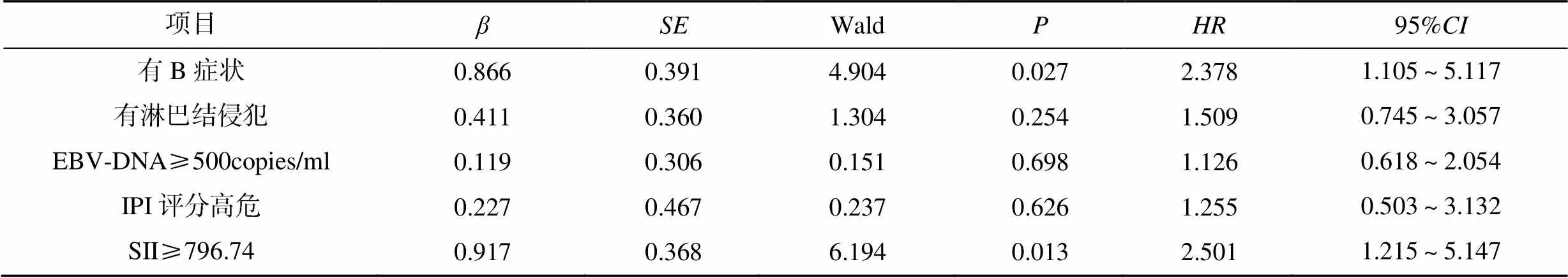
表4 影响患者总生存的Cox多因素分析
综上所述,SII对ENKTCL患者的预后具有一定预测价值,且该指标易测易得,值得临床推广使用。
[1] TSE E, ZHAO W L, XIONG J, et al. How we treat NK/T-cell lymphomas[J]. J Hematol Oncol, 2022, 15(1): 74.
[2] LEE J, KIM W S, PARK Y H, et al. Nasal-type NK/T cell lymphoma: Clinical features and treatment outcome[J]. Br J Cancer, 2005, 92(7): 1226–1230.
[3] YU B H, SHUI R H, SHENG W Q, et al. Primary intestinal extranodal natural killer/T-cell lymphoma, nasal type: A comprehensive clinicopathological analysis of 55 cases[J]. PLoS One, 2016, 11(8): e0161831.
[4] CHIM C S, MA S Y, AU W Y, et al. Primary nasal natural killer cell lymphoma: Long-term treatment outcomeand relationship with the international prognostic index[J]. Blood, 2004, 103(1): 216–221.
[5] HONG H, LI Y, LIM S T, et al. A proposal for a new staging system for extranodal natural killer T-cell lymphoma: A multicenter study from China and Asia Lymphoma Study Group[J]. Leukemia, 2020, 34(8): 2243–2248.
[6] CHEN S Y, YANG Y, QI S N, et al. Validation of nomogram-revised risk index and comparison with other models for extranodal nasal-type NK/T-cell lymphoma in the modern chemotherapy era: Indication for prognostication and clinical decision-making[J]. Leukemia, 2021, 35(1): 130–142.
[7] HU B, YANG X R, XU Y, et al. Systemic immune- inflammation index predicts prognosis of patients after curative resection for hepatocellular carcinoma[J]. Clin Cancer Res, 2014, 20(23): 6212–6222.
[8] MENG L, YANG Y, HU X, et al. Prognostic value of the pretreatment systemic immune-inflammation index in patients with prostate cancer: A systematic review and Meta-analysis[J]. J Transl Med, 2023, 21(1): 79.
[9] HUANG H, LIU Q, ZHU L, et al. Prognostic value of preoperative systemic immune-inflammation index in patients with cervical cancer[J]. Sci Rep, 2019, 9(1): 3284.
[10] WANG D, HU X, XIAO L, et al. Prognostic nutritional index and systemic immune-inflammation index predict the prognosis of patients with HCC[J]. J Gastrointest Surg, 2021, 25(2): 421–427.
[11] WANG Z, ZHANG J, LUO S, et al. Prognostic significance of systemic immune-inflammation index in patients with diffuse large B-cell lymphoma[J]. Front Oncol, 2021, 11: 655259.
[12] KIM S J, YOON S E, KIM W S. Treatment of localized extranodal NK/T cell lymphoma, nasal type: A systematic review[J]. J Hematol Oncol, 2018, 11(1): 140.
[13] WEN H, MA H, CAI Q, et al. Recurrent ECSIT mutation encoding V140A triggers hyperinflammation and promotes hemophagocytic syndrome in extranodal NK/T cell lymphoma[J]. Nat Med, 2018, 24(2): 154–164.
[14] PEREIRA-VEIGA T, SCHNEEGANS S, PANTEL K, et al. Circulating tumor cell-blood cell crosstalk: Biology and clinical relevance[J]. Cell Rep, 2022, 40(9): 111298.
[15] FRIDLENDER Z G, ALBELDA S M. Tumor-associated neutrophils: Friend or foe?[J]. Carcinogenesis, 2012, 33(5): 949–955.
[16] DUNN G P, OLD L J, SCHREIBER R D. The immunobiology of cancer immunosurveillance and immunoediting[J]. Immunity, 2004, 21(2): 137–148.
[17] BUERGY D, WENZ F, GRODEN C, et al. Tumor- platelet interaction in solid tumors[J]. Int J Cancer, 2012, 130(12): 2747–2760.
[18] TAN K M, CHIA B, LIM J Q, et al. A clinicohaematological prognostic model for nasal-type natural killer/T-cell lymphoma: A multicenter study[J]. Sci Rep, 2019, 9(1): 14961.
[19] YANG J, GUO X, HAO J, et al. The prognostic value of blood-based biomarkers in patients with testicular diffuse large B-cell lymphoma[J]. Front Oncol, 2019, 9: 1392.
Prognostic value of pre-treatment SII in extranodal NK/T-cell lymphoma
Department of Radiotherapy, the First Affiliated Hospital of Zhengzhou University, Zhengzhou 450052, Henan, China
To investigate the prognostic value of systemic immune-inflammation index (SII) in extranodal NK/T-cell lymphoma (ENKTCL) before treatment.The clinical data of 176 patients diagnosed with ENKTCL in the First Affiliated Hospital of Zhengzhou University from January 2012 to December 2019 were retrospectively analyzed. Receiver operating characteristic (ROC) curve was used to calculate the best cutoff value of SII, Cox proportional risk regression model was used for multivariate analysis, Kaplan-Meier method was used for survival analysis.The optimal cut-off value of SII was 796.74 and area under the curve was 0.752. Kaplan-Meier survival analysis showed that the overall survival rate of SII < 796.74 group was significantly higher than that of SII≥796.74 group (2=28.662,<0.001), and there was no significant difference in progression-free survival between the two groups (2=0.756,=0.384). Univariate analysis showed that international prognostic index (IPI) score, B symptoms, lymph node invasion and EBV-DNA were correlated with progression-free survival (<0.05). IPI score, B symptoms, lymph node invasion, EBV-DNA, and SII were all associated with overall survival (<0.05). Cox multivariate analysis showed that B symptoms (=2.636), lymph node invasion (=2.381) and EBV-DNA≥500copies/ml (=2.212) were independent risk factors for progression free survival. B symptoms (=2.378) and SII≥796.74 (=2.501) were independent risk factors for overall survival.SII is an independent risk factor affecting the prognosis of ENKTCL patients, and patients with higher SII value have worse overall survival prognosis.
Extranodal NK/T-cell lymphoma; Systemic immune-inflammation index; Risk factor; Survival prognosis
R733.4
A
10.3969/j.issn.1673-9701.2023.25.018
郑颖娟,电子信箱:zdyfyzlyy@163.com
(2022–11–22)
(2023–08–15)

