FADD基因在头颈鳞状细胞癌的预后价值
王晓忠 李 娜 王芊蔚 黄瑞哲 张月娇
Fas 通过死亡域关联(fas-associating with death domain protein,FADD)在细胞凋亡信号通路中扮演关键角色,是由肿瘤坏死因子受体超家族介导的。FADD 与Fas分子胞质区死亡结构域结合,可促进凋亡信号的传递,形成死亡诱导复合物,最终导致细胞凋亡。FADD 基因在肺癌、肝细胞癌、乳腺癌的进展存在密切联系,过度表达可导致肿瘤的进展及预后不良。肿瘤中FADD 的作用主要表现为促进肿瘤细胞的增殖和侵袭,过度表达可增强肿瘤细胞的凋亡抵抗性,从而促进肿瘤的进展和转移,因此,FADD已成为肿瘤治疗的重要靶点之一。深入研究FADD的分子机制,有助于揭示肿瘤发生的机制,为肿瘤的治疗提供新的思路和方法[1~7]。根据目前的报道,FADD 基因在程序性死亡过程中扮演关键角色,它通过调控半胱氨酸酶8 和苏氨酸蛋白激酶1 基因的表达水平[8~10],激活NF-κB,促进促炎细胞因子和趋化因子的释放,从而促进肿瘤炎症浸润和进展。FADD 基因的Ser194 位点磷酸化降低与化疗耐药性和肿瘤转移密切相关,并且还能形成炎症小体。目前对FADD 基因在泛癌研究方面的了解仍然很有限[11,12],此外,FADD 基因在肿瘤免疫细胞中的作用也还不清楚。本研究利用头颈鳞状细胞癌的数据对FADD 基因进行了综合分析,以明确该基因在头颈鳞状细胞癌中的预后影响。
资料与方法
1. FADD基因在人类泛癌组织中的表达水平
下载来自于GTEx 数据库和TCGA 数据库的表达谱数据,其来源于33 种不同类型的癌症和癌旁正常组织的原始数据,包括肾上腺皮质癌(ACC)、膀胱尿路上皮癌(BLCA)、乳腺癌(BRCA),宫颈鳞癌和腺癌(CESC)、胆管癌(CHOL)、结肠癌(COAD)、弥漫性大B 细胞淋巴瘤(DLBC)、食管癌(ESCA)、多形成性胶质细胞瘤(GBM)、脑低级别胶质瘤(LGG)、头颈鳞状细胞癌(HNSCC)、肾透明细胞癌(KIRC)、肾乳头状细胞癌(KIRP)、急性髓细胞样白血病(LAML)、肝细胞肝癌(LIHC)、肺腺癌(LUAD)、肺鳞癌(LUSC)、间皮瘤(MESO)、卵巢浆液性囊腺癌(OV)、胰腺腺癌(PAAD)、嗜铬细胞瘤和副神经节瘤(PCPG)、前列腺癌(PRAD)、直肠腺癌(READ)、肉瘤(SARC)、皮肤黑素瘤(SKCM)、胃癌(STAD)、甲状腺癌(THCA)、胸腺癌(THYM)、子宫内膜癌(UCEC)、子宫肉瘤(UCS)和葡萄膜黑色素瘤(UVM)。所有表达谱文件均为通过log2 转换进行标准化,提取头颈鳞状细胞癌(HNSCC)组织中FADD 基因表达水平。
2. FADD基因的预后分析
应用R语言“survminer”进行生存分析,FADD基因在头颈鳞状细胞癌中的预后指标进行相关分析,应用单因素生存分析计算风险比及95%置信区间,根据FADD 基因的高、低分组绘制Kaplan-Meier 曲线,评价FADD 基因的高、低分组对生存差异(OS、DSS、PFS)的影响。
3. 肿瘤突变负荷与微卫星不稳定性相关性分析
UCSC Xena(http://xena.ucsc.Edu/)下载TCGA 数据库中33 种癌症类型的突变数据,利用Perl 脚本根据肿瘤突变负荷定义计算每个样品的肿瘤突变负荷(TMB)。应用斯皮尔曼相关分析计算头颈鳞状细胞癌中肿瘤突变负荷、微卫星不稳定性与FADD 基因表达相关性。结果以R语言中“fmsb”包绘制雷达图(***P<0.001;**P<0.01;*P<0.05)。
4. FADD基因和肿瘤免疫浸润的相关性分析
下载来源于TCGA数据库的33种癌症与癌旁正常组织的表达谱数据集,应用“Immuneeconv”R 包,集成TIMER 和xCell 两种算法,对FADD 表达谱文件和FADD 在头颈鳞状细胞癌(HNSCC)中的免疫浸润进行评估,FADD 基因表达水平以log2 TPM 值展示。采对FADD 基因和免疫检查点进行斯皮尔曼相关分析。应用R 语言“heatmap”R 包绘制热图。随后应用TIMER 数据库(https://cistrome. shinyapps. io/timer/),对HNSCC行肿瘤免疫浸润评估及分析。
5. 多因素COX回归分析
使用TCGA portal 分析FADD 基因对头颈鳞状细胞癌(HNSCC)的FADD 基因、年龄、性别、种族、临床分期、肿瘤纯度,总生存期等临床数据,进行多因素COX 回归分析,分析HNSCC 中FADD 基因表达水平与临床参数的关系。
6. 免疫组化验证
2021 年1 月至2022 年12 月,经陕西省咸阳市中心医院伦理委员会批准,患者自愿签署知情同意书。采用随机数字表法收集头颈鳞状细胞癌患者30 例。总共60 个样本包括癌和癌旁健康组织。术后病理检查主要记录肿瘤大小、分化程度、TMN 分期、FADD 免疫组化数据,从术后出院开始随访,时间为4~6个月。
主要试剂:不同浓度梯度的乙醇、PBS 缓冲液、3%过氧化氢、10%正常山羊血清、0.01 M 柠檬酸缓冲液、二甲苯,抗体由马克西姆生物科技有限公司提供,产地为中国福州。DAB 显色液(目录号AR 1022)购自中国武汉博斯特生物科技有限公司。FADD 抗体(1:500;目录号CY7126),购自上海泊湾生物技术有限公司。酶标亲和纯化山羊抗兔IgG(1:20 00;目录号sa00001-2),购自中国武汉博斯特生物科技有限公司。
主要实验步骤:①石蜡切片,脱蜡至水。②抗原修复。用柠檬酸缓冲液修复高压抗原,空气注入高压锅2 分钟,冷却至室温。③3%H2O2室温孵育10分钟,阻断内源性过氧化物酶活性。④5%BSA 室温孵育30 分钟,阻断非特异性抗原反应。⑤加入一抗工作液稀释一抗,稀释倍数为1:500,1%BSA。4℃孵育过夜,然后用PBS 缓冲液洗3 次,每次3 分钟。⑥每节加2 滴稀释比1:2000,1%牛血清白蛋白稀释室温孵育30 分钟。PBS 冲洗3 次,每次3 分钟。⑦DAB 显色,苏木精复染,并用中性树脂密封。
7. 统计学处理
使用SPSS22.0 软件和Rx64 3.6 软件,头颈鳞状细胞癌(HNSCC)的癌组织与癌旁正常组织之间的FADD 基因差异表达采用t检验Kaplan-Meier 生存分析采用Log-rank 检验法,对于头颈鳞状细胞癌的生存分析评价,使用Cox 比例风险模型计算HR 和p值,以P<0.05 为差异有统计学意义。临床病理相关分析采用logistic 回归分析,生存分析应用Kaplan Meier 检验。FADD 在显微镜下观察实验结果,并在相同条件下拍照进行后续分析。FADD 阳性信号位于细胞质和细胞核上,苏木精染色后,治疗组呈棕黄色,呈强阳性信号。阳性细胞数<10%为阴性,阳性细胞数>10%为阳性,P值<0.05有统计学意义。
结果
1. FADD基因在33种癌症中的差异表达分析
在TCGA portal 数据库(www.tcgaportal.org)中,FADD 基因在肿瘤组织中表达水平显著高于癌旁正常组织(P<0.05,图1、图2)。FADD 基因在18 种恶性肿瘤中过度表达(图2);FADD 基因在BLCA、BRCA、CHOL、COAD、ESCA、HNSCC-HPVpos、HNSCC、KICH、KIRC、KIRP、LIHC、LUAD、LUSC、PRAD、READ、SKCM、STAD、THCA、UCEC 癌症谱中异常高表达,其中FADD 基因在头颈鳞状细胞癌中最显著:HNSCC(P=3.05E-23)。
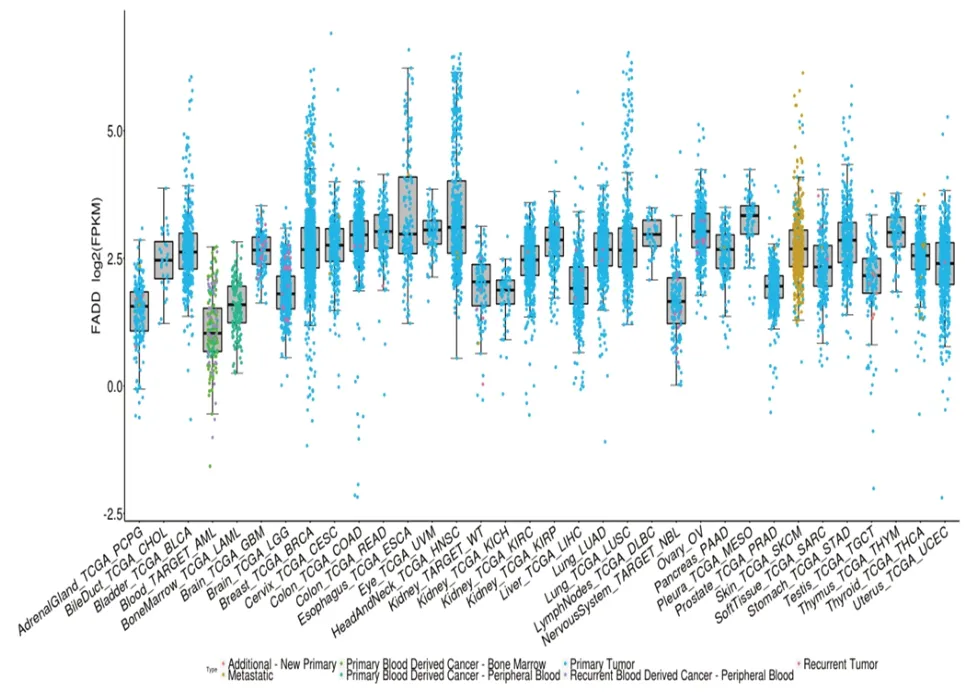
图1 FADD基因在33种癌症中的表达水平
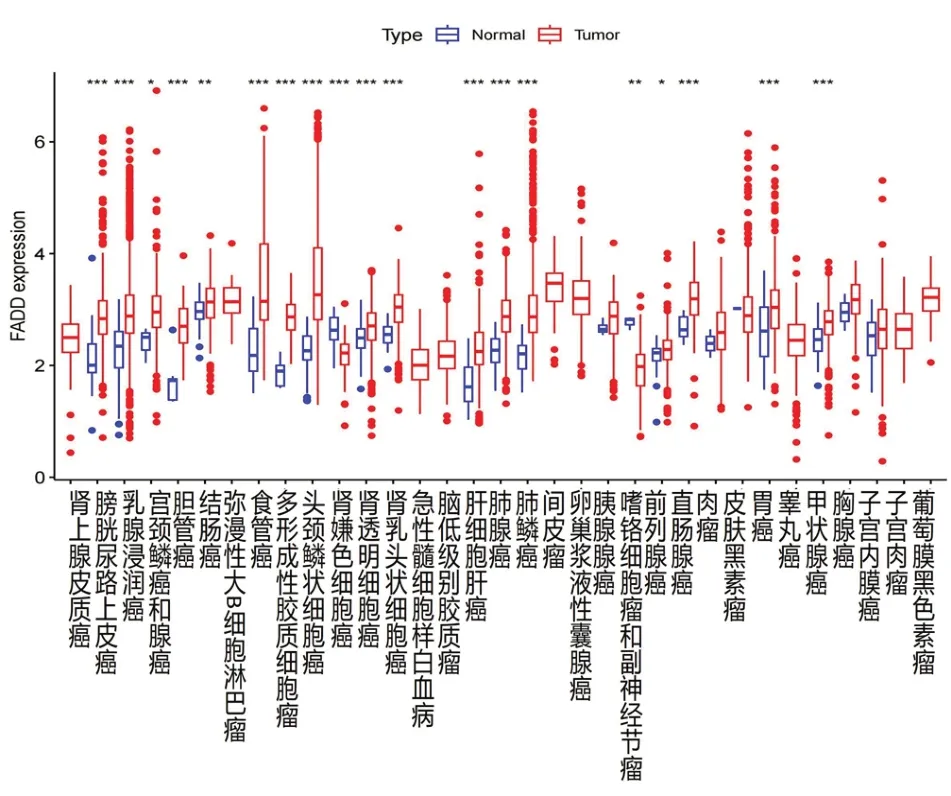
图2 FADD基因在33种癌组织中与癌旁正常组织的差异表达***P<0.001;**P<0.01; *P<0.05
2. FADD 基因对头颈鳞状细胞癌的OS、DSS、PFS三项预后指标的影响
在头颈鳞状细胞癌中,对FADD 基因表达水平和生存指标包括总生存率(overall survival,OS)、疾病特异性生存期(disease specific survival,DSS)、无进展生存期(progression-free survival,PFS)进行相关分析。结果显示,在总生存率方面,头颈鳞状细胞癌中FADD 基因高表达组的总生存率显著低于FADD 基因低表达组(P<0.05,图3A)。此外,FADD基因对HNSCC(P<0.05)的疾病特异性生存期有显著影响,即FADD 基因高表达组,相对于低表达组在头颈鳞状细胞癌中疾病特异性生存期较短(P<0.05,图3B)。在无进展生存期方面,FADD 基因对HNSCC(P<0.05)的无进展生存期有显著影响,既FADD 基因高表达组的无进展生存期显著低于FADD 基因低表达组(P<0.05,图3C)。Cox回归模型分析表明,FADD 基因的高表达是包括HNSCC 在内的8种肿瘤类型患者OS 的危险因素(图4)。在头颈鳞状细胞癌中,FADD 基因的表达与OS(图4)、DSS(图5)、PFS(图6)显著相关。
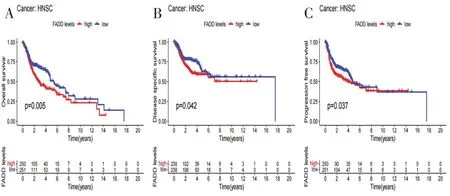
图3 头颈鳞状细胞癌中,FADD基因高、低风险组对HNSCC的总生存率(P=0.005)、疾病特异性生存期(P=0.042)、无进展生存期(P=0.037)均有显著影响(P<0.05)
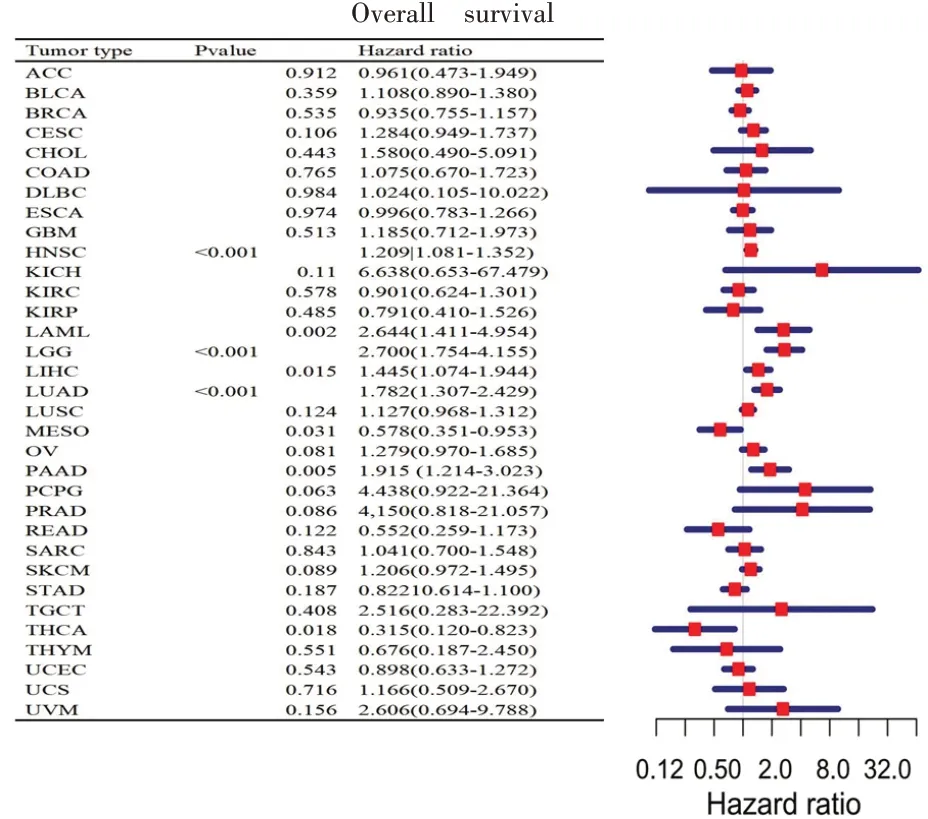
图4 COX比例风险模型揭示FADD基因对HNSCC总生存率有显著影响(P<0.001)

图5 COX比例风险模型揭示FADD基因对HNSCC疾病特异性生存期的差异影响(P<0.01)
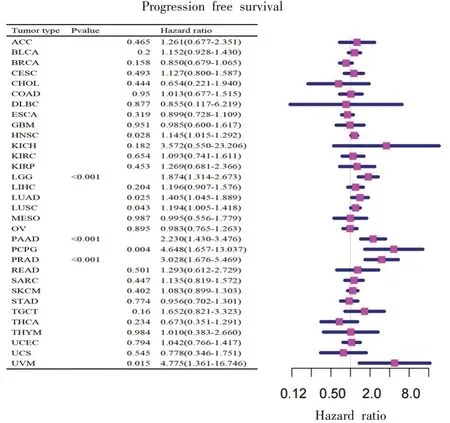
图6 COX比例风险模型揭示FADD基因对HNSCC无进展生存期的差异影响(P<0.05)
COX 比例风险模型揭示,FADD 基因对HNSCC的总生存率有显著影响(P<0.001,图4 所示)。FADD 基因对HNSCC(P=0.009)的疾病特异性生存期有显著影响(P<0.01,图5 所示)。FADD 基因对HNSCC 的无进展生存期有显著影响(P<0.05,图6所示)。
3. FADD 基因突变与肿瘤突变负荷、微卫星不稳定性的相关性分析
利用UCSC Xena 数据库(https://xena.ucsc.edu/)下载TCGA 数据库中33 种肿瘤类型的突变数据,进一步分析FADD 基因突变与肿瘤微卫星不稳定性的相关性,结果表明包括头颈部鳞状细胞癌在内的10种肿瘤的微卫星不稳定型与FADD 基因突变存在显著相关性。头颈部鳞状细胞癌的微卫星不稳定型与FADD 基因突变呈明显相关(P<0.05),与FADD 基因突变呈正相关,其余肿瘤则与FADD 基因突变呈负相关(图7A)。再对FADD 基因突变与泛癌的肿瘤突变负荷进行相关分析,结果显示FADD 基因突变对头颈部鳞状细胞癌的肿瘤突变负荷无显著影响(P>0.05,图7B)。
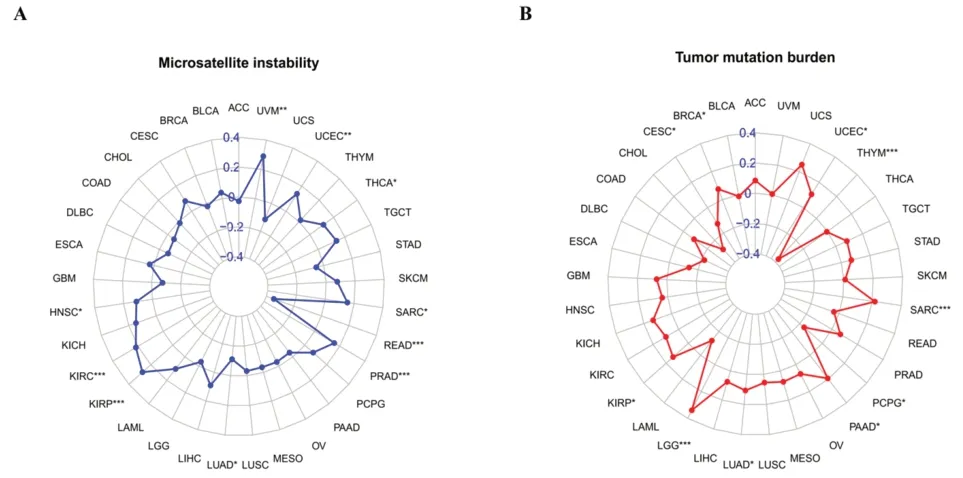
图7 FADD基因突变与肿瘤突变负荷、微卫星不稳定性的相关性分析
4. FADD 基因与头颈部鳞状细胞癌的免疫浸润分析
将FADD 基因表达谱数据与免疫增强剂之间进行斯皮尔曼相关性分析,结果显示头颈部鳞状细胞癌中FADD 基因的表达水平与CD276 的表达水平成正相关,而与CD27浸润水平呈负相关(图8A),具体而言,与TGFB1(R=0.341)、CD276(R=0.42)的表达水平呈正相关。FADD 的表达水平与CD27(R=-0.215)的表达水平呈负相关(图8B),从而说明FADD 在调节免疫细胞浸润和免疫增强剂的功能中发挥重要作用。

图8 FADD基因在泛癌的免疫浸润
5. 多因素COX回归分析
研究纳入下列指标:FADD 基因、年龄、性别、种族、临床分期、肿瘤纯度,应用多因素Cox分析,研究发现在头颈鳞状细胞癌中,FADD 基因、年龄和肿瘤分期(stageⅣ)都被确定为危险因素,即与较短的总生存期相关(P<0.05)。这意味着FADD 基因的差异表达量、年龄较大以及肿瘤处于较晚期(stageⅣ)都会对头颈鳞状细胞癌患者的预后产生不良影响。
6. FADD 基因在头颈部鳞状细胞癌中免疫细胞浸润分析
研究发现头颈部鳞状细胞癌(HNSCC)与FADD基因的差异表达之间存在密切相关。此外,通过分析肿瘤微卫星不稳定性和肿瘤突变负荷等指标,也发现了HNSCC 与FADD 基因的密切相关性。进一步应用TIMER 数据库对HNSCC 中FADD 基因表达水平,与免疫浸润细胞之间的关系进行分析,发现特定的免疫细胞亚型与HNSCC 密切相关(图9A-C)。具体而言,FADD 基因的表达与静息CD4 T 细胞、M0巨噬细胞、中性粒细胞浸润、树突状细胞呈正相关(图9D),而与CD8 T 细胞、B 细胞呈负相关(图9D)。HNSCC 这些结果表明FADD 基因在HNSCC 的发生和免疫浸润中可能发挥重要的作用。

图9 HNSCC免疫细胞浸润状况及FADD基因与细胞亚型的相关分析
7. 免疫组织化学验证
研究结果显示,FADD 基因染色呈阳性,棕黄色颗粒位于细胞核、细胞质。相比于阴性对照组(0.1 mol/L PBS),阳性表达率在肿瘤细胞中明显高于正常的颊黏膜(图10),此外,FADD 基因的高表达与HNSCC组织以及预后较差相关。
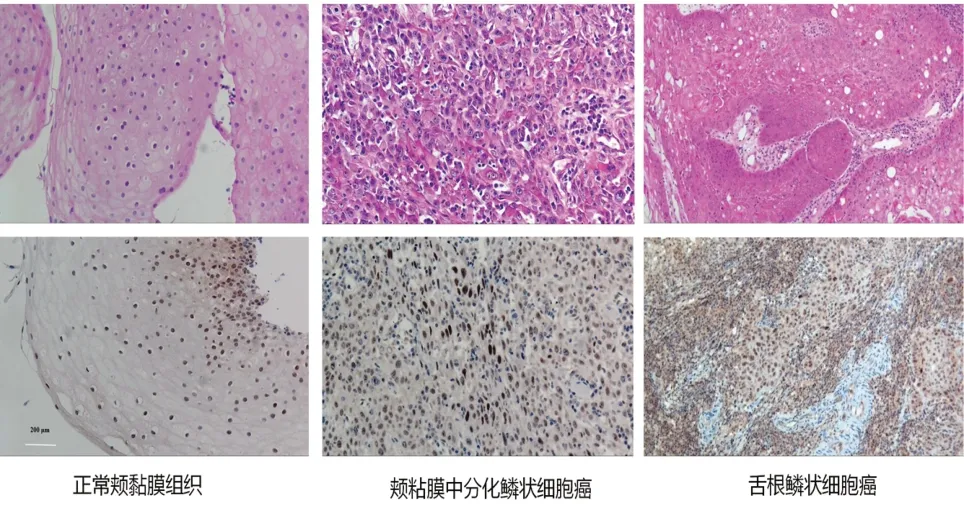
图10 FADD在正常口腔组织、颊黏膜中分化鳞状细胞癌、舌根鳞状细胞癌的差异表达
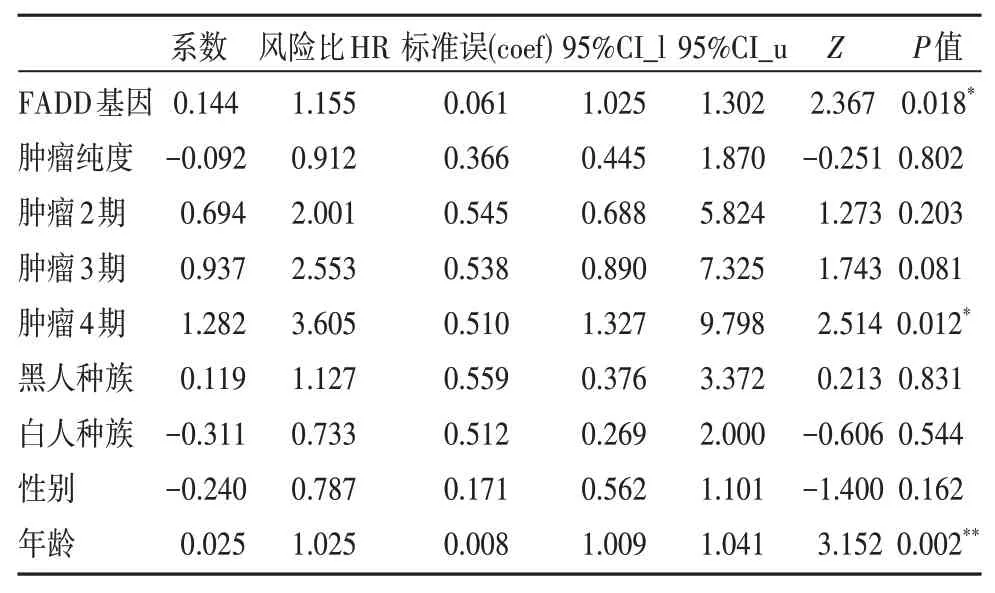
表1 纳入HNSCC的临床参数指标、FADD基因表达量进行多元回归分析
讨论
FADD 基因作为肿瘤坏死因子受体超家族介导的传递凋亡信号,是细胞坏死的负调控关键基因,其作为死亡受体和启动caspase-8/caspase-10 之间的桥梁,可以介导与死亡受体和caspases 的相互作用,诱导细胞凋亡[12]。有研究使用了Lasso Cox 回归分析模型来构建头颈部鳞状细胞癌(HNSCC)中自噬相关基因(ARGs)的预测模型[13]。研究发现FADD的免疫组化过表达与HNSCC 患者的总生存期风险比增加密切相关[14]。然而,该研究缺乏免疫组织化学评估,研究建议在HNSCC 的预后评估中应考虑应用FADD 过表达的免疫组织化学评估。此外,通过比较来自GEO 数据集的HPV 阳性和HPV 阴性HNSCC患者的转录组数据,研究确定了与HPV相关的标志物。研究选了7 个与HPV 阳性相关的标志物,包括CDKN2A,CELSR3,DMRTA2,SERPINE1,TJP3,FADD 和IGF2BP2[15]。这些标志物可能有助于预测HPV 阳性HNSCC 患者的预后。在已经发表的研究中,在HNSCC 研究中,FADD 构建的联合模型的预后价值已经被研究,但其单个基因在HNSCC 预后评估中的研究仍未展开。本研究通过应用GTEx数据库和TCGA 数据库中HNSCC 的表达谱文件,研究FADD 基因在该癌症中的预后价值。结果表明,FADD 基因可作为一种用于预测HNSCC 患者预后的标志物,并与肿瘤免疫浸润细胞的类型相关联。FADD 基因是HNSCC 中一种被研究广泛的基因,不仅在HNSCC 的发生过程中起到重要的作用,而且在该癌症的预后中也具有重要意义。本项研究证明,FADD 基因在HNSCC 的预后中具有非常显著的价值,其基因表达水平能够预测HNSCC患者的预后。
微卫星不稳定性(microsatellite instability, MSI)是一种基因组异常,常见于各种癌症。FADD 蛋白参与细胞对外部应激信号的反应,激活程序性细胞死亡途径。目前的研究表明,FADD 基因的突变与淋巴瘤、乳腺癌和结肠癌等多种癌症相关[16~19],而且目前发现FADD 基因突变可能与结直肠癌的MSI 相关。在结直肠癌中,与微卫星稳定(MSS)结直肠癌相比,MSI 结直肠癌中FADD 基因的表达水平较低[20],这一观察结果暗示FADD 可能在调节癌细胞微卫星稳定性中发挥作用。进一步的研究表明,FADD 与错配修复系统(MMR)之间存在功能关系。MMR 是一种DNA 修复机制,对维持微卫星的稳定性起着重要作用。一些研究报道表明,FADD 通过促进MMR 向细胞核的募集参与了MMR 功能的调节。FADD 基因的敲除导致MMR 蛋白的表达减少,从而导致MSI。除了结直肠癌,MSI 和FADD 突变也与乳腺癌、胃癌和淋巴瘤有关[21]。总之,微卫星不稳定性(MSI)与FADD 基因的突变和表达水平低有关,FADD 基因可能通过调节微卫星稳定性参与癌细胞的形成。FADD 基因与头颈癌MSI 的关系尚未被充分研究,需要进一步的研究来确定它们之间的关联。
有研究提示FADD 可能参与了口腔癌的免疫调节,与自噬有关[22]。FADD 是死亡受体介导细胞凋亡的关键受体蛋白,与先天免疫、炎症和癌症的发生有关[23]。有研究应用基因集富集分析显示,FADD相关基因显著富集于免疫相关通路。相关性分析显示FADD 的上调与口腔癌的低生存率和免疫浸润相关[22]。相对于CD276 基因低表达,CD276 基因高表达已被证实癌症患者的预后不良,CD276 在肿瘤中参与调控细胞增殖、凋亡、侵袭、细胞周期、细胞分化、细胞自噬、充质转化。瓦伯格效应(Warburg Effect)也是由CD276促进的。本研究观察CD276在HNSCC 肿瘤高表达,FADD 表达量的增加与CD276呈正相关,也发现FADD 表达增加与CD27 呈负相关,而CD27通过局部共刺激在T 细胞活化中起关键作用信号,被认为是肿瘤治疗中的免疫调节关键靶点[24]。一些研究表明,FADD 基因可能通过调节肿瘤相关免疫细胞的功能来影响HNSCC 预后。本研究中,笔者发现FADD 基因水平与HNSCC 中肿瘤免疫浸润细胞静息CD4 T 细胞、M0 巨噬细胞、中性粒细胞浸润、树突状细胞呈正相关,而与CD8 T细胞、B细胞呈负相关。这一结果表明FADD 基因在调节肿瘤免疫系统中具有重要的作用,从而影响HNSCC 患者的预后。总之,FADD 基因在HNSCC 的预后中具有显著价值,该研究为HNSCC 患者的治疗提供了新思路,也为患者的预后评估提供了新的方法。

