鸡腺病毒血清8a型毒株的分离鉴定及致病特点
李慧昕,宋文平,韩宗玺,刘胜旺
鸡腺病毒血清8a型毒株的分离鉴定及致病特点
李慧昕,宋文平,韩宗玺,刘胜旺
中国农业科学院哈尔滨兽医研究所/动物疫病防控全国重点实验室,哈尔滨 150069
【目的】鸡腺病毒(fowl adenovirus, FAdV)在鸡群中流行广泛且血清型众多,不同血清型毒株对鸡的致病能力尚不完全清楚。通过对FAdV-8a型分离株的致病特点进行研究,为了解血清8a型毒株的致病能力、进而对鸡群中不同血清型FAdV的防控提供科学依据。【方法】2017年,从发病鸡群采集肝脏组织,组织匀浆后无菌处理,接种鸡胚分离病毒,经PCR鉴定,初步确定分离毒株为鸡腺病毒。为确定分离株的分类情况,对病毒的全基因组进行测序及序列分析,经基因组序列比对及hexon基因遗传演化分析,从分子水平确定病毒的种/血清型。为了解分离株的致病特点和致病能力,30只10日龄SPF鸡随机分成2组,经滴鼻和点眼途径人工感染。从临床发病(发病率和死亡率)、病毒血症、排毒、循环抗体消长规律及其与中和抗体相关性、感染后5 d鸡剖检症状及病理组织学检测、病毒的组织分布及组织嗜性等方面评价分离株JL/170408对10日龄SPF鸡的致病性。【结果】对分离株的全基因组序列进行测定和分析,表明基因组序列与FAdV-8a型参考毒株TR59株同源性最高,基因组结构和编码基因特点与该毒株高度一致。基于全基因组序列进行遗传演化分析,分离株处于FAdV-E种的进化分支内,与TR59株亲缘关系较近。同时对分型基因hexon基因进行遗传演化分析,分离株划分为8a血清型。综合分离株基因组特征及遗传演化分析,确定分离株JL/170408为FAdV-E种、血清8a型毒株。分离株感染10日龄SPF鸡,感染后3—13 d是临床发病高峰期,但不引起鸡只死亡。感染后3 d开始出现病毒血症并经呼吸道和消化道排毒,病毒血症持续时间长达51 d之久,此时感染鸡的抗体未全部转为阳性且循环抗体滴度较低(平均S/P<1),低水平的循环抗体不能有效清除病毒。感染后54 d,感染鸡抗体滴度出现高峰(平均S/P>2),有效清除感染鸡体内病毒,表现为病毒血症消失和排毒明显下降。对感染后5 d的鸡剖检和病理组织学检测,未见明显病理组织学变化,但是荧光定量PCR可检测到15个组织中有不同程度的病毒载量,病毒的组织嗜性广泛且对肌胃有一定的偏嗜性。对循环抗体监测发现,感染鸡抗体阳转出现的较晚,感染后15 d部分鸡只抗体阳性,感染后24—51 d,循环抗体处于相对平稳状态,但此时感染鸡抗体未全部阳性。感染后54 d出现了循环抗体滴度的高峰,提示鸡只可能发生再次感染,到感染后63 d,循环抗体滴度开始下降,有2只鸡的抗体转为阴性。对感染后63 d的血清进行中和抗体测定,并与循环抗体相比较,两者之间无明显相关性。【结论】FAdV-8a型分离株JL/170408可单独致10日龄SPF鸡发病,但不引起死亡,为低致病力毒株。JL/170408的组织嗜性广泛,对肌胃具有偏嗜性,感染后鸡只排毒时间长,排毒具有反复性。
鸡腺病毒;血清8a型;基因组特征;致病性
0 引言
【研究意义】鸡腺病毒(fowl adenovirus, FAdV)在世界各国鸡群中广泛分布,引发的疾病也越来越严重和复杂。鸡腺病毒血清型众多,不同血清型毒株的致病能力和致病特点也不尽相同。在鸡群和野生禽类中,鸡腺病毒通常作为常在性的一类病原,多数在外表健康的鸡群中存在,感染鸡不表现症状或者临床症状不明显,有时作为机会性病原与其他病原协同致病。近年来,我国鸡群中常有鸡腺病毒感染的报道,鸡腺病毒单独致病的能力逐渐增强,不同血清型鸡腺病毒的致病性及其危害性逐渐引起养鸡业的重视。因此,了解我国鸡群中鸡腺病毒的流行及其致病特点的研究将有助于该病的有效防控。【前人研究进展】鸡腺病毒在鸡群中广泛分布,已有研究证明,经病毒分离、PCR检测以及病毒特异性抗体检测,健康鸡群和发病鸡群中均有FAdV存在[1-2]。自1987年在巴基斯坦卡拉奇市附近的安加拉哥特(Angara Goth)首次报道肝炎-心包积水综合征(hepatitis-hydropericardium syndrome, HHS)以来,人们改变了对FAdV的认识,明确FAdV可单独引起鸡群发病。FAdV为无囊膜的DNA病毒,基因组大小约43—45 kb[3-5],属于腺病毒科、禽腺病毒属成员。FAdV包括5个种(A—E)、12个血清型(1—8a、8b—11)[2]。包含体肝炎(inclusion body hepatitis, IBH)最早报道于1963年[6],几乎所有血清型FAdV均可引起,但是某些特定血清型(主要包括血清2、7、8a、8b和11型)可引起明显IBH临床症状[2, 7-9]。通常认为,IBH是一种继发性疾病,常与鸡传染性贫血及传染性法氏囊病等免疫抑制病共感染[10-11]。然而,近年来研究证明,鸡群在无免疫抑制病存在时,部分血清型FAdV可作为原发病原引起IBH的暴发[7, 12-13]。FAdV-1作为原发病原可引起肉鸡发生肌胃糜烂(gizzard erosion, GE)[14]。我国在2012—2013年开始陆续有HHS和IBH的报道,已经证明多由FAdV-4和FAdV-11型毒株引起[5],但是其他血清型FAdV对鸡的致病情况如何,尚未见明确报道。【本研究切入点】已有报道FAdV-8除了引起IBH外,还可引起肌胃糜烂,但感染鸡无临床表现[15]。在对我国鸡群进行FAdV流行病学监测发现,FAdV-8a型毒株在鸡场中分离率逐渐增高,该血清型毒株是否具有单独致病的能力、以及引起发病的类型有待于进一步阐明。【拟解决的关键问题】本研究团队在2017年从吉林某鸡场发病鸡群中分离到一株FAdV-8a型毒株,遂开展了该毒株对SPF鸡的致病性研究,以确定FAdV-8a血清型毒株对鸡的感染规律,明确病毒在鸡体的排毒情况以及对感染鸡的组织嗜性,将对不同血清型鸡腺病毒疫苗的研制以及疫病防控提供科学依据。
1 材料与方法
试验于2017年4月至2019年6月在中国农业科学院哈尔滨兽医研究所禽呼吸道病团队以及生物安全二级动物感染室完成。
1.1 SPF鸡胚和SPF鸡
9日龄SPF鸡胚和10日龄SPF鸡由中国农业科学院哈尔滨兽医研究所国家禽类实验动物资源库提供。
1.2 试剂和试剂盒
Premix Ex Taq DNA聚合酶购自Takara公司,AxyPrepTM体液DNA/RNA提取试剂盒购自Axygen公司,荧光定量检测试剂盒One Step SYBR®Prime ScriptTMRT-PRC Kit Ⅱ(M3003)购自New England Biolabs公司,禽腺病毒Ⅰ群抗体检测试剂盒(CK132)购自北京天之泰生物科技有限公司。
1.3 引物设计与合成
鸡腺病毒检测用通用引物HF2/HR2[16]、荧光定量检测用引物由北京六合华大基因科技有限公司合成引物序列见表1。病毒基因组扩增用引物根据FAdV TR59株(Acc. No. KT862810)基因组序列设计(附表1),由北京六合华大基因科技有限公司合成。

表1 FAdV通用检测引物及FAdV-8a型特异性荧光定量引物
a引物位置为JL/170408基因组序列位置(GenBank登录号MN417117)
Primer locations are listed on the basis of the sequence of JL/170408 strain (GenBank accession number MN417117)
1.4 病毒分离、鉴定及纯化
鸡腺病毒JL/170408株于2017年从吉林某鸡场9周龄蛋鸡肝脏病料中分离,发病鸡剖检有轻度心包积液。将肝脏组织用无菌磷酸盐缓冲液(Phosphate- buffered saline, PBS)以1﹕10(w/v)匀浆,经8 000×,4℃离心10 min,上清经0.22 µm滤器过滤后,尿囊膜途径接种9日龄SPF鸡胚。接种后的鸡胚于37℃继续培养4 d。采集鸡胚尿囊液,参照AxyPrepTM试剂盒说明书提取病毒基因组DNA。使用HF2/HR2引物进行PCR扩增[15],并对PCR产物进行序列测定和分析。同时对采集的尿囊液进行血凝试验。病毒经LMH细胞蚀斑纯化,挑取蚀斑接种LMH细胞,获得病毒储液,冻存于-70℃备用。
1.5 病毒滴度测定
将LMH细胞铺于96孔培养板,待细胞长成单层后,将收获的病毒液做10倍倍比稀释,将不同稀释度的病毒液接种LMH细胞,0.1 mL/孔,每个稀释度接种8孔,37℃培养,连续观察7 d,记录出现细胞病变孔数,接种按照Reed-Muench法测定病毒的半数组织感染量(TCID50)。
1.6 病毒基因组扩增及序列分析
使用病毒基因组扩增用引物对分离株的基因组进行PCR扩增,每个片段的扩增引物有约200 bp重复,将PCR产物经北京六合华大基因科技有限公司测序。参照参考毒株TR59基因组序列,用DNAStar软件分析序列,同时进行BLAST比对分析,进行基因组序列拼接。对基因组中可能编码的基因进行分析和注释。用MEGA软件对Hexon基因进行遗传演化分析,采用Jukes-Cantor(JC)方法的替换模式进行计算,用Maximum-Likelihood(ML)方法绘制系统发育进化树,分析分离株所属的种和血清型。
1.7 病毒致病性评价
1.7.1 实验动物分组与攻毒 30只10日龄SPF白来航鸡,随机分成2组,其中对照组15只,人工感染组15只。所有鸡只于生物安全二级动物感染室禽用负压隔离器中饲养,可任意采食和饮水。以接近自然感染的方式,将JL/170408株经滴鼻和点眼途径感染10日龄SPF鸡,剂量为105.0TCID50,0.1mL/只。动物试验经中国农业科学院哈尔滨兽医研究所实验动物福利伦理委员会审批,IACUC编号HSY-IACUC-2018-238。
1.7.2 临床评分 根据感染鸡只表现临床症状的轻重程度不同赋予分值,0分(正常)、1分(轻度沉郁)、2分(重度沉郁)、3分(卧地不起/瘫痪)、4分(死亡)。每日观察2次,每次2人观察并独立打分,每次不少于5 min,连续观察25 d,对每只鸡赋予临床症状打分。
1.7.3 口咽拭子及泄殖腔拭子排毒检测 采用荧光定量PCR方法检测口咽拭子和泄殖腔拭子,荧光定量PCR检测方法由本研究团队建立(未发表)。使用罗氏Lightcycler 480荧光定量PCR仪系统,20 µl体系中包括:Luna Universal qPCR Master Mix 10 µL、引物8aF/8aR 各0.4 µL、DNA 2 µL、无RNase ddH2O 7.2 µL。荧光定量PCR反应条件:95℃ 1 min,40个循环(95℃ 15s,60℃ 30s),95℃ 20 s,65℃ 1 min。数据经Lightcycler 480软件(v1.5.0)分析。
1.7.4 ELISA抗体及中和抗体测定 人工感染后,每隔7 d翅静脉采血,分离血清,用ELISA抗体检测试剂盒检测感染鸡血清抗体。在感染后63 d,采血,分离血清,分离的血清经56℃处理30 min,用于中和抗体测定。将2倍倍比稀释的血清与100 TCID50病毒于37℃作用1 h,接种长满单层的96孔LMH细胞,每个稀释度接种5个重复,37℃作用1 h,PBS洗3遍,换含有2%新生犊牛血清的MDEM继续于37℃、5%CO2培养7 d,观察细胞病变,Reed-Muench法判定终点滴度,分析中和抗体滴度与ELISA抗体水平的相关性。
1.7.5 病理组织学及病毒的组织分布检测 于人工感染后5 d,随机剖杀5只攻毒鸡,观察攻毒鸡的大体病变。同时取肝脏和肌胃固定,用于病理组织学研究。采肝脏、脾脏、肺脏、肾脏、腺胃、肌胃、胰腺、十二指肠、小肠、大肠、盲肠扁桃体、盲肠、直肠、法氏囊、气管。进行荧光定量PCR检测各组织中的病毒载量。
2 结果
2.1 分离株鉴定及基因组特征
用通用引物HF2/HR2对分离株进行PCR鉴定,并将扩增的基因片段进行序列测定,BLAST分析结果表明,分离株与FAdV-8a血清型毒株同源基因序列高度同源,分离毒株为FAdV-8a型毒株,命名为JL/170408。对分离株JL/170408全基因组序列进行扩增、拼接和分析,分离株基因组全长为44 209 bp,推测编码34个基因。与FAdV-8a和FAdV-8b型参考毒株比较(附表2),分离株基因组结构及编码基因与FAdV-8a型参考毒株TR59株(KT862810,日本分离株)相似,基因组核苷酸序列同源性达98.07%,而与FAdV-8b型HG株(GU734104,加拿大分离株)基因组编码基因有差异,基因组核苷酸序列同源性为95.43%(JL/170408基因组序列提交GenBank数据库,基因序列号为MN417117)。
2.2 分离株的系统发育进化分析
基于分离株全基因组序列进行系统发育进化分析,结果表明,分离株JL/170408与FAdV-E种参考毒株在同一簇,与FAdV-8a型的TR59株亲缘关系较近(图1-A)。根据Hexon基因进行系统发育进化分析,JL/170408与FAdV-8a型的TR59株位于同一进化分支内,确定分离株为FAdV-8a血清型(图1-B)。
2.3 分离株对SPF鸡致病性的评价
2.3.1 临床评分 通过每日临床观察对感染鸡只进行临床打分,SPF鸡在感染后3 d,出现轻微的临床症状,表现为缩颈,羽毛蓬乱;在感染后4 d,症状相对较为明显,部分鸡只出现重度精神沉郁,这种发病程度持续到感染后13 d,在感染后14 d开始临床症状减轻,鸡只精神状态转好,从感染后19—25 d,鸡只临床表现趋于正常(图2所示人工感染后20 d内的临床打分情况)。
2.3.2 感染鸡病毒血症及排毒规律 对感染鸡每3 d采集口咽拭子和泄殖腔拭子,采用荧光定量PCR方法检测感染鸡病毒血症情况以及经口咽和泄殖腔排毒情况。感染后3 d,部分感染鸡出现病毒血症(6/10),并开始通过呼吸道和消化道排毒。病毒血症持续时间可达51 d之久,感染后3—45 d是感染鸡持续排毒时间,感染后48 d排毒稍有下降,感染后51 d排毒率出现再次升高,与病毒血症的升高有一致性。感染后54 d经口咽和泄殖腔的排毒明显下降,排毒时间长达63 d以上。
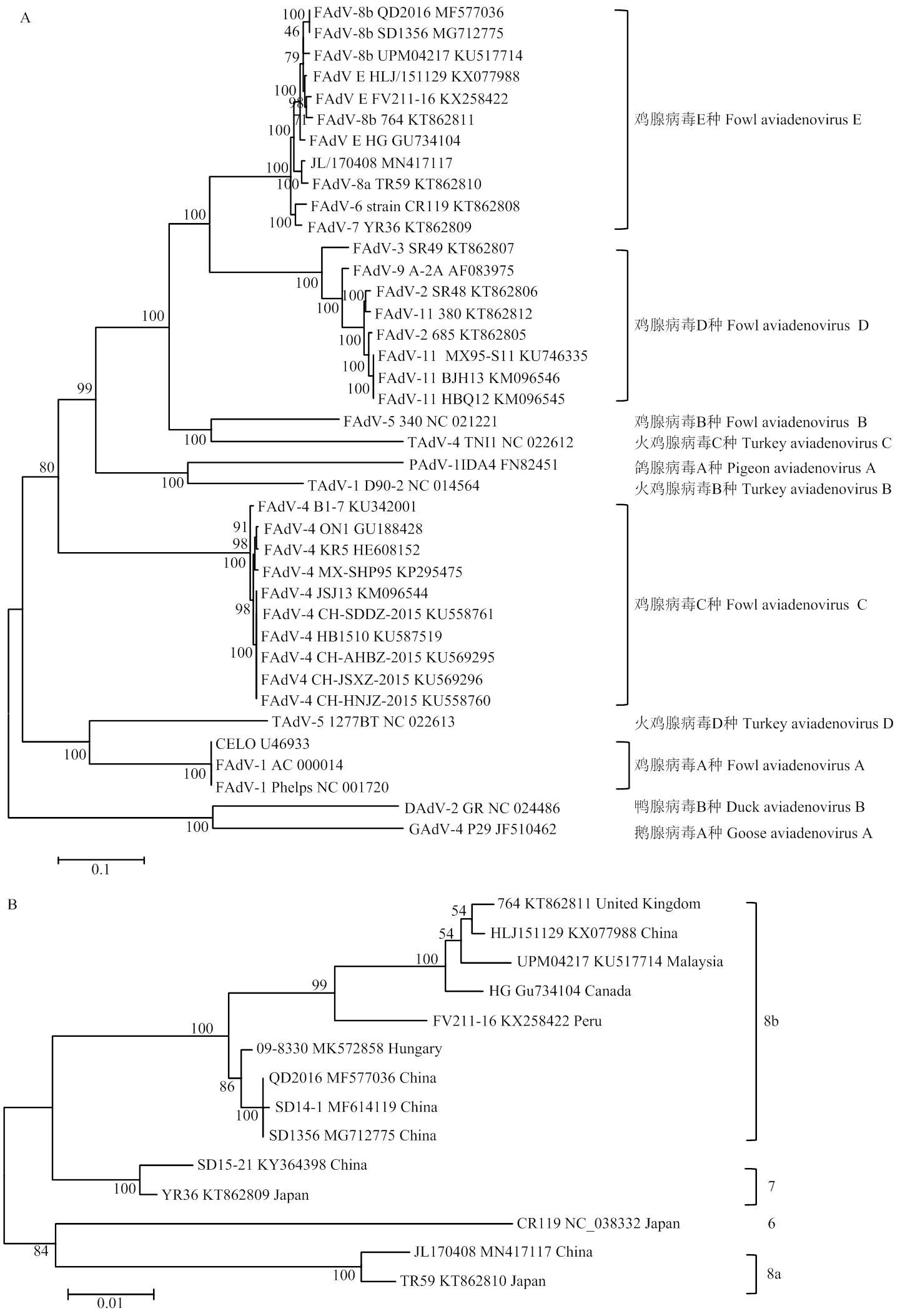
A:基于分离株和参考毒株全基因组序列的系统发育进化分析;B:基于分离株和FAdV-E种参考毒株hexon基因序列的系统发育进化分析
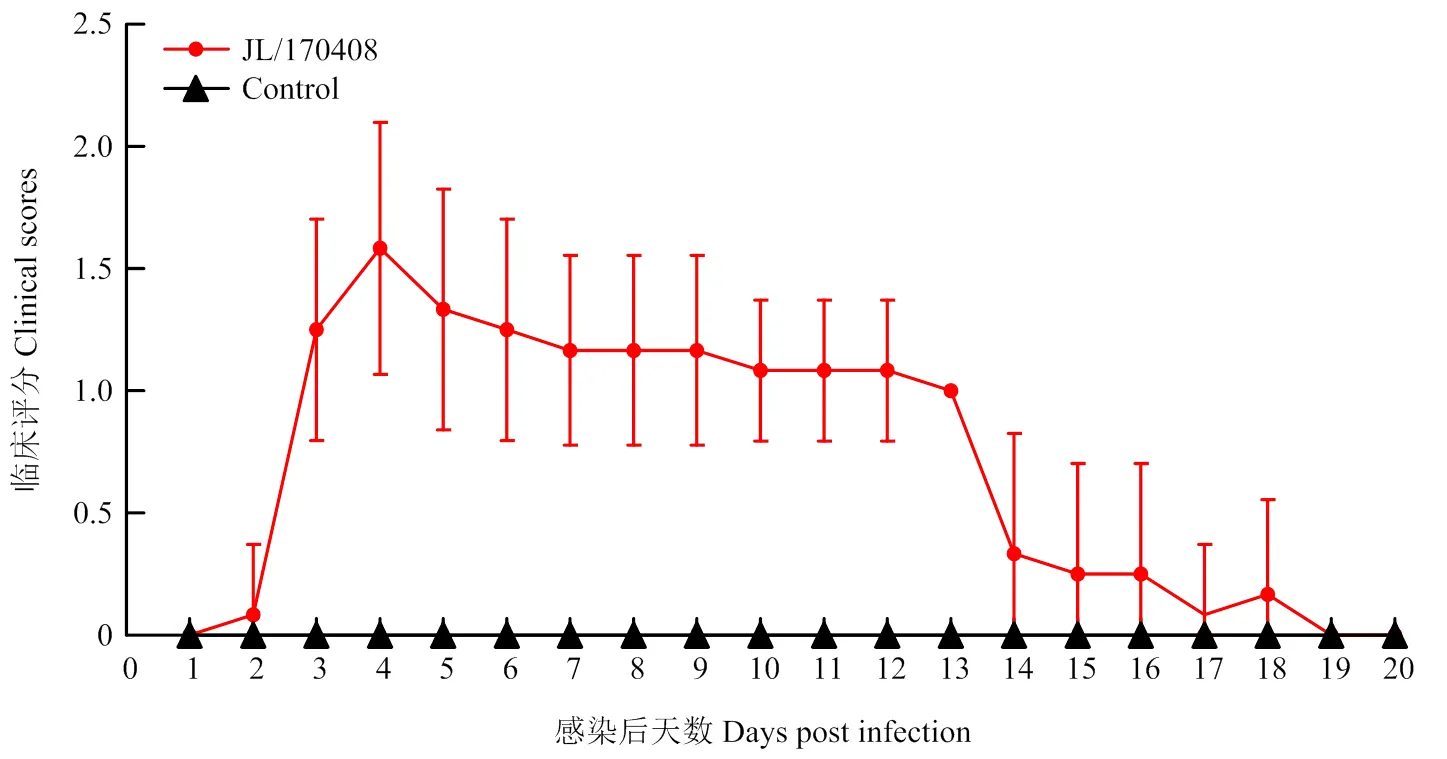
图2 感染鸡临床评分(n=10)
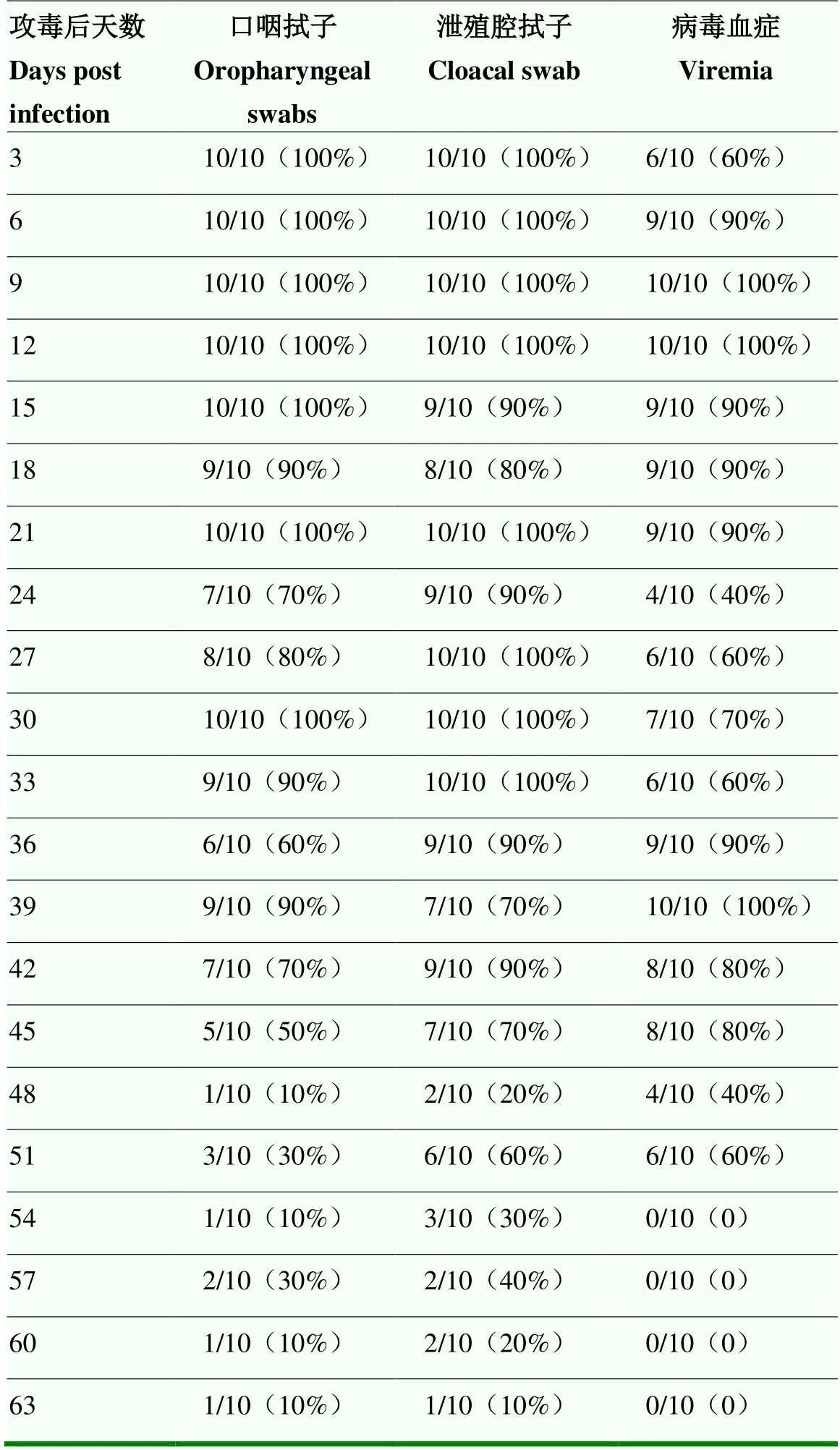
表2 感染鸡病毒血症及排毒检测
2.3.3 感染鸡病理变化 对接种分离毒株5 d的实验鸡剖检,均未见心包积液、肝脏和肾脏等组织的眼观病变,但是5只鸡中有1只鸡肌胃角质层下黏膜有明显的出血和糜烂(1/5)(图3-A,JL/170408感染组),对照组鸡的相关组织均未见病变。病理组织学研究结果表明,感染组鸡肝脏汇管区可见少量髓样细胞聚集,肌胃黏膜上皮细胞少量脱落,空白对照组鸡肝脏和肌胃均正常(图3-B)。
2.3.4 病毒在感染鸡中的组织分布 荧光定量PCR方法检测病毒在各组织中的病毒载量。结果显示,分离株JL/170408为泛嗜性病毒,对感染鸡各组织均有不同程度的亲嗜性。病毒在消化道相关组织中的病毒载量相对较高,肌胃和肠道(小肠、盲肠)中的病毒载量高于其他组织,在腺胃、胰腺、大肠和法氏囊中的病毒载量相对偏低(图4)。
2.3.5 感染鸡循环抗体和中和抗体检测结果 使用商品化ELISA抗体检测试剂盒对感染鸡血清循环抗体进行检测。感染后15 d,部分鸡只抗体开始出现阳性,至18—30 d感染鸡只ELISA抗体逐渐升高;感染后33—51 d,感染鸡ELISA抗体水平趋于平稳,平均S/P<1;感染后54 d开始,感染鸡抗体达到高峰,平均S/P>2,所有鸡只抗体为阳性,综合排毒和病毒血症情况,此时间点的排毒明显下降且病毒血症消失,提示,随抗体水平升高,感染鸡血循环内的病毒被有效清除(图5)。
为了确定循环抗体与中和抗体之间的相关性,对感染后63 d的血清测定中和滴度,并与循环抗体相比较。结果显示,循环抗体水平高的鸡,其相应的中和抗体滴度较高(如7号鸡)。感染后63 d,10只鸡中有2只鸡循环抗体下降到临界值以下,而相对应鸡只的中和抗体均大于6 log2,表明循环抗体与中和抗体之间没有明显的相关性(图6)。
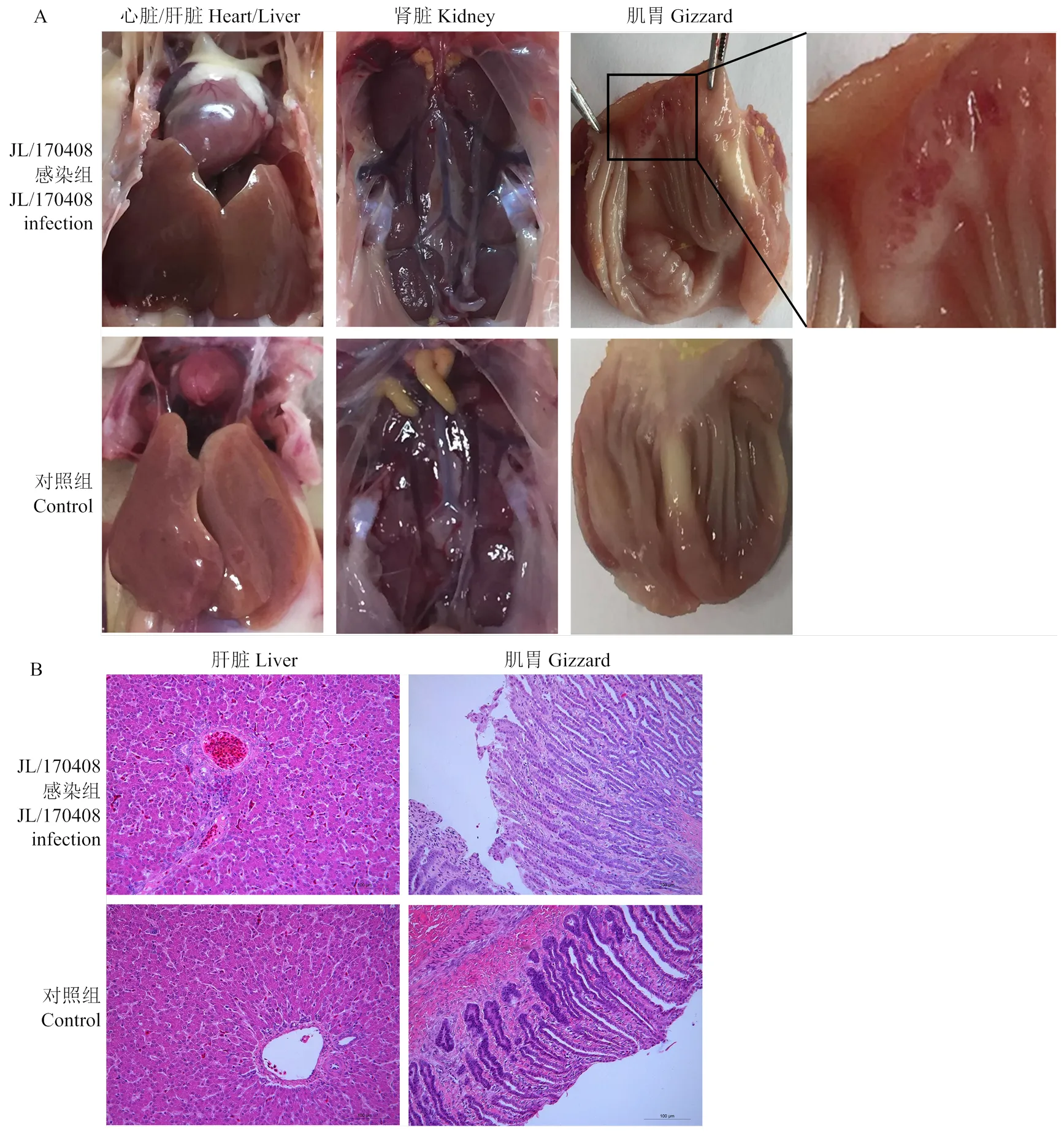
A:人工感染后5d剖检观察;B:人工感染后5d组织病理学检测
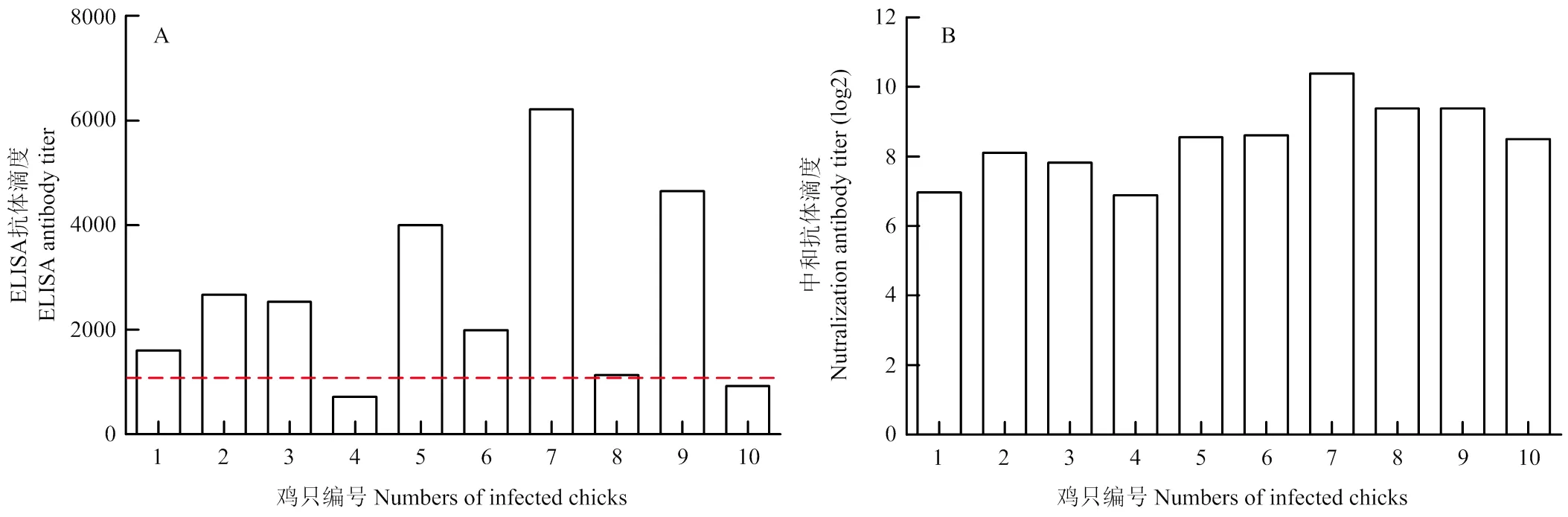
A:感染后63 d每只鸡的ELISA抗体,ELISA效价≥1071判为ELISA抗体阳性;B:感染后63 d每只鸡的中和抗体
3 讨论
3.1 鸡腺病毒不同血清型毒株在我国鸡群的流行及致病性
鸡腺病毒在全世界各地鸡群流行广泛,近年来也有鹅群中检测到该病毒的存在[17]。自2013年我国部分地区发生鸡腺病毒感染以来,本研究团队对涉及我国24个省/市/自治区的鸡群进行流行病学调查,发现鸡群中流行的鸡腺病毒血清型多且复杂,在同一鸡场中有多个血清型同时存在。目前我国鸡群中至少存在5种血清型的FAdV,包括FAdV-1、FAdV-4、FAdV-8a、FAdV-8b和FAdV-11(数据未发表)。FAdV部分血清型可单独致病,也可与其他病原因子协同致病[18-20]。已证明FAdV-4型毒株具有较强的致病力,可引起鸡群发生HHS,死亡率30%—90%。FAdV-11致病特点已有报道,主要引起IBH,死亡率10%—30%[5]。FAdV-7和FAdV-1可引起鸡群免疫失败以及免疫缺陷[21-22]。尽管偶有报道,在发生肌胃糜烂鸡群中检测到FAdV-8a或-8b型毒株,但是通过追溯性研究发现,FAdV-1仍是引起肌胃糜烂的主要病原[15, 23],因此FAdV-8a或-8b型毒株的致病能力如何,尚有待于进一步研究。
3.2 鸡腺病毒的分型依据
通常可用中和试验来确定病毒的血清型,但是中和试验比较费时,且需要有已知的参考血清进行血清型分型,有时也会出现难以分型的情况[2, 24]。鸡腺病毒Hexon蛋白为主要衣壳蛋白,含有型特异性抗原决定簇,可刺激机体产生中和抗体。hexon基因序列的遗传演化分析也可作为血清型分型的依据之一[2, 25],可替代传统的血清交叉中和试验和限制性片段长度多态性分析试验[2]。本研究根据全基因组序列的遗传演化分析,综合基因组序列同源性比对、基因组结构和基因编码特征,支持基于hexon基因的分型结果,将分离株JL/170408确定为FAdV-8a型。通过对分离株全基因组的遗传演化分析,发现FAdV-D和FAdV-E种的毒株在进化分支上亲缘关系较近,提示两个种的毒株在宿主体内适应的过程中,通过长期的共进化而产生了基因的多样性,进而形成了不同的种[26-28]。
3.3 FAdV-8a型毒株致病特点、排毒与循环抗体相关性
通常1日龄SPF鸡经点眼或口服途径感染FAdV,其发病高峰发生在感染后4—10 d[13, 29],分离株JL/170408感染10日龄SPF鸡,其发病高峰在感染后3—13 d,与上述报道一致。FAdV可垂直传播也可水平传播,粪-口途径传播是FAdV的主要传播方式。鸡只感染JL/170408后3 d即可检测到经口和泄殖腔排毒,同时出现病毒血症,排毒和病毒血症持续时间较长,在抗体阳性后仍然持续排毒和病毒血症,说明循环抗体不能完全清除机体内的病毒。
感染鸡在感染后24—51 d抗体水平相对平稳,在感染后54 d抗体水平激增,此时感染鸡只抗体全部阳性。综合排毒特点和抗体消长规律,提示鸡只可能在感染后48 d左右,由于生存环境中有带毒粪便,经粪-口途径再次感染,导致再次感染约1周左右(54 d)出现抗体水平的激增。同时在54 d时鸡只经口和泄殖腔排毒明显下降,且病毒血症消失,说明前期由于抗体水平不高(48 d以前的平均抗体滴度S/P值<1)致使病毒不能被有效清除,表现为排毒和病毒血症,随着抗体滴度的升高(54 d的平均抗体滴度S/P值>2),血清能有效中和机体中的病毒,使得病毒血症消失,排毒得到有效抑制。已有报道,鸡只在初次感染FAdV 45 d后,能够抵抗相同血清型病毒的再次感染,大约在8周后可激发机体产生再次应答,产生中和抗体和沉淀抗体,体液抗体的存在不能有效阻止排毒[30],这与本研究的结果一致。
3.4 FAdV-8a型毒株为泛嗜性低致病力毒株
感染后5 d剖检5只鸡,除了1只鸡肌胃可见有轻微的溃疡和糜烂外,其他鸡只各组织脏器未见明显病理学变化,但是经荧光定量PCR检测,各组织中均有不同拷贝数的病毒载量,其中肌胃组织中的病毒载量最高,提示病毒对肌胃有一定的偏嗜性。已有报道,短暂、瞬时的局部免疫可保护鸡只免于再次感染,循环抗体在抵抗内部组织器官被病毒入侵时,组织中仍有一定的病毒载量[31-32]。对各组织进行病理组织学检测,尽管1只鸡肌胃有轻微的溃疡和糜烂,但未见肌胃病理学变化。其他组织也未见病理学变化,说明鸡感染后其组织中虽有病毒复制,但不足以造成组织脏器的病理性损伤。这些结果表明,FAdV-8a毒株JL/170408具有单独致病能力,但致病性相对较低。
4 结论
对我国鸡群中流行的FAdV-8a型分离株JL/170408的致病特点进行评价,明确FAdV-8a型毒株具有单独致病能力,可致10日龄SPF鸡发病,但不引起死亡,为低致病力毒株。
[1] Adair B M, Fitzgerald S D. Group I adenovirus infections. In: Diseases of poultry, 12th ed. Saif Y M, Fadly A M, Glisson J R, McDougald L R, Nolan L K, Swayne D E, eds. Wiley- Blackwell, Hoboken, NJ. 2008: 252-266.
[2] HESS M. Detection and differentiation of avian adenoviruses: a review. Avian Pathology, 2000, 29(3): 195-206.
[3] GRIFFIN B D, NAGY É. Coding potential and transcript analysis of fowl adenovirus 4: insight into upstream ORFs as common sequence features in adenoviral transcripts. The Journal of General Virology, 2011, 92(6): 1260-1272.
[4] MAREK A, NOLTE V, SCHACHNER A, BERGER E, SCHLÖTTERER C, HESS M. Two fiber genes of nearly equal lengths are a common and distinctive feature of Fowl adenovirus C members. Veterinary Microbiology, 2012, 156(3/4): 411-417.
[5] ZHAO J, ZHONG Q, ZHAO Y, HU Y X, ZHANG G Z. Pathogenicity and complete genome characterization of fowl adenoviruses isolated from chickens associated with inclusion body hepatitis and hydropericardium syndrome in China. PLoS One, 2015, 10(7): e0133073.
[6] HELMBOLDT C F, FRAZIER M N. Avian hepatic inclusion bodies of unknown significance. Avian Diseases, 1963, 7(4): 446-450.
[7] GOMIS S, GOODHOPE A R, OJKIC A D, WILLSON P. Inclusion body hepatitis as a primary disease in broilers in Saskatchewan, Canada. Avian Diseases, 2006, 50(4): 550-555.
[8] DAR A, GOMIS S, SHIRLEY I, MUTWIRI G, BROWNLIE R, POTTER A, GERDTS V, TIKOO S K. Pathotypic and molecular characterization of a fowl adenovirus associated with inclusion body hepatitis in Saskatchewan chickens. Avian Diseases, 2012, 56(1): 73-81.
[9] MITTAL D, JINDAL N, TIWARI A K, KHOKHAR R S. Characterization of fowl adenoviruses associated with hydropericardium syndrome and inclusion body hepatitis in broiler chickens. Virusdisease, 2014, 25(1): 114-119.
[10] HOFFMANN R, WESSLING E, DORN P, DANGSCHAT H. Lesions in chickens with spontaneous or experimental infectious hepato- myelopoietic disease (inclusion body hepatitis) in Germany. Avian Diseases, 1975, 19(2): 224-236.
[11] FADLY A M, WINTERFIELD R W. Isolation and some characteristics of an agent associated with inclusion body hepatitis, hemorrhages, and aplastic anemia in chickens. Avian Diseases, 1973, 17(1): 182-193.
[12] STEER P, O'ROURKE D, GHORASHI S, NOORMOHAMMADI A. Application of high-resolution melting curve analysis for typing of fowl adenoviruses in field cases of inclusion body hepatitis. Australian Veterinary Journal, 2011, 89(5): 184-192.
[13] STEER P A, SANDY J R, O'ROURKE D, SCOTT P C, BROWNING G F, NOORMOHAMMADI A H. Chronological analysis of gross and histological lesions induced by field strains of fowl adenovirus serotypes 1, 8b and 11 in one-day-old chickens. Avian Pathology: Journal of the W V P A, 2015, 44(2): 106-113.
[14] OKUDA Y, ONO M, YAZAWA S, SHIBATA I, SATO S. Experimental infection of specific-pathogen-free chickens with serotype-1 fowl adenovirus isolated from a broiler chicken with gizzard erosions. Avian Diseases, 2001, 45(1): 19-25.
[15] OKUDA Y, ONO M, SHIBATA I, SATO S. Pathogenicity of serotype 8 fowl adenovirus isolated from gizzard erosions of slaughtered broiler chickens. The Journal of Veterinary Medical Science, 2004, 66(12): 1561-1566.
[16] LI H X, WANG J, QIU L Y, HAN Z X, LIU S W. Fowl adenovirus species C serotype 4 is attributed to the emergence of hepatitis- hydropericardium syndrome in chickens in China. Infection, Genetics and Evolution, 2016, 45: 230-241.
[17] 邵震, 刁有祥. 规模化鹅场主要病毒核酸检测结果与分析. 中国农业科学, 2023, 56(10): 2021-2034.
SHAO Z, DIAO Y X. Investigation and Analysis of Nucleic Acid Detection Results of Vain Viruses in Large-scale Goose Farms. Scientia Agricultura Sinica, 2023, 56(10): 2021-2034. (in Chinese)
[18] ADAIR B M. Immunopathogenesis of chicken anemia virus infection. Developmental & Comparative Immunology, 2000, 24(2/3): 247-255.
[19] HESS M. Commensal or pathogen - a challenge to fulfil Koch's Postulates. British Poultry Science, 2017, 58(1): 1-12.
[20] VAN DEN BERG T P, ETERRADOSSI N, TOQUIN D, MEULEMANS G. Infectious bursal disease (Gumboro disease). Revue Scientifique et Technique (International Office of Epizootics), 2000, 19(2): 509-543.
[21] NICZYPORUK J S, WOŹNIAKOWSKI G, CZEKAJ H, SAMOREK- SALAMONOWICZ E. Interactions between Marek's disease virus Rispens/CVI988 vaccine strain and adenovirus field strain in chicken embryo fibroblast (CEF) cultures. Polish Journal of Veterinary Sciences, 2014, 17(1): 3-8.
[22] SCHONEWILLE E, SINGH A, GÖBEL T W, GERNER W, SAALMÜLLER A, HESS M. Fowl adenovirus (FAdV) serotype 4 causes depletion of B and T cells in lymphoid organs in specific pathogen-free chickens following experimental infection. Veterinary Immunology and Immunopathology, 2008, 121(1/2): 130-139.
[23] MASE M, NAKAMURA K. Phylogenetic analysis of fowl adenoviruses isolated from chickens with gizzard erosion in Japan. The Journal of Veterinary Medical Science, 2014, 76(11): 1535-1538.
[24] LI C J, LI H Y, WANG D D, WANG J J, WANG Y M, WANG S C, LI J D, LIU P, WANG J L, XU S Z, CUI S J, ZHANG Y, YIN Y B. Characterization of fowl adenoviruses isolated between 2007 and 2014 in China. Veterinary Microbiology, 2016, 197: 62-67.
[25] MCFERRAN J B, ADAIR B M. Avian adenoviruses: a review. Avian Pathology, 1977, 6(3): 189-217.
[26] MORSHED R, HOSSEINI H, LANGEROUDI A G, FARD M H B, CHARKHKAR S. Fowl adenoviruses D and E cause inclusion body hepatitis outbreaks in broiler and broiler breeder pullet flocks. Avian Diseases, 2017, 61(2): 205-210.
[27] OLIVER-FERRANDO S, DOLZ R, CALDERÓN C, VALLE R, RIVAS R, PÉREZ M, BIARNÉS M, BLANCO A, BERTRAN K, RAMIS A, BUSQUETS N, MAJÓ N. Epidemiological and pathological investigation of fowl aviadenovirus serotypes 8b and 11 isolated from chickens with inclusion body hepatitis in Spain (2011-2013). Avian Pathology: Journal of the W V P A, 2017, 46(2): 157-165.
[28] BROWN J A, BLAKE L, BISNATH J, RAMGATTIE C, CARRINGTON C V, OURA C A L. Identification of four serotypes of fowl adenovirus in clinically affected commercial poultry co-infected with chicken infectious anaemia virus in Trinidad and Tobago. Transboundary and Emerging Diseases, 2019, 66(3): 1341-1348.
[29] MATOS M, GRAFL B, LIEBHART D, SCHWENDENWEIN I, HESS M. Selected clinical chemistry analytes correlate with the pathogenesis of inclusion body hepatitis experimentally induced by fowl aviadenoviruses. Avian Pathology: Journal of the W V P A, 2016, 45(5): 520-529.
[30] SAIFUDDIN M, WILKS C R. Pathogenesis of an acute viral hepatitis: inclusion body hepatitis in the chicken. Archives of Virology, 1991, 116(1/2/3/4): 33-43.
[31] SCHACHNER A, MAREK A, JASKULSKA B, BILIC I, HESS M. Recombinant FAdV-4 fiber-2 protein protects chickens against hepatitis-hydropericardium syndrome (HHS). Vaccine, 2014, 32(9): 1086-1092.
[32] SCHONEWILLE E, JASPERS R, PAUL G, HESS M. Specific- pathogen-free chickens vaccinated with a live FAdV-4 vaccine are fully protected against a severe challenge even in the absence of neutralizing antibodies. Avian Diseases, 2010, 54(2): 905-910.
附表1 用于扩增JL/170408 基因组序列引物Supplementary Table 1 Primers used in the complete genome sequencing of JL/170408
a 引物位置为JL/170408 基因组序列位置(GenBank登录号MN417117)
Primer locations are listed on the basis of the sequence of JL/170408 strain(GenBankaccession number MN417117).
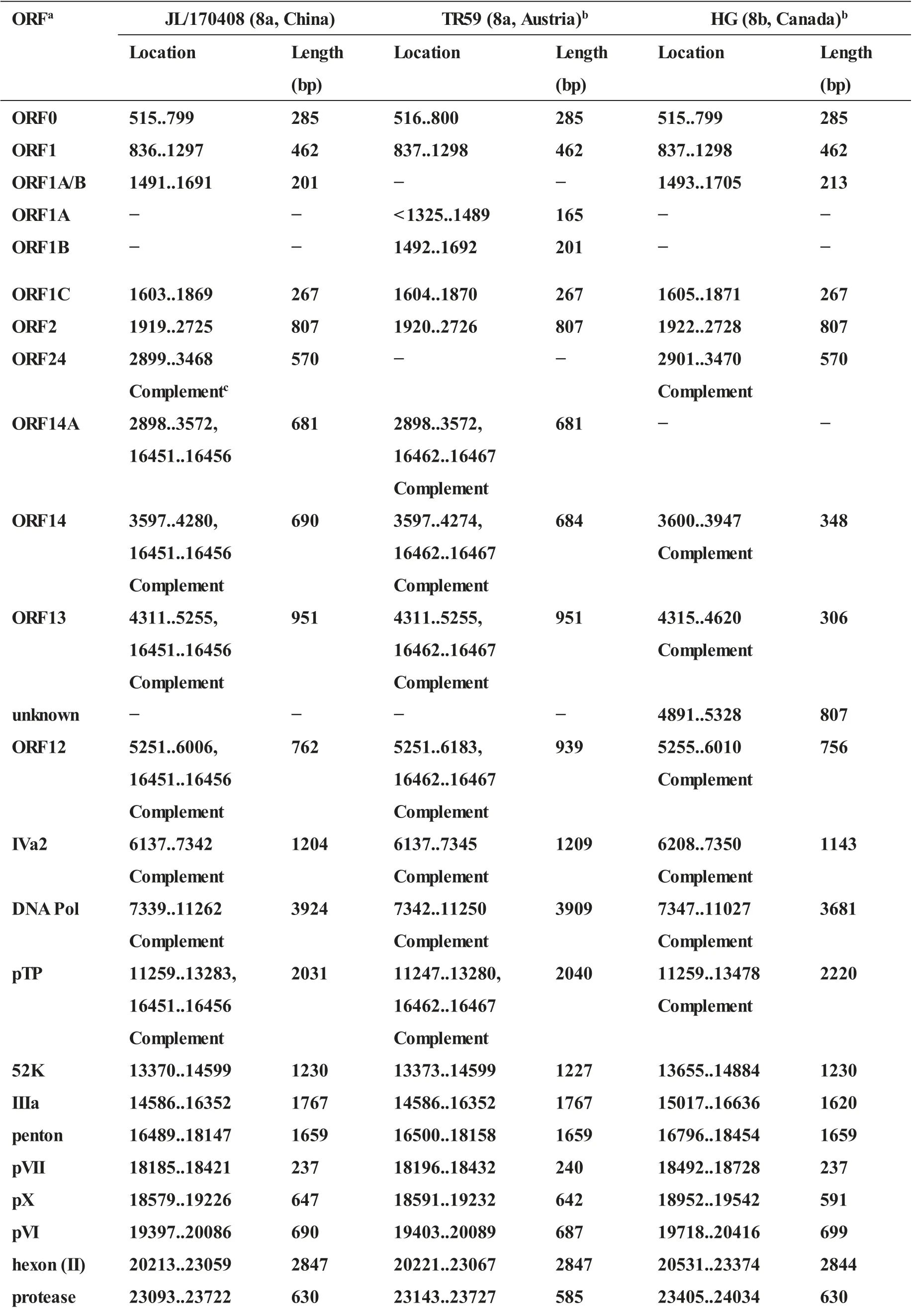
附表2 分离株JL/170408 基因组编码基因与FAdV-8a 和-8b 型参考毒株比较Supplementary Table 2 Predicted protein-encoding genes in the genome of isolate JL/170408 in comparison with reference strains of FAdV-8a and 8b

DBP23831..25345,25480..25653 Complement 168923835..25351,25491..25659 Complement 162024142..25542 Complement 1401 100K25711..28965325525717..28986325826164..292623099 33K−−28631..29030,29243..29556 71428910..29338429 22K28610..2918857928631..29209597−−pVIII29589..3031772929610..3033872929885..30610726 U exon−−lt;30359..30592 Complement 23430565..30864 Complement 300 fiber30570..32144157530591..32165157530863..324341572 ORF32−−−−31204..31431 Complement 228 ORF2232209..32787 Complement 57932230..32808 Complement 579−−ORF22a−−−−32501..32950 Complement 450 ORF22b−−−−32916..33080 Complement 165 ORF20a−−32812..33372,34372..34392 Complement 58233084..33638 Complement 555 ORF2033358..34167 Complement 81033376..34290,34372..34392 Complement 93633648..34457 Complement 810 ORF1934576..36774,36863..36877 Complement 221434594..36792,36883..36897 Complement 221434726..36807 Complement 2082 ORF28−−−−37926..38243318 ORF29−−−−38470..38670201 GAM−138367..3920083438051..38884834−−ORF8a−−−−38652..39047396 ORF8b−−−−39052..39486435 ORF8c−−−−39291..39551261 ORF1739822..40292 Complement 47139032..39502 Complement 47139682..40152 Complement 471 ORF33a−−−−40106..40300195 ORF33b−−−−40502..40666165 ORF1140653..41006,41078..41260,41366..41584 45639863..40217,40288..40469,40588..40740 55140513..41202634 ORF11A−−−−41344..41553 Complement 210 ORF2341920..4285873940999..4193793941852..42715864

ComplementComplementComplement ORF25−−42369..42374,42457..43005 555−−ORF25a−−−−43147..43773627 ORF25b43393..43860468−−43248..43706459
aORF 名称根据其他FAdV同源基因命名。
b括号内代表参考毒株血清型。参考毒株HG(GU734104,加拿大分离株)为FAdV-8b 血清型,TR59(KT862810,澳大利亚分离株)为FAdV-8a 血清型。
c Complement 代表该基因在FAdV基因组中的方向。
aORF name were designated according to the homologous genes of other FAdVs.
bNumber in the bracket represents the serotype of the reference strain. Reference strain HG (GU734104, from Canada)was serotype 8b of FAdV,TR59(KT862810,fromAustria)was serotype 8a of FAdV.
cComplement,represents the orientation of genes in the genome of FAdVs.
Isolation and Pathogenicity of Fowl Adenovirus Serotype 8a Strain
LI HuiXin, SONG WenPing, HAN ZongXi, LIU ShengWang
Harbin Veterinary Research Institute, Chinese Academy of Agricultural Sciences/State Key Laboratory for Animal Disease Control and Prevention, Harbin 150069
【Objective】 Fowl adenovirus (FAdV) circulates in chicken flocks with multiple serotypes, while there is less information about the pathogenicity of all serotype strains. To understand the capability of causing disease as a primary pathogen to chicken of the FAdV-8a strain, we carry out the experiment for evaluating the pathogenic characteristics of this serotype strain, which will help making the control strategy for breeding. 【Method】 In 2017, liver tissue was collected form the diseased flocks. The liver tissue homogenates were inoculated into the embryo egg for isolating the virus. The isolate was determined as a FAdV strain after PCR detection. To classify the isolate, genomic sequencing and the genetic evolution based on the complete genome sequence and the hexon gene sequence were performed. To clarify the pathogenicity, thirty 10-day-old SPF chicks were randomly divided into 2 groups and exposed to the isolate JL/170408 via nasal inhalation and eye droppings. The clinical syndrome (including morbidity and mortality), viremia, virus shedding, circulating antibody, postmortem examination and histopathological detection at 5 days post infection (d.p.i.), viral distribution and the tropism on tissues were performed to evaluate the pathogenic capability and characteristics of JL/170408 to SPF chicks. 【Result】 The complete genome sequencing showed that there were the highest identity between the isolate and the FAdV-8a TR59 strain. They showed high identity in the genomic structure and the encoding gene. Phylogenetic analysis based on the complete genome sequence, the isolate JL/170408 was in the cluster of FAdV-E, further was grouped into the branch of serotype 8a based on the hexon gene. Consequently, the isolate JL/170408 was determined as FAdV-8a serotype within the species of FAdV-E. The clinical peak was observed from 3 to 13 d.p.i. without death. The virus shedding and viremia was detected as early as 3 d.p.i. and last for a long period at least 51d, the antibody was not positive conversion completely and the mean ELISA titer S/P<1, which didn’t provide enough neutralizing ability to eliminate the virus in the blood and the intestinal tract. At 54 d.p.i., the ELISA titer reached a peak with a mean S/P>2, with the consequence of viremia disappearing and a sudden drop of virus shedding. Postmortem examination and histopathological detection at 5 d.p.i. showed no obvious pathologic change. While the viral load was detected in 15 tissues, suggested that the isolate propagated in multiple tissues and exhibited higher tropism to gizzard. By monitoring the circulating antibody, the infected birds showed later antibody positive conversion until 15 d post infection. Not all birds showed positive seroconversion even at 51 d post infection, and the antibody level was stable. At 54 d post infection, the antibody titer reached peak, suggesting that birds may suffer a second infection. Virus neutralization test based on the antiserum of 63 d.p.i. showed that there was no obvious correlation between the circulating antibody and the neutralization antibody. 【Conclusion】 The FAdV-8a strain JL/170408 causes disease to 10-day-old chicks as single pathogen without leading to death, the isolate is determined as low pathogenic strain. JL/170408 propagates in multiple tissues with higher tropism to gizzard. The infected chicks show a long duration of virus shedding with a repetitive characteristics.
fowl adenovirus; serotype 8a; genomic characteristic; pathogenicity

10.3864/j.issn.0578-1752.2023.16.014
2022-06-21;
2022-08-28
黑龙江省自然科学基金团队项目(TD2021C001)
李慧昕,Tel:0451-51051698;E-mail:lihuixin@caas.cn。通信作者刘胜旺,Tel:0451-51051699;E-mail:liushengwang@caas.cn
(责任编辑 林鉴非)

