珍珠龙胆石斑鱼气调保活工艺的研究
黄湘湄,黄 和,周倩帆,陆泽峰
( 广东海洋大学 食品科技学院,广东省水产品加工与安全重点实验室,广东普通高等学校水产品深加工重点实验室,广东 湛江 524088 )
鱼肉是人体所需优质蛋白质的主要来源,高需求量直接促使水产养殖业的迅速发展,预计至少到2025年仍会持续增长[1]。中国渔业统计年鉴2015年至2020年数据显示,石斑鱼(Epinephelus)养殖量年增长速率在10种养殖海水鱼中位列第一,由2014年的8.8×104t增至2019年的1.83×105t[2]。珍珠龙胆石斑鱼(E.fuscoguttatusi♀×E.lanceolatus♂)俗称龙虎斑或珍珠斑,是以棕点石斑鱼(E.lanceolatus,俗称老虎斑)为母本,鞍带石斑鱼(E.fuscoguttatus,俗称龙胆斑)为父本的杂交新品种[3],是一种生长速度快、抗病力强且养殖产量高的暖水性海水经济鱼类养殖品种,具有胶原蛋白含量高、肉质纤维细腻等优点[4],深受消费者青睐。目前国内外水产品保活运输方式主要包括有水保活运输和无水保活运输。珍珠龙胆石斑鱼以有水鲜活流通为主,销售市场有限。传统鲜活运输过程中常因水质恶化、应激、缺氧、振动等不利因素使其产生应激反应,剧烈挣扎,极易相互扎伤造成死亡[3,5-6]。且存在运输密度低、存活率低、运输后品质劣变及食用安全等问题。无麻醉剂添加的低温无水保活运输是一种低成本、高存活率、品质变化小的绿色、安全的新型活体流通模式,具有广阔的应用前景[7]。
气调包装是将一种或多种气体充入包装袋中,减缓食品劣变速率以维持新鲜度与品质,进而延长食品货架期的技术[8]。目前在水产品行业主要应用于保鲜,具有抑制细菌腐败、抗氧化、保持水产品品质、延长货架期等优点[9-10]。在黑鲷(Acanthopagrusschlegelii)[11]、泥蚶(Tegillarculagranosa)[12]、鲫(Carassiusauratus)[13]、海湾扇贝(Argopectenirradias)[14]、黄颡鱼(Pseudobagrusfulvidraco)[15]、大菱鲆(Psettamaxima)[16]、凡纳滨对虾(Litopenaeusvannamei)[17]、花鲈(Lateolabraxmaculatus)[18]、菲律宾蛤仔(Ruditapesphilippinarum)[19]等水产品保活中已有初步研究,但气体比例研究范围过于宽泛,主要聚焦于纯氧,保活效果不佳,相关报道研究缺乏针对性,不利于实际应用中精确控制,且造成资源浪费。笔者首次以珍珠龙胆石斑鱼为试验对象,通过单因素试验和正交试验筛选优化气调保活工艺,并对气调保活过程中肌肉成分、血清生化指标进行分析,旨在开发珍珠龙胆石斑鱼的无水气调保活工艺,为其实际应用提供理论依据。
1 材料与方法
1.1 试验材料
珍珠龙胆石斑鱼1龄,平均体质量(536.0±25.5) g,平均体长(32.25±1.42) cm,购自广东湛江市东风水产品批发市场,规格一致,体表无损伤,健康无病害,加水充氧运输至实验室。于119 cm×89 cm×32 cm暂养池中暂养24 h用于试验。暂养池条件:采用新鲜过滤海水,盐度20~24,水温21~23 ℃,溶解氧质量浓度6.5~8.5 mg/L,pH 7.2±0.5,试验鱼密度85 g/L。
1.2 仪器与设备
CK-901冷却机组(深圳祎祎科技有限公司);GXZ-280D智能型光照培养箱(105 cm×54 cm×54 cm,控温0~50 ℃,宁波市科技园区新江南仪器有限公司);MA 100水分分析仪(德国赛多利斯集团);3-550PD马福炉(美国Neytech公司);SZF-06A粗脂肪测定仪(上海洪纪仪器设备有限公司);VAP 450全自动凯氏定氮仪(德国Gerhardt公司);Cary 紫外可见分光光度计(美国安捷伦科技有限公司);Varioskan Flash全自动酶标仪(赛默飞世尔科技中国有限公司);3660系列模拟量流量计(日本KOFLOC公司)。
血糖、尿素氮、甘油三酯、谷草转氨酶、谷丙转氨酶、酸性磷酸酶、碱性磷酸酶试剂盒(南京建成生物工程研究所);皮质醇[江苏鱼皮质醇酶联免疫分析试剂盒]。O2、CO2、N2纯度均为99.9%(南风牌,湛江世纪双龙工业气体有限公司)。试验海绵(森森集团股份有限公司)。
1.3 方法
1.3.1 低温保活临界温度的测定
珍珠龙胆石斑鱼经停食暂养24 h后,采用梯度降温模式[5]将水温由23 ℃降至10 ℃ (23~15 ℃,2 ℃/h ;15~10 ℃,1 ℃/h),观察并记录珍珠龙胆石斑鱼在不同温度下的行为特征和呼吸频率。以鱼体侧翻,对外界刺激无反应,鳃盖张合频率稳定状态下的温度作为本试验的低温保活临界温度。
1.3.2 单因素试验设计
参照文献中的气体比例[11,13,15,18]、保湿材料[15,20-22]、保活温度[23]进行试验设计。珍珠龙胆石斑鱼经停食暂养24 h后,按上述梯度降温方式降温至鱼体进入休眠状态,选取不同保湿材料(纱布、海绵、丝瓜筋、水苔、木屑)包裹鱼身保持鱼体表面湿润,迅速放入双层自封袋中,充入不同配比(体积比)[V(O2)∶V(CO2)∶V(N2)=65∶5∶30、65∶10∶25、75∶0∶25、75∶5∶20、75∶10∶15、85∶0∶15、85∶5∶10、85∶10∶5、95∶0∶5、95∶5∶0,纯氧]的气体后迅速封口,置于不同温度(7、9、11、13、15、17、19、21、23 ℃)的培养箱中静态模拟运输,每组6尾鱼,分别考察保湿材料、气体配比、保活温度对珍珠龙胆石斑鱼保活时长的影响。
1.3.3 正交试验优化
根据单因素试验结果,采用正交试验进一步对珍珠龙胆石斑鱼无水保活工艺条件进行优化,L9(34)正交试验因素水平编码见表1。

表1 正交试验因素与水平
1.3.4 肌肉成分的测定
参照文献[24]的试验方法,珍珠龙胆石斑鱼经停食暂养24 h后,挑选66尾规格一致、行为活动正常、无机械性损伤的珍珠龙胆石斑鱼于最佳气调保活条件下静态模拟无水保活运输,将其随机分为11组,每组6尾。于暂养24 h后直接取样,记为正常对照组(NC组);暂养后以上述方式进行休眠取样,记为休眠组(DC组);休眠后进行无水保活2、4、6、8、10、12、13 h以及13 h后于室温海水复苏6、12 h后取样,记为无水保活组(WD组),分别记为WD 2 h、WD 4 h、WD 6 h、WD 8 h、WD 10 h、WD 12 h、WD 13 h、R 6 h、R 12 h组。取背部肌肉,用预冷至4 ℃的无菌生理盐水洗净表面血迹并用滤纸吸干表面水分,绞碎液氮速冻后于-80 ℃下冻存待测。暂养24 h后、各保活阶段结束后对珍珠龙胆石斑鱼分别进行称量质量并记录,计算累积体质量损失率。水分测定参考国家标准GB 5009.3—2010(105 ℃常压干燥法);粗蛋白测定参考国家标准GB 5009.6—2016(凯氏定氮法);粗脂肪测定参考国家标准GB 5009.5—2016(索氏抽提法);灰分测定参考国家标准GB 5009.4—2016。
1.3.5 血清生化指标的测定
参照文献[25]的试验方法,用200 mg/L 间氨基苯甲酸乙酯甲磺酸盐快速麻醉鱼体,10 mL注射器插入尾静脉取血,全血不加抗凝剂,4 ℃静置2 h,待血液明显分层后以3000 r/min 4 ℃(离心半径10 cm)离心20 min取血清,-80 ℃冻存待测。其中皮质醇含量采用酶联免疫法测定;指标血糖、尿素氮、甘油三酯、谷草转氨酶、谷丙转氨酶、酸性磷酸酶、碱性磷酸酶均采用试剂盒进行测定。
1.3.6 数据处理
采用SPSS 25.0软件对试验数据进行统计分析,结果以平均值±标准差表示,在单因素方差分析的基础上,结合Tukey检验进行邓肯多重比较,P<0.05表示具有显著性差异。
2 结果与分析
2.1 低温保活临界温度的确定
珍珠龙胆石斑鱼的呼吸频率随着水温的降低逐渐降低(图1)。当温度降至15 ℃时,鱼体游动减慢,呼吸频率(20±1) 次/min;降温至13 ℃时,鱼体较镇定贴于缸底,鱼体不游动,反应能力降低,呼吸频率(14±1) 次/min;降温至12 ℃时,鱼体基本失去平衡,身体侧翻,对外界刺激无明显反应,鳃盖张合频率稳定,呼吸频率(12.61±0.58) 次/min;降温至11 ℃时,呼吸频率无显著变化,但鱼体会出现激烈的应激反应,出现撞击缸壁、四处乱窜、鱼头摇摆不定、反复浮头、弯曲成弓形、肚皮朝上等应激行为;水温降至10 ℃时,呼吸频率7~9 次/min,鱼体呼吸不规律,出现咧鳃张嘴、尾部充血等现象,因此本试验将12 ℃作为珍珠龙胆石斑鱼的低温保活临界温度。与范秀萍等[26]的研究结果有所偏差。
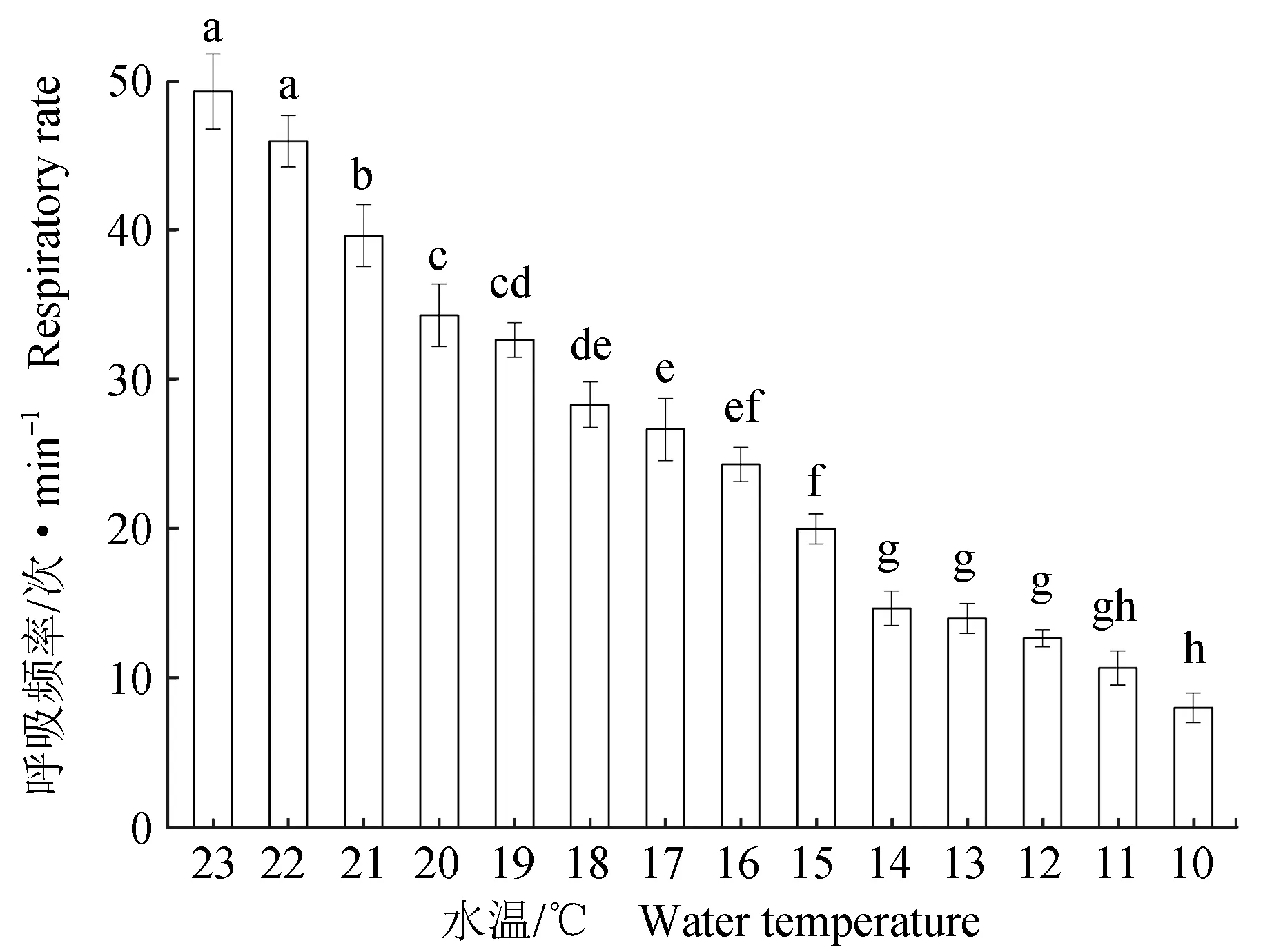
图1 不同温度下珍珠龙胆石斑鱼的呼吸频率Fig.1 Respiratory rate of hybrid grouper E. fuscoguttatus ♀× E. lanceolatus♂ at different temperatures
2.2 珍珠龙胆石斑鱼气调保活工艺优化试验结果
2.2.1 单因素试验结果
保活时长决定了珍珠龙胆石斑鱼保活运输中的实际应用与经济效益。气体配比V(O2)∶V(CO2)∶V(N2)为85∶0∶15时保活效果最佳,珍珠龙胆石斑鱼无水保活时长为(13.12±0.15) h(图2a);气体配比分别为75∶0∶25、65∶5∶30时,存活时长为(11.57±0.34)、(11.26±0.15) h。高体积分数的CO2抑制了鱼体的呼吸作用,不利于其存活,且伴随着一定的应激反应。随着氧气体积分数的升高,无水保活时间延长,氧气体积分数为85%时,保活效果最佳,氧气体积分数继续升高,保活时长呈下降趋势。其原因可能是低体积分数氧气易造成珍珠龙胆石斑鱼缺氧窒息而死亡,而高体积分数氧气增加了氧自由基的含量,造成鱼体细胞的损伤。张玉晗等[18]研究包装氧气浓度对无水活运花鲈组织结构及相关酶活性的影响得出了类似结果,发现花鲈体表黏液溶菌酶活性在包装充氧80%仍能维持在高水平,且鳃丝最接近正常形态。在7~11 ℃,进行无水保活珍珠龙胆石斑鱼的保活时长均低于7 h,保活效果较差(图2b);温度为15 ℃时,无水保活效果显著优于其余组(P<0.05),为(12.90±0.13) h;温度高于15 ℃时,保活时长随保活温度的升高而逐渐降低,与Fan等[23]的研究结果基本一致。温度过高或过低鱼体均会产生胁迫或应激,不利于无水保活。海绵和纱布作为保湿材料更有利于珍珠龙胆石斑鱼的保活(P<0.05),保活时长分别为(13.16±0.16)、(12.89±0.07) h(图2c),这可能与其保水性好、包裹性强有关;水苔的保活效果一般,保活时长为(11.65±0.09) h;丝瓜筋和木屑具有较差的锁水性,其保活时长最短。
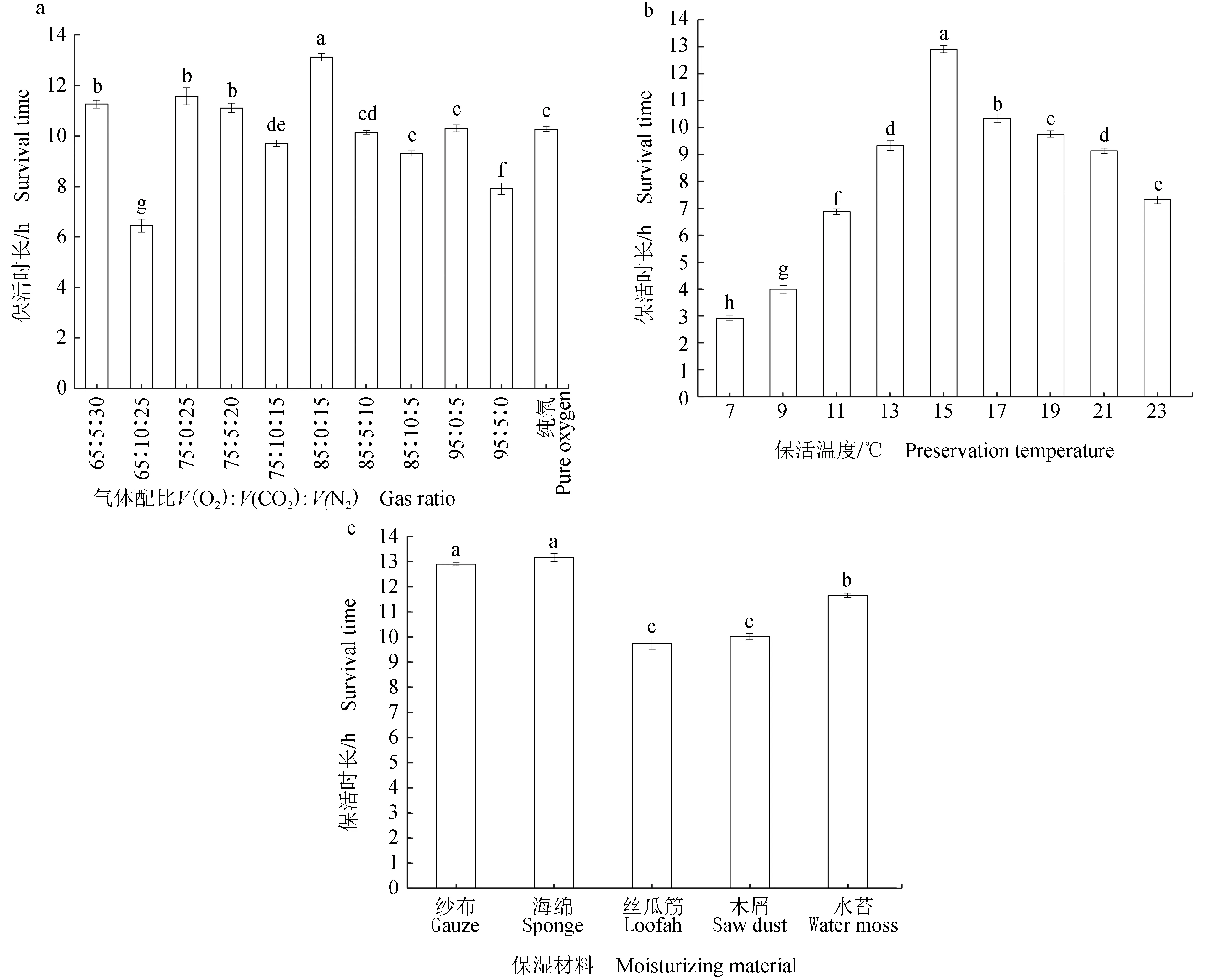
图2 不同因素对珍珠龙胆石斑鱼保活时长的影响Fig.2 Effects of different factors on survival time of hubrid grouper E. fuscoguttatus ♀× E. lanceolatus♂
2.2.2 正交试验结果
影响珍珠龙胆石斑鱼保活时长的各因素为保活温度(B)>气体配比(A)>保湿材料(C)(表2)。珍珠龙胆石斑鱼无水气调保活最佳工艺条件为A3B1C3,即气体配比为V(O2)∶V(CO2)∶V(N2)=85∶0∶15,保活温度为15 ℃,保湿材料为海绵。
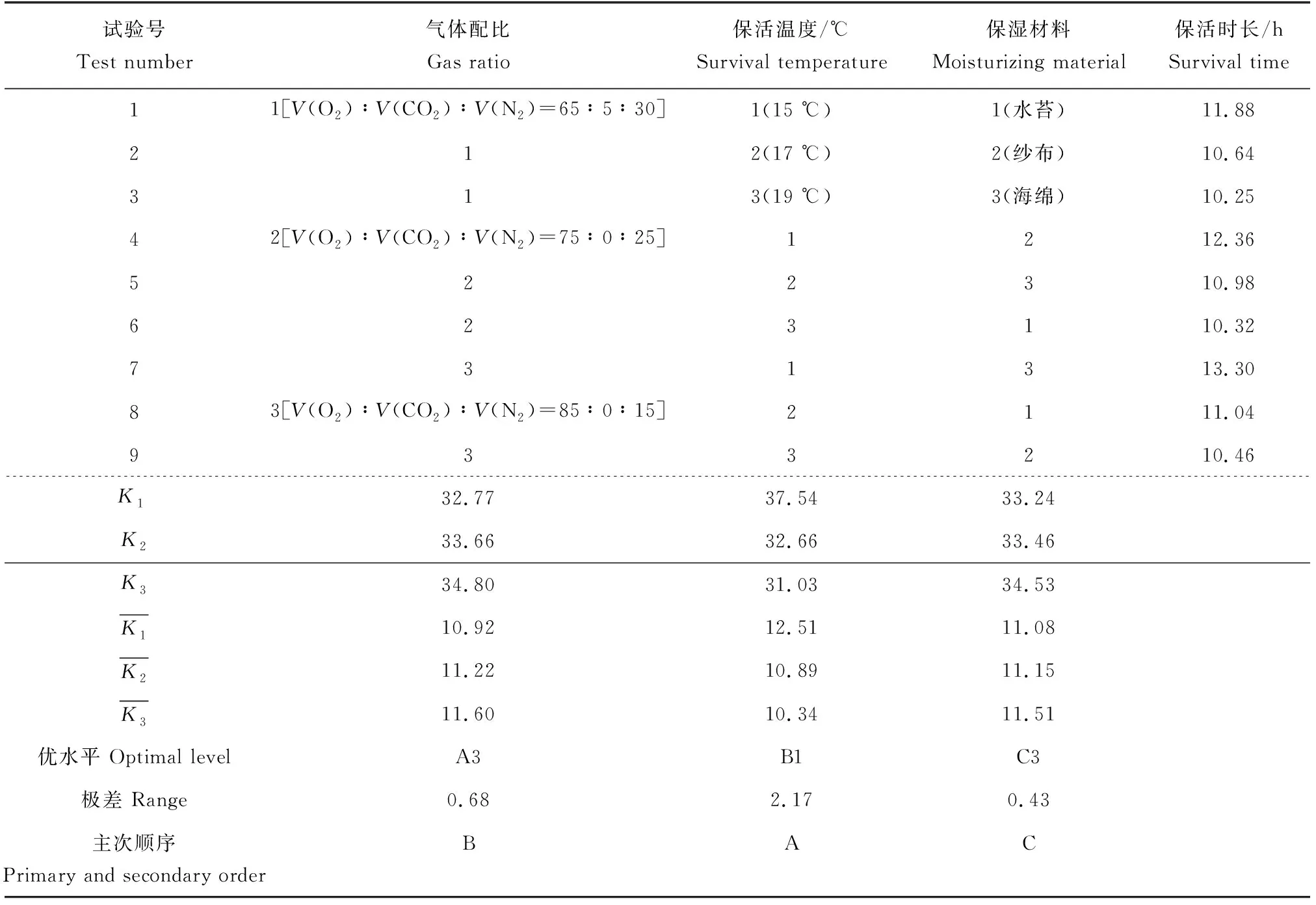
表2 正交试验数据分析结果
2.2.3 最佳条件验证结果
珍珠龙胆石斑鱼在最佳气调保活条件下平均保活时长为(13.88±1.00) h,无水保活12.0~12.5 h珍珠龙胆石斑鱼的存活率为100%,保活13 h时存活率仍达90%,证实了该条件的稳定可靠性(表3)。

表3 验证试验结果
2.3 气调保活对珍珠龙胆石斑鱼的累积体质量损失率的影响
鱼体质量与鱼体肌肉中蛋白质、脂肪等成分含量息息相关,是决定其最终售价的关键因素,更是衡量气调无水保活运输条件优劣的重要指标。珍珠龙胆石斑鱼的体质量损失率随保活时间的延长而逐渐升高,复水12 h后累积体质量损失率达(6.49±0.15)%,可能是保活阶段均未投食,为维持正常的生命活动,鱼体消耗自身的能量物质导致体质量逐渐降低(图3)。鱼体在适应无水环境过程中消耗了较多能量,无水保活2 h时体质量损失率显著高于休眠组(P<0.05);重新回归水体环境,游动消耗大量能量导致体质量急速下降。
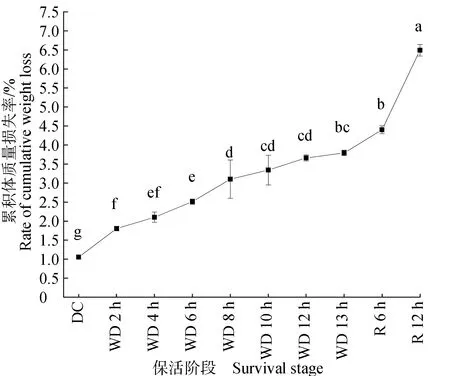
图3 不同保活阶段珍珠龙胆石斑鱼的累积体质量损失率Fig.3 Cumulative weight loss rate of hybrid grouper E. fuscoguttatus ♀× E. lanceolatys ♂ at different keep-alive stages
2.4 不同保活阶段珍珠龙胆石斑鱼肌肉成分含量的变化
不同保活阶段的珍珠龙胆石斑鱼背肌的水分含量、灰分含量、粗脂肪含量、粗蛋白含量见图4。珍珠龙胆石斑鱼气调保活至复水阶段,背肌中的水分含量无显著性变化(P>0.05);灰分含量随着保活时间的延长略微升高;粗蛋白、粗脂肪两者含量均逐渐降低,蛋白质减少了4.21 g/100 g,脂肪减少了2.66 g/100 g。
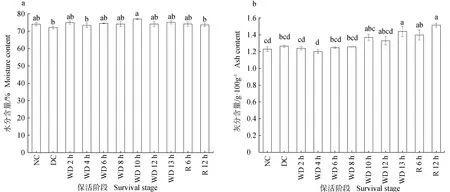
图4 不同保活阶段珍珠龙胆石斑鱼背肌的营养成分含量的变化Fig.4 Changes in nutritional components content in dorsal muscle of hybrid grouper E. fuscoguttatus ♀×E. lanceolatus♂ at different keep-alive stages
2.5 不同保活阶段珍珠龙胆石斑鱼血清生化指标的变化
最佳气调保活条件下珍珠龙胆石斑鱼不同保活阶段血清生化指标的变化见表4。血糖含量、皮质醇含量随保活时间的延长呈曲线变化,尿素氮含量、谷草转氨酶、谷丙转氨酶、酸性磷酸酶活性明显升高,甘油三酯含量、碱性磷酸酶活性有所下降;气调保活中珍珠龙胆石斑鱼肾脏、肝脏、免疫系统均受到一定程度的损伤但复苏之后均有所恢复趋于正常水平。
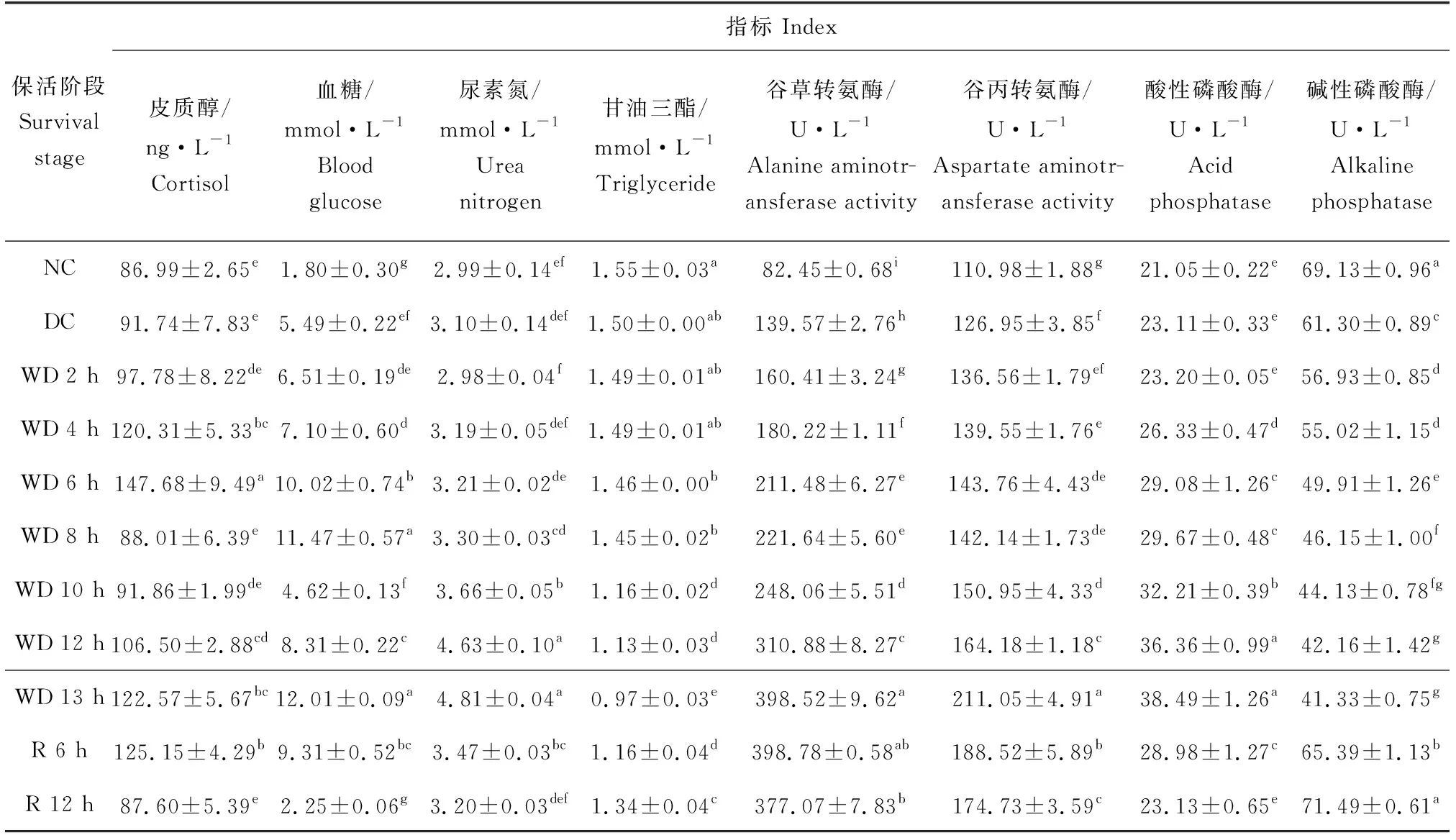
表4 不同保活阶段珍珠龙胆石斑鱼血清生化指标的变化
3 讨 论
3.1 珍珠龙胆石斑鱼气调保活工艺研究
鲜活水产品能最大限度保留肉质原有风味与营养价值,其安全性高,市场需求量大,经济效益高[27]。无水保活运输方法是一种高存活率、高质量、高安全性、长时间的绿色环保运输方法,具有运输量大、物理损伤小等优点[28]。目前珍珠龙胆石斑鱼保活运输的研究主要聚焦于暂养方式与人工诱导休眠方式。朱乾峰[7]研究结果显示,停食暂养24~48 h可有效缓解珍珠龙胆石斑鱼捕捞、运输所引起的应激反应,对肌肉营养成分含量无显著影响,可有效延长保活时长。Fan等[23]采用梯度降温方式对珍珠龙胆石斑鱼进行低温休眠处理,15~20 ℃其无水保活的存活时间为9~10 h。笔者经正交试验得到珍珠龙胆石斑鱼无水气调保活最佳工艺条件为气体配比为V(O2)∶V(CO2)∶V(N2)=85∶0∶15,保活温度为15 ℃,保湿材料为海绵;平均保活时长为(13.88±1.00) h,高效延长了珍珠龙胆石斑鱼无水保活时长。
3.2 不同保活阶段珍珠龙胆石斑鱼肌肉成分的变化
珍珠龙胆石斑鱼肌肉营养成分的含量与王际英等[29]的研究结果基本一致。无水气调保活运输对珍珠龙胆石斑鱼的肌肉水分含量影响极小,进一步证实了海绵具有优良的保湿性。灰分是经灼烧后所残留的无机物质,珍珠龙胆石斑鱼背肌中的灰分含量随保活时间的延长略微升高,这可能是因为有机能量物质被消耗而转化为无机物。粗蛋白、粗脂肪为功能性物质。初期低温胁迫鱼体耗费了较多能量,休眠状态下呼吸频率降低、新陈代谢减慢,但保活阶段均未投食,体内能量物质粗蛋白、粗脂肪为维持正常生命活动被逐渐消耗,以满足鱼体自身的能量需求。随着无水保活环境劣化,鱼体应激,新陈代谢加快,对供能物质消耗增多,复水后珍珠龙胆石斑鱼正常游动消耗导致两者含量均有所降低。整个过程中脂肪含量降低的幅度远大于蛋白质,表明气调保活期间珍珠龙胆石斑鱼体内的主要供能物质是脂肪而非蛋白质[26,30]。
3.3 不同保活阶段珍珠龙胆石斑鱼血清生化指标的变化
鱼体发生应激反应时生命活动剧烈、新陈代谢旺盛,导致血糖水平的变化,因此血糖通常被作为可靠的生理应激指标之一[31]。本试验结果表明,气调保活过程中珍珠龙胆石斑鱼血糖含量逐步上升,无水保活 8 h时显著高于正常对照组(P<0.05),可能是饥饿协同环境胁迫导致鱼体代谢活动增强,所需能量增多,肝糖原分解加速使血糖含量增加。适应生存环境后应激减缓,生存消耗造成无水保活10 h时血糖含量显著下降,随着包装袋中氧气的消耗以及二氧化碳的累积,生活环境恶化引起鱼体发生应激反应,加速糖原分解导致血糖含量急剧升高,复苏阶段鱼体饥饿不断消耗能量,鱼体内的血糖不断被分解以能量供给机体,慢慢趋于较低水平。
皮质醇是评价鱼类应激反应的指示性指标,当鱼体发生应激反应时会引起各项激素水平的变化,皮质醇作为反应链分泌的最后一种激素,其含量随着应激强度的增大而升高[6]。气调保活过程中,珍珠龙胆石斑鱼皮质醇含量呈直线上升,无水保活6 h时显著上升(P<0.05),为(147.68±9.49) ng/mL。逐渐适应无水环境后趋于平缓,随保活时间的延长,包装袋中氧气被消耗至鱼类生命极限,皮质醇含量稳步上升。移至复苏池珍珠龙胆石斑鱼皮质醇含量仍处于较高水平,复水12 h后皮质醇含量与正常对照组一致,此时珍珠龙胆石斑鱼正常平缓游动。
血中尿素氮来源于肝脏,通过肾脏随尿液排出体外。肾脏损伤引起功能衰竭、肾炎时血液尿素氮的含量会增加,因此尿素氮可作为肾脏功能的评价指标[5]。试验结果表明,尿素氮含量随保活时间的延长而显著升高(P<0.05),肾脏受到一定程度的损伤;无水保活13 h鱼体应激强烈,皮质醇增大刺激血清尿素氮的释放,肾脏受损保活时间无法延长。
甘油三酯是动物细胞储脂的主要形式[26]。本试验中,甘油三酯含量明显下降,一是未投食导致鱼体能量物质的消耗,二是肝脏损伤阻碍了肠肝循环的正常运行。相较于无水保活13 h,复苏阶段甘油三酯含量显著上升(P<0.05),可能是水体环境使鱼体恢复活力状态,甘油三酯通过肠肝循环被肝脏重吸收。
谷草转氨酶、谷丙转氨酶是鱼类重要的转氨酶,主要存在于肝脏和心肌细胞中,血清中含量极低。当肝细胞受损时,谷草转氨酶和谷丙转氨酶会被释放到血液中,因此血清中谷草转氨酶和谷丙转氨酶活性的增加被认为是肝功能损伤最具特异性和广泛使用的指标[32]。本试验结果显示,气调保活对鱼体造成损伤,两者活性均呈现持续升高趋势。无水保活13 h时谷草转氨酶、谷丙转氨酶活性显著高于正常对照组(P<0.05),可能是长时间低温无水环境致使鱼体抗氧化系统出现紊乱,珍珠龙胆石斑鱼肝脏出现不可修复的损伤。复水12 h后血清中谷草转氨酶和谷丙转氨酶活性显著高于正常对照组(P<0.05),气调保活引起的珍珠龙胆石斑鱼应激反应经12 h缓解后有所恢复但仍不能完全解除。
溶酶体可通过水解细菌细胞壁组分来清除细菌,因此常用作水生生物功能防御和健康状况的标志物,酶体膜通透性降低会释放碱性磷酸酶、酸性磷酸酶等酶类[33],两者可直接参与鱼体中磷酸基团的转移及钙磷代谢,还能够改变病原体的表面结构以增强机体对病原体的识别和吞噬能力,因而在鱼体内的免疫应答和物质代谢中起到重要作用[34-35]。本试验结果表明,珍珠龙胆石斑鱼血液中碱性磷酸酶活性明显下降,低温无水环境导致鱼体机体免疫能力降低或代谢活动下降,复水12 h后碱性磷酸酶活性回复到正常对照组水平,表明鱼体恢复了正常的代谢和免疫能力,与刘骁等[25,36]的研究结果高度一致。酸性磷酸酶活性随着保活时间的延长逐渐升高,无水环境刺激石斑鱼的免疫应答引起其活性的增强,进而增强机体免疫防御能力,复水12 h后回归正常水平,与王维政等[37]研究结果一致。
4 结 论
以存活时长为指标优化确定了珍珠龙胆石斑鱼的气调保活工艺,气体配比为V(O2)∶V(CO2)∶V(N2)=85∶0∶15,保活温度为15 ℃,保湿材料为海绵时,无水保活12.5 h存活率为100%。背肌水分含量无明显变化,灰分含量略微升高,粗蛋白、粗脂肪含量逐渐降低。血糖含量、皮质醇含量随保活时间的延长呈曲线变化,尿素氮含量,谷草转氨酶、谷丙转氨酶、酸性磷酸酶活性明显升高,甘油三酯含量、碱性磷酸酶活性有所下降;气调保活中珍珠龙胆石斑鱼肾脏、肝脏、免疫系统均受到一定程度的损伤但复水之后均有所恢复趋于正常水平,且保活时长高于目前常用的纯氧环境。可见气调保活具有极高的经济潜力,在较大程度上克服了活运时间短的问题,对促进珍珠龙胆石斑鱼保活运输、市场销售具有较好的指导作用。

