脑功能网络拓扑属性改变支持向量机模型预测海马硬化型颞叶癫痫患者术后转归
刘付金龙,刘高平,白义钧,李 凤,陈 钱,陈 玖,王正阁,张 冰,,*
(1.南京大学医学院附属鼓楼医院医学影像科,江苏 南京 210008;2.安徽省六安市人民医院医学影像科,安徽 六安 237000;3.南京医科大学鼓楼临床医学院医学影像科,江苏 南京 210008)
海马硬化(hippocampal sclerosis, HS)型颞叶癫痫(temporal lobe epilepsy, TLE)是成人常见药物难治性癫痫,以广泛海马神经元丢失和胶质增生为特征[1]。前颞叶切除术(anterior temporal lobectomy, ATL)是治疗HS-TLE的首选外科手段,但33%~50%患者术后仍可出现癫痫发作[2]。静息态功能MRI(resting-state functional MRI, rs-fMRI)可通过检测血氧水平依赖信号变化而评估大脑活动、观察脑区之间的功能连接和网络特性[3]。图论分析为一种数学方法,可用于量化复杂网络的拓扑属性[4];基于rs-fMRI图论分析能揭示大脑区域之间的功能整合或分离程度及信息传递方式[5]。本研究基于rs-fMRI图论分析所获HS-TLE患者脑功能网络拓扑属性改变建立支持向量机(support vector machine, SVM)模型,观察其预测HS-TLE患者ATL术后转归的价值。
1 资料与方法
1.1 一般资料 回顾性分析2009年7月—2021年3月南京大学附属金陵医院收治的34例接受ATL的单侧HS-TLE患者(HS-TLE组),男15例、女19例,年龄15~49岁、平均(26.9±9.1)岁;均为ATL术后2年;均为右利手并符合国际抗癫痫联盟HS-TLE诊断标准[6];其中15例致痫灶位于左侧海马、19例位于右侧海马。排除标准:①左利手或双利手;②其他颞叶内侧病灶所致颞叶内侧癫痫,如局灶性皮层发育不良及皮层良性占位;③头颅外伤或手术史;④MR禁忌证。根据癫痫Engel分级将HS-TLE组患者分为无癫痫发作(seizure-free, SF)亚组(Engel Ⅰa级,n=20)和癫痫发作(non-seizure-free, NSF)亚组(Engel Ⅰb~Ⅳ级,n=14)。另招募同期50名性别、年龄相匹配的健康对照者(healthy control, HC)为HC组,男27名、女23名,年龄19~46岁,平均(29.1±8.6)岁。本研究获院伦理委员会批准(2021-432-02)。检查前受试者或家属均签署知情同意书。
1.2 仪器与方法 采用Siemens TIM Trio 3.0T或Philips Ingenia 3.0T MR扫描仪及8通道头部线圈扫描头部。参数:高分辨率3D-T1WI,采用三维梯度回波序列,TR 2 300 ms,TE 2.98 ms,FA 9°,FOV 256 mm×256 mm,矩阵256×256,层厚1 mm;rs-fMRI,采用平面回波成像序列,TR 2 000 ms,TE 30 ms,FA 90°,层厚4.0 mm,层间距0,FOV 240 mm×240 mm,矩阵64×64,层数35,共采集250个时间点。
1.3 图像处理
1.3.1 预处理 采用Matlab R2022b平台DPARSF 6.0工具包(http://rfmri.org/DPARSF)对rs-fMRI数据进行预处理:①转换图像格式;②对右侧HS-TLE患者的图像进行左右翻转,使所有患者致痫灶均位于左侧[7];③去除前10个时间点的信号;④校正时间层及头动;⑤重定向图像方向;⑥配准与空间标准化,将数据配准至蒙特利尔神经学研究所(Montreal Neurological Institute, MNI)空间,并重采样为体素3 mm×3 mm×3 mm;⑦滤波,选用0.01~0.1 Hz频率消除混杂信号;⑧回归协变量,去除头动、脑白质及脑脊液信号的干扰。所有受试者rs-fMRI头动均<2 mm,旋转角度<2°。
1.3.2 图论分析 以Matlab平台的GRETNA工具包(https://www.nitrc.org/projects/gretna)构建脑网络及基于图论分析的网络属性。采用自动解剖标记90图谱将大脑分成90个脑区并构建脑网络。设置网络稀疏度阈值为0.05~0.50、间隔为0.05,计算所有受试者在该10个阈值点的大脑网络节点属性,包括介数中心性、度中心性及节点效率。采用独立样本t检验评估组间及亚组间节点属性的差异,以错误发现率(false discovery rate, FDR)进行校正。
1.3.3 分类分析 以亚组间差异具有显著统计学意义的图论指标组成特征向量,采用Matlab 2022b内置线性SVM进行训练,以5折交叉验证法评价模型预测HS-TLE患者ATL术后转归的分类效能。
1.4 统计学分析 采用SPSS 23.0统计分析软件。以χ2检验比较定性资料。以±s表示符合正态分布的计量资料,以中位数(上下四分位数)表示不符合正态分布者,行独立样本t检验或Mann-WhitneyU检验。P<0.05为差异有统计学意义。
2 结果
2.1 一般资料 组间及 HS-TLE组内亚组间一般资料差异均无统计学意义(P均>0.05,表1)。
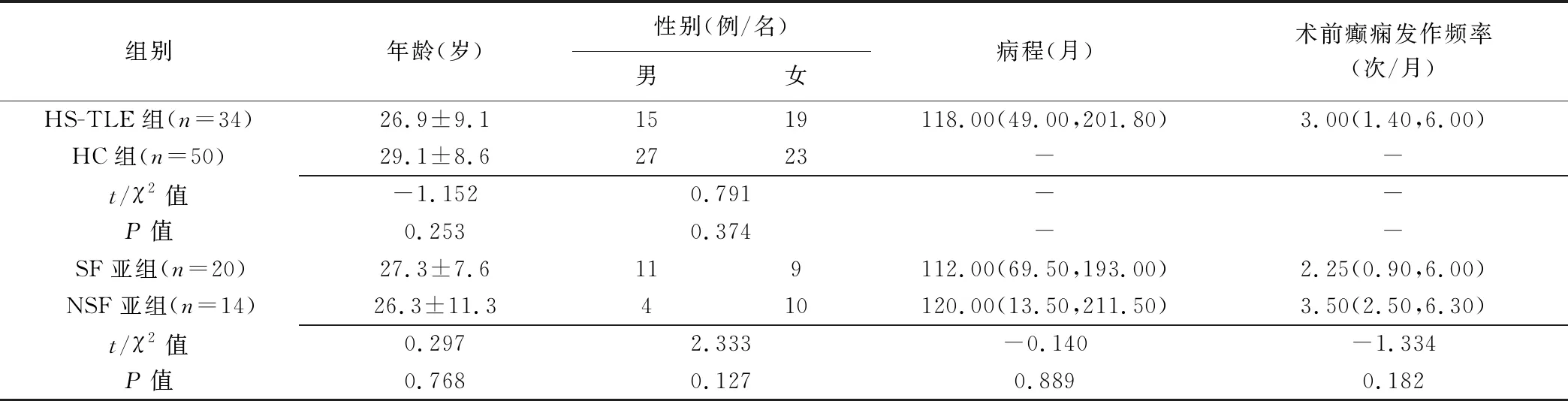
表1 34例HS-TLE与50名HC一般资料
2.2 图论分析 相较HC组,HS-TLE组患侧海马介数中心性降低,对侧额中回和额中回眶部及左侧额下回岛盖部、额下回三角部、额下回眶部和尾状核度中心性升高,而双侧海马及左侧海马旁回、杏仁核、枕上回度中心性降低;HS-TLE组对侧额中回及左侧额下回三角部节点效率升高,而患侧海马、海马旁回及杏仁核节点效率降低,见表2及图1。

图1 HS-TLE组与HC组存在显著差异属性的大脑网络节点(FDR校正) 色带代表t值
HS-TLE组内,相比NSF亚组,SF亚组患侧杏仁核及对侧直回、角回、颞中回介数中心性降低,而对侧枕上回、梭状回介数中心性升高,且对侧枕上回和枕中回度中心性及节点效率均升高。见图2及表3。
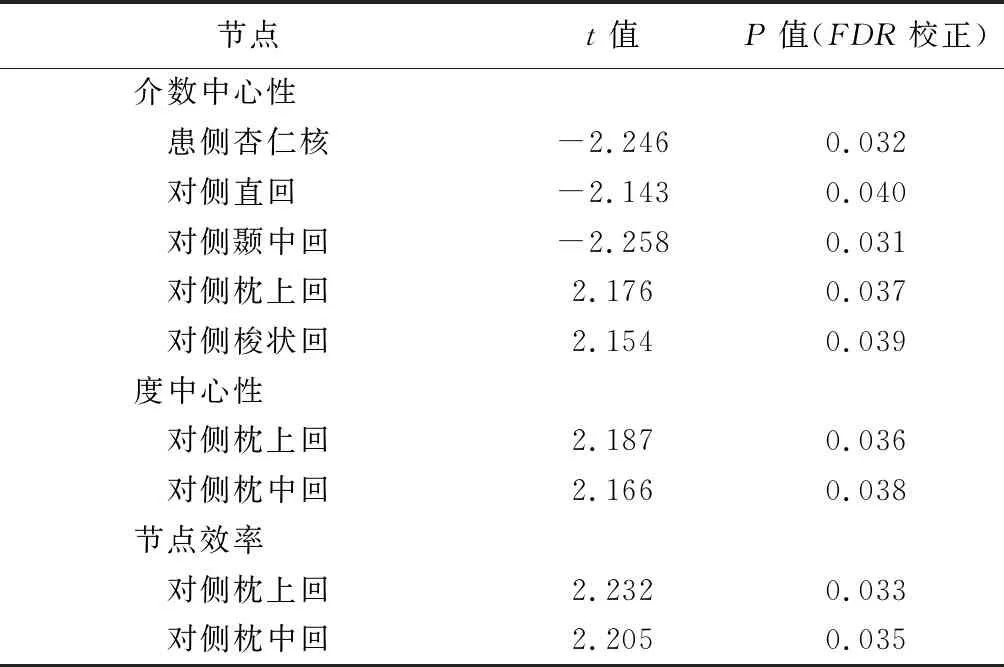
表3 SF亚组相比NSF亚组存在显著差异属性的大脑网络节点
2.3 SVM模型的分类效能 SVM模型预测34例HS-TLE患者ATL术后转归的准确率为76.47%(26/34),见图3。
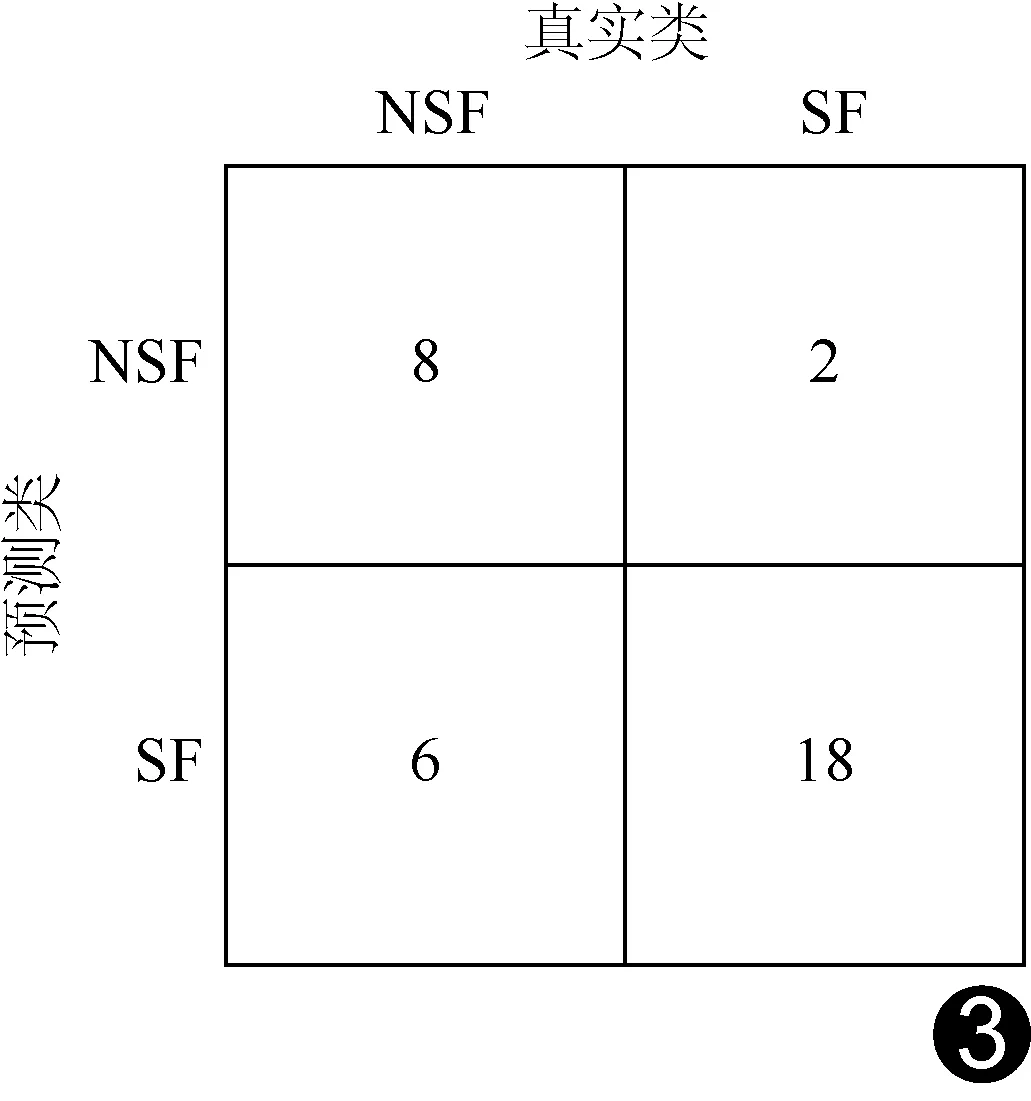
图3 SVM模型预测34例HS-TLE患者ATL术后转归
3 讨论
海马是TLE活动的中心;杏仁核及海马旁回是TLE重要活动区域,包括癫痫起源、扩散和传播,均可致TLE发作[7]。既往研究[8]表明,HS-TLE患者颞叶内侧结构和功能受损可致脑区之间连接模式改变,使其结构及功能网络发生重组。本研究发现HS-TLE患者大脑网络节点拓扑属性发生改变,主要表现为以海马、杏仁核及海马旁回等为主的患侧颞叶介数中心性、度中心性及节点效率降低,提示在HS-TLE患者脑功能网络中,颞叶信息传递能力及网络连接数量均下降,使其在网络中的重要性降低;而以双侧额叶等为主的患侧颞外区域度中心性及节点效率升高则代表上述区域在HS-TLE患者脑功能网络中的重要性上升,即承担更多信息传递或处理任务,可能源于对颞叶内侧功能损伤的代偿。
杏仁核是HS-TLE活动的重要区域[9]。本研究结果显示,相比NSF亚组,SF亚组患侧杏仁核介数中心性降低,表明患侧杏仁核中介效应更低、功能连接更少,即在癫痫活动的扩散及传播中起限制作用,可缩小癫痫累及范围。多项研究[10-11]表明,TLE患者ATL术后癫痫复发与对侧大脑半球异常有关。DESALVO等[12]发现,TLE患者对侧颞岛叶皮层全局网络整合程度较低与术后持续性癫痫发作相关。一侧TLE亦可累及对侧颞叶内侧[13];而HS-TLE患者ALT术后癫痫发作与致痫灶切除不完整、致痫网络断开不完全有关[14]。本研究HS-TLE组中,相比NSF亚组,SF亚组对侧颞中回等介数中心性降低,表明其对侧颞中回功能连接减少、在脑功能网络中的重要性降低;而NSF亚组对侧颞中回在脑功能网络中的重要性上升的可能原因则在于一侧HS-TLE累及对侧颞叶或可促进癫痫发生、发展及扩散;对侧枕上、中回度中心性及节点效率升高表明对侧枕叶功能受损。以上结果表明,HS-TLE患者ATL术后脑功能网络发生了重组,而对侧大脑半球网络拓扑属性异常可能是预测HS-TLE患者ALT术后转归的重要指标之一。
本研究对基于rs-fMRI图论分析所获HS-TLE亚组间存在差异大脑网络节点的拓扑属性进行训练,构建SVM模型用预测HS-TLE患者ALT术后转归,其准确率为76.47%(26/34),提示其可用于预测HS-TLE患者ALT术后转归。
综上,脑功能网络拓扑属性变化SVM模型可用于预测HS-TLE患者ATL术后转归。但本研究样本量有限,且均已接受抗癫痫药物治疗,可能影响大脑网络,且未涉及致痫灶侧别,有待积累更多病例进一步观察。

