达雷妥尤单抗治疗伴心肾损害的系统性轻链型淀粉样变性一例
徐卓涵 何灵芝
系统性轻链(amyloid light chain,AL)型淀粉样变性是单克隆轻链错误折叠形成的淀粉样蛋白沉积于细胞外基质的疾病,可累及多处组织器官,导致器质损害和功能障碍,这一罕见病发病率在9.7~14.0例/百万人年,发病时平均年龄为63 岁[1]。达雷妥尤单抗(daratumumab,DARA)是针对浆细胞表面CD38抗原的人源化IgG1-κ 单抗,2021 年10 月DARA 以原发性AL 型淀粉样变性为适应证在中国获批,并且写入指南[2],成为AL 型淀粉样变性治疗的新热点。由于此疾病罕见且国内DARA 上市时间较短,相关治疗经验和数据较少。本文报道了1 例典型伴心肾损害的AL 型淀粉样变性患者,经DARA 治疗获得良好疗效,并结合相关文献进行讨论,旨在增强对此病的认识及提供部分治疗经验。
1 病例资料
本研究经浙江中医药大学附属第一医院伦理委员会审核通过(伦理批件号:2023-KLS-037-01)。
患者,男,68 岁,因“反复胸闷2 年伴蛋白尿7 d”于2021 年9 月16 日至浙江中医药大学附属第一医院肾内科住院治疗。患者诉2 年前出现反复胸闷,1年前有心绞痛发作史,当时行冠脉支架植入,7 d 前出现下肢水肿,查白蛋白25.7 g/L,尿蛋白+++。既往有高血压病史20 余年,2 年前因低血压停用降压药。入院查体:体温36.5 ℃,脉搏78 次/分,呼吸18 次/分,血压94/55 mmHg(1 mmHg=0.133 kPa)。心律不齐,肺、腹部查体未见明显异常,下肢轻度浮肿。实验室检查:尿蛋白定量1.53 g/24 h,尿红细胞0/μL,尿微量白蛋白1433.5 mg/L,微量白蛋白/尿肌酐4.115,尿轻链κ 20.10 mg/L,尿轻链λ 21.40 mg/L。血清白蛋白26.9 g/L,球蛋白25.9 g/L,肌酐74 μmol/L,尿素氮7.0 mmol/L,尿酸403 μmol/L,肌酸激酶54 U/L。B 型利钠肽249.1 ng/L,N 端前脑钠肽3975.0 ng/L,高敏肌钙蛋白-Ⅰ0.050 μg/L。血常规、肝功能正常。血清轻链κ 4.99 g/L,血清轻链λ 12.70 g/L,血轻链差值7.71 g/L,κ/λ=0.39。血清IgG 14.00 g/L。血、尿免疫固定电泳:IgG 型、λ 型单克隆免疫球蛋白阳性。辅助检查(见图1):光镜:未见肾小球球性硬化及节段性硬化,肾小球系膜区见均质淡染的无结构物质沉积,PASM 染色节段肾小球基底膜外侧见睫毛样结构;超微结构:肾小球系膜区和节段外周袢可见低密度电子致密物,上皮侧呈“毛刺状”样改变,高倍镜下为随机排列的、无分支的直径约8~12 nm 丝状结构。免疫荧光:IgG(-),IgM(-),IgA(-),C3(-),C1q(-),Fib(-),ALB(-),kappa(±),lambda(+++),IgG1(-),IgG2(-),IgG3(-),IgG4(-),PLA2R(-),THSD7A(-)。特殊染色(刚果红):肾小球、少量肾间质、少量血管阳性。综合光镜、免疫荧光及电镜检查,符合肾淀粉样变性(AL 型)。骨髓常规:浆细胞比例略偏高约占3.0%,形态正常,余未见明显异常。骨髓流式:骨髓中可见单克隆增生的浆细胞,约占有核细胞的1.73%。心电图:不排除为不完全性左束支传导阻滞。心脏超声:左房容积指数(LAVI)42.5 mL/m2,左室射血分数(LVEF)63%。心脏磁共振:左房增大(前后径约42 mm);室间隔增厚(厚度约17~23 mm),左室各壁增厚(最厚处约15 mm),考虑心肌淀粉样变性可能;左室舒张运动减弱;二、三尖瓣及主动脉瓣少许反流;心包积液。

图1 患者辅助检查结果
诊断:AL 型淀粉样变性(λ 轻链型Mayo 分期Ⅲa期累及心脏、肾脏)。患者共接受6 个疗程化疗(见图2)。第1 个疗程予BRD 方案(硼替佐米2.4 mg+来那度胺25 mg+地塞米松40 mg),患者D-二聚体及纤维蛋白原持续增高,查肺动脉CT 血管造影(CT angiography,CTA)提示肺栓塞,予肝素抗凝后凝血指标逐渐下降。其后患者因胃肠道不适更换化疗方案,共接受5 个疗程化疗(DARA 800 mg+环磷酰胺0.4 g+地塞米松20 mg)。6 次疗程结束后复查:血液、尿液免疫固定电泳阴性,血轻链κ 2.80 g/L,血轻链λ 2.56 g/L,血轻链差值0.24 g/L,κ/λ=1.09。N 端前脑钠肽623.5 ng/L。尿蛋白+++,血肌酐58 μmol/L。根据2021年AL 型淀粉样变性指南[6],血液学疗效达完全缓解,心脏疗效达非常好的部分缓解,肾脏疗效未缓解。
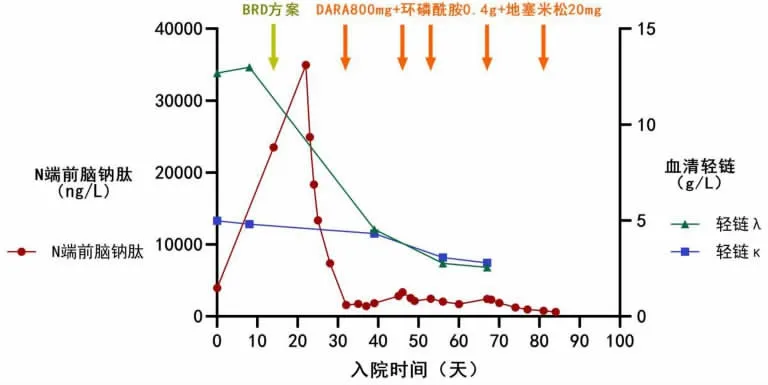
图2 患者血清轻链λ、轻链κ 和N 端前脑钠肽水平的变化
2 讨 论
淀粉样变性既往被分为原发性、继发性及遗传性,现以淀粉样蛋白种类为分型依据更受认可,如免疫球蛋白轻链型(AL 型)、免疫球蛋白重链型(immunoglobulin heavy chain amyloidosis,AH)等,目前已知的淀粉样蛋白有40 种[3]。AL 型除原发外,还常继发于多发性骨髓瘤等浆细胞恶性增生性疾病。AL型淀粉样变性预后具有较大的异质性,确诊后6 个月内死亡概率约24%[4],此病临床表现多样,而特异性体征如舌体肥大、眶周紫癜只出现在15%的患者,因此极易漏诊与误诊[5]。
本例患者在没有完善检查的情况下,极易诊断为心肌肥厚及肾病综合征而漏诊,因此疑似病例的全面检查、尤其是组织学活检至关重要。本例患者血、尿免疫固定电泳示IgG、λ 型单克隆免疫球蛋白阳性,但肾活检的免疫荧光单见λ 轻链沉积,故无法诊断为重轻链淀粉样变性(heavy-and light-chain amyloidosis,AHL),只有当活检及血液中同时检测到单克隆IgG(且为单一IgG 亚型)以及单克隆轻链时才可诊断为AHL 型。
AL 型淀粉样变性治疗目标是降低体内轻链的水平,阻止淀粉样蛋白的进一步沉积,治疗主要围绕清除产生异常轻链的浆细胞。AL 型淀粉样变性一线化疗方案多推荐以硼替佐米为基础的联合治疗,尽管其血液学缓解良好,但由于心脏受累难以缓解,受累严重患者的中位生存时间仅为3~4 个月[6]。
由于本例患者浆细胞比例不高(3%)且心脏受累严重,故不考虑自体外周血干细胞移植。第1 轮化疗时选择酶体抑制剂(硼替佐米)、免疫调节剂(来那度胺)联合地塞米松治疗,化疗后患者N 端前脑钠肽已有明显下降,但患者耐受性较差,出现了肺栓塞及胃肠道不适,故转而选择DARA 联合环磷酰胺进行5 轮化疗。研究发现,来那度胺与地塞米松、化疗药物等联合治疗骨髓瘤时,静脉血栓的发生率明显高于单独使用,机制可能与血浆Ⅷ因子和血管血友病因子水平的增加有关[7]。本例患者的D-二聚体及纤维蛋白原持续增高反映了淀粉样蛋白的降解,而肺栓塞的出现可能与来那度胺的使用相关。
研究表明,骨髓瘤细胞的CD38 高度表达,而DARA 作为抗CD38 抗体,可以通过补体依赖的细胞毒作用、抗体依赖细胞介导的细胞毒作用、抗体依赖细胞吞噬作用等直接使骨髓瘤细胞溶解死亡;且DARA 与免疫抑制细胞表面的CD38 结合可减少免疫抑制细胞数量,从而使T 细胞增加,加强免疫系统对骨髓瘤细胞的清除[8]。AL 型淀粉样变性患者的异常浆细胞同样表达CD38 分子,使DARA 在这一疾病的应用成为可能。
目前国外部分研究表明,DARA 治疗AL 型淀粉样变性有良好的疗效和安全性[9-10]。我国的多中心回顾研究显示,一线应用DARA 的AL 型淀粉样变性患者均达到部分缓解以上疗效[11]。国外一项纳入338例初诊AL 型淀粉样变性患者的多国随机对照试验中[12],接受DARA 的患者血液学缓解明显优于硼替佐米+环磷酰胺+地塞米松组(53.3%比18.1%),且在治疗6 个月时心、肾反应明显优于对照组,生存预后更佳,而与DARA 治疗相关的主要3 或4 级不良事件是淋巴细胞减少和肺炎。心脏受累进展是AL 型淀粉样变性患者死亡的主要原因。有研究表明,在难治复发的心脏受累AL 型淀粉样变性患者中,DARA 有良好疗效和安全性,这和DARA 可快速诱导血液学缓解从而阻止心脏等器官进一步受累有关[6]。但心脏受累最严重的Ⅲb 期患者1 个月内死亡率仍为40%,并未展现出超越硼替佐米的优势。以上研究表明,运用DARA 治疗初诊及复发的AL 型淀粉样变性具有一定优势,但对于其可能的副作用,另外联合哪种抗浆细胞药物(如硼替佐米、来那度胺等)及针对心脏严重受累患者的治疗策略等问题仍需进一步研究。AL 型淀粉样变性治疗体现了肿瘤及肾脏等学科的交叉,若要更精准的治疗,除目前熟悉的抗浆细胞药物,未来针对轻链和淀粉样纤维丝的靶向治疗也至关重要。

