超声造影参数联合血清TS对微小甲状腺结节性质的鉴别效能分析
程海燕董 刚
郑州大学第一附属医院 (河南 郑州 450052)
甲状腺疾病在我国广泛存在,而大部分病变最初都呈现为结节性病变。研究表明,微小甲状腺结节的出现可能会对甲状腺疾病的诊断和治疗策略产生重要影响。针对甲状腺结节,医学界长期以来一直将其作为临床研究的热点。同时关注的焦点包括运用生化标志物,例如促甲状腺激素(thyroid stimulating hormone,TSH),以及利用超声影像学技术等手段来进行准确的诊断和评估。TSH,这一由腺垂体分泌的激素,在调控甲状腺细胞的发育和合成过程中扮演着关键角色。其在甲状腺微小功能障碍的诊断中表现出极高的敏感性,因而在甲状腺病变的早期检测中具有重要地位。近年来,超声造影定量分析在甲状腺结节的诊断中得到了广泛应用。该技术通过对结节周围信号强度分布的评估,能够辅助判断结节的性质。这其中,与结节丰富的血供有关的特征与恶性病变之间可能存在一定的关联。并且超声造影在甲状腺结节的良恶性鉴别方面展现出一定的诊断能力。因此,本研究的主要目标在于通过结合超声造影参数和血清TSH水平,探究它们在鉴别微小甲状腺结节性质方面的效果。研究对象将聚焦于患有微小甲状腺结节的病例,以期为临床提供更准确的诊断和干预手段。
1 资料与方法
1.1 一般资料将2019年1月至2019年10月在我院进行住院治疗的94例微小甲状腺结节病例作为研究对象。
纳入标准:甲状腺B超检查明确为实性甲状腺结节且未明确结节性质的患者;甲状腺结节直径<1cm,符合微小甲状腺结节的特点;微小甲状腺结节全部经过病理检查;研究前对所有患者进行研究目的告知,并且知情同意,所有病例均行声触诊组织成像联合血清TSH进行甲状腺结节性质诊断。排除标准:其他系统恶性肿瘤性疾病的患者;精神疾病的患者;年龄较大不能配合的患者;结节有囊性成分,既往甲状腺手术治疗的患者。纳入研究的94例患者中男性49例,女性45例;平均年龄(42.16±4.28)岁,甲状腺结节平均直径(cm):(0.64±0.18)cm[1]。
1.2 研究方法全部被纳入的患者均在入院后进行甲状腺超声检查,同时入院后第二天采晨血5mL,检测血清TSH。血清TSH检测采用了化学发光法,其正常值范围为0.35~5.5 μ IU/mL。超声甲状腺结节造影采用9-15MHz高分辨率线阵探头,患者取仰卧位,充分暴露颈前区,超声医师首先对病变部位进行二维检查,对病变的部位进行精准定位,同时将机器设定为造影模式,找到感兴趣结节后,将切面打至结节最大切面,保持位置固定不动,同时将SonoVue造影剂稀释后2mL注射入肘部正中静脉,造影时要对图像进行动态保存,观察造影剂进入结节及出结节的血流变化全过程,由两名超声医师对图像进行分析。并且根据图像使用专用软件生成时间-强度曲线。并生成上升时间(rise time,RT),峰值强度(peak intensity,PI),平均渡越时间(mean transit time,MTT),曲线下面积(area under the curve,AUC),峰值降半时间(time to peak half,TPH),上升斜率(waveform initial slope,WIS),达峰时间(time to peak,TTP)。
1.3 统计学方法本文采用SPSS 20.0进行数据统计,计量资料采用(±s)进行统计,计数资料采用%进行表示,以秩和检验分析差异,P<0.05差异有统计学意义。绘制ROC曲线,计算曲线下面积。
2 结 果
2.1 手术病理微小甲状腺结节质性诊断结果及血清TSH表达情况术后病理诊断显示 全部94例患者中,共有164个微小甲状腺结节中,其中良性结节有63例共108个结节,恶性结节中有31例共58个。良性微小甲状腺结节中包括甲状腺病56个,甲状腺纤维腺瘤40个,甲状腺病伴甲状腺纤维腺瘤12个。恶性微小甲状腺结节中包括甲状腺乳头状癌26个,滤泡状腺癌14个,髓样癌10个,未分化癌8个。另外血清TSH表达情况显示,63例检出良性微小甲状腺结节病例的血清TSH表达为5.63±0.74 μ IU/mL,31例检出恶性微小甲状腺结节结节病例的血清TSH表达为5.80±0.76 μIU/mL,良性微小甲状腺结节病例和恶性微小甲状腺结节结节病例的血清TSH表达比较无差异性(T=0.817,P=0.134>0.05)。
2.2 良恶性甲状腺结节超声影像学表现良、恶性微小甲状腺结节病例的超声参数对比显示:良、恶性微小甲状腺结节病例在RT、MTT、TPH、WIS、TTP上比较差异无差异性(P>0.05);良、恶性微小甲状腺结节病例在PI、AUC上比较,差异具差异性(P<0.05),恶性微小甲状腺结节病例的PI、AUC高于恶性微小甲状腺结节病例。典型病例见图1、图2。
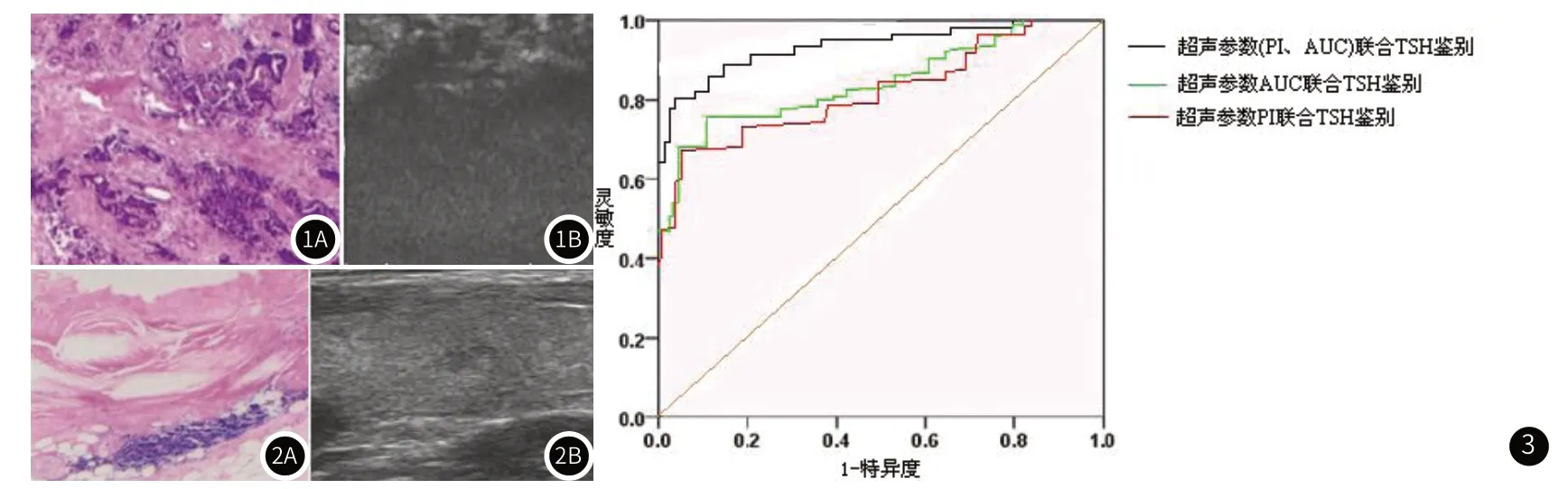
图1 周某,男性,40周岁,综合诊断为微小甲状腺实质性恶性结节。图1A:术后病理示为甲状腺乳头状癌;图1B:超声造影图,PI值为10.14(dB),AUC为81.78(dB/s)。图2 荣某,女性,36周岁,综合病理诊断为微小甲状腺实质性良结节。图2A:术后病理示为甲状腺病;图2B:超声造影图,PI值为3.43(dB),AUC为48.63(dB/s)。图3 超声造影参数(PI、AUC)联合血清TSH的结节良恶性诊断的ROC曲线图。
2.3 超声造影参数(PI、AUC)联合血清TSH的结节良恶性诊断符合率分析以病理鉴别结节性质为“金标准”,超声参数PI联合TSH鉴别诊断结果显示,恶性结节118例(误诊10例),良性结节48例(误诊10例),诊断符合率分别为87.80%。以病理鉴别结节性质为“金标准”,超声参数AUC联合TSH鉴别诊断结果显示,恶性结节116例(误诊8例),良性结节50例(误诊8例),诊断符合率分别为90.25%。以病理鉴别结节性质为“金标准”,超声参数(PI、AUC)联合TSH鉴别诊断结果显示,恶性结节109例(误诊1例),良性结节57例(误诊1例),诊断符合率分别为98.79%。超声参数(PI、AUC)联合TSH鉴别诊断符合率(98.79%)高于超声参数PI联合TSH鉴别诊断(87.80%)、超声参数AUC联合TSH鉴别诊断(90.25%)(χ2=13.129,P=0.001<0.05)[2-3]。见表3。

表1 良、恶性微小甲状腺结节病例的血清TSH表达比较表
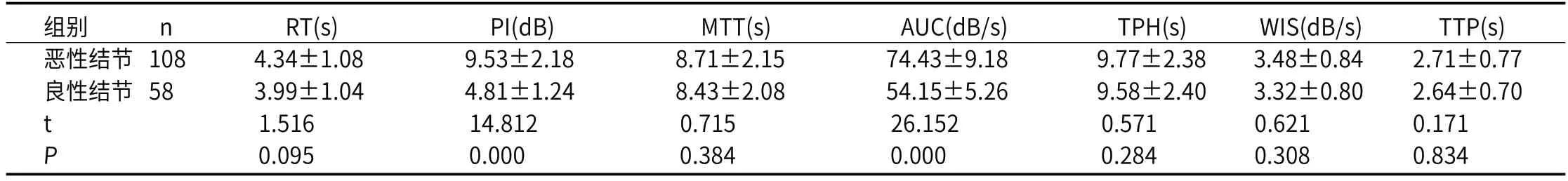
表2 良、恶性微小甲状腺结节病例的超声参数比较表
表3 超声造影参数联合血清TS的结节良恶性诊断符合率比较表
诊断方法 良性病灶检出数 恶性病灶检出数 符合率(%)病理鉴别结节性质 108 58 /超声参数PI联合TSH鉴别 118 48 87.80超声参数AUC联合TSH鉴别 116 50 90.25超声参数(PI、AUC)联合TSH鉴别 109 57 98.79
2.4 超声造影参数(PI、AUC)联合血清TSH的结节良恶性诊断价值分析ROC曲线显示(图3):以超声参数PI联合TSH鉴别的ROC曲线最优临界点(检测敏感性)为72.48%,检测特异性为76.81%,其线下面积0.6943(准确率为69.43%),95%置信区间为0.484~0.819。以超声参数AUC联合TSH鉴别的ROC曲线最优临界点(检测敏感性)为75.63%,检测特异性为78.09%,其线下面积0.7318(准确率为73.18%),95%置信区间为0.386~0.891。以超声参数(PI、AUC)联合TSH鉴别的ROC曲线最优临界点(检测敏感性)为84.98%,检测特异性为86.11%,其线下面积0.8293(准确率为82.93%),95%置信区间为0.432~0.917。超声参数(PI、AUC)联合TSH诊断的准确率、敏感性、特异性(82.93%、84.98%、86.11%)高于超声参数PI联合TSH鉴别诊断(69.43%、72.48%、76.81%)、超声参数AUC联合TSH鉴别诊断(73.18%、85.63%、78.09%)(P<0.05)[4]。
3 讨 论
目前,甲状腺疾病已经演变成一个全球性的公共卫生问题。特别是由不同类型的甲状腺结节引发的甲状腺癌,如乳头状癌、滤泡状腺癌以及髓样癌等,已经成为临床领域备受瞩目的重要议题。微小甲状腺结节的恶性病变通常表现为周围组织浸润不明显,并且缺乏典型的恶性特征。由于这些特点,常规的临床诊断方法在区分和鉴别诊断上显得较为棘手,尤其是在良性和恶性性质的鉴别方面更具有挑战性。作为腺垂体分泌的重要激素,促甲状腺激素(TSH)在促进甲状腺素分泌以及调控甲状腺细胞的发育和合成过程中扮演着关键角色。在临床甲状腺功能鉴别方面,TSH是一个敏感的生化指标,尤其对于微小甲状腺结节引发的功能障碍鉴别诊断,其敏感性表现得尤为突出[5-7]。然而,本研究中微小甲状腺结节病例的血清TSH表达情况显示,良性、恶性微小甲状腺结节病例的血清TSH表达分别为5.63±0.74 μ IU/mL和5.80±0.76 μ IU/mL,相较于正常参考值0.35~5.5 μ IU/mL均属于阳性表达,但是良性、恶性微小甲状腺结节病例的血清TSH表达比较无显著性。这提示,虽然血清TSH表达对微小甲状腺结节病变进行鉴别诊断具有一定的敏感性,但在微小甲状腺结节病变的性质鉴别中却敏感性较低。当前,在甲状腺结节的诊断中穿刺技术已经必不可少,对感兴趣的结节进行有效地穿刺能对二维不能轻易分辨的结节进行有效地鉴别,也是现代超声新技术的一种。然而,尽管其在诊断上表现出一定的准确性,穿刺技术的有创性特点限制了其在临床实践中的广泛应用。除此之外,微小型甲状腺结节的最重要特点是结节的体积偏小,同时,由于体积小故穿刺针往往穿刺不准确,导致穿刺出的组织较少,影响结节性质的判断[10]。微小型甲状腺结节的性质鉴别诊断面临着愈发复杂和富有挑战性的局面。这个问题的出现进一步加剧了医学领域对于这类病变的诊断难度。微小型甲状腺结节因其尺寸小、特征隐匿,使得临床医生在鉴别良恶性方面面临更多困难。这不仅需要高度专业的知识和经验,还需要先进的技术手段和方法。寻找一种简便而又实用的诊断方法,以辅助医生做出更准确的判断,已成为当前临床研究的焦点之一。只有通过不断的努力和创新,才能突破当前的限制,为患者提供更精准的诊断和治疗。
目前在临床实践中,常规超声技术已经将甲状腺结节的诊断准确率提升到了令人满意的水平[4,8],并且其操作简便。然而,在判断甲状腺结节是否为恶性病变方面,常规超声技术存在一定的局限性[8-9]。这主要是由于以下原因:恶性病变的甲状腺结节通常会呈现出中央区淋巴结转移的特征[9-11],并且由于甲状腺本身解剖位置的特殊性,位于颈深部,周围血管、淋巴等组织干扰严重,同时锁骨干扰也较为常见。超声造影定量分析开辟新路径,利用超声造影进行甲状腺结节的定量分析,为鉴别结节良恶性提供了全新的诊断途径。这种方法为甲状腺结节恶性判定提供了崭新的可能性。本研究对我院行手术治疗的微小甲状腺结节进行了超声造影定量分析结果显示,研究发现,恶性甲状腺结节的超声参数峰值强度(PI)和曲线下面积(AUC)显著高于良性结节。峰值强度反映了造影剂在组织内达到的最大强度,而AUC与组织内血管分布和血流速度呈正相关,这些参数在一定程度上揭示了血管数量和血液流动的程度。而通过对甲状腺结节行病理检查发现,病理检查揭示,恶性甲状腺结节的微血管分布相对密集,易发生坏死,微血管也容易受到破坏和阻塞,导致血液流通受限。这使得恶性甲状腺结节的血液供应更为充足,造影剂的流动更加顺畅,与高超声参数值相符[12-14]。相关研究[14-16]表明,其他研究显示,恶性甲状腺结节发生恶性病变时,新生血管的数量较多。这些新生血管的管壁较薄,内皮和基质膜不完整,细胞间隙较大,使癌细胞更易侵入微血管,从而引发恶性病变。因此,超声参数PI和AUC被认为可以作为判断甲状腺是否发生恶性病变的敏感性诊断指标。故本研究观察超声造影参数(PI、AUC)联合血清TSH对微小甲状腺结节的性质进行鉴别诊断,结果显示,超声参数(PI、AUC)联合TSH诊断的准确率、敏感性、特异性(82.93%、84.98%、86.11%)高于超声参数PI联合TSH鉴别诊断(69.43%、72.48%、76.81%)、超声参数AUC联合TSH鉴别诊断(73.18%、85.63%、78.09%)(P<0.05)。研究结果提示,血清TSH有助于微小甲状腺结节鉴别,但超声造影参数(硬度评分、剪切波速度)联合血清TSH在微小甲状腺结节性质鉴别诊断中更具应用价值。在本研究中,尽管超声造影参数(如PI和AUC)与血清TSH的联合运用在微小甲状腺结节性质鉴别诊断中取得了较好的效果,但仍出现了一些情况:1例良性微小甲状腺结节被错误地诊断为恶性,以及1例恶性微小甲状腺结节被错误地诊断为良性,即出现了假阳性和假阴性的情况。这可能有以下原因[16-21]:微小甲状腺结节致密程度影响: 某些情况下,微小甲状腺结节的致密程度较高,可能会影响超声造影质量,进而导致超声测量不准确。这种情况可能会导致一些结果误判,从而引发假阳性或假阴性的判定;结节位置的影响: 微小甲状腺结节的位置也可能影响诊断准确性,特别是当结节位于较深的区域,尤其是锁骨深处时。这种情况可能会导致超声造影声像图质量不佳,从而影响了判定的精准性。
综上所述,微小型甲状腺结节病变性质的鉴别诊断是临床研究的热点问题,单纯超声造影参数和单纯血清TSH在微小甲状腺结节性质鉴别诊断中均具有较高的假阳性率和假阴性率。血清TSH有助于微小甲状腺结节鉴别,但超声造影参数(PI、AUC)联合血清TSH在微小甲状腺结节性质鉴别诊断中更具应用价值。

