多三元环季铵自燃离子液体的合成及性能
蒋 章,姚 远,刘 雪,刘 龙,焦念明,张延强,
(1.中国科学院过程工程研究所, 中国科学院粉体材料技术重点实验室, 离子液体清洁过程北京市重点实验室, 北京 100190;2.沈阳化工大学 化学工程学院, 辽宁 沈阳 110020; 3.郑州中科新兴产业技术研究院, 河南 郑州 450000)
0 引 言
在空天飞行器中,推进剂燃烧释放热量和气体,气体经压缩通过喷嘴喷出,从而产生推力。随着对深空的不断探索,高能推进剂作为主要动力源,得到了更多的关注。肼及其衍生物作为性能优异的双组元推进剂被广泛应用[1-4],但肼基燃料的高毒性和高挥发性,使其制备、运输和使用风险较高[5-6]。研发替代性绿色高能燃料对于太空探索的持续发展具有深远意义。
近年来,随着研究的不断深入,自燃离子液体(Hypergolic Ionic Liquids, HILs)有望成为肼类燃料的有效替代品。HILs 蒸汽压低、热稳定性好、毒性低[2,7-10],很好地弥补了肼类燃料的不足。此外,HILs结构的可设计性强,可以通过化学合成引入不同的含能基团[11-12]。值得注意的是,燃料的能量密度对飞行器的推进性能至关重要。一般而言,提高HILs 能量密度的方法是在结构中引入富氮含能基团[13-18],例如烷基取代的咪唑类、三唑类、吡咯烷类、吡啶类以及硼唑类离子液体(Ionic Liquids, ILs)[19-21]。富氮结构有效提高了HILs 的能量密度,但离子液体推进剂在实际应用中还存在许多问题,如能量密度、比冲等还需要进一步提高。
据报道,引入具有张力的小环结构也是增加化合物能量密度的一种重要方法[22-28]。三元或四元碳环C─C 键角与理想值109.5°有较大偏差,使分子具有较大的角张力和扭转张力而表现出较高的内能,如环丙烷 张 力 能 达121.4 kJ·mol-1[29],在 分 解 时 可 以 释 放 出比直链结构更多的能量[30-31]。同时,小环结构可以增加分子内和分子间的相互作用,分子堆积更紧密,能够有效提高化合物的密度[32-33]。将张力碳环引入离子液体结构中,为设计高能量密度的HILs 提供了可行的研究思路。前期我们设计合成了系列丁啶类高能ILs[34],这些氮杂四元环基ILs 表现出比五元环异构体更高的生成焓(ΔfH),证明小环结构可以增加ILs 的能量。但是,氮杂小环分子张力能有限,热稳定性较差,限制了氮杂张力环自燃离子液体结构的设计范围。通过优化小环结构,进一步提高此类结构的热稳定性和能量,有助于推进张力环高能离子液体的推广应用。
本研究设计了具有多个三元环能量单元的N,N(-二环丙基甲基)环丙胺作为阳离子,选用N(CN)2-和BH3CN-作为阴离子[35],通过离子交换合成了以三元张力碳环为能量单元的系列HILs。通过核磁(NMR)、红外光谱(IR)和高分辨率质谱(HRMS)确认了HILs 的结构,测试或计算了离子液体的热稳定性、粘度、密度、生成焓、比冲、点火延迟时间等性质,详细讨论了三元张力碳环和推进性能之间的内在关系。
1 实验部分
1.1 试剂与仪器
试剂:环丙胺(98%,阿拉丁生化科技股份有限公司),溴甲基环丙烷(97%,毕得医药科技有限公司),碘甲烷(98%,泰坦科技股份有限公司),碘乙烷(99%,泰坦科技股份有限公司),1-碘丙烷(98%,泰坦科技股份有限公司),四氢呋喃(99%,麦克林生化科技股份有限公司),氢氧化钠(99%,麦克林生化科技股份有限公司),丙酮(98%,西陇科学股份有限公司),乙腈(98%,麦克林生化科技股份有限公司),二氯甲烷(99%,麦克林生化科技股份有限公司),无水硫酸钠(99%,麦克林生化科技股份有限公司),硝酸钠(99%,西陇科学股份有限公司),浓硫酸(95%~98%,西陇科学股份有限公司),硝酸银(99%,西陇科学股份有限公司),二氰胺钠(96%,阿拉丁生化科技股份有限公司)。
仪器:瑞士Mettler-Toledo 差示扫描量热仪(DSC1),SETARAM LABSYS 高 温 热 重 分 析 仪(DTG-60H),傅里叶变换红外光谱仪(Nicolet-380),瑞士Bruker 制造600 MHz 液体核磁共振波谱仪(AVANCE III HD 600),液质联用LCMS/ESI/QTOF,DMA 5000-Lovis2000ME 数字式密度粘度仪,卡氏水分测定仪,高速摄像机(OLYMPUSi-SPEED3)。
1.2 合成路线
以环丙胺为原料,先与溴甲基环丙烷反应生成N,N-(二环丙基甲基)环丙胺,后与卤代烃反应制备相应的多环季铵卤盐(1a~5a),最后通过离子交换反应制备基于二氰胺根(DCA)、氰基硼氢根(CBH)的张力环 季 铵 类 离 子 液 体(1b~5b,1c~5c),合 成 路 线 如(图1)所示。通过三步反应,共计合成5 种前体,得到了10 种张力环季铵类自燃离子液体。
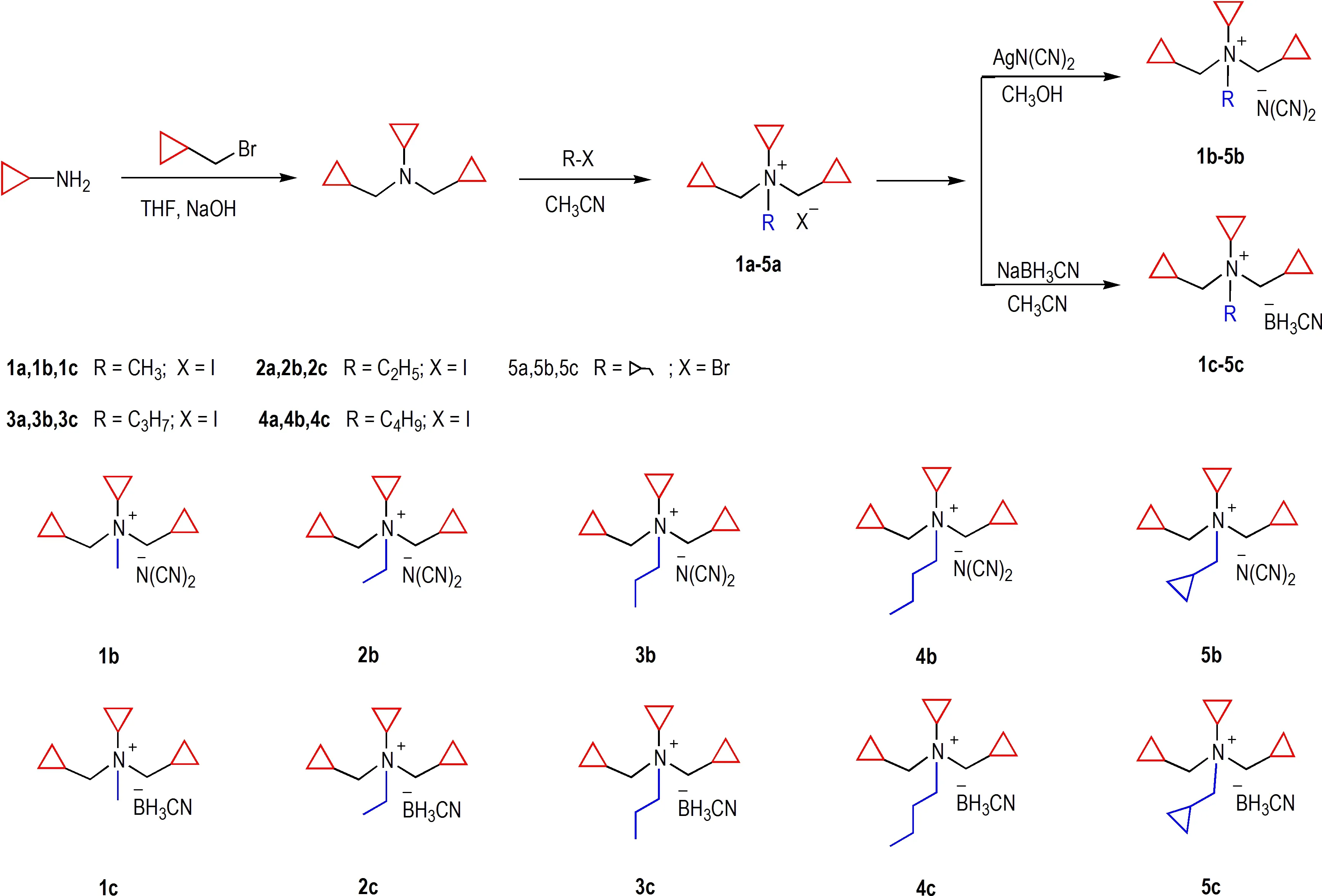
图1 多环季铵类自燃离子液体的合成路线Fig.1 Synthesis routes of the polycyclic quaternary ammonium-based HILs
1.3 N,N-(二环丙基甲基)环丙胺的制备
量取四氢呋喃(THF,100 mL)于250 mL 圆底烧瓶中,称取环丙胺(19.95 g,0.35 mol,1 eq)、溴甲基环丙烷(94.50 g,0.70 mol,2 eq)和NaOH(24.00 g,0.50 mol,2 eq)依次加入上述圆底烧瓶中。反应温度为50 ℃,反应时间为3 d。反应结束后,溶液呈淡黄色,过滤除去不溶物,收集滤液。减压精馏(压力20 kPa),油浴温度180 ℃,温度计温度145 ℃,收集馏分,最终得到无色液体,即为N,N-(二环丙基甲基)环丙胺,产率82%。表征数据:1H NMR(600 MHz,CDCl3, 25 ℃)δ:2.56(d,4H),1.85-1.80(m,1H),0.97-0.90(m,2H),0.50-0.46(m,8H),0.12(q,4H);13C NMR (151 MHz, CDCl3, 25 ℃)δ: 60.3, 36.1, 8.3,7.4, 4.0。
1.4 多三元环季铵卤盐的制备
量取CH3CN(60 mL)于100 mL 圆底烧瓶中,称取N,N-(二环丙基甲基)环丙胺(11.55 g,0.07 mol,1 eq)于上述圆底烧瓶中,加入卤代烃(0.11 mol,1.5 eq),反应温度为80 ℃,反应回流3 d,反应结束时溶液呈紫色。反应结束后,旋蒸除去CH3CN,有大量固体生成。收集粗产物用丙酮(50 mL)洗涤,重复以上操作2~3 次,收集得到灰白色固体,70 ℃真空干燥24 h,得到最终产物。
甲基(二环丙基甲基)环丙基铵碘盐(1a):白色固体,14.5 g,产率81%。1H NMR(600 MHz,D2O,25 ℃)
δ:3.39(m,4H),3.27-3.21(m,1H),2.83(s, 3H),1.29-1.21(m,4H),1.00-0.94(m,2H),0.85-0.79(m,4H),0.51-0.44(m,4H);13C NMR(151 MHz,DMSO-d6,25 ℃)δ:69.5,45.8,42.7,4.7,4.4,2.6。
乙基(二环丙基甲基)环丙基铵碘盐(2a):白色固体,16.1 g,产率70%。1H NMR(600 MHz,D2O,25 ℃)δ:3.49(q,2H),3.27-3.11(m,5H),1.37(t,3H),1.31-1.25(m,2H),1.23-1.14(m,2H),1.01-0.93(m,2H),0.84-0.75(m,4H),0.49-0.41(m,4H);13C NMR(151 MHz,DMSO-d6,25 ℃)δ:64.1, 54.3,45.2,7.9,4.6,4.3,2.1。
丙基(二环丙基甲基)环丙基铵碘盐(3a):白色固体,14.1 g,产 率65%。1H NMR(600 MHz,D2O,25 ℃)δ: 3.39-3.30(m,2H),3.29-3.15(m,5H),1.90-1.75(m,2H),1.36-1.25(m,2H),1.25-1.13(m,2H),1.01-0.94(m,5H),0.85-0.75(m,4H),0.50-0.40(m,4H);13C NMR(151 MHz,DMSO-d6,25 ℃)δ:64.7,59.9,45.4,15.8,10.5,4.6,4.3,2.3。
丙基(二环丙基甲基)环丙基铵碘盐(4a):白色固体,11.3 g,产率59%。1H NMR(600 MHz,DMSO-d6,25 ℃)δ:3.34(s,3H),3.22-3.18(m,4H),1.74-1.64(m,2H),1.37-1.30(m,4H),1.19-1.09(m,2H),0.95(t,3H),0.87-0.76(m,2H),0.72-0.66(m,4H),0.46-0.40(m,4H);13C NMR(151 MHz,DMSO-d6,25 ℃)δ:63.3,58.2,45.1,24.2,19.9,14.1,4.8,4.6,2.5。
(三环丙基甲基)环丙基铵溴盐(5a):白色固体,26.8 g,产率60%。1H NMR(600 MHz,D2O,25 ℃)δ:3.40-3.18(m,7H),1.30(d,2H),1.20(d,3H),1.05-0.92(m,2H),0.80(t,6H),0.48(t,6H);13C NMR(151 MHz,DMSO-d6,25 ℃)δ:63.9,44.5,3.8,3.5,2.8。
1.5 多环二氰胺类自燃离子液体的制备
称 取 季 铵 盐(0.04 mol,1 eq)于 圆 底 烧 瓶 中(250 mL),用量筒量取无水甲醇(150 mL)加入烧瓶中,再称取AgN(CN)2(8.70 g,0.05mol,1.2 eq)。室温下反应24 h,反应完成后,过滤除去不溶物,收集滤液。将收集的滤液旋蒸除去溶剂甲醇。加入CH2Cl2(20 mL),放入冰箱静置冷藏过夜,过滤除去少量的不溶物,收集有机相。将收集的有机相旋蒸除去CH2Cl2,得到淡黄色液体,50 ℃真空干燥24 h,得到最终产物。
甲基(二环丙基甲基)环丙基铵二氰胺盐(1b):淡黄色液体,9.7 g,产率94%,含水量:0.52%。1H NMR(600 MHz,CDCl3,25 ℃)δ:3.44(q,4H),3.26-3.21(m,1H),2.86(s,3H),1.28(q,2H),1.21-1.14(m,2H),1.07-1.02(m,2H),0.90-0.84(m,4H),0.58-0.53(m,4H);13C NMR(151 MHz,CDCl3,25 ℃)δ:119.8,70.2,45.8,42.4,5.2,4.9,4.8,2.8;IR(KBr,ν/cm-1):3086,3008,2227,2192,1475,1306,1031,841;HRMS(ESI,m/z):calcd for C12H22N+:180.1747,found: 180.1732;calcd for C2N3-:66.0098, found:66.0105。
乙基(二环丙基甲基)环丙基铵二氰胺盐(2b):淡黄色液体,7.0 g,产率97%,含水量:0.58%。1H NMR(600 MHz,CDCl3,25 ℃)δ:3.51(q, 2H),3.29-3.19(m,4H),3.18-3.12(m,1H),1.44(t,3H),1.38-1.30(m,2H),1.15-1.07(m,2H),1.06-1.00(m,2H),0.91-0.82(m,4H),0.59-0.50(m,4H);13C NMR(151 MHz,CDCl3,25 ℃)δ:117.4,61.6,51.9,42.7,5.8,2.7,1.9,0.4。 IR(KBr,ν/cm-1):3088,3080,2227, 2127, 1478, 1305, 1033, 836; HRMS (ESI,m/z) :calcd for C13H24N+:194.1903,found:194.1885;calcd for C2N3-:66.0098,found:66.0101。
丙基(二环丙基甲基)环丙基铵二氰胺盐(3b):淡黄色液体,11.1 g,产率96%,含水量:0.73%。1H NMR(600 MHz, CDCl3, 25 ℃)δ: 3.39-3.15(m,7H),1.88-1.77(m,2H),1.41-1.29(m,2H),1.17-1.07(m,2H), 1.03(d,5H), 0.90-0.81(m,4H), 0.58-0.48(m,4H);13C NMR(151 MHz,CDCl3,25 ℃)δ:119.8, 65.9, 63.7, 60.0, 45.5, 16.0, 10.9, 5.0,4.4, 2.9; IR(KBr,ν/cm-1):3130, 3085, 2974,2880,2223,2127,1475, 1304,1032,839;HRMS(ESI,m/z):calcd for C14H26N+:208.2065,found:208.2039;calcd for C2N3-:66.0098,found:66.0102。
丁基(二环丙基甲基)环丙基铵二氰胺盐(4b):淡黄色液体,11.3 g,产率93%,含水量:0.64%。1H NMR(600 MHz, CDCl3, 25 ℃)δ:3.34-3.27(m,2H),3.26-3.16(m,4H),3.16-3.09(m,1H),1.78-1.66(m,2H),1.43-1.36(m,2H),1.35-1.24(m,2H),1.12-1.01(m,2H),1.00-0.95(m,5H),0.87-0.79(m,4H),0.54-0.45(m,4H)。13C NMR(151 MHz,CDCl3, 25 ℃)δ: 119.5, 64.2, 58.4, 45.3, 24.0,19.5, 13.3, 4.8, 4.1, 2.6; IR (KBr,ν/cm-1): 3084,3006,2964,2870,2225,2129, 1471, 1304, 1031,836; HRMS (ESI, m/z): calcd for C15H28N+:222.2216, found: 222.2197; calcd for C2N3-:66.0098, found: 66.0099。
(三环丙基甲基)环丙基铵二氰胺盐(5b):白色蜡状固体,10.9 g,产率90%,含水量:0.66%。1H NMR(600 MHz, CDCl3,25 ℃)δ: 3.42(d,6H),3.27-3.21(m,1H),1.43-1.35 (m,2H),1.17-1.09(m,3H),1.08-1.02(m,2H),0.92-0.83(m,6H),0.62-0.53(m,6H);13C NMR(151 MHz,CDCl3,25 ℃)δ:119.8,64.2,45.6,5.2,4.5,3.3; IR(KBr,ν/cm-1):3137, 3083, 3011, 2225, 2127, 1465, 1430,1306, 1034, 836; HRMS(ESI, m/z): calcd for C15H26N+: 220.2060, found: 220.2031; calcd for C2: 66.0098, found: 66.0095。
1.6 多环氰基硼氢类自燃离子液体的制备
称 取 季 铵 盐(0.05 mol,1 eq)于 圆 底 烧 瓶 中(250 mL),用量筒量取CH3CN(150 mL)加入烧瓶中,再 称 取NaBH3CN(3.78 g,0.06 mol,1.2 eq)。在60 ℃下反应48 h,反应结束后,过滤除去不溶物,收集滤液。将收集的滤液通过旋蒸除去CH3CN。加入CH2Cl2(20 mL),放入冰箱冷藏过夜,过滤除去少量的不溶物,收集有机相。将有机相旋蒸除去CH2Cl2,得到米黄色粘稠状物质,50 ℃真空干燥24 h,得到终产物。
甲基(二环丙基甲基)环丙基铵氰基硼氢盐(1c):无色液体,10.9 g,产率93%,含水量:0.56%。1H NMR(600 MHz,DMSO-d6,25 ℃)δ: 3.33(t,4H),3.22-3.15(m,1H),2.77(s,3H),1.30-1.24(m,2H),1.23-1.15(m, 2H),0.85-0.78(m,2H),0.73-0.65(m,4H),0.46-0.39(m,4H),0.30-0.05(m,3H)。13C NMR(151 MHz,DMSO-d6,25 ℃)δ:142.1,69.1, 45.3, 42.2, 5.0(s),4.8,2.4;IR(KBr,ν/cm-1):3084, 3007, 2337, 2215, 2127, 1621, 1471,1120, 1029, 839; HRMS(ESI, m/z): calcd for C12H22N+: 180.1747, found: 180.1829。
乙基(二环丙基甲基)环丙基铵氰基硼氢盐(2c):白色固体,9.9 g,产率91%,含水量:0.61%。1H NMR(600 MHz, DMSO-d6, 25 ℃)δ: 3.41(q,2H),3.17(d, 4H),3.13(m, 1H),1.32(q, 2H),1.27(t, 3H),1.18-1.09(m, 2H),0.85-0.78(m, 2H),0.73-0.63(m, 4H), 0.51-0.39(m, 4H), 0.34-0.06(m, 3H)。13C NMR(151 MHz, DMSO-d6, 25 ℃)δ: 142.1,62.8,54.0,44.6,8.2,4.8,4.6,2.3; IR(KBr,ν/cm-1):3087,3007,2322,2284,2166, 1633,1469,1123,1027,737; HRMS(ESI,m/z):calcd for C13H24N+:194.1903, found: 194.1968。
丙基(二环丙基甲基)环丙基铵氰基硼氢盐(3c):米黄色蜡状固体,12.4 g,产率95%,含水量:0.59%。
1H NMR(600 MHz, DMSO-d6, 25 ℃)δ: 3.28-3.23(m, 2H),3.22-3.12(m, 5H),1.77-1.67(m, 2H),1.38-1.30(m,2H),1.20-1.11(m,2H),0.92(t,3H),0.85-0.78(m, 2H),0.74-0.66(m, 4H),0.51-0.38(m,4H),0.32-0.04(m,3H)。13C NMR(151 MHz,DMSO-d6,25 ℃)δ: 142.1, 63.5, 59.5, 45.0, 15.8,11.1, 4.8, 4.7,2.4; IR (KBr,ν/cm-1): 3075, 3014,2972,2877,2321,2173,1471,1121,1021,837;HRMS(ESI,m/z): calcd for C14H26N+: 208.2065,found: 208.2112。
丁基(二环丙基甲基)环丙基铵氰基硼氢盐(4c):白色固体,7.2 g,产率93%,含水量:0.55%。1H NMR(600 MHz,DMSO-d6, 25 ℃)δ: 3.34-3.12(m,8H),1.73-1.59(m, 2H), 1.39-1.26(m, 4H),1.19-1.10(m, 2H),0.93(q, 3H),0.85-0.77(m,2H),0.73-0.62(m, 4H),0.54-0.36(m, 2H),0.46-0.38(m, 4H),0.32-0.06(m, 3H).13C NMR(151 MHz,DMSO-d6,25 ℃)δ:142.2,63.4,58.2,45.1, 23.9, 19.9, 14.0, 4.8, 4.7, 2.4; IR(KBr,ν/cm-1): 3086, 3011, 2966, 2877, 2321, 2223,2170, 1477, 1429, 1124, 1027, 837; HRMS(ESI,m/z): calcd for C15H28N+: 222.2216, found:222.2287。
(三环丙基甲基)环丙基铵氰基硼氢盐(5c):白色固体,11.0 g,产率90%,含水量:0.71%。1H NMR(600 MHz,DMSO-d6, 25 ℃)δ: 3.36(d, 6H),3.30-3.25(m, 1H),1.41-1.36(m, 2H),1.17-1.10(m, 3H), 1.09-1.03(m, 2H), 0.87(q, 6H), 0.60(q, 6H),0.58-0.12(m, 3H)。13C NMR(151 MHz,DMSO-d6, 25 ℃)δ: 142.4,138.7, 64.2, 45.7, 5.2,4.6, 3.4; IR (KBr,ν/cm-1): 3090, 3011, 2324,2280, 2214, 2170, 1465, 1121, 1027, 828;HRMS(ESI, m/z): calcd for C15H26N+: 220.2060,found: 220.2119。
1.7 性质测试
熔点测试:采用差示扫描量热仪(DSC1)进行测试,试样量2~5 mg,温度范围是25~220 ℃,气体氛围为N2,流速50 mL·min-1。
分解温度测试:采用高温热重分析仪进行测试,温度范围25~900 ℃,升温速率10 ℃·min-1,N2氛围流速50 mL·min-1。
红外光谱测试:采用傅里叶变换红外光谱仪进行测试,测试过程以KBr 压片作为背景。
核磁测试:采用600 MHz 液体核磁共振波谱仪进行测试,使用D2O、CDCl3、DMSO-d6作溶剂,Me4Si 为标准。
高分辨质谱测试:采用液质联用LCMS/ESI/QTOF对产物的分子量进行测试,选用乙腈作为溶剂将待测样品稀释至1 mg·L-1。
密度和粘度测试:采用数字式密度粘度仪进行测试,固体化合物的密度测定采用Accupyc 1340 固体密度仪,气氛为N2,测试压力保持为135 KPa。
水含量测试:采用卡氏水分测定仪进行测试,液体采用库伦滴定法测定,固体采用卡氏加热炉将水份汽化后测定。
点火延迟时间测试:采用高速摄像机对点火过程拍摄,测试过程如下:用规格为1 mL 的滴管将1 滴待测样品滴入一个装有2 mL 白烟硝酸(WFNA)的小瓶内,样品接触WFNA 后瞬间燃烧;整个测试过程由一台速度为1000 帧/秒的高速摄像机记录。
生成焓计算:利用密度泛函理论(DFT)的第一性原理对HILs 生成焓计算评估。除非特别说明,结构优化均是通过B3LYP 泛函/def-TZVP 基组,使用Gaussian 09(Revision D.01)软件[36-37]进行计算。采用ORCA 软 件(Revision 5.0.2)[38-39],通 过PVPB95 泛 函/def2-QZVPP 基组[40-41]和RIJCOSX[42]加速方法来计算单点能量。所有的模拟都使用DFT-D3 方法进行了色散校正,以补偿弱相互作用的计算误差[43-44]。焓值(H)由Multiwfn 软件[45]计算,而生成焓(ΔfH)则通过Born-Haber 能量循环计算。具体来说,离子液体通过等键反应被分解成小分子[46],其中小分子能量通过原子化能量法[47]计算。单个气相原子的能量通过Gaussian 09 软件,结合热力学组合算法G4MP2 计算得到[48]。根据自燃离子液体的分子组成和实验测得的密度,计算得到生成焓。
比冲(Isp)计算:采用NASA CEA 软件计算得到。所有报告的Isp值在燃烧室压力为2068 kPa,喷管出口视为真空,喷管膨胀比为50 的条件下计算得到。
2 结果与讨论
2.1 红外光谱
为了确认自燃离子液体的分子结构,利用傅里叶变换红外光谱(FT-IR)对所合成自燃离子液体的特征振动峰进行了实验测试和计算模拟。其中,振动分析通过DFT 理论在B3LYP/6-311G(d,p)级别下计算得到。以离子液体5b 为例,其结果如表1 所示。三元环上C—H 键类似于不饱和烃上的C—H 键,其伸缩振动峰大于3000 cm-1。三元环中C—H 键伸缩振动吸收峰范围在3011~3138 cm-1,而1467~2226 cm-1处是DCA 中C—N 键的伸缩振动峰,它们与计算数据相匹配。在500~1000 cm-1的C—H 键弯曲振动峰也能与计算值相匹配。计算以气相分子为模型,而实际的ILs为液态,且ILs 间的静电作用较强,使得计算存在一定误差,但峰形和强度与实验值基本保持一致,证明成功合成目标离子液体。
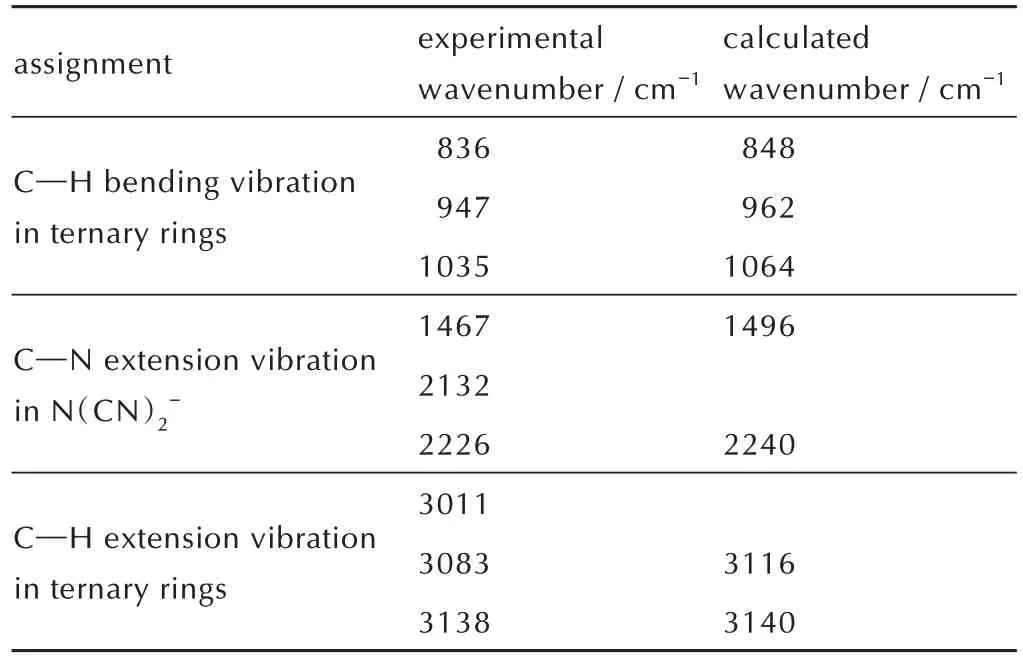
表1 离子液体5b 红外的实测与计算结果Table 1 The experimental and calculated FT-IR results of ionic liquid 5b
2.2 熔点和热分解温度
性能优良的液体推进剂需具备较低的熔点和较高的热分解温度,宽泛的液程使推进剂可适应于恶劣或者特殊的环境要求。熔点(Tm)和分解温度(Td)结果见表2。结果表明:1b~4b 以及1c 的熔点均低于常用的偏二甲肼(UDMH)燃料(-57 ℃)[17],1b 的熔点更是达到了-82 ℃。由表2 可知,10 种ILs 的分解温度为224~262 ℃,分解温度较高,表明其具有很好的热稳定性。两类ILs 随着烃基侧链的增长,热分解温度呈现递减的趋势,说明烃基侧链的增长对ILs 的热稳定性是不利的。相较于CBH 类ILs,DCA 类的ILs 液程更宽,热稳定性更好。
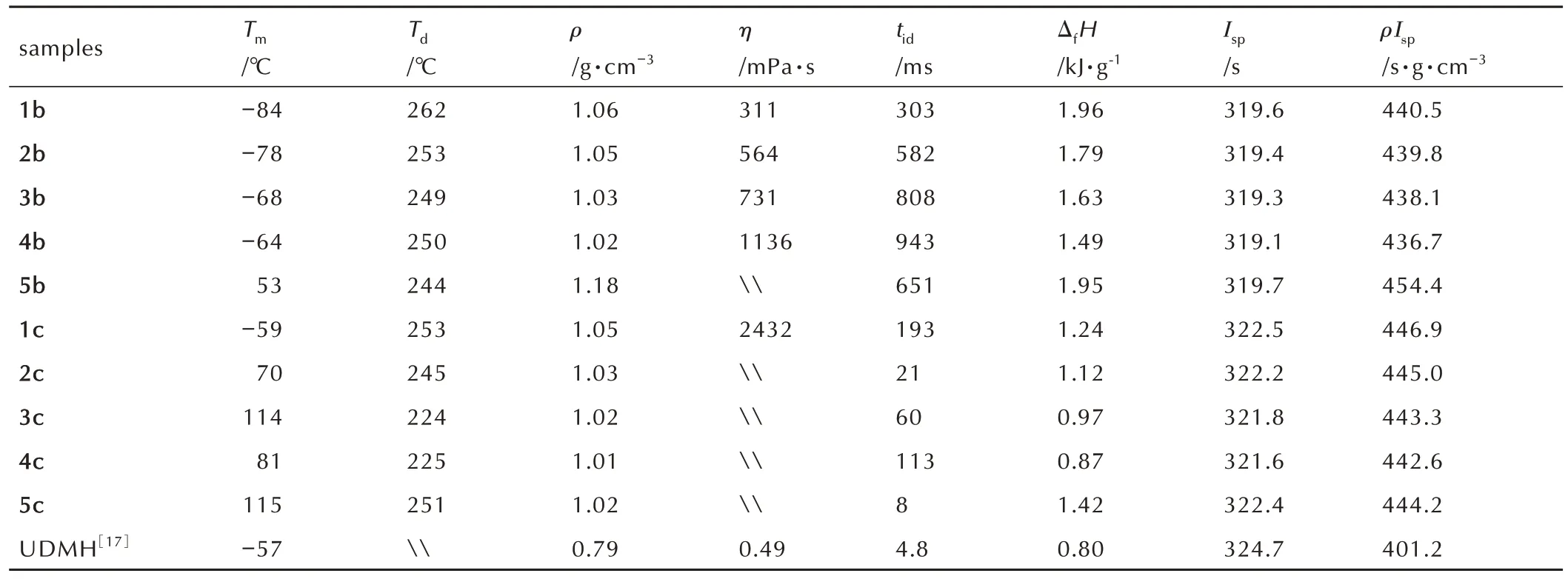
表2 多三元环季铵自燃离子液体的物理性质数据Table 2 Physical property data of polycyclic quaternary ammonium-based hypergolic ILs
2.3 密度和粘度
密度是衡量推进剂性能的重要参数之一,在发动机容积不变的条件下,密度越高,能够携带的燃料越多。如表2 所示,25 ℃条件下,测得10 种ILs 的密度为1.01~1.18 g·cm-3,远 高 于UDMH 的 密 度(0.79 g·cm-3)[17]。在阳离子相同情况下,DCA 类ILs 的密度高于相应CBH 类ILs。在阴离子相同的情况下,随着烷基链的增长,离子液体的密度呈现降低的趋势。在总碳原子数相同的条件下,环的增加可以有效地提高化合物的密度,如5b(1.18 g·cm-3)>4b(1.02 g·cm-3),5c(1.02g·cm-3)>4c(1.01 g·cm-3),说明三元张力环可以提高分子间的有效堆积,继而提高化合物密度。
粘度的大小对推进剂燃料的点火性能具有重要影响。推进剂的粘度越小,与氧化剂接触时,更利于两者间的传质扩散,推进剂的燃烧效果越好。如表2所示,10 种离子液体在30 ℃条件下1b-4b 以及1c 是液体,其余均为固体。离子液体粘度是多种影响因素综合作用的结果,测得的粘度未呈现出明显规律。在阳离子相同的条件下,DCA 类ILs 粘度小于相应CBH 类ILs,表 明DCA 类ILs 具 有 更 好 的 混 合、流动性。
2.4 生成焓和比冲
生成焓是评价ILs 能量高低的重要指标。计算结果 表 明(表2),10 种ILs 的 生 成 焓 范 围 在0.87~1.96 kJ·g-1,远高于UDMH 的生成焓(0.80 kJ·g-1)[17]。两类ILs 的生成焓均随着-R 基碳链的增长而降低,随着三元张力环的增加而增加(图2)。其中DCA 类ILs 的生成焓尤为突出,均大于1.49 kJ·g-1,特别是具有4 个三元环的5b,生成焓更是达到了1.95 kJ·g-1。张力环数量的增加使离子液体的能量大幅增加(5b>4b,5c>4c),说明三元张力环可以有效提高ILs 的能量。
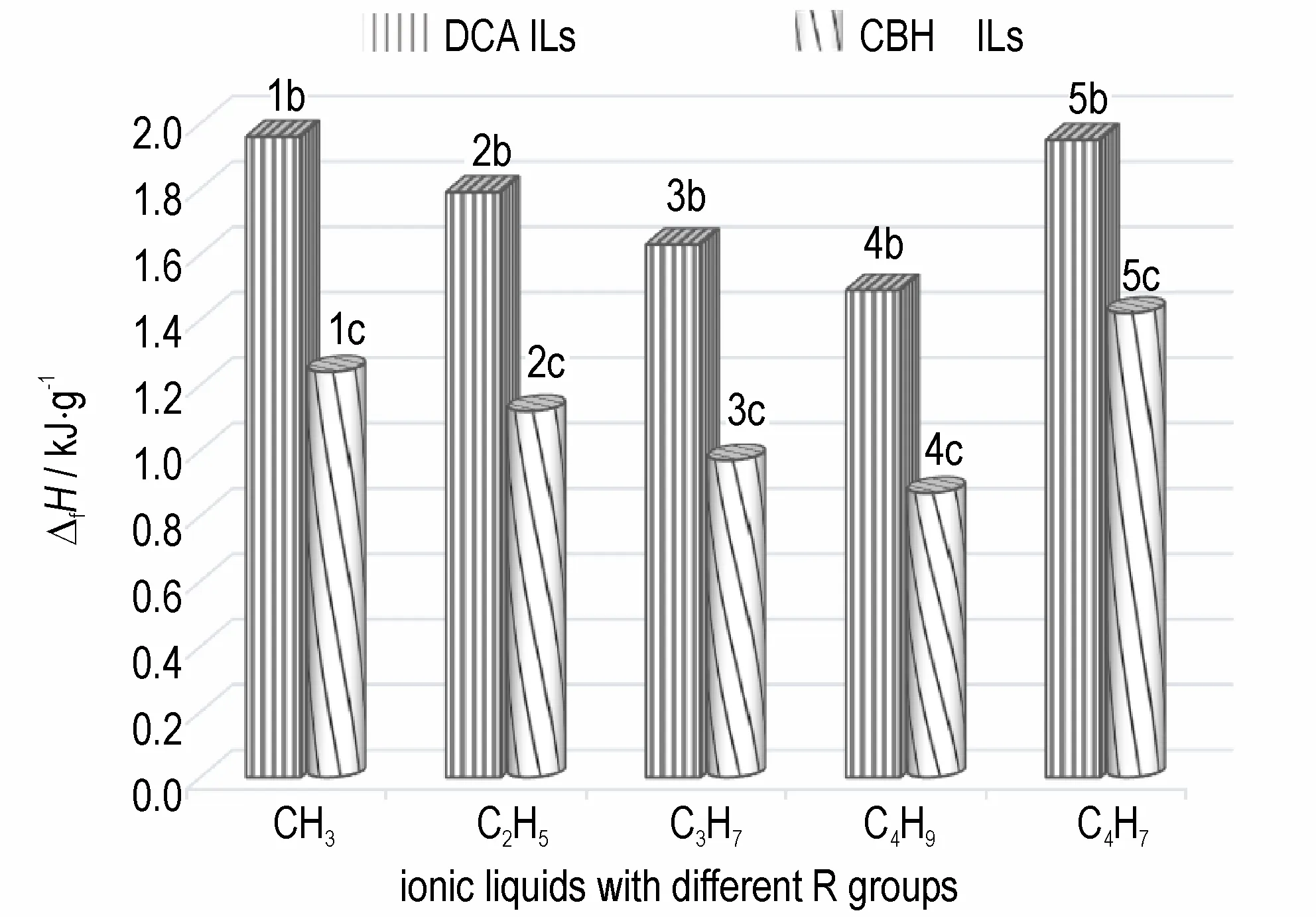
图2 不同R 取代基ILs 的生成焓变化Fig.2 Variation in heats of formation of ILs with different R substituents
比冲是衡量推进剂能量效率高低的重要标准[12],比冲越大,火箭能够获得的总动力越大。使用NASA CEA 软件[49]计算了ILs 与WFNA 不同配比时推进剂系统的比冲量。如图3所示,随着氧化剂与燃料比值(O/F)的增大,体系的比冲先增大后降低,两类ILs 比冲变化趋势一致都在O/F 占比3.0~4.5 时,体系的比冲值较大,为适宜的配比区,当O/F 达到4 左右时,比冲值接近最大值。在此基础上选取了ILs 的峰值比冲,结果如表2 所示,所有ILs 的真空比冲范围在319.1~322.5 s,离子液体1c的真空比冲为322.5 s,接近UDMH 的比冲(324.7 s),而密度比冲范围在436.7~454.4 s·g·cm-3,远 超UDMH(401.2 s·g·cm-3)。此外,CBH 类ILs 的比冲和密度比冲都优于相应的DCA 类ILs。如图4所示,两类ILs 的比冲和密度比冲变化趋势一致,都是随着-R 基碳链的增长而降低,在碳原子数相同时,三元碳环的增加可以大幅提高离子液体的比冲,如5b(454.4 s·g·cm-3)>4b(436.7 s·g·cm-3);5c(444.2 s·g·cm-3)>4c(442.6 s·g·cm-3),进一步说明了三元碳环的增加可以有效提高ILs 的能量。
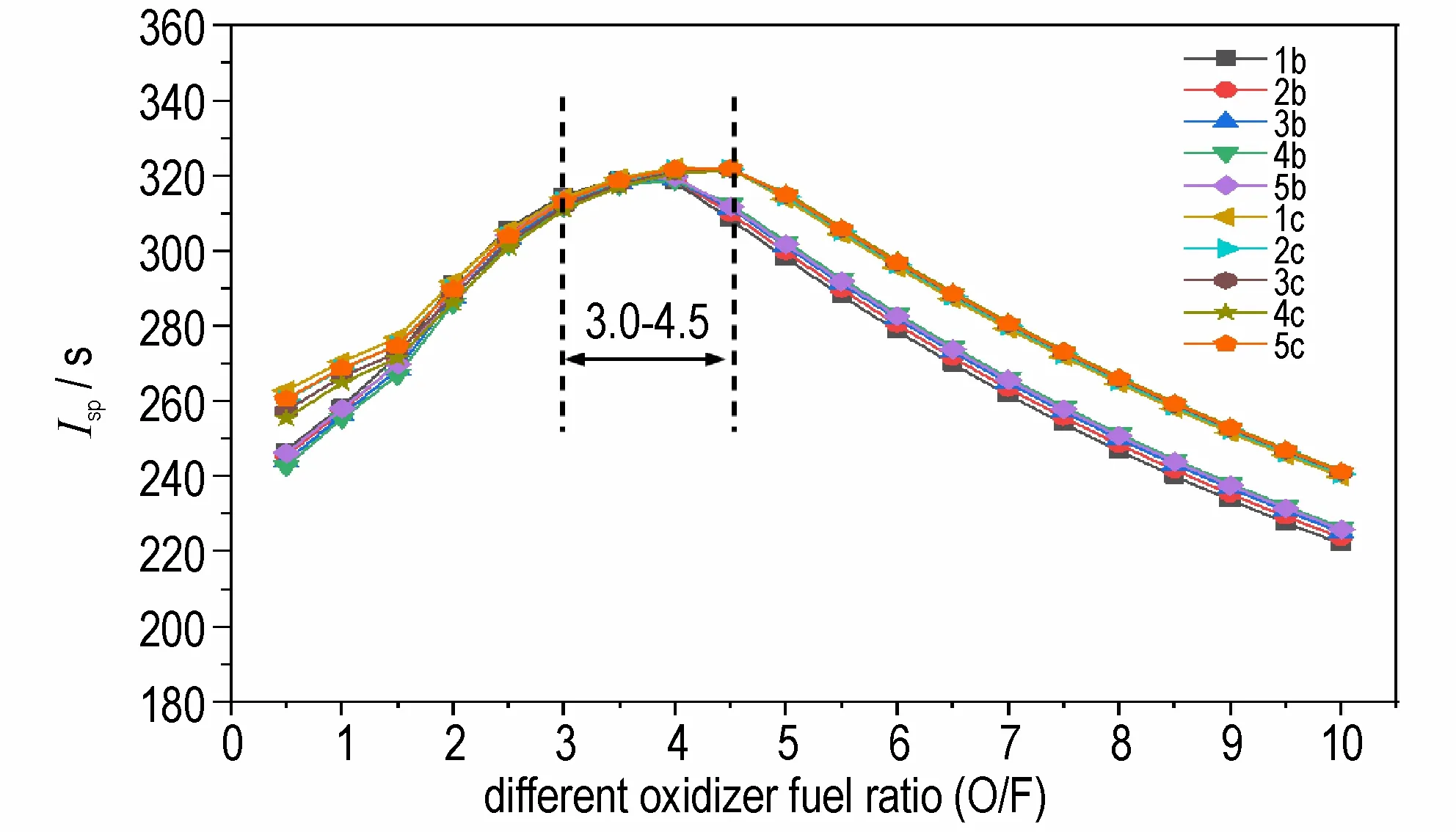
图3 ILs 与WFNA 不同配比时的比冲曲线Fig.3 Specific impulse curves at different ratios of ILs and WFNA
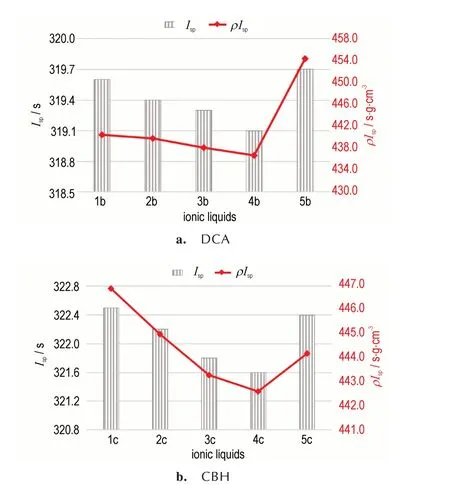
图4 所合成ILs 的比冲和密度比冲Fig.4 Specific impulse and density-specific impulse of obtained ILs
2.5 点火测试
点火延迟时间(tid)是指燃料与氧化剂接触到产生火焰的时间间隔,是自燃推进剂的重要评价参数。研究中ILs 的点火延迟时间通过液滴接触法测定,测试所用氧化剂为白烟硝酸,具体过程如图5 所示。所合成的10 种ILs 均可以与WFNA 发生自燃。如表2 所 示,CBH 类HILs 的tid在8~193 ms 范 围 内,其中5c 的tid最短,为8 ms(图5)。点火测试表明DCA类ILs 随着-R 基碳链的增长点火性能逐渐变差,如1b>2b>3b>4b,但CBH 基ILs 并未表现出这样的规律,这可能是由于聚集态不同造成的(CBH 基ILs 在室温下为固体)。另外,在保持结构相似且碳原子数相同的条件下,增加张力环结构可以有效缩短点火延迟时间,如5b(651 ms)<4b(943 ms)、5c(8 ms)<4c(113 ms)。这是因为多环结构的ILs 在燃烧反应瞬间释放出更多的能量,使其可以更快达到燃点。从点火实验可以发现,三元环结构对HILs 的点火性能具有积极作用。

图5 高速摄像机记录的离子液体5c 的点火延迟时间(1000 帧/秒)Fig.5 Ignition delay time recorded by a high-speed camera (1000 frames per s) of ionic liquid 5c
3 结 论
研究设计合成了10 种含三元张力环基团的HILs,并对其结构进行了全面表征。物化性能测试结果表明:(1)张力环HILs 具有优异的热稳定性,其热分解温度达224 ℃以上;(2)多环结构使得HILs分子间堆积更加紧密,密度可达1.01~1.18 g·cm-3;(3)在张力环基团作用下,多环HILs 的能量明显提高(ΔfH=227.3~558.1 kJ·mol-1,Isp=267.4~270.3 s,ρIsp=363.1~379.0 s·g·cm-3),证明引入张力环基团可显著增强ILs 的能量。三元张力环HILs 的设计合成为进一步提高自燃型液体推进剂能量提供了新的思路。

