AlCl3-EMIC 离子液体中纳米铝粉的制备
王路超,李文川,凌国平
(浙江大学材料科学与工程学院, 浙江 杭州 310030)
0 引 言
纳米铝粉具有易点燃、燃烧耗氧量低和燃烧热高等优异的燃烧性能。将纳米铝粉作为添加剂用于固体燃料时,其燃烧速度相比亚微米铝粉成倍提高,能够显著增加火箭的整体推力性能[1]。同时,纳米铝粉极易与炸药的主要爆燃产物水、二氧化碳反应,放出大量热,将其应用于炸药中,可以降低炸药的反应温度,提高爆轰热[2];此外,因其有极高的表面能和较低的烧结温度,纳米铝粉在制氢[3]、太阳能电池[4]和超级铝热剂[5]等领域也有潜在应用价值。
纳米铝粉制备方法主要分为物理法和液相化学法。物理法为自上而下的方法,包括雾化法、电爆炸法和电子束光刻法等[6],这些方法存在对设备要求高,耗能大,且粒径控制难等缺陷。液相化学法为自下而上的方法,包括氧化还原法和前驱体分解法。这2 种方法具有能耗低、工艺简单、通过改变工艺参数可获得不同粒径、形貌的纳米铝粉等优势,因此成为近年来研究的主要方向[7-8]。氧化还原法以甲苯、均三甲苯和正己烷等为反应介质,利用AlCl3和LiAlH4的反应制备纳米铝粉,其中AlCl3和LiAlH4皆为Al 源[9]。此类方法需要在强挥发的有机溶剂中进行,环境不友好,对人体有危害。前驱体分解法通过在反应介质中分解含铝的有机前驱体制备纳米铝粉[10]。其反应介质与氧化还原法类似,同样存在污染问题;且前驱体在分解过程中不稳定,易发生爆炸,制备过程比较危险。因此,探索一种绿色环保且工艺流程安全的纳米铝粉制备新方法十分必要。
离子液体(Ionic Liquid)是熔点低于100 ℃完全由阴离子和阳离子组成的液态盐[11]。由于阴阳离子体积相差较大,在静电力作用和空间阻碍作用下,晶体的有序结构被破坏,在室温或室温附近呈现液态[12]。离子液体主要具有以下特性[13]:优良的可设计性。可以按照实际需求调节阴阳离子,得到很大温度范围的液体;溶解能力强,对无机盐、有机物甚至高分子有很好的溶解能力;良好的化学稳定性,不易氧化,不燃烧;饱和蒸气压几乎为零,不易挥发;易与其他物质分离,可循环利用。由于上述优点,离子液体在材料、化工、生物和电化学方面展现出巨大的应用前景。
离子液体在纳米金属粉末的制备中,表现出明显优势:金属粉末形核率高、纳米粒径稳定和团聚难等[14]。以离子液体为反应介质,通过液相化学法已成功制备Rh、Pd、Pt、Ir、Ru、Au、Ag 等贵金属,以及Fe、Co、Ni、Cu、Zn 等过渡金属纳米粉末[15],但未见制备活泼金属纳米粉末的报道。利用离子液体为介质,有望实现绿色且安全的纳米Al 粉的制备。
氯化铝-氯化-1-乙基-3-甲基咪唑(AlCl3-EMIC)离子液体与其他离子液体如氯化铝-氯化正丁基吡啶(Al-Cl3-BPC)相比,熔点更低(-75 ℃ vs -50 ℃),电导率更高(1.21 S·m-1vs 0.41 S·m-1),粘度更低(15.6 mPa·s vs 36.5 mPa·s)且还原电位窗口更宽(4.5 V vs 3.5 V)[16],在电沉积Al 镀层方面已有广泛应用[17]。本研究以几乎不挥发的AlCl3-EMIC 离子液体作为反应介质制备纳米铝粉,并对所得纳米铝粉进行X 射线衍射(XRD)、纳米粒度检测、透射电子显微镜(TEM)表征,探究了纳米铝粉的长大过程以及反应机理,为纳米铝粉的可控制备奠定基础。
1 实验部分
1.1 试剂和仪器
试剂:摩尔比为2∶1 的AlCl3-EMIC,合成过程见文献[18];DIBAL(1.5 mol·L-1二 异 丁 基 氢 化 铝 的 甲 苯 溶液),上海易恩化学技术有限公司;无水乙醇(99.8%),国药集团化学试剂有限公司;甲苯(99.5%),国药集团化学试剂有限公司。
仪 器 :X 射 线 衍 射 仪(XRD,Rigaku-D/MAX-2550),日本理学公司;扫描电子显微镜(SEM,SU-70),日本日立公司;透射电子显微镜(TEM,JEM-2100),日 本 电 子 公 司;X 射 线 能 谱 仪(EDS,X-MAX65T),英国牛津公司;纳米粒度分析仪(Zetasizer Nano-ZS),英国Malvern 公司;电 化学工 作站(PAR2273),美国阿美特克公司。
1.2 纳米铝粉制备
将摩尔比为2∶1 的AlCl3-EMIC 离子液体(30 mL)加热至140 ℃,磁力搅拌,磁子(C200 20 mm×6 mm)转速800 r·min-1,向100 mL 烧杯中通过注射器快速注入DIBAL 至一定浓度,反应一段时间后,将烧杯置于乙醇中快速冷却终止反应(45 ℃下离子液体与DIBAL不反应),离心分离得到固相。离心转速9000 r·min-1,离心时间10 min。反应环节在充满高纯氩气的手套箱内进行,箱内水氧含量(w)均小于1×10-6。无水乙醇和甲苯在使用前经分子筛脱水处理3 d 以上。所得产物名称与对应实验参数表1,其中,DIBAL 浓度是指DIBAL 占离子液体的摩尔浓度。产物经无水乙醇和甲苯的等体积混合液清洗3 次以上,离心分离固相,之后真空干燥得到产物。
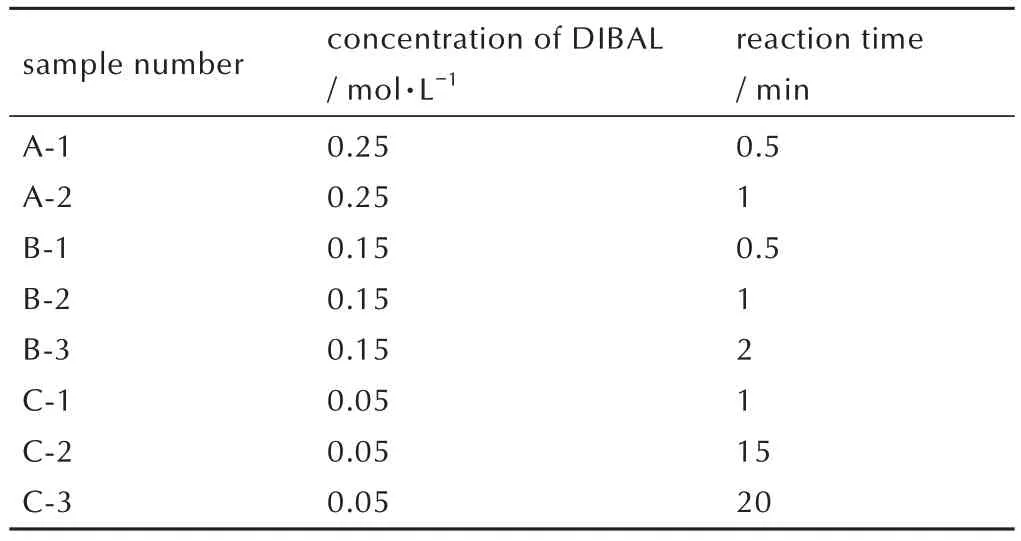
表1 液相化学法所得纳米铝粉产物及对应实验相关条件Table 1 Nano-aluminum powder products obtained by liquid chemical method and the corresponding experimental conditions
1.3 表征和测试
采用XRD 表征A-1 产物的物相结构,使用的辐射源为Cu-Kα,波长1.5406 Å,步宽0.02o,电压40 kV,电流30 mA,入射角度30°~80°。采用TEM 表征A-1 形貌,加速电压200 kV,其余产物采用SEM 表征,加速电压8 kV,A-1 的成分用EDS 表征,加速电压20 kV,基底为超薄碳膜铜网。采用纳米粒度分析仪检测所有产物的粒径,产物于无水乙醇中超声0.5 h 后检测,无水乙醇粘度1.071 mPa·s、折射率1.362,产物折光系数1.480、吸收率0.1。采用电化学工作站测定AlCl3-EMIC离子液体的线性扫描伏安曲线,螺旋Al 丝(99.999%)为对电极,Pt 丝(99.999%)为工作电极,放置于玻璃管中(含2∶1 AlCl3-EMIC 离子液体,底部为多孔陶瓷)的高纯Al 丝(99.999%)为参比电极,扫速10 mV·s-1。
2 结果与讨论
2.1 反应液体的外观
观察了DIBAL 浓度为0.25 mol·L-1时的制备过程,得到了AlCl3-EMIC 离子液体及反应0.5 min、1 min 的液体外观图,如图1 所示。观察发现,AlCl3-EMIC 离子液体加热至140 ℃,液体无色透明(图1a),快速注入DIBAL,产生大量气泡。反应0.5 min后,液体变灰但保持透明(图1b),反应1 min 后液体变为不透明(图1c),并且气泡量明显减少。由此推测,产物A-2 相比A-1,其粒径有剧烈变化。
2.2 纳米铝粉的表征
对所得产物A-1 进行了XRD 检测,结果如图2a 所示。由图2a 可见,产物的XRD 谱图与Al 标准卡片的衍射峰完全 吻合,在2θ为38.47°,44.74°,65.13°和78.23°有明显的特征峰,分别对应Al 的(111)、(200)、(220)和(311)晶面。图2a 没有发现其他杂相,确认制备得到为铝粉。根据Scherrer 公式[19]计算,产物平均晶粒尺寸为60.2 nm。
为得到铝粉整体的粒径分布情况,对产物A-1 进行粒度检测,结果如图2b 所示。由图2b 可见,铝粉粒径分布在40~100 nm,集中在60 nm,分布范围很窄。相比Ghanta 等[20]采用氧化还原法得到的纳米铝粉(TEM 统计粒径分布在50~250 nm,集中在100 nm),以及查明霞等[21]采用前驱体分解法获得的产物(SEM统计粒径分布在80~150 nm,集中在100 nm),本方法获得的粒径更均匀集中。
图2c~2g 为 产 物A-1 的TEM 和EDS 结 果。由 图2c 和图2d 所示的产物稀疏区和密集区形貌可见,产物都为60 nm 左右的颗粒,粒径较为均匀,纳米铝粉之间没有团聚。由图2d 还可以看出产物的形貌为类球形,与喷雾法制备的球形纳米铝粉[22]形貌相似。从图2e 所示的HRTEM 图中,可以看到明显的晶格条纹,间距为0.23 nm,对应Al 的(111)面。颗粒最外层存在3.2 nm 的无定型薄膜,应为纳米铝粉表面的氧化膜,分析认为,这是由于纳米铝粉与空气接触,表面被氧化。与喷雾法制备的纳米铝粉氧化膜(厚约5~6 nm)[22]相比,本方法得到的氧化膜厚度更薄。由图2f 选区电子衍射花样可以观察到较明显的多晶衍射环,经标定,分别对应Al 的(111)、(200)、(220)和(311)等晶面,与XRD 结果一致。由图2g 所示的EDS 结果可知,结果中主要含C、O、Cu、Al 和微量Cl 元素。其中,C、Cu与大多数O 为基底信号;Al 和少数O 为纳米铝粉成分;微量Cl 推测为纳米铝粉吸附液体中离子所致,含量很低,说明清洗较彻底。
综上可见,采用AlCl3-EMIC 离子液体制备的纳米铝粉无团聚、粒径分布窄且氧化膜薄。原因分析如下:纳米金属通常与阴离子具有强的吸附作用[23]。相同电性的离子吸附层之间存在静电排斥作用,可有效抑制纳米金属粉末团聚或长大[24]。AlCl3-EMIC 离子液体中,存在大量的Al2C和AlCl4-阴离子[25]。这些阴离子吸附在Al 表面,形成阴离子吸附层,因此得到的纳米铝粉无团聚且粒径分布均匀。并且,纳米铝粉经多次清洗,表面的阴离子吸附层并未被完全洗去,EDS结果中的微量Cl 也说明了阴离子吸附层的存在。离子吸附层可以阻碍纳米粉末与空气接触,对纳米粉末的氧化起到抑制作用[26],所得纳米铝粉表面的氧化膜更薄。
2.3 纳米铝粉的长大过程
为深入探究纳米铝粉的长大过程,通过降低DIBAL 浓度来减缓纳米铝粉生长速率。结果表明,DIBAL 浓度为0.15 mol·L-1和0.05 mol·L-1时,液体外观变化与0.25 mol·L-1浓度时相似,只是变不透明的时间不同。因此选择液体外观接近图1c 的产物A-2、B-3、C-3,和外观接近图1b 的产物B-2、C-2,以及液体更透明时的产物B-1、C-1 进行表征,粒径分布结果如图3 所示,SEM 照片(除特殊说明外,均为有代表性的区域的形貌)如图4 所示。
图3 A-2,B-1,B-2,B-3,C-1,C-2,C-3 的粒径分布结果Fig.3 Results of particle size distribution of the samples A-2,B-1,B-2, B-3, C-1, C-2 and C-3

图4 A-2,B-1,B-2,B-3,C-1,C-2,C-3 的SEM 照片Fig.4 SEM image of the samples A-2, B-1, B-2, B-3, C-1, C-2 and C-3
由图3 的粒径分布检测结果可见,A-2、B-3、C-3的粒径都主要集中在400 nm,B-1、B-2、C-1、C-2 的粒径分别主要集中在70,90,100,110 nm;其中C-1 和C-2 的粒径分布结果中存在1 个小峰,粒径在400 nm左右。粒径分布结果说明铝粉粒径和液体色泽之间存在如下关系:粒径100 nm 左右及以下,液体保持透明;粒径达到400 nm 左右时,液体呈不透明状态。此外,可以发 现,DIBAL 浓 度为0.25 mol·L-1时,30 s 时间内铝粉粒径由60 nm 快速超过100 nm(A-1 和A-2),表明0.5 min 后铝粉存在异常长大的情况。而DIBAL 浓度为0.15 mol·L-1和0.05 mol·L-1时,则分别在1 min 和15 min 后异常长大,在此之前,粒径均在100 nm 附近及以下。
由图4 的SEM 图片可知,A-2、B-3 和C-3 部分颗粒有晶体外形(如图4 中箭头所示),其余呈近球形。并且,SEM 观察到的主要颗粒尺寸皆与粒径检测结果一致。此 外,图4 中C-1 和C-2 的 插 图 为C-1 和C-2 含 大尺寸颗粒(数量很少)的区域。由图4 可见,C-1 和C-2的大尺寸颗粒为100 nm 颗粒的团聚体,对应图3 中C-1 和C-2 小 峰。
综 合0.25,0.15 mol·L-1和0.05 mol·L-1DIBAL时反应不同时间所对应铝粉的粒径分布和SEM 结果,可以发现铝粉长大规律:开始时铝粉快速形核并长大,粒径维持在100 nm 附近及以下,形貌为近球形;一段时间后铝粉异常长大,粒径快速超100 nm,同时呈现出晶体外形。并且,随DIBAL 浓度降低,异常长大开始的时间逐渐延后。可见长大过程呈现出前后2 个阶段,第一阶段为开始反应至铝粉异常长大之前的“反应前期”,第二阶段为铝粉异常长大阶段的“反应后期”,如图5 所示,我们推测,AlCl3-EMIC 离子液体中加入DIBAL 后,溶液中瞬间均匀形核,产生纳米Al 核。之后,随着反应进行,新产生的Al 进入晶格,Al 核逐渐生长。反应前期符合形核生长机制[27]。该阶段粒径细小,晶面能对表面能影响不大,比表面积影响占主要因素,因此颗粒外形趋于球状[28]。在颗粒继续生长的过程中,存在一个临界半径r0,半径大于r0的颗粒趋于长大,半径小于r0的颗粒趋于溶解[29-30]。并且,r0随反应物浓度下降而增大[31]。也就是说,在铝粉制备的反应后期,反应物的消耗导致r0增大,铝粉生长模式发生了转变:大量小于r0的铝粉溶解,使大颗粒的铝粉快速生长。反应后期由Ostwald 熟化机制控制[32],铝粉发生异常长大。在该阶段,颗粒为降低晶面能,高能量晶面优先生长,进而形成晶体外形。而异常长大开始时间之所以随DIBAL 浓度降低而延后,其原因是:DIBAL浓度降低,Al 核数量减少,反应物消耗速率减慢,所以r0增大需要更长的时间。

图5 纳米铝粉长大过程示意图Fig.5 Diagram of growth process of nano-aluminum powder
2.4 反应机理探究
为了分析AlCl3-EMIC 离子液体制备纳米铝粉的反应机理,研究用线性扫描伏安法(LSV)[33]进行了线性扫描伏安曲线的测定。LSV 是控制电极电势以恒定速率变化,同时测量通过电极电流的方法,测量结果以i-E曲线表示,该曲线即为线性扫描伏安曲线。LSV 可用于研究电化学反应、判断电极过程的可逆性、分析电活性物质的相关变化等。AlCl3-EMIC 离子液体中的Al2C为 电 活 性 离 子[34],通 过LSV 可 以 获 知 其 浓 度变化。
图6 为测定得到的线性扫描伏安曲线,其中曲线i、ii、iii 分 别 对 应AlCl3-EMIC 离 子 液 体,已 加 入DIBAL但未反应的离子液体,以及反应后的离子液体。由图6 可以看出,对于AlCl3-EMIC 离子液体(曲线i),在电势逐渐负移过程中,-0.1 V 左右电流密度迅速升高。这是由于在低于-0.1 V 电位时,Al2Cl7-在阴极上得到电子被还原为Al,反应式为[35]:
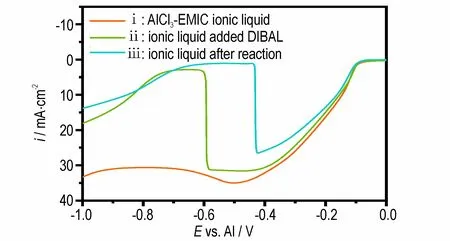
图6 AlCl3-EMIC 离子液体与其制备反应前后的线性扫描伏安曲线Fig.6 Linear sweep voltammetry curves of AlCl3-EMIC ionic liquid before and after preparation
在测试条件一致的前提下,电流密度主要取决于Al2Cl7-浓度[36-37]。由图6 可以看到,离子液体中加入DIBAL 后,电流密度(曲线ii)略低于未加入DIBAL 的离子液体(曲线i),说明Al2Cl7-浓度略微下降。这是由于加入DIBAL 后,离子液体体积增加20% 左右,而Al2Cl7-总量未变,所以Al2Cl7-浓度下降。在-0.6 V 左右电流密度突降,推测是DIBAL 在电极表面的吸附所致。比较反应前后的曲线ii 和曲线iii 可知,电位在-0.1~-0.4 V 范围内,反应后的电流密度明显低于反应前,也就是说,反应后Al2Cl7-浓度明显下降。由于反应后溶液体积基本不变,因此曲线iii 中电流密度的下降,是离子液体中Al2Cl7-总量下降所致。此外,曲线iii相比曲线ii 突变电位正移,推测因Al2Cl7-浓度下降,DIBAL 及其产物可更快地吸附在电极表面。上述结果表明:离子液体中的Al2Cl7-参与了反应,被还原为Al,即离子液体不仅是反应介质,也是Al 源。而目前的液相化学法中,反应介质和Al 源是2 种物质,分别是有机溶剂和含Al 的无机或有机化合物。由于另一反应物为DIBAL,结合Nobuyuki 等化学镀铝观点[38],研究认为,在AlCl3-EMIC 离子液体中,主要通过反应式(2)得到纳米铝粉。反应过程中观察到的气泡,即为该反应中产生的氢气。
3 结 论
(1)提出一种绿色安全的纳米铝粉制备新方案,采用AlCl3-EMIC 离子液体在0.25 mol·L-1DIBAL、反应0.5 min 条件时成功制备了无团聚的纳米铝粉,尺寸为40~100 nm,且粒径均匀,呈近球形。
(2)纳米铝粉在不同DIBAL 浓度下均存在异常长大现象,粒径快速超100 nm,并呈现出一定的晶体外形,与反应后期形核生长机制转变为Ostwald 熟化机制有关,同时发现降低DIBAL 浓度,进入反应后期时间延后。
(3)线性扫描伏安曲线中电流密度下降,表明Al-Cl3-EMIC 离子液体不仅是反应介质,同时也是纳米铝粉的Al 源。

