右侧额顶颞部囊实性神经内分泌癌1例报告并文献复习
王晓雨 张军
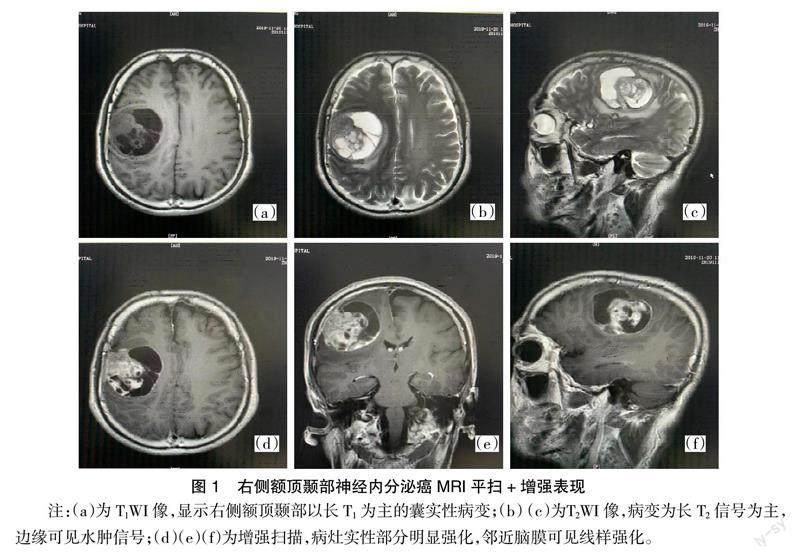
【摘要】 报道1例罕见的右侧额顶颞部囊实性神经内分泌癌。患者主因出现进行性加重的左侧肢体无力入院,头颅CT检查提示右侧额顶颞部不规则团块影,密度混杂,周围水肿明显,右侧基底节受压,中线结构移位。磁共振成像(magnetic resonance imaging,MRI)平扫检查:右侧额顶颞部类圆形异常团块影,T1加权成像(t1-weighted imaging,T1WI)呈混杂低信号,T2加权成像(t2-weighted imaging,T2WI)呈混杂稍高信号,液体衰减反转恢复(FLAIR)呈高信号,弥散加权成像(diffusion weighted imaging,DWI)部分呈高信号,病灶形态规则,大小约4.8 cm×5.2 cm,与周围组织分界清晰,邻近颅骨未见明显破坏。MRI增强检查:病灶实性成分呈明显不均匀强化,邻近脑膜可见轻度强化。入院初步诊断考虑为右侧额顶颞部脑膜瘤或血管外皮细胞瘤可能性大。术后病理诊断:右额顶颞神经内分泌肿瘤(G3)。术后患者左侧肢体无力情况逐渐好转,出院时复查头颅CT,右侧额顶颞部病变消失,基底节受压情况恢复正常。
【关键词】 神经内分泌肿瘤; 神经内分泌癌; 额顶颞部; 囊实性
中图分类号:R445.3;R730.4;R730.5 文献标识码:A
文章编号:1672-1721(2023)25-0139-03
DOI:10.19435/j.1672-1721.2023.25.045
神经内分泌肿瘤(neuroendocrine neoplasms,NENs)是一类相对少见的起源于神经内分泌细胞的肿瘤[1-4]。神经内分泌肿瘤的临床表现多样,绝大部分神经内分泌肿瘤生物行为表现为惰性,恶性程度低,预后较好;但部分具有高侵袭性及转移性,预后较差。神经内分泌肿瘤的高度异质性为临床诊断及治疗带来了诸多挑战。近40年来全世界各地区的神经内分泌肿瘤的发病率呈持续上升趋势。根据2010年世界卫生组织(world health organization,WHO)对神经内分泌肿瘤的最新命名规定,將其中高分化神经内分泌肿瘤命名为神经内分泌瘤(neuroendocrine tumor,NET),低分化神经内分泌肿瘤命名为神经内分泌癌(neuroen-docrine carcinoma,NEC)[5]。消化系统和肺部是神经内分泌癌最常见的原发部位[6-8],出现在颅内原发性神经内分泌癌在临床上极其罕见[9-11]。内蒙古包钢医院近期收治1例罕见的右侧额顶颞部囊实性神经内分泌癌患者,分析其临床表现、影像学表现、综合治疗效果及预后等,以期提高该疾病的诊治水平,现报告如下。
1 病例摘要
患者男性,60岁,已婚。该患者于2019年11月15日无明显诱因出现进行性加重的左侧肢体无力被收入内蒙古包钢医院神经外科。患者自患病以来无头晕、头痛,无视物模糊,精神状态尚可,饮食情况正常,大小便正常,既往无任何特殊病史。实验室检查,血常规、血液生化及肝脏功能检查等均未发现明显异常指标。头颅CT检查提示右侧额顶颞部不规则团块影,密度混杂,周围水肿明显,右侧基底节受压,中线结构移位。MRI平扫检查:右侧额顶颞部类圆形异常团块影,T1WI呈混杂低信号,T2WI呈混杂稍高信号,FLAIR呈高信号,DWI部分呈高信号,病灶形态规则,大小约4.8 cm×5.2 cm,与周围组织分界清晰,邻近颅骨未见明显破坏。MRI增强检查:病灶实性成分呈明显不均匀强化,邻近脑膜可见轻度强化,见图1。入院初步诊断考虑为右侧额顶颞部脑膜瘤或血管外皮细胞瘤可能性大。术前准备:患者取仰卧位,全麻成功后进行手术,选定右额颞预定手术切口入路,分层切开头皮、皮下、肌肉,深达颅骨,颅骨钻4孔,铣刀切开,取下骨瓣,大小约8 cm×9 cm,见硬膜部分侵蚀,小针细线悬吊硬膜,十字形剪开硬脑膜,并切除异常硬膜,见额叶表面组织呈灰白色,鱼肉样,质韧,血供丰富,分块切除异常组织,部分呈囊实性肿物,含黄褐色液体,与正常组织界限稍欠清,镜下完全切除,创面彻底止血、分层缝合头皮、皮下及肌肉,无菌敷料覆盖伤口。术后病理显示:考虑为恶性肿瘤。免疫组织化学标记:波形蛋白(vimentin)局部弱(+),角蛋白(CK)灶(+),上皮膜抗原(EMA)灶(+),神经原特异性烯醇化酶(NSE)灶(+),突出素(Syn)灶(+),免疫蛋白CD56(+),抗原Ki-67约50%。病理诊断:右额顶颞神经内分泌肿瘤(G3)。术后患者左侧肢体无力情况逐渐好转,出院时复查头颅CT,右侧额顶颞部病变消失,基底节受压情况恢复正常。
2 讨论
近40年来,NENs发病率从1.09/100 000上升至6.98/100 000,增加了约5.4倍[12],较癌症的发病率增加更为迅速,给患者家庭带来了沉重的负担。NENs几乎可发生于身体任何部位,最常见部位为胃肠道、胰腺和肺部[6-8],通常起病隐匿,病程较短,多数表现为头痛、恶心、呕吐等颅内压增高症状。NENs由分泌特异性肽激素或生物胺的细胞组成,这些激素或生物胺储存在电子致密的膜结合颗粒中。神经内分泌细胞分布于消化系统黏膜中,形成具有内分泌功能的器官或细胞簇,如垂体、甲状旁腺、胰腺和副神经,均起源于上皮或神经外胚层。上皮神经内分泌细胞的潜在来源为局部多能(分泌)干细胞,此上皮细胞来源的NENs包括类癌、嗜银细胞瘤、小细胞癌、 胰岛细胞瘤、髓样癌、Merkel细胞瘤、NET和NEC。神经外胚层来源的NENs包括副神经节瘤、嗜铬细胞瘤-神经母细胞瘤和嗅神经母细胞瘤。除肺小细胞癌外,其他NENs比较少见,且呈现形态学、激素产生和自然过程中的部位特异性。鉴于无充足的样本进行随机对照研究(random control trial,RCT),故难以评估NENs患者预后和对治疗的反应。
不同于其他上皮细胞恶性肿瘤,NENs 来源于全身弥散分布的神经内分泌细胞,有其独特的生物学特征。(1)惰性生长。NENs常常生长缓慢,例如直肠NENs在10余年的时间里只增长1~2 cm。(2)分泌功能:功能性NENs可分泌激素等物质导致类癌综合征(carcinoid syndrome,CS),严重影响患者生活质量甚至危及生命。(3)侵袭性强。病程较长的NENs可转移至肝、肺、骨、脑、淋巴结等器官。(4)预后相对较好。虽然侵袭性强,但大多数NENs患者预后明显优于其他上皮细胞恶性肿瘤,例如阑尾NENs患者平均生存期长达30年,直肠NENs患者平均生存期超过25年。(5)独特的病理分级。分为高分化的神经内分泌瘤(neuroen-docrine tumor,NET)和低分化的神经内分泌癌(neuroen-docrine carcinoma,NEC)[12]。NENs按照肿瘤是否分泌活性激素并引起特征性临床表现,分为功能性和无功能性神经内分泌癌两大类。功能性神经内分泌癌的表现常以类癌综合征为主,例如腹泻、腹部绞痛及阵发性皮肤潮红等。依据核分裂象计数和Ki-67指数的高低,NENs分为3个组织级别,低级别(G1,核分裂象为1个/10HPF,Ki-67<3%),中級别(G2,核分裂象为2~20个/10HPF,Ki-67为3%~20%),高级别(G3,核分裂象>20个/10HPF,Ki-67>20%)[13]。G1级神经内分泌肿瘤患者的中位生存期最长,平均16.2年,G2级神经内分泌肿瘤患者中位生存期短,平均8.3年,G3级神经内分泌肿瘤患者的中位生存期最差。
颅内原发性神经内分泌癌的发病率约0.74%,颅内是否含有神经内分泌细胞尚不明确,有报道称其发生可能源于蛛网膜及软脑膜[14-15],与间变性脑膜瘤的组织学表现很类似,可能伴随脑膜瘤病理进展而发生,但具体机制尚不明确。其表现可为实性及囊实性,可位于脑实质内,也可位于颅内脑组织外。根据其临床表现、影像学检查及化验检查一般很难作出准确的诊断,多数需要术后病理检查才能最后确诊。其中,嗜铬粒蛋白A(CGA)及突出素Syn对神经内分泌肿瘤诊断有着特异性[16-17],目前CGA是应用较多且敏感性较强的一种标志物,还可以评价治疗效果以及提示肿瘤是否复发。本例患者CGA、Syn均表达为阳性,诊断为神经内分泌肿瘤是准确的。病灶位于功能区时,可能出现肢体活动障碍、语言障碍、视力障碍等,本例患者病变定位于右侧额顶颞部,引起的临床症状主要是左侧肢体乏力,也就是病变部位受损产生的定位体征,并没有出现与神经内分泌激素相关的临床表现,说明本病例为无功能性的神经内分泌癌。影像学表现方面,既往临床报道过的颅内神经内分泌肿瘤多为实性,呈胶质瘤或转移瘤样改变,本例病变为囊实性,在CT上表现为混杂密度占位,MRI各序列信号混杂,周围水肿明显,强化明显,邻近脑膜受侵出现强化,此特点与脑膜瘤表现极为相似,比较特殊,这也就表示颅内神经内分泌肿瘤的影像学表现比较多样化,缺乏典型的特征,容易误诊。且由于神经内分泌肿瘤发生于颅内比较少见,目前还没有较为完善的治疗方案,手术切除被认为是首选,可根据实际情况辅以放化疗,提高患者的生存率[4,18]。针对治疗方面也有文献报道[19],颅内原发性且无明显占位效应的神经内分泌癌,可行立体定向穿刺活检术,明确病理性质,为进一步放化疗提供基础。颅内单发病灶且占位效应明显或者多发病灶有局部占位效应明显,不管是原发性还是转移性神经内分泌癌,在保留功能的情况下,应尽量全切除肿瘤;对于非功能区的单发病灶,可以适当地扩大切除,术后辅助以放化疗。目前,还出现了一些新的治疗方式,比如研究显示表皮生长因子受体-酪氨酸激酶抑制剂和血管生成抑制剂可用于源自肺神经内分泌癌的脑转移,能够改善患者的预后,但是对于颅内原发性神经内分泌癌治疗中使用表皮生长因子受体-酪氨酸激酶抑制剂和血管生成抑制剂的研究暂无可靠的临床数据支持。
另外,值得一提的是核医学在神经内分泌肿瘤的诊断方面也拥有着不可替代的重要作用。氟代脱氧葡萄糖(18F-FDG)正电子发射断层显像(PET)可根据肿瘤的18F-FDG 摄取量来判断肿瘤的恶性程度。BINDERUP T等[20]对98例该疾病患者的研究提示,血小板衍生生长因子(PDG)摄取量还可以判断患者的预后。氟-多巴(18F-DOPA) PET相对碳-5-羟色氨酸(11C-5-HTP)PET敏感性更加优越,弥补了11C只有20 min半衰期的不足,而能更好地应用于实际的临床诊断,整合18F-DOPA PET/CT和11C-5-HTP PET/CT的成像技术也展现出了更优越的应用价值。68Ga-DOTA PET成像具有更高的空间分辨率和敏感性。
综上所述,颅内神经内分泌癌非常罕见,起源、形态结构、功能、分子特征、类型、部位特异性、侵袭性及对治疗的反应等方面均存在差异,术前诊断困难,容易误诊,需要结合病理及免疫组化指标进行明确。该病目前采用以手术治疗为主的综合性治疗,具有一定疗效,但由于病历较少且缺乏系统性研究,其诊断及治疗方案仍有待未来进一步研究及探索。
参考文献
[1] CHAUHAN A,KOHN E,RIVERO J D.Neuroendocrine tumors-less well known,often misunderstood,and rapidly growing in incidence[J].JAMA Oncol,2020,6(1):21-22.
[2] MANIVANNAN S,SHAROUF F,LAMMIE G,et al.Unusual cause of a painless soft tissue mass of the scalp:a rare presentation of primary intracranial neuroendocrine neoplasm[J].BMJ Case Rep,2021,14(2):e236856.
[3] LIM C H,LEE I S,JUN B Y,et al.Incidence and clinical characteristics of gastroenteropancreatic neuroendocrine tumor in Korea:a single-center experience[J].Korean J Intern Med,2017,32(3):452-458.
[4] 熊平,唐晓平,张涛.颅内神经内分泌癌6例报道及文献复习[J].中国临床神经外科杂志,2019,24(3):135-137.
[5] KLIMSTRA D S,ARNOLD R,CAPELLA C,et al.Neuroen-docrine neoplasms of the pancreas.WHO classification of tumoum of the digestive system[M].Lyon:IARC Press,2010:322-326.
[6] WYLD D,WAN M H,MOORE J,et al.Epidemiological trends of neuroendocrine tumours over three decades in Queensland,Australia[J].Cancer Epidemiol,2019,63:101598.
[7] GENUS T S E,BOUVIER C,WONG K F,et al.Impact of neuroendocrine morphology on cancer outcomes and stage at diagnosis:a UK nationwide cohort study 2013—2015[J].Br JCancer,2019,121(11):966-972.
[8] ANAIZI A,RIZVI-TONER A,VALESTIN J,et al.Large cell neuroendocrine carcinoma of the lung presenting as pseudoachalasia:a case report[J].J Med Case Rep,2015,9:56.
[9] CAO J W,XU W Z,DU Z H,et al.Pathologic progression,possible origin,and management of multiple primary intra-cranial neuroendocrine carcinomas[J].World Neurosurg,2017,106:1054.e13-1054.e17.
[10] HOOD B,BRAY E,BREGY A,et al.Primary carcinoid tumor of the cavernous sinus[J].World Neurosurg,2014,81:e209-e213.
[11] ZHANG S,CAI Q,FAN L,et al.Primary intracranial small cell carcinoma:a case report and review of the literature[J].Onko-logie,2013,36(7/8):428-431.
[12] DASARI A,SHEN C,HALPERIN D,et al.Trends in the incidenceprevalence,and survival outcomes in patients with neuroendocrine tumors in the United States[J].JAMA Oncol,2017,3(10):1335-1342.
[13] 中華医学会病理学分会消化疾病学组,2020年中国胃肠胰神经内分泌肿瘤病理诊断共识专家组.中国胃肠胰神经内分泌肿瘤病理诊断共识(2020版)[J].中华病理学杂志,2021,50(1):14-20.
[14] NAKAGUCHI H,MATSUNO A,MIYAWAKI S,et al.Small cell car cinoma originating from the cavernous sinus[J].Acta Neurochir(Wien),2010,152(3):493-500.
[15] PORTER D G,CHAKRABARTY A,MCEVOY A,et al.Intracranial carcinoid without evidence of extracranial disease[J].Neuropathol Appl Neurobiol,2000,26(3):298-300.
[16] 钟定荣,张红凯.神经内分泌肿瘤病理诊断过程中的陷阱及预防[J].诊断病理学杂志,2021,28(10):870-873.
[17] NIELSEN K,BINDERUP T,LANGER S W,et al.P53,Somatostatin receptor 2a and chromogranin a immunostaining as prognostic markers in high grade gastroenteropancreatic neuroendocrine neoplasms[J].BMC Cancer,2020,20(1):27.
[18] WANG X,LI Y L,DUAN J H,et al.Capecitabine and temozo-lomide as a promising therapy for advanced thymic atypical carcinoid[J].Oncologist,2019,24(6):798-802.
[19] 陆冬,王子德,王强,等.颅内神经内分泌癌的诊治分析(附15例报道)[J].中国临床神经外科杂志,2022,27(4):252-254.
[20] BINDERUP T,KNIGGE U,LOFT A,et al.18F-fluorodeoxy-glucose positron emission tomography predicts survival pf patients with neuroendocrine tumors[J].Clin Cancer Res,2010,16(3):978-985.
(收稿日期:2023-06-13)

