慢性阻塞性肺疾病多重耐药菌感染的病原菌分布特点及耐药性分析
余敏敏 胡顾生


【摘要】 目的 分析慢性阻塞性肺疾病(COPD)多重耐藥菌感染的病原菌分布特点及耐药性。方法 以98例COPD多重耐药菌感染患者作为研究对象,病例来源于2019年12月—2022年1月于九江市中医医院就诊的患者,对患者进行痰培养,并行药敏试验。对病原菌分布特点及耐药性进行分析。结果 98例COPD多重耐药菌感染患者共培养出105株病原菌,其中75株革兰阴性菌,占比71.43%,前4依次为鲍曼不动杆菌、铜绿假单胞菌、大肠埃希菌和肺炎克雷伯菌;革兰阳性菌24株,占比22.86%,前3依次为金黄色葡萄球菌、表皮葡萄球菌和肺炎链球菌。鲍曼不动杆菌对抗生素耐药率均在60.00%以上;铜绿假单胞菌对头孢噻肟完全耐药;大肠埃希菌对头孢他啶、哌拉西林、头孢噻肟等耐药率较高;除替卡西林、阿米卡星、哌拉西林他唑巴坦外,肺炎克雷伯菌对其他抗生素耐药率均较高。金黄色葡萄球菌、表皮葡萄球菌分别对氧氟沙星、青霉素耐药率为100.00%;肺炎链球菌对青霉素和红霉素耐药率最高,耐药率均为80.00%。结论 COPD患者多重耐药菌感染的病原菌主要为革兰阴性菌,在COPD患者抗感染治疗前应先予以病原菌培养和药敏试验,规范、合理应用抗生素,有效控制感染,控制病原菌耐药性,确保治疗的有效性,从而有效改善患者病情,改善患者预后。
【关键词】 慢性阻塞性肺疾病; 多重耐药菌感染; 病原菌分布; 耐药性
中图分类号:R563;R446.5 文献标识码:A
文章编号:1672-1721(2023)25-0136-03
DOI:10.19435/j.1672-1721.2023.25.044
慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)是一种临床常见肺部疾病,一旦发病,会出现咳嗽、咳痰等症状,若不及时治疗,症状呈进行性加重,可进展为呼吸衰竭、肺心病等,严重损害患者生命健康[1]。COPD多见于老年人群,在我国老龄人口数量不断增长的形势下,其发病率不断上升,已成为威胁我国国民健康的重大疾病之一。现代医学针对该病的治疗以应用糖皮质激素、抗生素药物为主,由于患者肺功能处于持续损伤状态,多频繁入院治疗。为有效控制临床症状,临床常采用多种抗生素治疗,而长期频繁应用抗生素会增加肺部感染风险,导致多重耐药菌感染在该病中发生率越来越高。多重耐药菌的日益增加,导致COPD患者对常规抗生素不敏感,从而增加抗菌药物使用难度,致使患者病情加重,延长患者住院时间、增加住院费用,甚至会因无效抗菌而诱发患者死亡[2]。因而规范、合理应用抗生素尤为重要。基于此,本研究分析COPD多重耐药菌感染的病原菌分布特点及耐药性,以控制多重耐药菌感染的发生,现报告如下。
1 资料与方法
1.1 一般资料 选取2019年12月—2022年1月收治于九江市中医医院的98例多重耐药菌感染的COPD患者,其中男性54例,女性44例,年龄50~78岁,平均年龄(59.33±3.58)岁;COPD病程1~15年,平均(6.45±1.17)年;COPD分级,1级6例,2级22例,3级70例;文化程度:高中及以下52例,大专34例,本科及以上12例。纳入标准:符合COPD诊断标准[3];符合多重耐药菌感染的诊断标准,即培养出的菌株对3类及以上抗生素同时耐药;临床资料齐全;患者知情同意;语言、认知功能正常。排除标准:吞咽功能障碍,无法获取痰液者;其他疾病诱导肺部感染者;重要脏器功能障碍者;合并恶性肿瘤者;存在其他部位明显感染者。
1.2 方法 患者入院48 h内,于清晨清洁口腔后清水漱口3次,用力咳出痰液,第1口痰弃之,留取第2口痰置入无菌杯中。依据《全国临床检验操作规程》进行细菌分离。采用VITEK-32全自动细菌鉴定/药敏系统进行菌株鉴定和耐药性分析。药敏试验采用K-B纸片扩散法。将同一患者的重复菌株剔除,如实记录结果。
1.3 统计学方法 使用SPSS 22.0统计学软件进行数据分析,计量资料以x±s表示,采用t检验,计数资料以百分比表示,采用χ2检验,P<0.05为差异有统计学意义。
2 结果
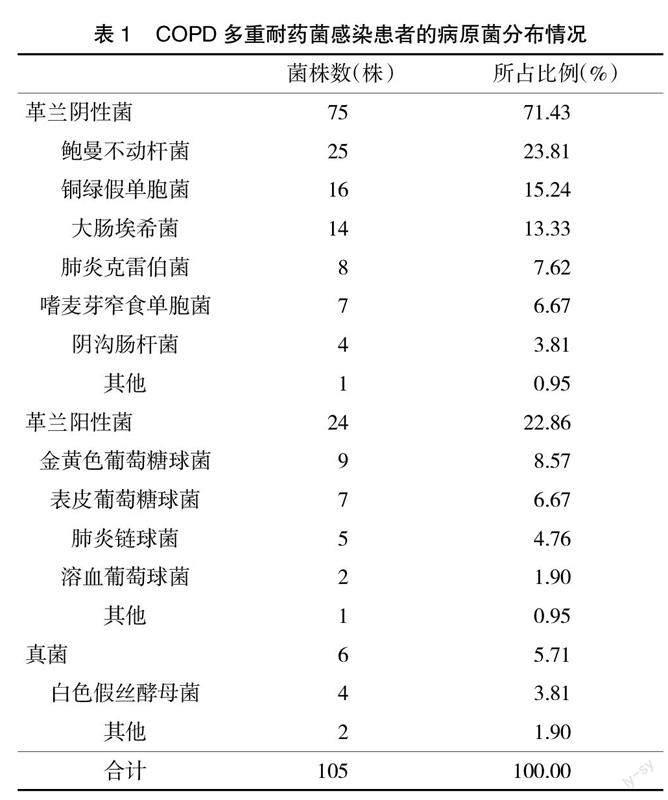
2.1 病原菌分布 98例COPD多重耐药菌感染患者共培养出105株病原菌,其中75株为革兰阴性菌,占比71.43%,前4依次为鲍曼不动杆菌、铜绿假单胞菌、大肠埃希菌和肺炎克雷伯菌;革兰阳性菌24株,占比22.86%,前3依次为金黄色葡萄球菌、表皮葡萄球菌和肺炎链球菌,见表1。
2.2 主要革兰阴性菌对抗生素的耐药性 鲍曼不动杆菌对多数抗生素耐药率>60.00%;铜绿假单胞菌对头孢噻肟完全耐药,其次为复方磺胺甲恶唑,耐药率为62.50%,对替卡西林耐药率56.25%,对其余抗生素耐药率普遍较低;大肠埃希菌对哌拉西林、头孢他啶、头孢噻肟等耐药率较高,对哌拉西林他唑巴坦、阿米卡星耐药率较低;肺炎克雷伯菌对替卡西林、哌拉西林他唑巴坦、阿米卡星耐药率较低,对其他抗菌药物耐药性均较高,见表2。
2.3 主要革兰阳性菌对抗生素的耐药性 金黄色葡萄球菌对氧氟沙星耐药率为100.00%,对青霉素耐药率为88.89%,对红霉素耐药率为77.78%;表皮葡萄球菌对青霉素耐药率最高,耐药率为100.00%,其次为苯唑西林和红霉素,耐药率均为85.71%;肺炎链球菌对青霉素和红霉素耐药率最高,耐药率均为80.00%,见表3。
3 讨论
COPD病程长,病情反复发作,对肺功能造成持续性损伤,导致其发病率和病死率居高不下。相关研究指出,多重耐药菌感染的独立危险因素为长期使用抗生素及糖皮质激素[4]。近年来,广谱抗菌、糖皮质激素药物的大量应用,病原菌种类及药物敏感性也不断变化,多重耐药菌感染现象日益严重,增加临床感染控制难度,致使患者病情加重,危及生命。此外,COPD患者治疗过程中,常常需要进行机械通气,而治疗中所使用的呼吸机、氧气管会导致机体部分生理屏障作用消失,为病原菌侵入机体提供了便利的通道,且呼吸机设备中细菌定植率较高。因此,临床应对COPD多重耐药菌感染患者的病原学特点及耐药性进行分析,以合理选用抗生素。
任泽强等[5]对急性加重COPD患者病原菌分布进行分析,结果显示,共分离出139株病原菌,其中81株革兰阴性菌,占比58.30%。白焕强等[6]研究显示,高海拔地区274例COPD患者痰液中共培养出165株致病菌,其中革兰阴性菌占71.50% ,革兰阳性菌占17.00%。潘小东等[7]共纳入104例COPD机械通气患者,各种标本中分离出病原菌163株,其中革兰阴性菌最多,占比74.80%。本研究结果显示,98例多重耐药菌感染的COPD患者共培养出105株病原菌,其中革兰阴性菌75株,占比71.43%,革兰阳性菌24株,占比22.86%,均说明革兰阴性菌是引发COPD患者多重耐药菌感染的主要病原菌,与既往研究一致。本研究检出的革兰阴性菌以大肠埃希菌、鲍曼不动杆菌、铜绿假单胞菌和肺炎克雷伯菌为主,检出的革兰阳性菌以金黄色葡萄球菌、肺炎链球菌和表皮葡萄球菌为主。张丽等[8]研究显示,COPD急性加重期肺部感染患者共391例,共培养出病原菌455株,其中革兰阴性菌、革兰阳性菌分别占比68.35%、25.27%,革兰阴性菌主要为大肠埃希菌、鲍曼不动杆菌、铜绿假单胞菌和肺炎克雷伯菌,革兰阳性菌主要为金黄色葡萄球菌、肺炎链球菌和表皮葡萄球菌,与本研究具有一致性。本研究耐药试验结果显示,革兰阴性菌中,鲍曼不动杆菌对多数抗生素耐药率>60.00%;铜绿假单胞菌对头孢噻肟完全耐药;大肠埃希菌对头孢他啶、哌拉西林、头孢吡肟、头孢噻肟耐药性较高;肺炎克雷伯菌对替卡西林、哌拉西林他唑巴坦、阿米卡星耐药率较低,对其他抗生素耐药性均较高。革兰阳性菌中,金黄色葡萄球菌对氧氟沙星耐药率为100.00%;表皮葡萄球菌对青霉素耐药率为100.00%;肺炎链球菌对青霉素和红霉素耐药率最高,耐药率均为80.00%。说明COPD多重耐药菌感染患者对多数抗生素均存在较高的耐药性,临床治疗中应避免使用头孢噻肟、哌拉西林、头孢他啶、头孢吡肟等耐药率较高的抗菌药物。分析原因主要与广谱抗生素的广泛应用、长期反复使用多种抗生素有關。
对于COPD患者的治疗,应根据患者地区耐药状况、病情急性加重程度、潜在依从性与治疗费用合理使用抗生素,而不是经验性应用抗生素[9-12]。临床还应加强抗生素耐药性监测,并采取有效措施预防耐药性及多重耐药的发生。在临床治疗COPD患者时,应首先进行病原菌分布及耐药性分析,以合理选用抗生素,注意联合用药,对于新型广谱抗生素的应用更应慎重,以控制病原菌耐药性,减少多重耐药菌感染的发生。尤其对于长期使用抗生素且年老体弱的COPD患者,应充分考虑致病菌发生多重耐药的可能,积极留取合格的痰标本,尽早送检痰培养,依据药敏试验结果及时调整用药,保证治疗的有效性。
当今形势下,耐药性问题日趋严重,临床应加强药敏试验,合理选择抗生素,注意联合用药,同时应加强对临床抗生素使用的管理,避免滥用,使患者得到有效的治疗。然而本研究存在一定局限性,所选取的样本量较少,结果可能存在一定的偏差,后期应增加样本的纳入数量,进行深入研究。
综上所述,COPD多重耐药菌感染患者的病原菌主要为阴性革兰菌。为保证治疗的有效性,建议根据药敏试验结果合理使用抗生素,预防多重耐药菌感染的发生。
参考文献
[1] 何光辉,蔡立长,吕玉亮,等.伴下呼吸道多重耐药菌感染的慢性阻塞性肺病患者病原菌分布及危险因素分析[J].中国微生态学杂志,2019,31(6):707-711.
[2] LU Y F,WANG X B,ZHAO J.Effects of azithromycin on treating chronic obstructive pulmonary disease with acute exacerbation of chronic bronchitis in the stable phase[J].Am J Transl Res,2021,13(6):7370-7375.
[3] 中华医学会,中华医学会杂志社,中华医学会全科医学分会,等.慢性阻塞性肺疾病基层诊疗指南(2018年)[J].中华全科医师杂志,2018,17(11):856-870.
[4] CHIU Y C,LEE S W,LIU C W,et al.Comprehensive profiling of the gut microbiota in patients with chronic obstructive pulmonary disease of varying severity[J].PLoS One,2021,16(4):e0249944.
[5] 任泽强,张蓬波.老年慢性阻塞性肺疾病急性加重期患者呼吸道病原菌分布与耐药性[J].中华老年多器官疾病杂志,2020,19(10):759-763.
[6] 白焕强,王淑萍.高海拔地区慢性阻塞性肺疾病患者病原菌分布及相关因素分析[J].中国微生态学杂志,2019,31(11):1309-1312,1316.
[7] 潘小东,邢超,汤鲁明,等.慢性阻塞性肺疾病机械通气患者病原菌耐药性分析[J].中华急诊医学杂志,2019,28(4):455-458.
[8] 张丽,范忠杰,周凡.慢性阻塞性肺疾病急性加重期肺部感染患者的病原菌分布、耐药性及危险因素分析[J].中国病原生物学杂志,2019,14(12):1456-1459.
[9] 宋玉龙,侯伟,金茜.慢性阻塞性肺疾病患者急性加重期合并肺部感染的病原菌分布及危险因素分析[J].工业卫生与职业病,2019,45(3):227-228,231.
[10] AKATA K,YAMASAKI K,FILHO F S L,et al.Abundance of non-polarized lung macrophages with poor phagocytic function in chronic obstructive pulmonary disease(COPD)[J].Biomedicines,2020,8(10):398.
[11] 唐火焰,刘虎,赵赟,等.慢性阻塞性肺疾病急性加重期患者痰培养菌种分布及耐药性分析[J].中国实用内科杂志,2019,39(5):447-451.
[12] 陈丽敏,孙荣强.慢性阻塞性肺疾病合并肺部真菌感染的相关危险因素与耐药性分析[J].中国卫生检验杂志,2019,29(23):2906-2909.
(收稿日期:2023-06-22)

