推拿扌衮法对兔骨骼肌钝挫伤修复及Wnt/β-catenin信号通路的影响
阮 磊,黄 博,王兰兰,薛惠天,孙梦龙,段苗苗,彭 亮*
湖南中医药大学针灸推拿与康复学院,湖南 长沙 410208
骨骼肌钝挫伤是骨骼肌损伤中较为常见的类型之一,主要是指由外界重力物体造成的机械损伤,常伴随受损局部肌细胞受损、毛细血管破裂、浸润性出血、水肿、炎症以及氧化应激等一系列内在病理变化,从而进一步加重组织损伤[1-2]。 病理性纤维化是骨骼肌损伤修复异常的主要病理表现,是由于细胞外基质生成或累积过度使得原有正常组织被胶原瘢痕取代所致[1-3],其外在常表现为肢体功能受限或障碍,且易发生二次损伤[4]。 因此,进一步探究骨骼肌损伤的相关病理机制,探讨如何有效减轻骨骼肌损伤后的病理改变,提高骨骼肌功能恢复质量,是当下医体结合领域研究的重要课题之一。研究显示,Wnt/β-catenin 信号通路与转化生长因子-β1(transforming growth factor-β1, TGF-β1)/smads 信号通路之间存在一定串扰[5-7],二者的激活与多种组织、器官纤维化的形成关系密切,抑制Wnt/β-catenin 信号通路可有效降低细胞外基质的沉积、抑制纤维化,进而提高骨骼肌修复质量,促进骨骼肌功能恢复[8-9]。 故Wnt/β-catenin 信号通路的抑制可能是抑制骨骼肌纤维化,从而减轻骨骼肌损伤的另一关键靶点。前期研究证实,推拿法对骨骼肌损伤修复具有明显的促进作用,并能通过调控TGF-β1/smads 信号通路,减少损伤骨骼肌纤维化,从而促进修复[1]。 但推拿法抑制骨骼肌损伤后纤维化与Wnt/β-catenin 信号通路的关系尚未见相关研究。基于此,本实验拟通过建立家兔骨骼肌钝挫伤模型,观察推拿法对家兔受损骨骼肌病理变化、胶原沉积、炎症因子以及Wnt/βcatenin 信号通路表达水平的影响,探究推拿法通过调控Wnt/β-catenin 信号通路抑制骨骼肌损伤后纤维化的可能性,为进一步探讨推拿法促进骨骼肌损伤修复提供参考资料。
1 材料与方法
1.1 实验动物
36 只成年健康普通级新西兰大耳白兔,雌雄各半,体质量2~2.5 kg,由湖南中医药大学动物实验中心采购供应[动物许可证号:SCXK(湘)2020-0005]。于湖南中医药大学动物实验中心普通级动物房进行饲养,室温20~25 ℃,湿度50%~70%,定时进食进水。 实验方案由湖南中医药大学动物实验伦理委员会批准并通过(批准编号:LL2022042006)。
1.2 主要仪器与试剂
HE 染色试剂盒、Masson 染色试剂盒、兔源Wnt3a抗体、鼠源β-catenin 抗体、兔源糖原合成酶激酶-3β(glycogen synthase kinase-3β, GSK-3β)抗体、兔源磷酸化糖原合成酶激酶-3β(phosphorylated glycogen synthase kinase-3β, p-GSK-3β)抗体、兔源TGFβ1 抗体、兔源Ⅰ型胶原蛋白(Collagen Ⅰ, COL-Ⅰ)抗体、鼠源β-actin 抗体、50×Cocktail 蛋白酶抑制剂、磷酸化蛋白酶抑制剂、RIPA 裂解液、脱脂奶粉、转膜缓冲液、电泳缓冲液、TSB 缓冲液(武汉Servicebio 公司,批号:G1005、G1006、GB113750、GB12015、GB11099、GB114582、GB111876、GB114197、GB15001、G2006-250UL、G2007-1mL、G2002、GC310001-100 g、G2017、G2018、G0001-2L);戊巴比妥钠(德国Merck 公司,批号:P3761)。
1.3 动物分组与造模
实验家兔适应性喂养7 d 后,依照随机数字表分为对照组、模型组、法组,每组12 只,再根据不同取材时间点随机分为干预结束后第1 天、第3天、第6 天(下称干预结束后1、3、6 d)3 个亚组,每组4 只。
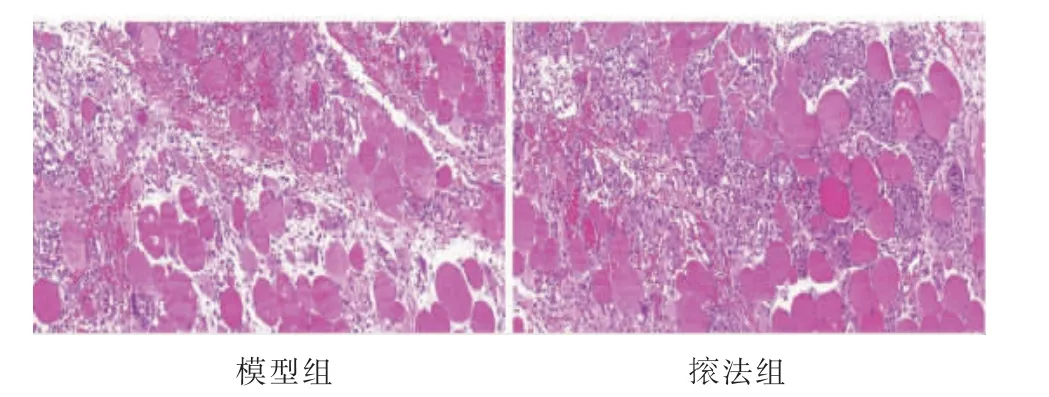
图1 造模后骨骼肌病理改变(HE,×200)
1.4 干预方法
为保证手法操作标准化,由同一实验人员完成操作。 在正式实验前,实验人员在ZTC-II 按摩手法测试仪上进行反复多次测试训练以便熟练掌控。 造模成功后7 d 开始进行干预[14]。 将法组家兔仰卧位固定于兔台,充分暴露右下肢股四头肌内侧损伤部位,采用课题组自制法按摩器附于股四头肌实施法[15],前后滚动力度比约为3∶1,最大下压力约为3 N,操作频率为140 次/min、3 min/次、2 次/d,连续治疗3 d。对照组、模型组家兔进行同时段捆绑,不予任何其他干预。
1.5 指标检测
1.5.1 取材 分别于干预结束后1、3、6 d 进行取材。 按批次家兔耳中动脉采血,静置分层后对称放入离心机中离心。 采血完成后,2%戊巴比妥钠耳缘静脉注射麻醉。待家兔完全麻醉后,家兔颈动脉分离放血处死,死后立即进行取材。取右下肢股四头肌患部组织一小块(约1 cm×1 cm×0.5 cm),于冰板上对肌肉组织进行切割分离成两等份。 其中,一份采用4%多聚甲醛浸泡固定, 用于HE 和Masson 染色;另外一份立即放入-80 ℃冰箱保存,用于Western blot 检测。
1.5.2 骨骼肌病理形态观察 (1)取材:将组织用4%多聚甲醛固定24 h 以上,取出修正放入对应脱水盒内。 (2)脱水浸蜡:脱水盒放置于脱水机内降梯度(95%→85%→70%)浸入乙醇内脱水。 (3)包埋、切片:将组织完全浸入热蜡中包埋,待组织热退成块后修整切片。 (4)HE 染色:室温下将所制备的切片滴加适量苏木精染液,时间到后取出再将切片放入1%乙醇盐酸溶液中,以达到去除多余苏木精的目的,随后反染5 min。(5)Masson 染色:将制备的切片依次使用重铬酸钾隔、铁苏木素、丽春红浸染,每步时间长度不等,浸染完成后皆用自来水清洗;随后,使用磷钼酸与苯胺蓝染色、醋酸分化,透明封片,使用专业阅片软件进行图像采集分析。
1.5.3 ELISA 检测血清中白细胞介素-6(interleukin 6, IL-6)、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)的表达 家兔耳中动脉采血,静置1~2 h,待分层后匀称放入离心机内,以1 300 r/min、半径8 cm 离心10 min,取出,使用移液枪吸取上清液至离心管,随后立即放入-80 ℃冰箱保存。采用ELISA测定样本中IL-6 和TNF-α 两者浓度,具体操作方法按试剂盒说明书步骤进行。
1.5.4 Western blot 检 测 股 四 头 肌 中Wnt3a、βcatenin、GSK-3β、p-GSK-3β、TGF-β1、COL-Ⅰ表达剪取受损骨骼肌组织,并加入400 μL RIPA 裂解液,在低温条件下反复研磨10 min, 置于4 ℃左右的离心机内,以12 000 r/min、半径8 cm 离心15 min,提取上清液转移至1.5 mL 离心管中,后经过制胶、蛋白上样、电泳、转膜、封闭、抗体孵育(β-actin 一抗1∶2 000,Wnt3a 一抗1∶3 000,β-catenin一抗1∶2 000,GSK-3β 一抗1∶3 000,p-GSK-3β 一抗1∶3 000,TGFβ1 一抗1∶3 000,COL-Ⅰ一抗1∶3 000、二抗1∶5 000)、显色曝光, 检测骨骼肌中Wnt3a、β-catenin、GSK-3β、p-GSK-3β、TGF-β1、COL-Ⅰ蛋白表达量。 采用专业灰度分析软件对所得蛋白条带进行分析。
1.6 统计学方法
采用SPSS 26.0 统计软件进行数据分析。计量资料以“±s”表示,服从正态分布采用One-Way ANOVA检验,方差齐采用LSD 检验,方差不齐则采用Games-Howel 检验;组内比较采用重复测量的方差分析;不满足正态分布用秩和检验。以P<0.05 表示差异有统计学意义。
2 结果
2.1 各组家兔股四头肌病理变化
对照组肌细胞排列规整有序,细胞间隙狭小,细胞膜完整,细胞质均匀,细胞核统一位于肌细胞边缘;模型组肌细胞大小、形态不一,排列紊乱,间隙增宽,细胞膜边界不清,细胞质染色不均,炎细胞浸润,结缔组织增生明显,随时间延长炎细胞浸润有所减少;法组肌细胞结构相对完整,细胞间隙缩小,排列规整,少量炎细胞浸润,结缔组织明显减少。详见图2。

图2 各组家兔股四头肌病理变化(HE,×200)
2.2 各组家兔股四头肌肌纤维变化
对照组可见红染骨骼肌纤维排列规整紧凑,形态大小一致,肌束膜包裹完整,未见有明显胶原纤维沉积;模型组可见肌纤维形态多样,粗细不均,间隙增宽,四周被大量蓝染的胶原纤维包绕,且随时间推移胶原沉积逐渐增多;法组肌纤维结构相对完整,粗细较为均匀一致,周围包绕的蓝色胶原纤维显著减少,随时间推移逐渐接近对照组。 详见图3。
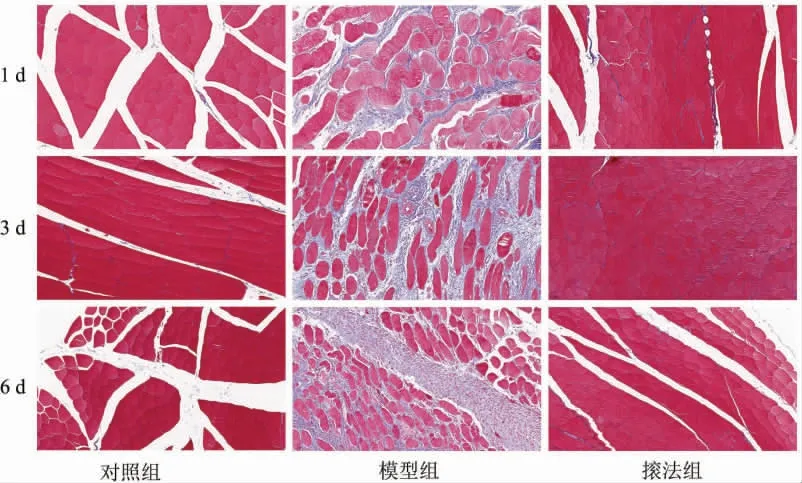
图3 各组家兔股四头肌肌纤维变化(Masson 染色,×200)
2.3 各组家兔股四头肌胶原沉积比较
与对照组相比,1、3、6 d 模型组家兔股四头肌胶原沉积均显著升高(P<0.01);与模型组相比,法组同一时间点的家兔股四头肌胶原沉积明显降低(P<0.05,P<0.01)。 详见图4。
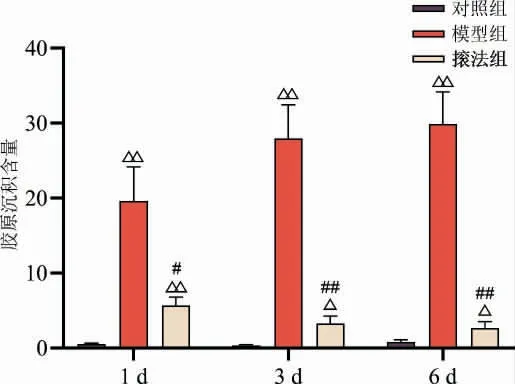
图4 各组家兔股四头肌胶原沉积比较
2.4 各组家兔血清中炎症因子IL-6 和TNF-α 表达比较
与对照组相比,模型组家兔血清中IL-6 和TNF-α水平在1、3、6 d 均显著升高(P<0.01);与模型组相比,法组家兔血清中IL-6 和TNF-α 水平于1、3、6 d 均显著降低(P<0.01)。 详见图5—6。
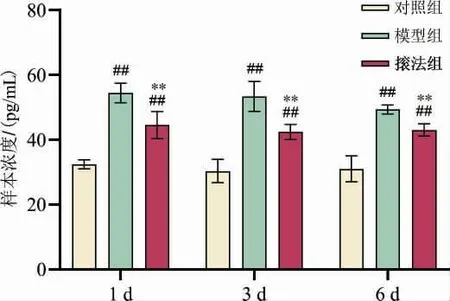
图5 各组家兔血清中IL-6 表达比较

图6 各组家兔血清中TNF-α 表达比较
2.5 各组家兔股四头肌通路蛋白Wnt3a、β-catenin、GSK-3β、p-GSK-3β 表达比较
与对照组相比,1、3、6 d 模型组家兔股四头肌中Wnt3a、β-catenin、p-GSK-3β 表达量均显著升高(P<0.01),GSK-3β 表达量显著降低(P<0.01);与模型组比较,法组家兔股四头肌中Wnt3a、β-catenin、p-GSK-3β 表达量于1、3、6 d 均明显降低(P<0.01),而GSK-3β 表达量明显升高(P<0.05,P<0.01)。 详见表1—2、图7。
表1 各组家兔股四头肌Wnt3a、β-catenin 蛋白表达比较(±s)

表1 各组家兔股四头肌Wnt3a、β-catenin 蛋白表达比较(±s)
注:与对照组比较,#P<0.05,##P<0.01;与模型组比较,**P<0.01。
β-Catenin 1 d 3 d 6 d对照组模型组组别 n Wnt3a 1 d 3 d 6 dimages/BZ_150_275_595_304_627.png法组4 4 4 0.25±0.07 0.82±0.03##0.54±0.08##**0.26±0.08 0.87±0.09##0.43±0.03#**0.30±0.06 0.96±0.17##0.18±0.04**0.22±0.03 0.62±0.10##0.41±0.06#**0.20±0.04 0.68±0.08##0.38±0.09#**0.22±0.03 0.78±0.05##0.22±0.06**
表2 各组家兔股四头肌GSK-3β、p-GSK-3β 蛋白表达比较(±s)
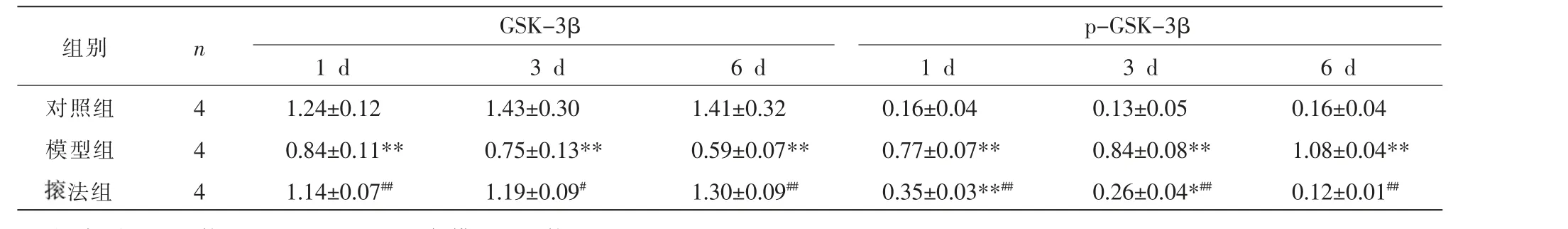
表2 各组家兔股四头肌GSK-3β、p-GSK-3β 蛋白表达比较(±s)
注:与对照组比较,*P<0.05,**P<0.01;与模型组比较,#P<0.05,##P<0.01。
p-GSK-3β 1 d 3 d 6 d对照组模型组组别 n GSK-3β 1 d 3 d 6 dimages/BZ_150_275_1071_304_1102.png法组4 4 4 1.24±0.12 0.84±0.11**1.14±0.07##1.43±0.30 0.75±0.13**1.19±0.09#1.41±0.32 0.59±0.07**1.30±0.09##0.16±0.04 0.77±0.07**0.35±0.03**##0.13±0.05 0.84±0.08**0.26±0.04*##0.16±0.04 1.08±0.04**0.12±0.01##
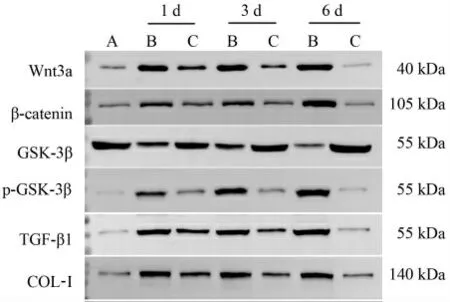
图7 各组家兔股四头肌Wnt3a、β-catenin、GSK-3β、p-GSK-3β、TGF-β1、COL-Ⅰ蛋白条带图
2.6 各组家兔股四头肌TGF-β1、COL-I 蛋白表达比较
与对照组相比,1、3、6 d 模型组家兔股四头肌中TGF-β1、COL-Ⅰ表达量均显著升高(P<0.01);与模型组比较,同一时间点法组家兔股四头肌中TGFβ1、COL-Ⅰ表达量皆明显降低(P<0.01)。 详见表3、图7。
表3 各组家兔股四头肌TGF-β1、COL-Ⅰ蛋白表达比较(±s)

表3 各组家兔股四头肌TGF-β1、COL-Ⅰ蛋白表达比较(±s)
注:与对照组比较,##P<0.01;与模型组比较,**P<0.01。
COL-Ⅰ1 d 3 d 6 d对照组模型组组别 n TGF-β1 1 d 3 d 6 dimages/BZ_150_275_1546_304_1577.png法组4 4 4 0.32±0.03 1.14±0.33##0.68±0.13**0.34±0.01 0.96±0.31##0.52±0.07**0.34±0.02 0.85±0.24##0.49±0.08**0.21±0.01 0.98±0.14##0.62±0.09##**0.20±0.02 0.87±0.13##0.58±0.10##**0.20±0.02 0.84±0.11##0.54±0.09##**
3 讨论
骨骼肌损伤是常见的软组织损伤疾病,其主要表现为局部红、肿、热、痛以及功能受限或障碍[16],现代学者大多将其归属为中医学“筋伤”范畴[17-18]。 “跌打损伤,血瘀气滞,经脉阻塞不通”是筋伤病最为主要的发病机制。现代研究证实,推拿法作为传统中医外治法之一,能够产生活血化瘀、解痉镇痛、舒筋通络等治疗效应[19]。 炎症与纤维化是骨骼肌损伤后常见的病理改变。 IL-6 是引发各种炎症反应的关键性细胞因子,在组织内环境稳态中发挥着双向调控作用,此外,还可通过介导多条信号传导途径,促进炎症反应与纤维化的发生[20-21]。 TNF-α 是介导炎症反应的促炎因子之一,其长时间高水平表达可对肌肉修复以及纤维化产生重大影响[22-24]。 有研究表明,病理条件下TNF-α 与IL-6 含量变化趋势与创伤程度呈正相关,是直接映射损伤程度的重要指标[25]。TGF-β1 是目前公认的最强致纤维化因子,与器官、组织等纤维化的形成密切相关[26]。课题组前期研究显示,推拿法治疗骨骼肌损伤疗效显著,可有效改善受损局部微循环、抑制炎症反应与纤维化、减轻骨骼肌损伤、提高修复质量、促进肢体功能恢复[1,10-12,27]。本研究中,造模后模型组家兔病理染色显示炎细胞浸润和胶原纤维沉积明显,且血清IL-6、TNF-α 与肌肉组织TGF-β1、COL-Ⅰ表达量显著升高;然经法治疗后,法组家兔病理染色炎细胞浸润和胶原纤维沉积明显减少,修复优于模型组,血清IL-6、TNF-α 与肌肉组织TGF-β1、COL-Ⅰ表达量明显降低。以上结果表明,推拿法可有效抑制炎症反应与纤维化,减轻骨骼肌损伤,促进骨骼肌损伤修复,与前期研究结果一致[12,14,27]。
Wnt 配体是一种富含半胱氨酸的分泌型糖蛋白,可以通过自分泌或旁分泌的途径选择性与膜上受体相结合,将膜外信号传导至细胞膜内,进而激活膜内一系列信号转导途径,是Wnt/β-catenin 信号通路激活的始动因子[28-30]。 β-catenin 是Wnt/β-catenin信号通路的关键调节因子,伴随Wnt/β-catenin 信号通路的激活可发生核转移,进而调节下游靶基因的表达[29]。GSK-3β 是介于Wnt 配体与β-catenin 之间的重要信号转导因子之一,也是Wnt/β-catenin 信号通路中的关键负向调控因子。 在无Wnt 配体的条件下,GSK-3β 能够与腺瘤性结肠息肉蛋白、轴蛋白等形成复合物,使β-catenin 磷酸化而被泛素化降解。相反,GSK-3β 因磷酸化失活,致使细胞质中的βcatenin 磷酸化降解受阻而含量增加,游离的βcatenin 核转移增加进一步激活Wnt 信号通路,介导其下游靶基因的表达[30-32]。 由此可知,Wnt3a、GSK-3β、β-catenin 是评判Wnt/β-catenin 信号通路活性的重要标志。孟丽红等[33]通过抑制Wnt/β-catenin 信号通路相关分子基因及蛋白表达,从而减轻肺纤维化大鼠模型中的肺泡炎症反应,且对肺纤维化的发展产生了抑制作用。刘晶等[34]研究发现,抑制Wnt3a/β-catenin 信号通路可有效减轻膝骨关节炎兔股直肌纤维化程度。 此外,国外学者BRACK 等[35]通过小鼠体外注射Wnt3a 重组蛋白观察发现,骨骼肌内细胞外基质沉淀增加,使受损骨骼肌纤维化进一步加剧;反之,Wnt 抑制剂可有效降低胶原蛋白等细胞外基质组分沉积,抑制骨骼肌纤维化的发展。 TRENSZ等[36]研究结果与Brack 等研究相一致。 以上研究均表明,Wnt/β-catenin 信号通路在纤维化的发展进程中扮演着十分重要的角色。本研究结果显示,造模后,家兔股四头肌Wnt3a、β-catenin、p-GSK-3β 表达量均显著升高,而GSK-3β 表达量显著降低,表明Wnt/β-catenin 信号通路已处于被激活状态;经法治疗后,家兔股四头肌Wnt3a、β-catenin、p-GSK-3β 表达量显著降低,而GSK-3β 表达量显著升高,说明本研究中推拿法对Wnt/β-catenin 信号通路产生了一定的抑制作用。

